Similar presentations:
Боковой_Амиотрофический_склероз
1. Современные и Перспективные Стратегии Генной Терапии Бокового Амиотрофического Склероза
Меранович ИванБулыга Павел
Заяц Игнатий
Симоненко Владислав
Гусев Илья
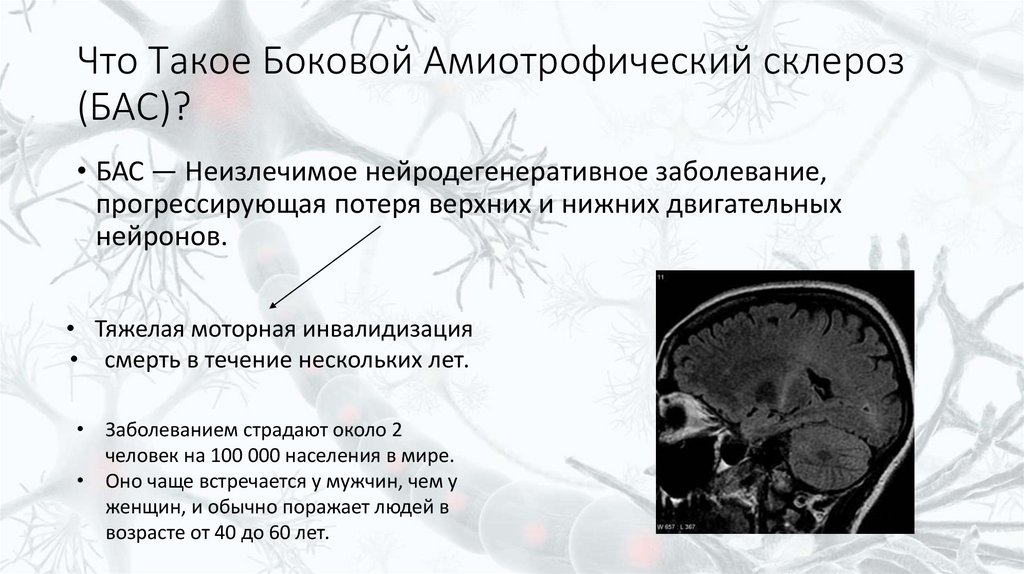
2. Что Такое Боковой Амиотрофический склероз (БАС)?
• БАС — Неизлечимое нейродегенеративное заболевание,прогрессирующая потеря верхних и нижних двигательных
нейронов.
• Тяжелая моторная инвалидизация
• смерть в течение нескольких лет.
• Заболеванием страдают около 2
человек на 100 000 населения в мире.
• Оно чаще встречается у мужчин, чем у
женщин, и обычно поражает людей в
возрасте от 40 до 60 лет.
3. Ключевые Патогенетические Механизмы БАС
• Агрегация белков (TDP-43, SOD1, FUS).• Нарушения РНК-гомеостаза
• Глутамат-опосредованная
эксайтотоксичность
• Хроническое нейровоспаление
• Мутации:
• C9orf72 (самая распространенная,
токсичные РНК/DPR-белки)
• SOD1 (токсичные агрегаты).
4. Обзор Существующих Подходов
АнтисмысловыеОлигонуклеотиды (АСО)
•Механизм: Деградация целевой мРНК
через RNase H (например, Tofersen для
SOD1).
•Клинический Статус: Одобрена
Sodesta (SOD1-ALS) — замедляет
снижение функций на 25% за год; Phase 3
для ION363 (FUS-ALS).
RNA-Интерференция (RNAi)
•Механизм: Использование siRNA/shRNA для
деградации мРНК посредством RISC.
•Клинический Статус: Phase 1/2 для AMT162 (SOD1).
Проблемы: Требуют повторных интратекальных введений;
ограниченное проникновение в ЦНС.
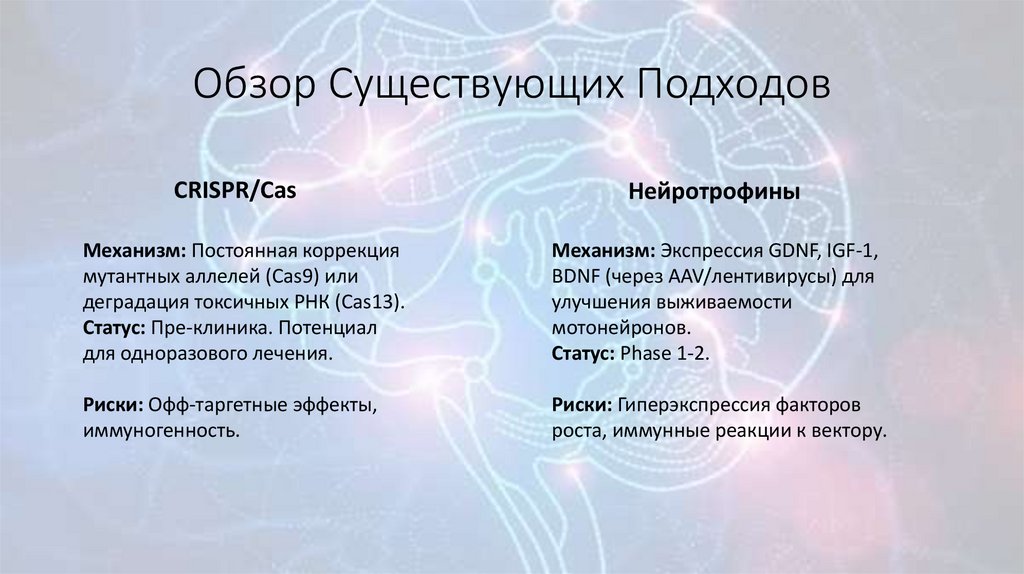
5. Обзор Существующих Подходов
CRISPR/CasНейротрофины
Механизм: Постоянная коррекция
мутантных аллелей (Cas9) или
деградация токсичных РНК (Cas13).
Статус: Пре-клиника. Потенциал
для одноразового лечения.
Механизм: Экспрессия GDNF, IGF-1,
BDNF (через AAV/лентивирусы) для
улучшения выживаемости
мотонейронов.
Статус: Phase 1-2.
Риски: Офф-таргетные эффекты,
иммуногенность.
Риски: Гиперэкспрессия факторов
роста, иммунные реакции к вектору.
6. Обзор Существующих Подходов
Клеточные Подходы•Механизм: Трансплантация модифицированных
клеток (MSC, NPC) для доставки нейротрофинов
и иммуномодуляции.
•Статус: Phase 3. Относительная безопасность.
•Преимущества: Улучшение микросреды,
иммуномодуляция.
•Риски: Ограниченный клинический эффект,
онкогенность при использовании интегрирующих
векторов.
7. Предложенные Теоретические Стратегии
8. Стратегия 1: Постоянная Продукция АСО/amiR
• In vivo терапия. Однократное интратекальное или паренхиматозноевведение.
• Механизм: Обеспечение постоянной внутриклеточной продукции
терапевтических антисмысловых агентов для устойчивого глушения
токсичного транскрипта. Это позволяет решить проблему короткого
срока действия АСО/RNAi.
• Мишень: Мотонейроны и/или околонейронные клетки.
• Агент Терапии: Репликативный РНК-вектор, содержащий:
• Промотор, управляющий экспрессией репликазы;
• Рамку считывания репликазы;
• Кассету для экспрессии терапевтических АСО/amiR (например, под контролем
конститутивного или нейрон-специфичного промотора).
9. ACO/amiR: Сравнение и риски
• Аналог: ASO-терапия, например,Tofersen (SOD1).
• Эта стратегия решает проблему
повторных инъекций и ограниченной
стабильности АСО в ликворе.
• Риски: Необходимость детального
исследования тропизма и безопасности
репликативных векторов, контроль
уровня экспрессии.
10. Стратегия 2: Генетическая Модуляция Нейровоспаления
•In vivo терапия. Введение AAV / CRISPR в ЦНС.•Механизм: Переключение фенотипа микроглии
из провоспалительного в нейропротективный.
Уменьшение хронического воспаления косвенно
защищает мотонейроны.
•Мишень: Микроглия.
•Агент Терапии:
•AAV: Вектор, содержащий промотор, специфичный
для микроглии, и кДНК противовоспалительного
цитокина (например, IL-10).
•CRISPR: Вектор (AAV) с промотором микроглии и
гидовой РНК (sgRNA), нацеленной на ключевые
компоненты cGAS-STING пути для их редукции.
11. Модуляция воспаления: Сравнение и риски
•Аналог: Клинические испытания MSCтрансплантации с иммуномодулирующей
целью.
•Сравнение: Более точечное воздействие
на воспалительный путь (STING) в
микроглии, в отличие от общего
воздействия MSC.
•Риски: Риск иммунных ответов на AAV-вектор,
возможные системные эффекты при изменении
иммунного статуса.
12. Стратегия 3: Компенсаторная Экспрессия STMN2
• Этапы: In vivo терапия. Однократноеинтратекальное или системное введение
AAV.
• Механизм: Восстановление аксональной
регенерации и пластичности
мотонейронов. При патологии TDP-43
происходит утрата экспрессии критически
важных нейрональных факторов, таких как
STMN2.
• Мишень: Мотонейроны.
• Агент Терапии: AAV-вектор, содержащий
нейрон-специфичный промотор
(например, hSyn) и полноразмерную кДНК
STMN2.
13. Компенсаторная Экспрессия STMN2: Сравнение и риски
•Аналог: Клинические испытанияAAV-доставки нейротрофинов
(например, AAV-GDNF).
•Сравнение: Вместо "внешнего"
нейротрофина, стратегия
восстанавливает "внутренний"
фактор (STMN2), утрачиваемый при
TDP-43 патологии, что является
более патогенетически
обоснованным.
•Риски: Риск гиперэкспрессии фактора,
иммуногенность AAV-вектора.
14. Стратегия 4: Гибридная
• Этапы: In vivo терапия. Совместное илипоследовательное введение двух векторов.
• Механизм: сочетание уменьшения
токсичности (через глушение мутантного
транскрипта) и усиления выживаемости
нейронов (через нейропротекцию).
Сочетание ASO/RNAi (для глушения) и AAVвектора (для экспрессии нейротрофина).
• Мишень: Мотонейроны.
• Агент Терапии :
• ASO/amiR для глушения мутантного транскрипта
(SOD1, C9orf72)
• AAV-вектор, несущий нейротрофин (GDNF/IGF1) под контролем нейрон-специфичного
промотора.
15. Гибридная стратегия: Сравнение и Риски
• Гибридная стратегияявляется эволюцией
наиболее успешных
существующих подходов.
• Сочетание рисков ASO
(доставка) и AAV
(иммуногенность/гиперэкспр
ессия); сложность
дозирования двух агентов.
16. Заключение
• Клинический Прогресс: Генная терапия модифицирует течение БАС(одобрение Tofersen). АСО и RNAi доказали свою способность
эффективно снижать уровень токсичных белков при генетических
формах.
• Будущее — Мультитаргетный Подход: Гибридная стратегия,
сочетающая снижение токсичности и нейропротекцию, является
наиболее перспективной для достижения синергетического
клинического эффекта.
• Перспектива лечения: Ожидается прорыв в лечении спорадического
БАС (sALS) через подходы, нацеленные на патологию TDP-43
(например, через восстановление STMN2) и модуляцию
нейровоспаления.