Similar presentations:
Генетическая инженерия
1. Генетическая инженерия
2.
• Генетическая инженерия - конструирование in vitroфункционально
активных
генетических
структур
(рекомбинантных ДНК), или иначе - создание
искусственных генетических программ (Баев А. А.).
Академик А.А. Баев был первым в нашей стране ученым, который поверил в
перспективность генной инженерии и возглавил исследования в этой области.
• По
генетическая
инженерия
система
экспериментальных
приемов,
позволяющих
конструировать лабораторным путем (в пробирке)
искусственные генетические структуры в виде так
называемых рекомбинантных или гибридных молекул
ДНК (Пирузян Э. С.).
3.
Геннаяинженерия
(генетическая
инженерия) – совокупность методов и
технологий, в том числе технологий получения
рекомбинантных
рибонуклеиновых
и
дезоксирибонуклеиновых
кислот,
по
выделению
генов
из
организма,
осуществлению манипуляций с генами и
введению их в другие организмы.
4.
Генная (генетическая) инженерия –область
молекулярной
генетики,
занимающаяся искусственным созданием
новых
генетических
комбинаций
и
внедрением
комбинированных
ДНК
в
клетку-хозяина, в результате чего клетка
получает заданные свойства.
5.
• Речь идет о направленном, по заранее заданнойпрограмме
конструировании
молекулярных
генетических систем вне организма с последующим
введением их в живой организм.
При этом рекомбинантные ДНК становятся
составной
частью
генетического
аппарата
реципиентного организма и сообщают ему новые
уникальные генетические, биохимические, а затем и
физиологические свойства.
• Цель прикладной генетической инженерии
заключается в конструировании таких рекомбинантных
молекул ДНК, которые при внедрении в генетический
аппарат придавали бы организму свойства, полезные
для человека.
6.
Генная инженерия- составная часть современной
биотехнологии.
Возникновение генетической инженерии связано
прежде всего с развитием молекулярной биологии.
С точки зрения методологии генная инженерия
сочетает в себе
фундаментальные принципы
(генетика, клеточная теория, молекулярная биология,
системная биология), достижения самых современных
постгеномных наук: геномики, метаболики, протеомики
с
реальными
достижениями
в
прикладных
направлениях:
биомедецина,
агробиотехнология,
биоэнергетика, биофармакология, биоиндустрия и т.д.
7.
• Генетическая инженерия направление вдеятельности
человека,
позволяющее
целенаправленно, по заранее намеченной
программе,
экспериментально
модифицировать геном с использованием
генетической информации из разных
гетерологических систем:
вирусов, бактерий, насекомых, животных
и человека.
• С
помощью
генетической
инженерии
становится возможным изменять структуру
генов, создавать новые, в том числе и
гибридные, гены.
8.
• Позволило переносить гены междутаксономически удаленными видами
растений, относящимися, например, к
классам однодольных и двудольных.
9.
В настоящее время четко прослеживаютсятри аспекта использования трансгенных
растений:
1) изучение
фундаментальных
проблем
функционирования генов у растений;
2)
трансгенные растения – биореакторы
фармацевтически ценных белков;
3) улучшение качества и хозяйственно ценных
признаков важных сельскохозяйственных
культур и декоративных растений.
10.
Трансген – чужеродная рекомбинантнаяДНК, искусственно введенная в геном
клеток растений или зародышевых
клеток животных, становящаяся его
резидентной
частью
после
восстановления полноценного организма
и рекомбинирующая среди потомков,
согласно законам Менделя.
Трансгенные растения – генетически
модифицированные растения, у которых
трансген введен в ядерный геном.
Транспластомные
растения
–
генетически модифицированные растения, у которых
трансген введен в хлоропластный геном.
11.
Генная инженерия появилась благодаря работаммногих исследователей в разных отраслях
биохимии и молекулярной генетики.
В 1953 г. Дж. Уотсон и Ф. Крик создали
двуспиральную модель ДНК.
На рубеже 50 – 60-х гг. 20 в были выяснены
свойства генетического кода, а к концу 60-х годов
его
универсальность
была
подтверждена
экспериментально.
были удостоены Нобелевской премии (1978 г.).
12.
Шло интенсивное развитие молекулярной генетики,объектами которой стали E.coli, ее вирусы и
плазмиды.
Были
разработаны
методы
выделения
высокоочищенных
препаратов
неповрежденных
молекул ДНК, плазмид и вирусов. ДНК вирусов и
плазмид вводили в клетки в биологически активной
форме, обеспечивая ее репликацию и экспрессию
соответствующих генов.
В 1970 г. Г. Смитом был впервые выделен ряд
ферментов – рестриктаз, пригодных для генноинженерных целей. Полученный из бактерий
очищенный фермент HindII сохраняет способность
разрезать молекулы нуклеиновых кислот (нуклеазная
активность), характерную для живых бактерий.
За открытие рестриктаз Вернер Арбер, Даниел
Натанс и Хамилтон Смит.
13.
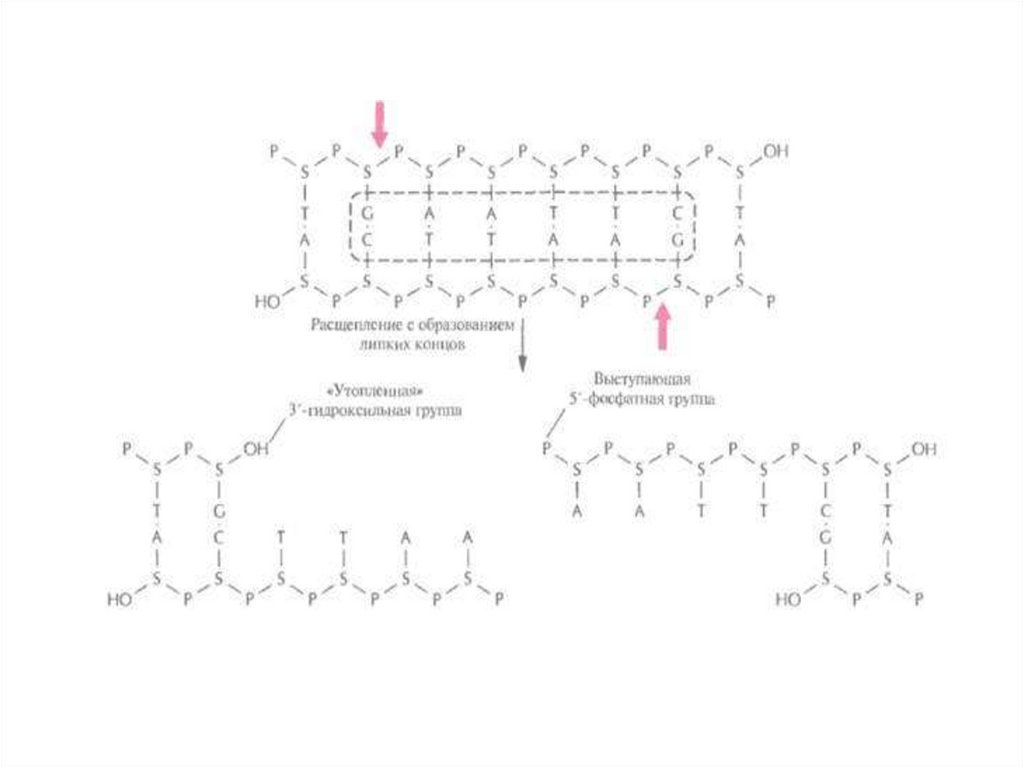
• КомбинированиеДНК-рестриктаз
(для разрезания молекул ДНК на
определенные
фрагменты)
и
выделенных
еще
в
1967
г.
ферментов
–
ДНК-лигаз
(для
«сшивания»
фрагментов
в
произвольной последовательности) по
праву можно считать центральным
звеном
в
технологии
генной
инженерии.
14.
Генетическая инженериякак новое направление
исследований развивается
с 1972 г. когда группа
американских ученых П. Берг, С. Коэн, Х. Бойер с
сотрудниками
(Стенфордский
университет)
впервые
сконструировала рекомбинантную ДНК, состоящую из
трех источников:
- генома онкогенного вируса обезьяны SV40;
- части генома умеренного лямбда-фага E. сoli;
- гена галактозного оперона E. сoli.
Впервые целенаправленный
осуществлен в 1977 г.
перенос
гена
был
15. «Генетическая инженерия» в природных экосистемах
• Наследственной системаобладает способностью
к
«естественной генетической инженерии». В клетке существует
режим генетического поиска
и реорганизации структуры и
функции генома.
• В середине 70-х годов XX в. было высказано представление о
повсеместности распространения вирусов в природе.
Пути распространения вирусов в биоценозах, и соответственно,
пути горизонтального межвидового переноса генетического
материала, поразительны. Так РНК-содержащий вирус гриппа
переносится водоплавающими перелетными птицами, но
обнаружен и у китов и у планктонных организмов (Жданов, 1990).
• Другой важный фактор в эволюции - бактерии. Миллиарды лет
бактерии были единственными обитателями биосферы. Они и
сейчас настоящие «хозяева планеты». Бактерии — истинные
космополиты.
Горизонтальный перенос генов от одного организма в другой
являлся существенным механизмом эволюции, в основном, у
бактерий. Этот факт стал очевидным в последние несколько
десятилетий.
16.
• Джошуа Ледерберг в 1952 году ввел понятие«плазмида». Он обнаружил в кишечной палочке, кроме
основной спиралевидной; вытянутой ДНК, еще и
маленькие, свернутые в кольцо ДНК.
• Плазмидами Д. Ледерберг предложил обозначать все
внеядерные генетические элементы, способные к
автономной репликации.
• Плазмиды имеют особые гены устойчивости к
антибиотикам.
• ДНК плазмиды легко переходят от бактерии к
бактерии, делая их невосприимчивыми к лекарствам.
17.
• В 1945 г. в Японии для борьбы с дифтерией сталиприменять сульфаниламид - эффективность только
первые 5 лет.
• Вскоре появились устойчивые штаммы дифтерийной
палочки, а уже некоторое время спустя 80-90% изолятов
были устойчивыми.
• Затем сульфаниламид заменили антибиотиками. Уже в
1952 г. от больного дифтерией был выделен штамм
дифтерийной палочки, одновременно устойчивый к
тетрациклину, стрептомицину и сульфаниламиду.
В 1964 г. половина всех бактериальных штаммов,
выделенных из больных дизентерией, несла гены
устойчивости одновременно к четырем антибиотикам.
Эти гены устойчивости были собраны в одной
плазмиде,
способной
к
горизонтальному
распространению среди бактерий.
18.
• Гены плазмид, в свою очередь, могут попадать вхромосомы клеток-реципиентов. Считают, что таким
путем в кишечную палочку попали гены, кодирующие
ферменты инактивации антибиотиков.
• То, что затрудняло работу медиков, пригодилось генным
инженерам.
• Особенности жизненных циклов вирусов, плазмид и
бактерий привели в дальнейшем к созданию так
называемых
«векторов»
—
искусственно
реконструированных
молекул
материала
наследственности,
которые
могут
переносить
чужеродный материал от одного организма к
другому.
19.
• Перенос генов называется трансгенозом.• Организмы, в которые включены чужеродные гены, носят
название трансгенных.
• Используемые длчя переноса генетические конструкции носят
название рекомбинантных ДНК.
В их состав входят фрагмент донорной ДНК (клонируемая ДНК)
и векторная ДНК ( вектор, который отвечает за перенесениеи
встраиваение – интеграцию – клонируемой ДНК).
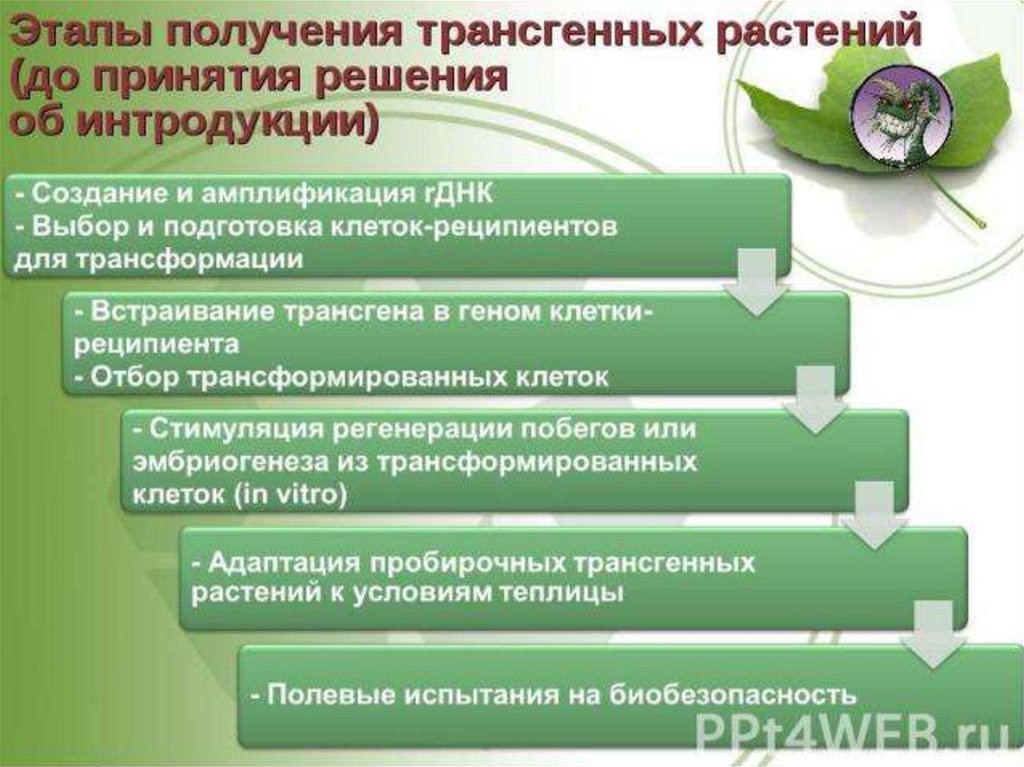
20. Задачи и методы генной инженерии
Традиционная селекция имеет целый ряд ограничений, которыепрепятствуют получению новых пород животных, сортов растений
или рас практически ценных микроорганизмов:
1. отсутствие рекомбинации у неродственных видов. Между
видами
существуют
жесткие
барьеры,
затрудняющие
естественную рекомбинацию.
2. невозможность управлять процессом рекомбинации в организме
извне. Отсутствие гомологии между хромосомами приводит к
неспособности сближаться и обмениваться отдельными участками
(и генами) в процессе образования половых клеток.
3. невозможность точно задать признаки и свойства потомства, т.к.
процесс рекомбинации – статистический.
Природные механизмы, стоящие на страже чистоты и
стабильности генома организма, практически невозможно
преодолеть методами классической селекции.
21.
• Технологияполучения
генетически
модифицированных
организмов
(ГМО)
принципиально
решает
вопросы
преодоления
всех
естественных
и
межвидовых
рекомбинационных и репродуктивных барьеров.
• В отличие от традиционной селекции, в ходе которой генотип
подвергается изменениям лишь косвенно, генная инженерия
позволяет непосредственно вмешиваться в генетический
аппарат, применяя технику молекулярного клонирования.
Генная инженерия позволяет оперировать любыми генами,
даже синтезированными искусственно или принадлежащими не
родственным организмам, переносить их от одного вида к
другому, комбинировать в произвольном порядке.
22.
• Технология рекомбинантных ДНК, широко использующаяся вмикробиологических системах, применяется и на растениях.
• Технология рекомбинантных ДНК позволяет выделять гены как
прокариотического,
так
и
эукариотического
происхождения,
переносить этот ген
( или несколько генов) в хромосомы
реципиентного растения, обеспечивать его экспрессию и передачу
следующим поколениям (наследоваться).
С помощью генетической
инженерии новые сорта не
создаются, а достигается улучшение свойств существующего
сорта либо изменением существующей, либо созданием новой
генетической вариации.
Исходный сорт должен быть
адаптирован к определенным условиям внешней среды, а также
технологиям возделывания.
• Аргументы в пользу получения трансгенных растений:
1. Повышение сельскохозяйственной ценности и декоративных качеств
культурных растений.
2. Могут
быть живыми биореакторами при малозатратном
производстве экономически важных белков или метаболитов.
3. Изучение действия генов в ходе развития растения и других
биологических процессов.
23. Генная инженерия
Клонирование гена
Модификация гена
Создание вектора для трансформации
Создание трансгенного растения
24. Ферменты
• Рестриктазы – разрезающие молекулу ДНК, с помощью ихвыделяют фрагменты ДНК.
Eco RI: род микроорганизма обозначается прописной буквой, а
вид — двумя строчными; штамм обычно не указывается. Римские
цифры — порядковый номер данной эндонуклеазы в ряду прочих
рестриктаз, выделенных из данного микроорганизма. Например, Hра
I и Нра II — это соответственно первая и вторая рестрицируюшие
эндонуклеазы типа II, выделенные из Haemophilus parainfluenzae.
ДНК- полимеразы – ферменты, синтезирующие ДНК на матрице
ДНК или РНК (обратные транскриптазы, ревертазы)
Лигазы – соединяющие фрагменты ДНК.
ДНК-лигаза бактериофага Т4 - катализирует образование
фосфодиэфирных связей между концами полинуклеотидных цепей,
которые уже удерживаются вместе благодаря спариванию липких
концов.
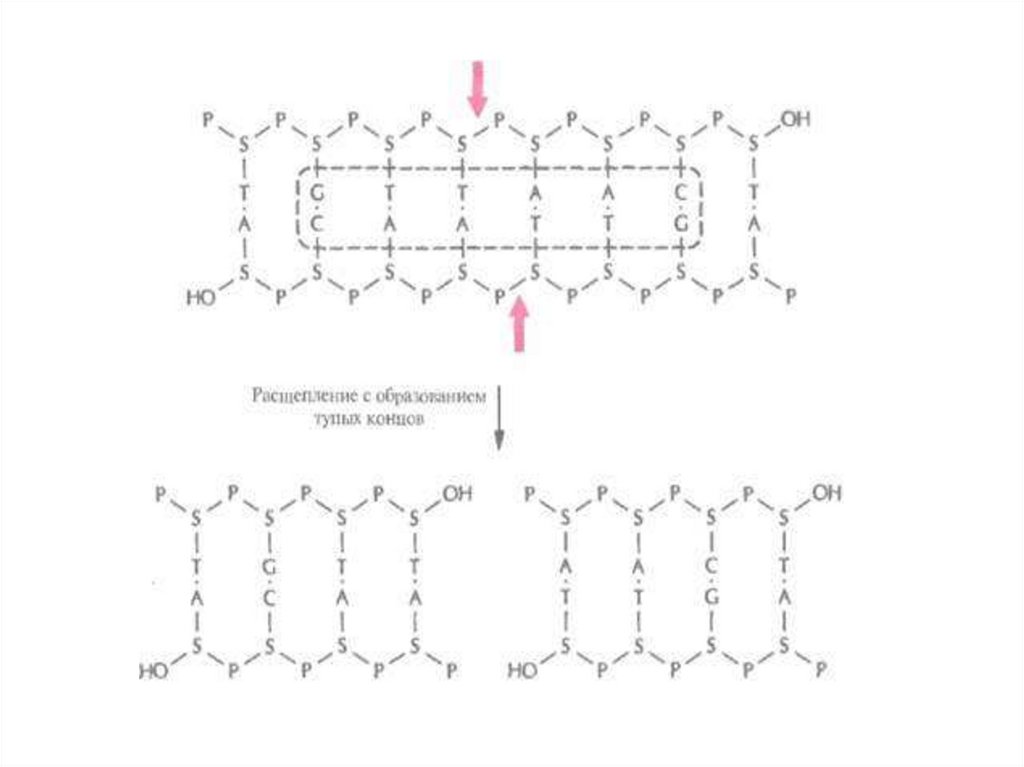
ДНК-лигаза Т4 «сшивает» и тупые концы.
25.
26.
27.
ДНК может быть разрезана рестриктазами, а затемсоединена в единую цепь в ЛЮБОМ порядке – это
положение лежит в основе получения рекомбинантных
молекул
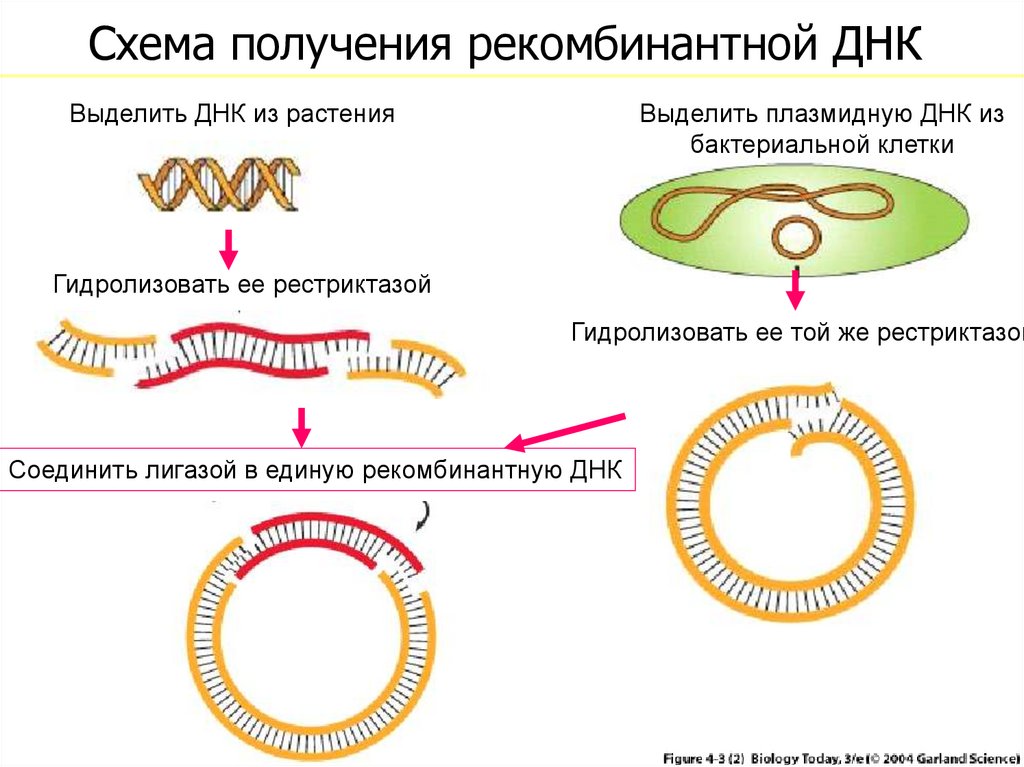
28. Схема получения рекомбинантной ДНК
Выделить ДНК из растенияВыделить плазмидную ДНК из
бактериальной клетки
Гидролизовать ее рестриктазой
Гидролизовать ее той же рестриктазой
Соединить лигазой в единую рекомбинантную ДНК
29.
Генная инженерия —хотя и исключительно важный, но
лишь
один
из
многочисленных
методов
управления
генетической
изменчивостью
организмов, широко используемых в
селекционной практике.
30.
Задачитрадиционной
селекции
значительно шире:
они включают и позволяют
продукционные
средоулучшаюшие направления
введение в культуру новых видов
современные
методы
селекции
позволяют
манипулировать
одновременно десятками признаков,
включая полигенные.
Возможности трансгеноза ограничиваются
единичными генами.
31.
• Посколькус
помощью
генетической
инженерии не создают, а только улучшают
уже адаптированные к определенным
условиям внешней среды, а также
технологиям возделывания сорта и
гибриды,
в комплексных селекционно-агротехнических
программах должны быть изначально
определены цели и этапы использования
классических и биоинженерных методов
управления
наследственной
изменчивостью при реализации той или
иной морфофизиологической модели сорта
(гибрида).
32.
• Методы биотехнологи иявляются качественноновым инструментом для непосредственного
изучения
структурно-функциональной
организации генетического материала.
• А это в свою очередь позволяет предположить,
что генетическая инженерия растений окажет
наибольшее влияние при селекции на такие
адаптивно и хозяйственно ценные признаки,
как интенсивность чистого фотосинтеза,
индекс урожая и др.
• Наиболее перспективные направления в области
защиты
растений
включают
получение
трансгенных
сортов,
устойчивых
к
гербицидам
и
вредным
видам,
биопестицидов,
новых
форм
микроорганизмов и др.
33.
Генетическаяинженерия,
непрерывно
совершенствуясь и усложняясь, расширить
возможности человека в целенаправленном
преобразовании организмов.
Вполне
вероятно,
что
дальнейшее
развитие методов молекулярной биологии, в
том числе трансгеноза, позволит поднять
современную
селекцию
растений
на
качественно новый уровень.
34. Конструирование растений
1. Выделитьи
идентифицировать
отдельный
ген,
соответствующий
фрагментам ДНК или РНК.
2. Разработать
методы,
обеспечивающие включение гена в
наследственный
аппарат
растительной клетки.
3. Регенерировать из единичных клеток
нормальное растение с измененным
генотипом.
35.
Для доставки чужеродных генов вклетки растений применяют
векторы,
вирусов и
плазмид почвенных бактерий.
созданные
на
основе
36.
• Длядвудольных
растений
используют
природный вектор горизонтального переноса
генов – плазмиды почвенных бактерий (Tiплазмида Agrobacterium tumefaciens и Riплазмида A. rhizogenes).
• В генно-инженерных работах наиболее часто
используют векторы на основе Ti-плазмиды
(Tumor inducing – индукция новообразований)
A. tumefaciens, которая в естественных
условиях вызывает у растений образование
опухолей (корончатых галлов) в местах
проникновения бактерии.
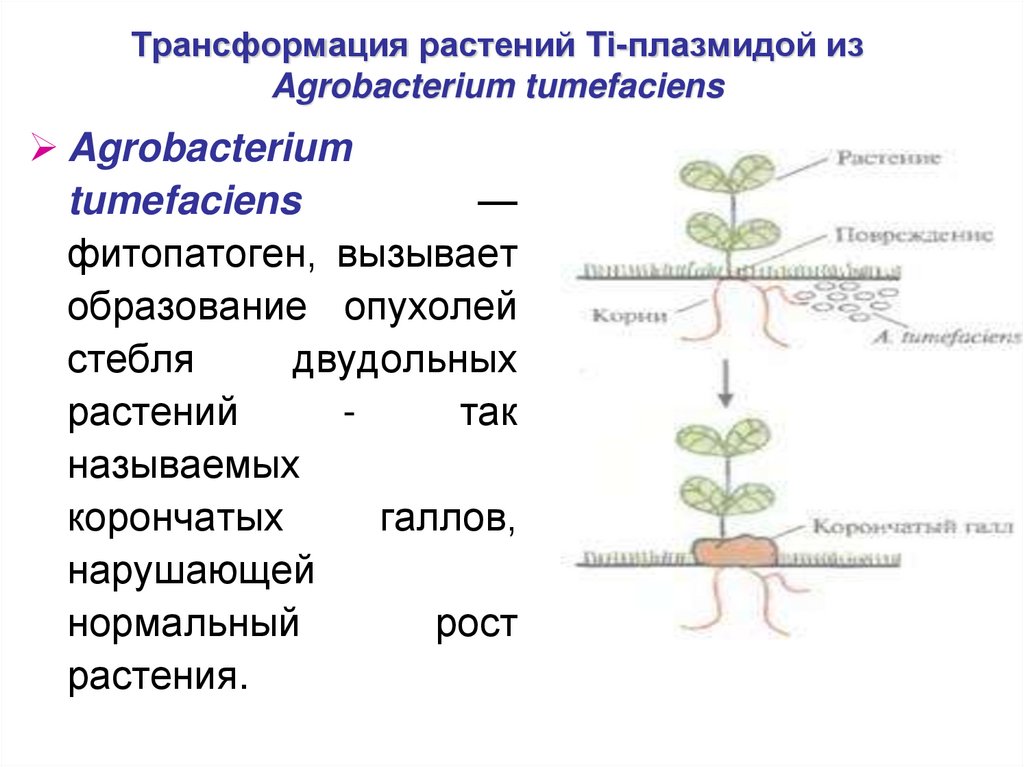
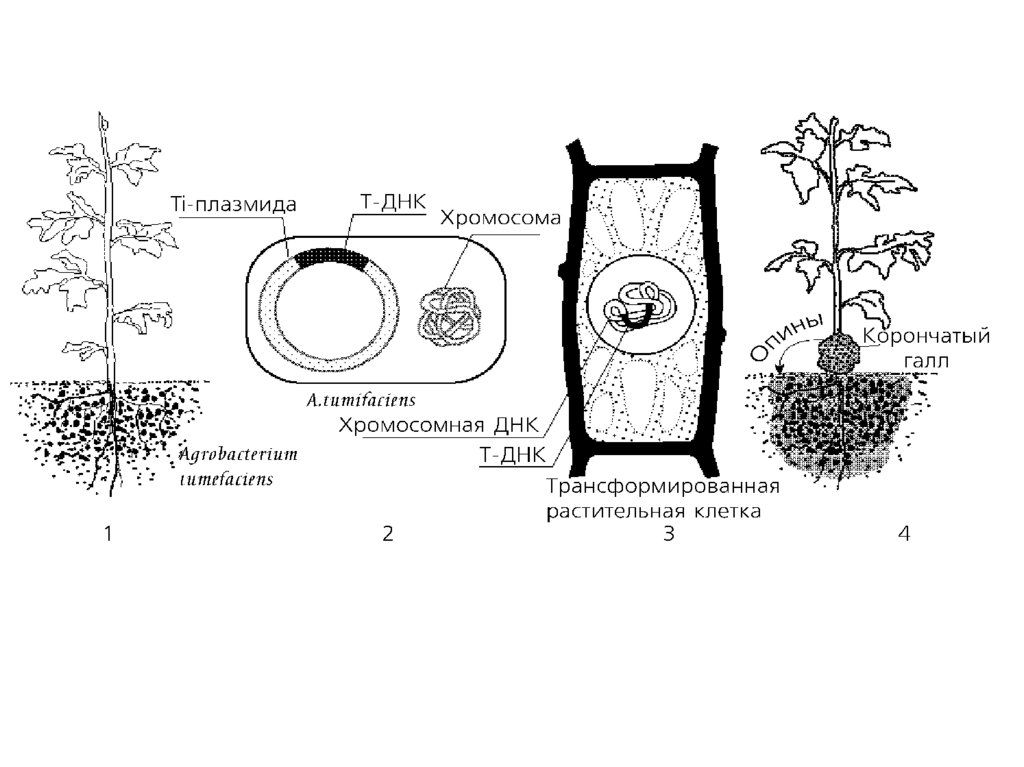
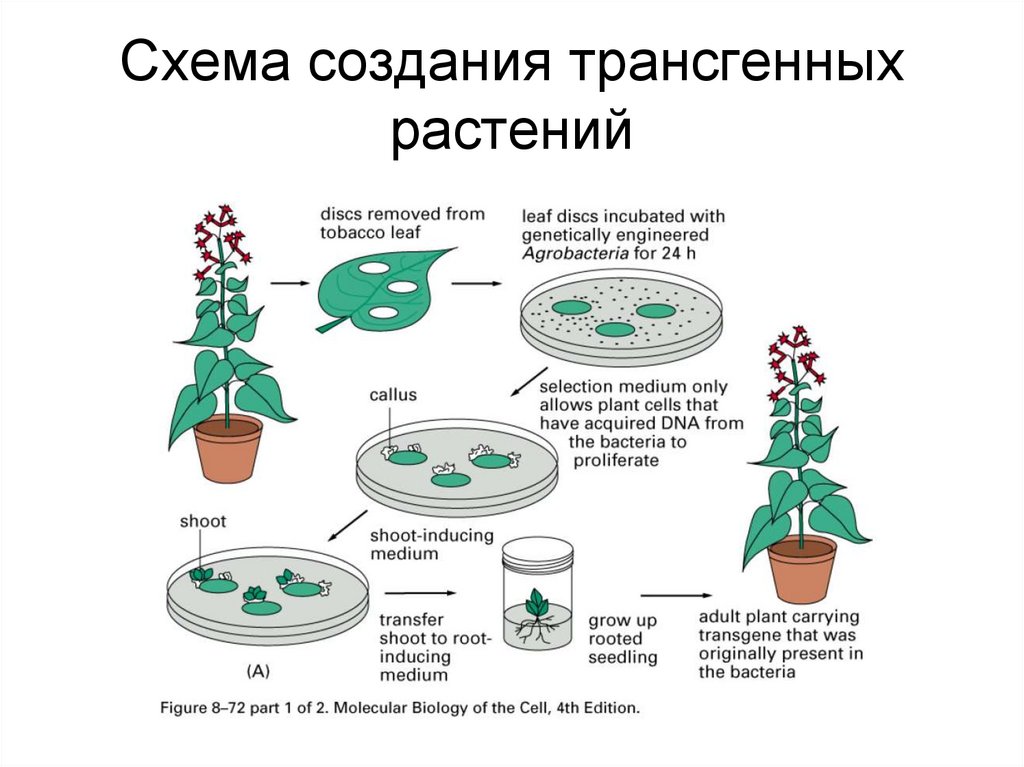
37. Трансформация растений Ti-плазмидой из Agrobacterium tumefaciens
Agrobacteriumtumefaciens
—
фитопатоген, вызывает
образование опухолей
стебля
двудольных
растений
так
называемых
корончатых
галлов,
нарушающей
нормальный
рост
растения.
38.
Другой вид агробактерий –A. rhizogenes,
- вызывает заболевание, именуемое
"бородатый корень", при котором в
зоне повреждения корня образуется
масса новых корешков.
39.
A.rubi
обычно
индуцируют
неорганизованные опухоли (тератомы),
штаммы A. radiobacter авирулентны.
40.
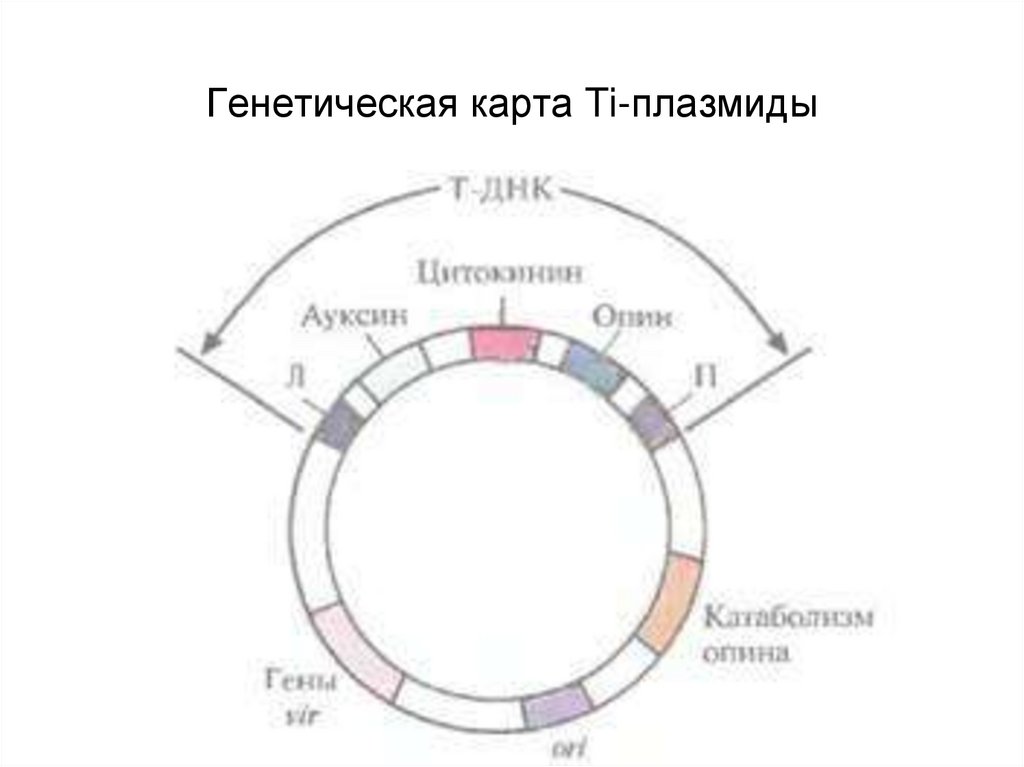
41. Генетическая карта Ti-плазмиды
42.
Клеточнаястенка
растения
повреждается вследствие выделения
бактериями
пектолитических
ферментов, что обеспечивает плотный
контакт бактерий с плазмалеммой
растительной клетки.
Этот контакт необходим для передачи
ДНК от бактерий в растительную клетку.
43.
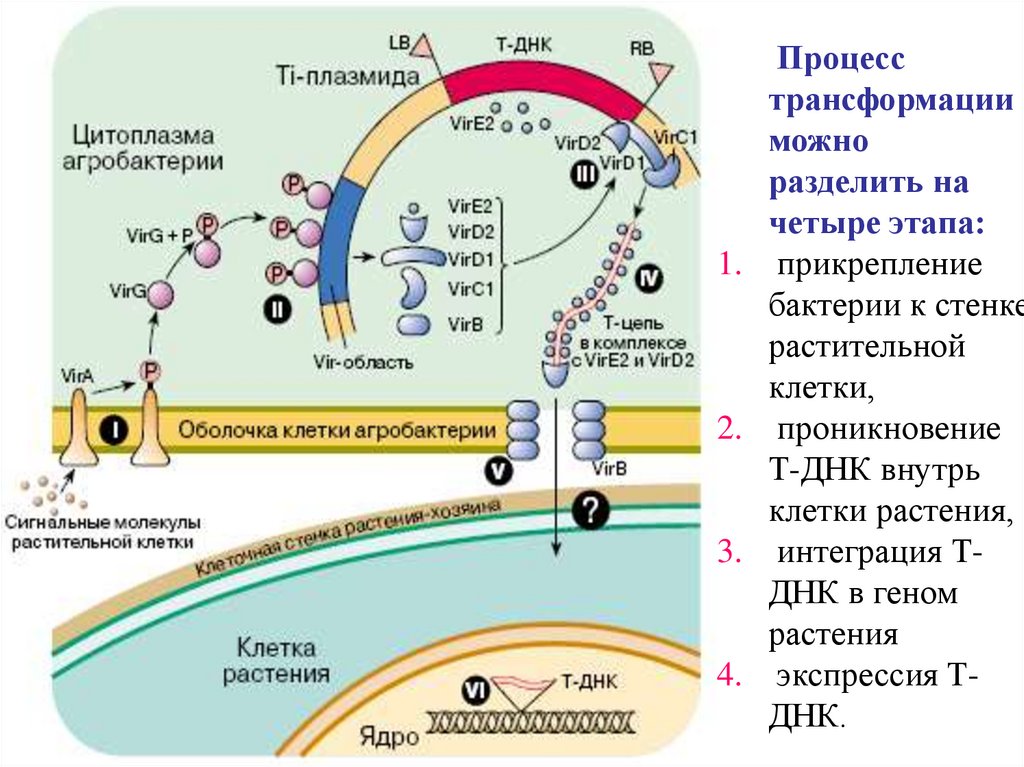
1.2.
3.
4.
Процесс
трансформации
можно
разделить на
четыре этапа:
прикрепление
бактерии к стенке
растительной
клетки,
проникновение
Т-ДНК внутрь
клетки растения,
интеграция ТДНК в геном
растения
экспрессия ТДНК.
44.
• Продукты vir-генов необходимы для транспорта и интеграции ТДНК в геном растительной клетки. Существуют по меньшей мересемь разных νir-генов.
• Большинство генов Т-ДНК активируются только после ее
встраивания в геном растения. Их продукты и вызывают
образование корончатого галла.
• И ауксин, и цитокинины регулируют рост и развитие растительной
клетки, но, присутствуя в избытке, могут вызывать у растений
образование опухолей, таких как корончатый галл.
• Содержит ген, детерминирующий синтез соединения из класса
опинов. Опины — это уникальные продукты конденсации аминои кетокислот или аминокислот и сахаров.
• Опины синтезируются в корончатом галле, а затем секретируются.
Они могут использоваться как источник углерода (а иногда и как
источник азота) любой A. tumefaciens, которая несет в Ti-плазмиде
ген(ы) катаболизма соответствующего опина, локализованные вне ТДНК.
45.
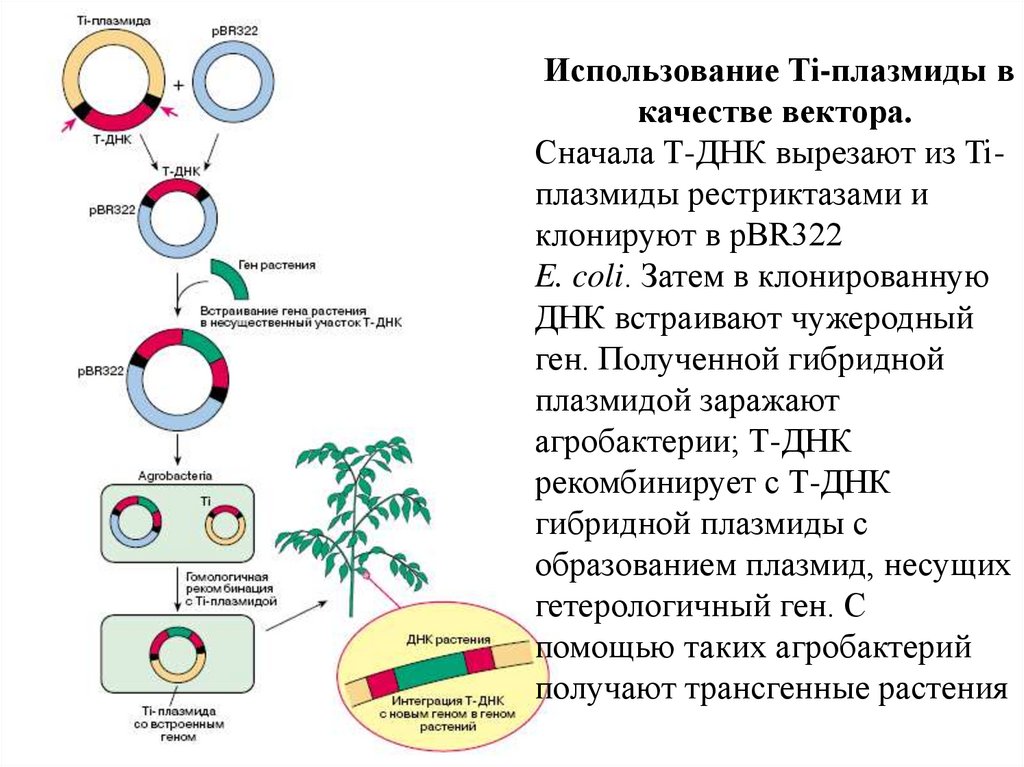
Использование Ti-плазмиды вкачестве вектора.
Сначала Т-ДНК вырезают из Tiплазмиды рестриктазами и
клонируют в pBR322
E. coli. Затем в клонированную
ДНК встраивают чужеродный
ген. Полученной гибридной
плазмидой заражают
агробактерии; Т-ДНК
рекомбинирует с Т-ДНК
гибридной плазмиды с
образованием плазмид, несущих
гетерологичный ген. С
помощью таких агробактерий
получают трансгенные растения
46. Векторные системы на основе Τi-плазмид
• Ti-плазмиды являются эффективными природными векторами,Ограничения на их использование в качестве векторов для
клонирования:
• Фитогормоны, синтезируемые трансформированными клетками в
культуре, подавляют регенерацию из этих клеток зрелого растения,
поэтому при конструировании векторов на основе Ti-плазмиды гены
ауксина и цитокинина должны быть удалены.
• Ген опина несуществен для трансгенных растений. При создании
векторов ген опина также должен быть удален.
• Ti-плазмиды имеют очень большой размер (от 200 до 800 т. п. н.).
Для экспериментов с рекомбинантными
ДНК
нужны
векторы
меньшего размера, поэтому участки ДНК, несущественные для
клонирующего вектора, должны быть удалены.
Ti-плазмиды не реплицируются в Escherichia coli, что исключает
работу с рекомбинантными Ti-плазмидами в этих бактериях.
При конструировании векторов на основе Ti-плазмид необходимо ввести
в них сайт инициации репликации, обеспечивающий их
поддержание в E. coli.
47.
• Образование корончатого галла начинается с проникновения,интеграции в геном растительных клеток (в ядерную ДНК растительной
клетки)
и экспрессии специфического сегмента бактериальной
плазмидной ДНК — так называемой Т-ДНК (от англ, transferred DNA).
Т-ДНК — это часть плазмиды, индуцирующей развитие опухоли.
• Длина Т-ДНК варьирует от 12 до 24 т. п. н. в зависимости от штамма.
Штаммы A. tumefaciens, не содержащие Ti-плазмиды, не способны
индуцировать развитие корончатого галла.
• Предполагается, что интеграция Т-ДНК в геном растения зависит от
специфических последовательностей, локализованных в правой
фланкирующей последовательности, которая содержит повтор
длиной 25 п. н.
48.
Все векторы на основе Ti-плазмид организованы сходнымобразом и имеют следующие элементы:
Селективный
маркерный
ген,
например
ген
неомицинфосфотрансферазы, который обеспечивает устойчивость
трансформированных растительных клеток к канамицину (по своей
природе прокариотический).
Этот
ген
находится
под
контролем
растительных
(эукариотических) сигналов регуляции транскрипции, в том числе
промотора и сигнала терминации - полиаденилирования. Это
обеспечит эффективную экспрессию гена в трансформированных
растительных клетках.
Сайт инициации репликации, который позволяет плазмиде
реплицироваться в E. coli. Некоторые векторы содержат также и сайт
инициации репликации A. tumefaciens.
Правая фланкирующая последовательность Т-ДНК. Этот
элемент абсолютно необходим для интеграции Т-ДНК в клеточную
ДНК растений. Большинство же векторов содержат как правую, так и
левую фланкирующие последовательности.
Полилинкер (множественный сайт клонирования)
встраивания гена в участок между границами Т-ДНК.
для
49.
• Вотличие
от
селективных,
репортерные
гены
позволяют
выявлять
присутствие
в
ткани
трансформированного
растения
рекомбинантного
белка
и
предварительно судить об уровне
экспрессии самого гена.
50.
• Вкачестве
селективных
генов
используют
гены
устойчивости
к
антибиотикам (канамицин, гигромицин),
устойчивости
к
гербицидам
(фосфинотрицин) и т. д.,
• в качестве репортерных – ген зеленого
флюоресцирующего белка (gfp) или ген
uidA, кодирующий фермент бетаглюкуронидазу.
51. Конструирование вектора
Поскольку клонирующие векторы не содержат генов vir, они самине способны обеспечивать транспорт и интеграцию Т-ДНК в клетки
растения-хозяина.
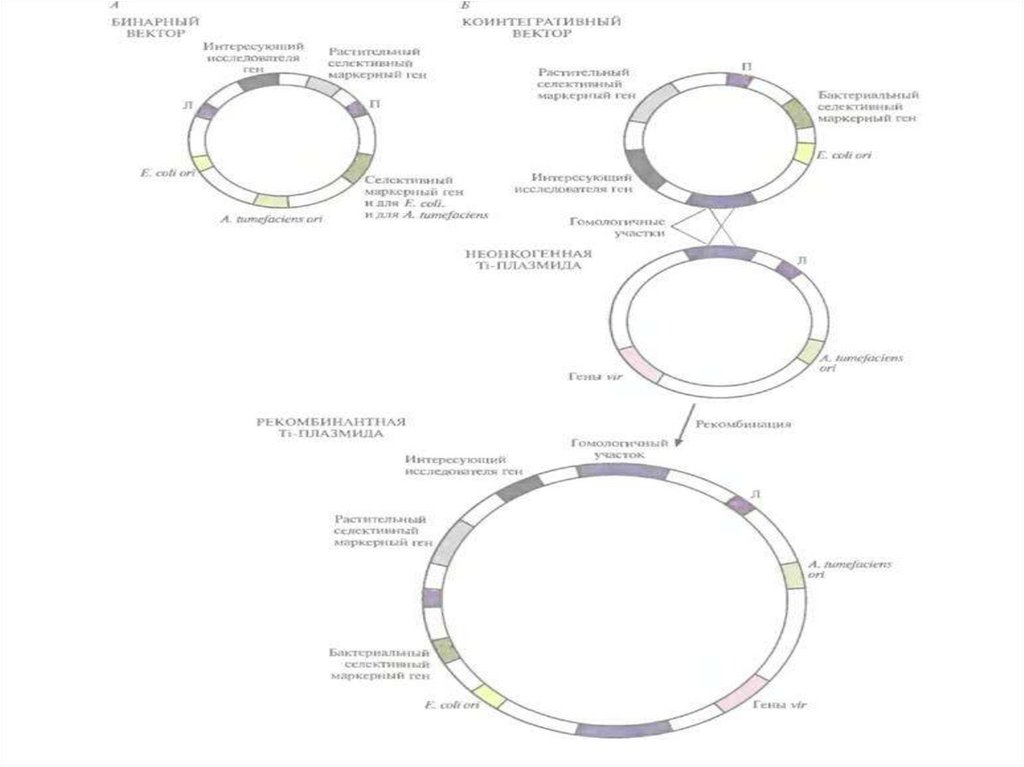
• Бинарный клонирующий вектор содержит сайты инициации
репликации и для E. coli, и для A. tumefaciens, но не несет генов vir, т.
е. это практически челночный вектор E, coli — A. tumefaciens.
• Все стадии клонирования проводят в Е. соli, а затем вектор вводят в
A. tumefaciens, которая несет модифицированную неонкогенную
(«разоруженную») Ti-плазмиду; она содержит полный набор vir-генов,
но из нее удалена часть (или вся) Т-ДНК (так что Т-ДНК не может быть
транспортирована).
• Продуцируя белки, кодируемые vir-генами, неонкогенная Tiплазмида выступает в роли помощника, способствуя встраиванию ТДНК из бинарного клонирующего вектора в хромосомную ДНК
растения.
52.
53.
Во втором случае используют коинтегративнуювекторную систему.
Векторная ДНК рекомбинирует в A. tumefaciens с
«разоруженной» Ti-плазмидой, Т-ДНК которой не несет
опухолеродных генов, таким образом, что весь
клонирующий вектор встраивается в неонкогенную Tiплазмиду.
• Коинтегративный вектор и неонкогенная Tiплазмида-помощник
содержат
гомологичные
последовательности, которые образуют сайт для
гомологичной рекомбинации in vivo.
54.
Интеграция Т-ДНК в растительныйгеном осуществляется случайным
образом в различные районы
генома
растений
путем
негомологичной
(незаконной)
рекомбинации, механизм которой
предполагает наличие коротких (1–8
п.н.)
• участков гомологии между нуклеотидными
последовательностями на концах Т-ДНК и
геномными районами.
55.
• Экспрессия чужеродных белков в специфическихклетках находится под контролем сильного
конститутивного 35S-промотора вируса мозаики
цветной капусты, функционирующего во всех
растительных тканях в течение всей жизни растения.
Использовали промотор гена малой субъединицы
фотосинтетического фермента рибулозобисфосфаткарбоксилазы,
работающего
только
в
фотосинтезирующих тканях, например в листьях.
• Аналогично для контроля экспрессии некоторых
чужеродных генов использовали растительные
промоторы,
функционирующие
только
в
специфических
тканях
или
только
при
неблагоприятных условиях.
56.
57.
Рис. Пример транзиентной экспрессии гена uidAв тканях листа табака после обстрела золотыми
частицами.
58.
59. Схема создания трансгенных растений
60.
61.
• Введенные в геном растения трансгеныстановятся его резидентной частью,
проявляются как доминантные мутации
и наследуются согласно классическим
законам Менделя.
62. Т-ДНК-индуцированные мутации
• Трансгенныерастения
могут
служить
источником мутаций, вызванных природным
инсерционным агентом – Т-областью Tiплазмиды A. Tumefaciens.
• Перенос и интеграция в геном растения
чужеродных генов при агробактериальной
трансформации в некоторой степени сходны
с перемещением мобильных генетических
элементов.
63.
Спектр описанных в литературе Т-ДНКиндуцированных мутаций достаточно широк.Известны мутации,
затрагивающие морфологические признаки
(высота растений, размеры и форма
листовых пластинок, структура цветка),
влияющие на формирование мужского и,
обеспечивающие
снижению
женского
гаметофитов
(приводящие
к
мутации
фертильности,
а
также
нарушающие
развитие зародышей на ранних стадиях),
и
трансформантам
устойчивость
к
агробактериальному заражению .
64.
• Мутации,индуцированные
у
трансгенных
растений
внедрением
фрагментов
экзогенной
ДНК,
представляют
интерес
для
идентификации и клонирования генов,
что является важным направлением по
анализу
структурно-функциональной
организации генома растений.
65.
ТРАНСГЕННЫЕРАСТЕНИЯ
–
БИОПРОДУЦЕНТЫ
ФАРМАЦЕВТИЧЕСКИ
ЦЕННЫХ
БЕЛКОВ
ВЕТЕРИНАРНОГО
И
МЕДИЦИНСКОГО
НАЗНАЧЕНИЯ
(БИОФАРМИНГ)
66.
Перваяволна
трансгенных
растений,
допущенных
для
практического применения, содержала дополнительные гены
устойчивости (к болезням, гербицидам, вредителям, порче при
хранении, стрессам).
Нынешний этап развития генетической инженерии растений
получил название «метаболическая инженерия».
При этом ставится задача не столько улучшить те или иные
имеющиеся качества растения, как при традиционной селекции,
сколько научить растение производить совершенно новые
соединения, используемые в медицине, химическом производстве
и других областях.
Этими соединениями могут быть, например, особые жирные
кислоты, полезные белки с высоким содержанием незаменимых
аминокислот, модифицированные полисахариды, съедобные
вакцины, антитела, интерфероны и другие «лекарственные» белки,
новые полимеры, не засоряющие окружающую среду и многое,
многое другое.
Использование трансгенных растений позволяет наладить
масштабное и дешевое производство таких веществ и тем самым
сделать их более доступными для широкого потребления.
67.
Генетическимодифицированные
растения
могут служить
более
дешевым
и
безопасным
источником рекомбинантных белков
по
сравнению
с
традиционными
системами
экспрессии
на
основе
бактерий,
дрожжей,
культур
клеток
насекомых и млекопитающих.
68.
• Впервые идея использования клетокрастений для синтеза рекомбинантных
антигенов была успешно реализована в
1992 г. группой исследователей под
руководством
доктора
Чарлза
Арнтзена.
69.
Авторами этой работы было установлено, чтоповерхностный
HBsAg-антиген
вируса
гепатита В не только синтезируется в тканях
трансгенных растений табака, но и способен
к самосборке в вирусоподобные частицы
размером около 22 нм.
Такие
частицы
были
идентичны
рекомбинантным вирусоподобным частицам
HBsAg-антигена,
выделенным
из
промышленной рекомбинантной вакцины на
основе дрожжей, а также вирусоподобным
частицам из плазмы крови больных вирусом
гепатита В.
70. Свойства трансгенных растений
• Устойчивость к гербицидам• Устойчивость к насекомым
• Улучшение питательных свойств
– Золотой рис – содержит бета-каротин
– Соя с белками кукурузы
• Повышение длительности хранения
– Томат
– Цветы на срезку
• Изменение состава масла
• Самонесовместимость
71.
Крупнейшим успехом генной инженерииявилось
создание
под
руководством
швейцарского профессора И. Потрикуса
нового
сорта
риса
с
повышенным
содержанием провитамина А, железа и
фолиевой кислоты.
Употребление такого «золотого» риса
позволит компенсировать нехватку витамина
А в повседневном рационе, особенно в
странах, испытывающих его дефицит.
72.
Ещеодин
сорт
риса
(высокопродуктивный, устойчивый к
засухе и засолению почв) создали
американские ученые из Корнельского
университета.
Они перенесли в растительный геном
от обычной кишечной палочки два гена,
контролирующих
синтез
углевода
трегалозы, который обеспечивает
высокую устойчивость растений как к
высоким, так и низким температурам.
73.
• Потенциальнаясфера
применения
трансгенных
растений
необычайно
широка.
• Например, созданы растения для
очищения окружающей среды от
различного рода загрязнений, в том
числе
тяжелых
металлов;
для
биодеградации полимеров и т. д.
74.
• Первые трангенные растения былисозданы в начале 80-х годов прошлого
столетия, и уже в 1994 г. в США было
получено первое разрешение на
генетически
модифицированный
пищевой продукт – томаты «Flavr Savr»,
• а в 1995 г. отмечен выход на рынок
трансгенных растений кукурузы (Btкукурузы), устойчивых к насекомымвредителям.
75.
• В мире к 2012 г. быликоммерциализованы такие виды
сельскохозяйственных культур, как соя,
кукуруза, хлопчатник, рапс, сахарная
свекла, папайя, тыква, томаты, сладкий
перец, люцерна и тополь.
76.
• В 2014 г. планируется получить разрешение навозделывание нового сорта биотехнологического
картофеля Фортуна, устойчивого к фитофторозу, что
позволит сократить число обработок растений
фунгицидами и снизить потери урожайности.
• При одобрении регулирующих органов уже с 2013–
2014 гг. на Филиппинах могут начать высевать
«золотой» рис, а в Индонезии – засухоустойчивый
сахарный тростник.
К 2015 г. ожидается, что число стран, возделывающих
биотехнологические культуры, возрастет за счет
присоединения
нескольких
новых
стран
из
развивающихся регионов.
77.
• К настоящему времени выведены линиитрансгенных мышей, которые используются как
модельные системы для изучения механизма
возникновения рака, муковисцидоза, болезни
Альцгеймера и других заболеваний человека.
78. История
• Первые ГМ растения были получены в 1982 г. учеными изИнститута растениеводства в Кельне и компании Monsanto.
• Первые
трансгенные
растения
(растения
табака
со
встроенными генами из микроорганизмов) были получены в 1983
г.
• Первые успешные полевые испытания трансгенных растений
(устойчивые к вирусной инфекции растения табака) были
проведены в США уже в 1986 г.
• 1994 г. Первые продажи томата Flavr-Savr с замедленным
созреванием, созданные фирмой «Calgen», а также гербицидустойчивая соя компании «Monsanto».
• В РФ возможность получения трансгенного картофеля методом
бактериальной трансформации с использованием Agrobacterium
tumefaciens была показана в 1990 г.
• 1999 г. отказ Европы от ГМ сои
• 2006 г. посевы ГМ растений в мире превышают 100 млн. гектаров.
79.
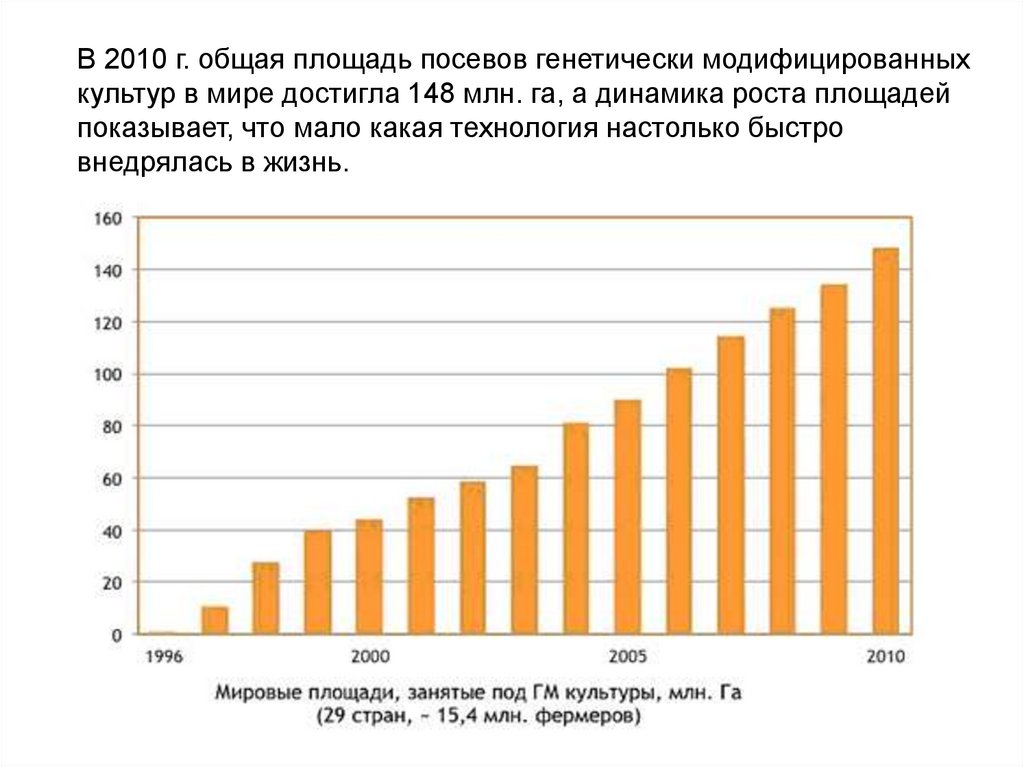
В 2010 г. общая площадь посевов генетически модифицированныхкультур в мире достигла 148 млн. га, а динамика роста площадей
показывает, что мало какая технология настолько быстро
внедрялась в жизнь.
80.
• 2011 г. – 160 млн га• 2012 г. - 170,3 млн га
81. Трансгенные культуры
Соя
Кукуруза
Хлопок
Рапс
Сахарная свекла
Томат
Табак
Картофель
Лен
Папая
Рис
Дыня
82.
Используемые основные генетическимодифицированные
сорта растений
По культурам :
1. соя - 60% общей ГМ площади
2. кукуруза (RR и Bt) - 23% общей ГМ площади
3. хлопчатник - 11 % общей ГМ площади
4. рапс - 6 % общей ГМ площади
По признаку :
- Гербицид-устойчивые ГМО - 72%
- Bt культуры — 19%
- Устойчивые к гербициду+вредителям - 9%
83.
• уменьшить поглощение гербицида растениемобеспечить синтез белка, чувствительного к
гербициду, в таком количестве, чтобы его хватало на
выполнение присущих ему функций в присутствии
гербицида
уменьшить способность белка, чувствительного к
гербициду, к связыванию с ним
обеспечить инактивацию гербицида в растении в
ходе метаболизма.
84.
• Были получены растения, устойчивые к глифосату - гербициду,быстро разлагающемуся в почве на нетоксичные составляющие
и потому безопасному для окружающей среды.
• Глифосат является ингибитором 5-енолпирувилшикимат-3фосфатсинтазы (EPSPS) - фермента, играющего важную роль в
синтезе ароматических аминокислот и у бактерий, и у растений.
• Из глифосатустойчивого штамма E. coli был выделен ген,
кодирующий EPSPS, помещен под контроль растительного
промотора
и
сигналов
терминации
транскрипции/полиаденилирования и введен в растительные
клетки.
• Трансгенные растения табака, петуньи, томата, картофеля и
хлопка, синтезировавшие EPSPS в количестве, достаточном
для замены ингибированного гербицидом растительного
фермента, были устойчивы к глифосфату и при обработке, в
отличие от сорняков, не погибали.
85. Устойчивые к гербицидам ГМ-растения
Из генома сорных растений выделен ген,ответственный за кодирование белка,
связывающего атразин.
• Введение такого гена в геном культурного
растения делает полученное трансгенное
растение устойчивым к гербицидам.
86.
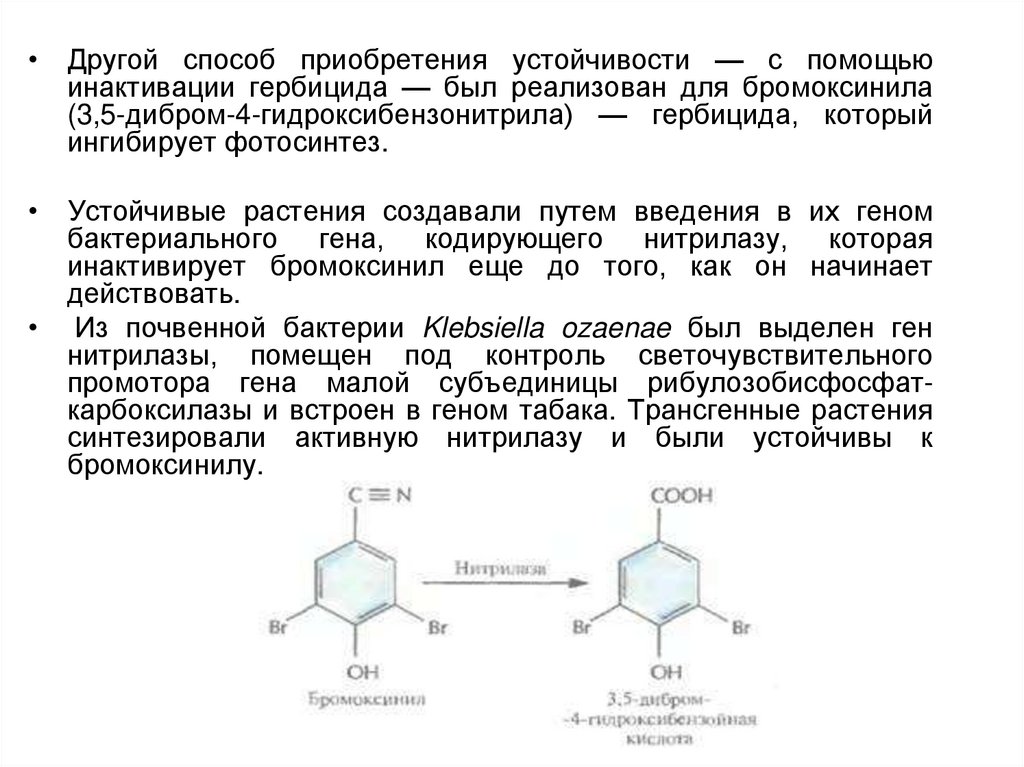
• Другой способ приобретения устойчивости — с помощьюинактивации гербицида — был реализован для бромоксинила
(3,5-дибром-4-гидроксибензонитрила) — гербицида, который
ингибирует фотосинтез.
• Устойчивые растения создавали путем введения в их геном
бактериального гена, кодирующего нитрилазу, которая
инактивирует бромоксинил еще до того, как он начинает
действовать.
• Из почвенной бактерии Klebsiella ozaenae был выделен ген
нитрилазы, помещен под контроль светочувствительного
промотора гена малой субъединицы рибулозобисфосфаткарбоксилазы и встроен в геном табака. Трансгенные растения
синтезировали активную нитрилазу и были устойчивы к
бромоксинилу.
87. Устойчивые к фитопатогенам ГМ-растения
• Для разрушения клеточныхстенок фитопатогенных грибов
в
растения
вводят
гены
хитиназы и β-1,3-глюконазы.
• Так
получены
растения
табака,
хлопка,
кукурузы,
рапса, картофеля, томата,
риса.
88.
создания растений, устойчивых к насекомымвредителям, с помощью генноинженерных методов былиразработаны различные стратегии.
• Для
• В одном случае использовали ген инсектицидного протоксина,
продуцируемого одним из подвидов Bacillus thuringiensis.
В другом — гены растительных белков типа ингибиторов амилазы
или протеиназ, эффективных в отношении широкого круга
насекомых.
• Насекомое, в организм которого попадал один из этих ингибиторов,
было не способно переваривать растительную пищу, потому что
ингибиторы препятствовали гидролизу крахмала или растительных
белков.
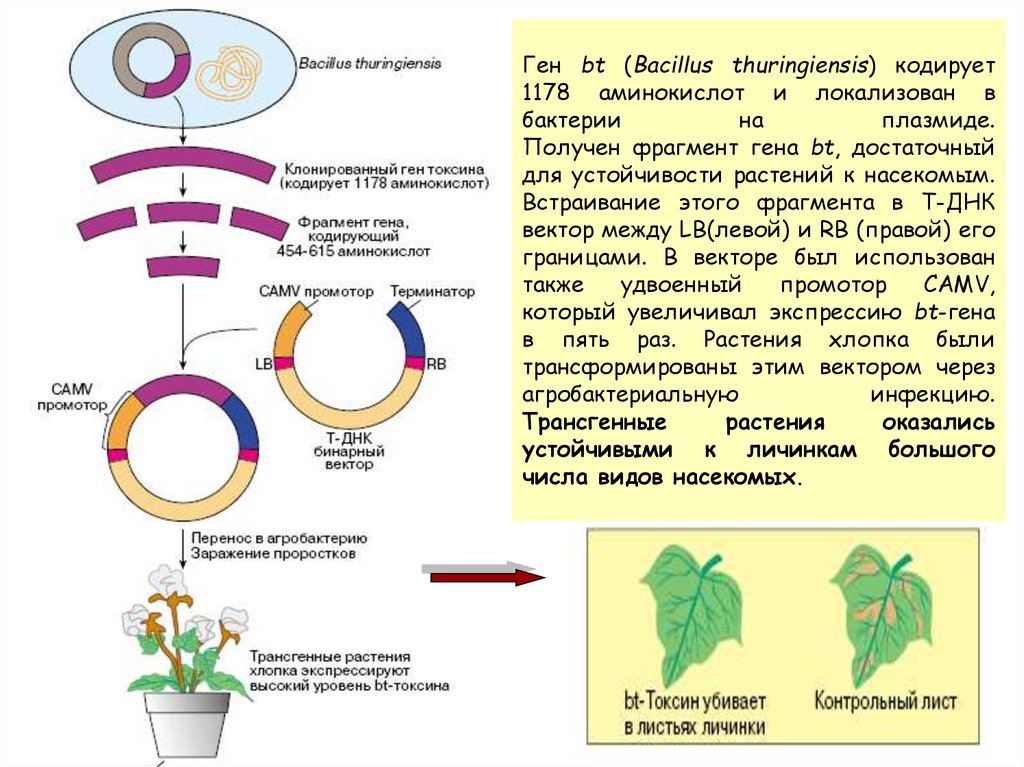
89. Ген bt (Bacillus thuringiensis) кодирует 1178 аминокислот и локализован в бактерии на плазмиде. Получен фрагмент гена bt,
достаточныйдля устойчивости растений к насекомым.
Встраивание этого фрагмента в Т-ДНК
вектор между LB(левой) и RB (правой) его
границами. В векторе был использован
также
удвоенный
промотор
CAMV,
который увеличивал экспрессию bt-гена
в пять раз. Растения хлопка были
трансформированы этим вектором через
агробактериальную
инфекцию.
Трансгенные
растения
оказались
устойчивыми к личинкам большого
числа видов насекомых.
90.
Методы генной инженерии позволяютвстраивать в растение-реципиент сразу
несколько разных генов устойчивости,
создавая, таким образом, «пирамиду
генов», обеспечивающую комплексную
резистентность сорта.
91.
Существуют две стратегии изменения окраскицветков с помощью трансгенных технологий:
1.
Количественный и качественный контороль
эндогенных флавоноидный пигментов в цветках –
снижение содержания эндогенных пигментов путем
ингибирования
активности
соответствующих
ферментов для их биосинтеза (получение белых
цветков у табака и петунии, 1988; у генцианы и
бледно-голубых у торении, 2006).
2. В накоплении в них неестественных (уникальных)
пигментов – трансгенные роза сорт Эплоуз (Япония,
2007) и гвоздика (2009, выращивается в колумбии,
Эквадоре и Австралии для продажи в Северной
Америке),
накапливающие
антоцианины
дельфидинового
типа,
которые
обычно
не
содержатся в этих видах.
92.
93. Изменение окраски цветков
• Можно использовать методы, основанные наманипуляциях с генами ферментов биосинтеза
антоцианинов.
• Антоцианины, соединения класса флавоноидов,
являются наиболее распространенными пигментами
цветков.
Они синтезируются из аминокислоты фенилаланина
в ходе нескольких ферментативных реакций. Окраска
цветка определяется химическими свойствами их
боковой цепи, при этом производные цианидина
ответственны за красный цвет, а производные
дельфинидина зa синий.
94.
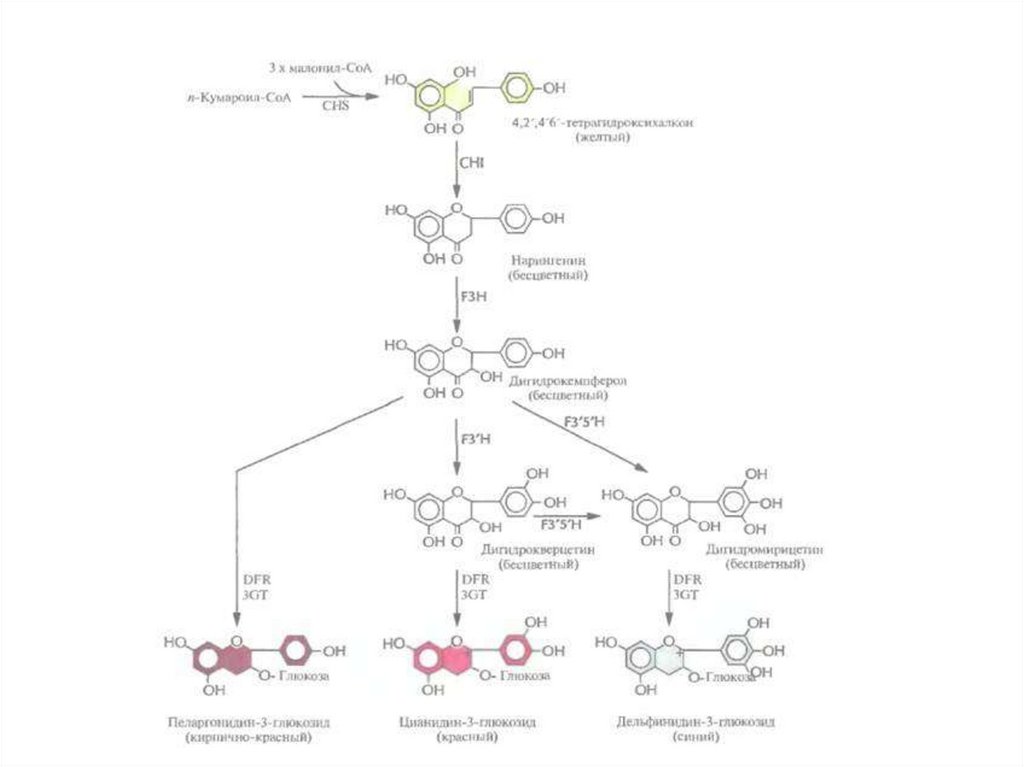
• Дигидрофлавонол-4-редуктазапетуньи
катализирует
превращение бесцветного дигидрокверцетина в цианидин-3глюкозид, соединение красного цвета, а бесцветного
дигидромирицетина — в синий дельфинидин-3-глюкозид, но не
может использовать в качестве субстрата бесцветный
дигидрокемпферол.
Однако
после
трансформации
петуньи
геном
дигидрофлавонол-4-редуктазы кукурузы ее цветки приобретают
кирпично-красную окраску (1987). Этот необычный цвет, никогда
ранее у петуний не наблюдавшийся, обусловлен синтезом в
трансгенном
растении
пеларгонидин-3-глюкозида
из
дигидрокемпферола.
95.
• Модификация аромата• Биосинтез
компонентов
запаха
регулируется
главным образом на уровне транскрипции, и
скорость
биосинтеза
часто
ограничивается
отсутствием субстрата для ферментов.
• На 2011 г. не удалось создать генетически
модифицированные сорта цветочных культур с
измененным ароматом.
• У роз в ходе селекции утерян естественный аромат
при увеличении вазовой жизни.
96. Растения как биореакторы
• Крупномасштабныйбактериальный
синтез
поли-βгидроксибутирата, полимера, из которого получают пластик,
подверженный биодеградации, обходится довольно дорого.
• В бактериях типа Alcaligenes eutrophus поли-β-гидроксибутират
синтезируется из ацетил-СоА в три стадии, катализируемые
тремя ферментами, гены которых входят в один оперон.
• Растения неспособны процессировать транскрипт оперона с
более чем одним геном, поэтому каждый из генов был
клонирован по отдельности и встроен в хлоропластную ДНК
растения Arabidopsis thaliana.
Хлоропласты были выбраны потому, что, как показали
выполненные ранее эксперименты, в цитоплазме полимер
синтезировался
в
небольшом
количестве,
при
этом
большинство растений были чахлыми. Кроме того, в
хлоропластах может накапливаться другой биополимер —
крахмал.
97.
• К каждому из трех генов поли- β -гидроксибутирата былиприсоединены фрагменты ДНК, кодирующие хлоропластную
сигнальную
последовательность
малой
субъединицы
рибулозобисфосфат-карбоксилазы гороха, и каждый ген был
помещен под транскрипционный контроль 35S-промотора вируса
мозаики
цветной
капус
ты.
• Гены были введены в растения A. thaliana в составе бинарных
векторов на основе Ti-плазмид.
• Два трансгенных растения, каждое со своим чужеродным геном,
скрещивали, чтобы получить растения с двумя чужеродными
генами, включенными в хлоропластную ДНК.
• Затем трансгенное растение с двумя чужеродными генами
скрещивали с растением, несущим третий чужеродный ген, и
отбирали растения, несущие все три бактериальных гена поли-βгидроксибутирата.
• В зрелых листьях некоторых трансгенных растений, экспрессирующих все три бактериальных гена, синтезировалось
более 1 мг поли-β-гидроксибутирата на I г сырой ткани листа. Эту
работу можно считать первым важным шагом в создании
сельскохозяйственных культур, которые можно использовать для
получения в больших количествах поли-β-гидроксибутирата.
98. Страны, выращивающие ГМ растения
СШАБразилия
Аргентина
Мексика
Канада
Китай
ГМ-культуры выращивались в 2010 г. в 29 странах.
Основные площади были заняты:
под биотехнологические сою (53%),
кукурузу (30%),
хлопчатник (12%)
и рапс (5%).
99. Трансгенные культуры в США
При этом в США доля генетически модифицированной сои вобщем производстве сои превысила
Соя – 90%
Хлопок – 80%
Кукуруза – 75%
ГМ-томаты не получили разрешения на использование нигде,
кроме США, Канады Мексики и Японии.
Всего существовало шесть зарегистрированных линий ГМтоматов, пять из которых имели свойство «отложенного
созревания» для улучшения технологических свойств при
транспортировке, и одна – устойчивость к насекомым (с геном из
повсеместно распространенной почвенной бактерии Bacillus
thuringiensis).
100.
Животные-биореакторыУ крупного рогатого скота на литр молока может
экспрессироваться около 2 гр рекомбинантного белка.
Учитывая
среднюю
молочную
продуктивность
и
эффективность очистки, 5400 коров могли полностью
покрывать годовую потребность в 100 000 кг сывороточного
альбумина человека; 4500 овец - 5000 кг антитрипсина, 100
коз для получения 100 кг литров молока с концентрацией
моноклональных антител 0.5–1.0 µг/мл.
Некоторые фармакологические продукты, полученные
таким путем, уже широко используются, такие, как,
например, антитела к антитромбину III у молочных коз, 75
коз для продукции 75 кг антитромбина III и 2 животных для
получения 2 кг фактора свертываемости IX в год.
101.
Трансплантация органовБлагодаря
успешным
трансплантациям
в
настоящее время живут 250 000 людей. Около 75–90%
пациентов
выживают
в
первый
год
после
трансплантации.
Среднее время жизни людей после трансплантации
сердца, печени или почек около 10–15 лет. Тем не
менее, все время существует дефицит органов для
трансплантации. В листе ожидания США насчитывается
более 88000 пациентов и соотношение между
имеющимися органами и пациентами сохраняется 1:4
(http://www.unos.org).
Альтернативный
источник
органов
–
ксенотрансплантация.
Для
этого
пытаются
использовать органы трансгенных свиней.
102.
Получение трансгенных свиней, экспрессирующих белкичеловека, которые подавляют запуск каскада событий, связанных с
комплементом, таких как hCD59 и hDAF, способствуют преодолению
иммунологического барьера.
Удалось достичь выживания приматов в течение 23 дней с
пересаженным сердцем от трансгенной свиньи.
Другая стратегия преодоления острого отторжения связана с
«выбиванием»
генов,
контролирующих
образование
антигенных структур таких как 1,3-гал-эпитопы, которые
отсутствуют у человека, формирование которых определяются
активностью 1,3-галактозилтрансферазы.
Получены трансгенные поросята с делетированными обоими
аллелями 1,3-галактозилтрансферазы.
103.
Увеличение резистентности к болезнямЛизостафин – пептидогликан гидролаза, которая
секретируется Staphylococcus simulans и оказывает
бактерицидное действие на другие стафиллококки, в
том числе и на S. aureus.
Эффективность
использования
лизостафина
против S. aureus была подтверждена у трансгенных
по этому гену мышей, у которых лизостафин
экспрессировался в эпителии молочной железы.
Получены трансгенные коровы, у которых в
молоко секретируется лизостафин в концентрации 14
мг/мл.
104.
• Начало дискуссии по проблеме биобезопасности в науке и обществеположили основатели нового направления — биоинженерии.
• В 1974 г. 11 ведущих молекулярных биологов мира во главе с
американцем П. Бергом, создавшим первую рекомбинантную
молекулу ДНК, обратились к мировому сообществу с письмом через
журнал «Science», в котором предложили отказаться от
экспериментов
с
рекомбинантными
ДНК
до
проведения
международной конференции по этой проблеме.
• В 1975 г. на конференции в Асиломаре (США) ученые пришли к
выводу - эксперименты в области генной инженерии не более
опасны, чем аналогичные работы в других отраслях, но при этом, как
и везде, необходим строгий контроль за соблюдением мер
безопасности.
• В 1976 г. в США были приняты первые правила, регламентирующие
работу с рекомбинантными микроорганизмами, которые запрещалось
выпускать за стены лабораторий.
• В конце 70-х годов в большинстве стран мира было разработано
соответствующее законодательство.
• Постепенно эти правила корректировались в сторону смягчения
жесткости требований, так как 30 лет интенсивных работ по
генетической инженерии свидетельствуют о безопасности этих
исследований.
105. О понятии безопасности
• Природные, техногенные и другие факторыоказывают постоянное и значительное воздействие на
человека и окружающую его среду обитания.
• Главнейшим объектом безопасности является
человек с его потребностями, правами и здоровьем.
Безопасность человека не может быть обеспечена без
защиты безопасности среды его обитания и
жизнедеятельности, а также общества, в котором он
живет.
• Безопасность может быть биологической,
экологической, экономической, продовольственной,
военной и другой в зависимости от внутренних и
внешних факторов, масштабы, направленность и
степень воздействия которых угрожают деятельности,
существованию и самой жизни объектов (человека,
общества, государства, цивилизации в целом).
106.
Во всех государствах мира разработаны иприменяются различные методы контроля
• за технологическими процессами и качеством
вновь вовлеченных в сферу использования
человеком новых биологических объектов и
веществ,
• их токсичностью,
• аллергенностью и
• общей безопасностью для здоровья людей и
состояния окружающей среды.
107. Биобезопасность в клеточных, тканевых и органных биотехнологиях
• Манипуляции с растительными и животными клетками иих органеллами, а также с одноклеточными
микроорганизмами основаны на фундаментальных
исследованиях биологии и цитологии клеток и тканей,
открытии явления тотипотентности клеток ,а также на
выявлении способности к слиянию (соматическая
гибридизация), обмену органеллами, дифференциации
и дедифференциации.
• В клеточных технологиях для получения клеток с
измененной наследственностью используют
спонтанный и направленный мутагенез.
• Поэтому в клеточных биотехнологиях необходим
постоянный мониторинг за спектром соматической
вариабельности. В большинстве случаев соматическая
вариабельность позволяет получать материал для
селекции растений с улучшенными или исходными
свойствами в границах обеспечения
биобезопасности.
108.
Задача клеточной биотехнологии — получение
устойчивых генотипов сельскохозяйственных растений
комплексно
В этой связи лабораторный и полевой контроль за полученными
клеточными регенерантами растений является крайне важным с точки
зрения экологической безопасности при использовании в производстве.
Система государственного испытания и регистрации сортов и гибридов
при строгом соблюдении утвержденных методов и критериев оценки
позволяет значительно ограничить подобную опасность.
109.
• Технология получения продуктов вторичного метаболизма вбиореакторах на основе культуры клеток и суспензий дает
возможность
непрерывно
автоматически
контролировать
и
своевременно выявлять различные отклонения от нормы по
основным параметрам и качеству получаемой продукции, не
допускать возникновения опасных нарушений в любом звене
технологического процесса.
• Биотехнологи, работающие с клетками (их суспензиями) и тканями
животных, отмечают случаи накопления токсичных веществ в
последних при нарушении техники и технологии их хранения и
использования.
• Таким образом, в растениеводстве в целом складывается безопасная
ситуация при использовании клеточных биотехнологий в селекции,
получении продуктов вторичного метаболизма для фармацевтической
и пищевой промышленности. В то же время в животноводстве
требуется проводить более жесткий контроль за производством и
качеством продукции, получаемой на основе клеточных и тканевых
технологий.
110. Генетический риск и биобезопасность в биоинженерии
• Встраивание в ДНК реципиентной клетки чужеродного донорского генасопряжено с определенными трудностями
Проблема нормального их функционирования — экспрессии
• Возможно получение мутантов с содержанием токсичных или
аллергенных для человека белков или других опасных соединений.
Дестабилизация генома при трансгенозе может происходить не только за
счет обогащения генома новыми генами или мутагенного эффекта
вставки, а, возможно, в силу индуцирования эндогенных систем
рекомбинации и активации «молчащих» генов (Газарян).
Все это дает основание считать теоретически возможным возникновение
при трансгенозе генотипов, опасных для здоровья и жизни человека.
Риск получения таких мутантов значительно возрастает при
использовании искусственных, синтетических генов для получения
трансгенных растений, животных и микроорганизмов с улучшенными и
принципиально новыми свойствами.
• Спонтанный перенос с пыльцой в другие растения геновмодификаторов, при взаимодействии которых возможно появление
новых генотипов с опасными свойствами для человека и окружающей
среды.
111. Возможные риски использования трансгенных растений
• Bt токсин – возможность сохранения срастительными остатками
• Повышение использования гербицидов
• Аллергия: возможность появления новых алергенов
• Токсические эффекты – изменение метаболических
путей
• Возможность появления устойчивости бактерий к
антибиотикам
• Возможность переноса генов в дикие виды
112.
Опасности ГМ сортов: пищевые (за исключением хлопка, рапса), иэкологические – распространение трансгенных конструкций.
Пищевые: Регулирование процесса биотехнологии в США осуществляют три
государственных органа:
Министерство сельского хозяйства США (USDA);
Управление по охране окружающей среды (ЕРА);
Управление продуктов питания и лекарств (FDA).
FDA использует термин «биоинженерные пищевые продукты» для обозначения
созданных с использованием ГМ технологий. До настоящего времени, с 1996 г
первого выхода на рынок трансгенного помидора, по 2010 г, достоверных
данных о пищевой опасности распространенных сортов ГМ растений не
получено.
Заявление на сертификацию нового сорта включает руководство, содержащее
вопросы, ответы на которые должны дать производители пищевых продуктов из
новых сортов растений, чтобы обеспечить безопасность новых продуктов и
подтвердить соответствие требованиям действующего законодательства, а
также, чтобы побудить представителей пищевой промышленности к
проведению консультаций с FDA по вопросам безопасности новых пищевых
продуктов.
113.
Экологические - обсуждаются три основных аспекта:1. Не будут ли организмы, полученные методами генной
инженерии, оказывать вредное воздействие на другие
живые организмы или на окружающую среду?
Сконструированные гены могут быть переданы с пыльцой
близкородственным диким видам и их гибридное потомство
приобретет новые привнесенные свойства или способности
конкурировать с другими растениями.
114.
2. Не приведет ли создание и распространениегенетически
модифицированных
организмов
к
уменьшению природного генетического разнообразия?
Трансгенные сельскохозяйственные растения могут
стать сорняками для сельского хозяйства и вытеснить
произрастающие рядом другие растениия.
Трансгенные растения могут стать прямой угрозой
для человека, домашних и диких животных (например,
из-за их токсичности или аллергенности).
3. не нанесет ли молекулярная биотехнология
ущерб традиционному сельскому хозяйству?
115.
Исследования выполнялись по переопылению на трансгенномрапсе, картофеле, ряду других культурных растений; установлены
оптимальные границы для исключения переопыления; на
почвенных микроорганизмах и т.д.
Основной вывод: горизонтальный перенос есть – но его
количества исчезающие в пространстве и поколениях.
Наиболее яркие данные по горизонтальному преносу трансгенной
конструкции получены на кукурузе в Мексике.
116.
Вывод – экологическая опасность определяется качествомконтроля за легальными посевами трансгенных сортов.
Отсутствие производства трансгенных сортов и легального
контроля их использования способствует горизонтальному
распространению трансгенных конструкций за счет нелегального
использования, неизбежного в связи с коммерческими
преимуществами.
117. На чем основана биобезопасность
Использованием природных генов, которые на протяжении всей
эволюции
участвовали
и
участвуют
в
рекомбиногенезе,
подвергаются отбору и элиминации, вследствие чего выработались
механизмы на всех уровнях организации биологических объектов,
обеспечивающие устойчивый характер репарации нарушенных
процессов биосинтеза белков;
• Разработкой и постоянным применением эффективных методов
мониторинга за качеством получаемых трансгенных организмов и
прежде всего за составом и свойствами белковых компонентов
вновь созданных генотипов, что позволяет заблаговременно, на
этапе создания ГМО выявлять опасные для человека и окружающей
среды генотипы и не допускать их выпуска из лаборатории для
использования в производстве и продовольственном обороте;
• Отбором известных, проверенных природных генов и их
регуляторных генетических структур и созданием на их основе
векторов, обеспечивающих получение трансгенов с заданными
свойствами.
118. Критерии, показатели и методы оценки биобезопасности генетически модифицированных организмов (ГМО) и получаемых из них
продуктовСанитарно-гигиеническая экспертиза - проводят в
Институте питания РАМН
• Показатели:
химическому составу исходных и трансгенных
растений;
биологической
ценности
и
усвояемости
приготовленных из ГМО продуктов;
выявлению токсичных, канцерогенных, мутагенных и
аллергенных веществ в продуктах, полученных на
основе использования ГМО;
оценке влияния ГМО на репродуктивные функции
животных и человека.
119.
Испытания на биобезопасность проводятся• в Центре биоинженерии РАН,
• ВНИИ фитопатологии РАСХН
• ВНИИ биологической зашиты растений РАСХН
По следующим направлениям:
проверка генов, интегрированных в геном растений,
на способность наследования в потомстве и их
переноса в другие организмы;
оценка влияния новых генов
растений к болезням и вредителям;
на
устойчивость
выявление и анализ характера изменчивости
почвенной микрофлоры и других составляющих
биоценоза под влиянием трансгенных растений.
120.
Медико-биологическая оценка пищевой продукции,полученной из ГМО.
Разработаны методические указания — «Медикобиологическая оценка пищевой продукции, полученной из
генетически модифицированных источников», которые
введены в действие Минздравом РФ 1 июня 2000 г.
В методических указаниях установлены порядок
гигиенической экспертизы и государственной регистрации
пищевой продукции, полученной из ГМО, а также
утверждены методики медико-гигиенической, медикобиологической оценки и клинических испытаний новых
видов пищевой продукции, полученных на основе ГМО.
Методические
указания
являются
официальным
изданием
и
их
выполнение
должно
строго
контролироваться Министерством здравоохранения РФ, а
также соответствующими юридическими и правовыми
органами РФ.
121.
Государственный контроль и регулирование генно-инженернойдеятельности и использования генетически модифицированных
организмов (ГМО) и полученных из них продуктов
Принятые законы и другие государственные акты, создают нормативно-правовую базу.
Закон «О государственном регулировании в области генноинженерной деятельности» - 5 июня 1996 года за № 86-ФЗ
На основании ФЗ № 86-ФЗ правительство РФ приняло ряд
постановлений, обеспечивающих его реализацию. При этом
предусматривается
создание
Межведомственной
комиссии
по
проблемам генно-инженерной деятельности для контроля за
выполнением закона и постановлений правительства.
Постановлением № 120 от 16 февраля 2001 г. утвердило положение
«О государственной регистрации генно-инженерномодифицированных
организмов», предназначенных для первого на территории Российской
Федерации
выпуска
в
окружающую
среду,
промышленного
использования или импорта. Регистрацию ГМО и ведение сводного
государственного реестра правительство возложило на Министерство
промышленности, науки и технологий (Минпромнауки) РФ.
В соответствии с этим постановлением Минпромнауки РФ приказом
№ 264 от 10 июля 2001 года был создан Экспертный совет по вопросам
биобезопасности и утверждено положение
122.
• ФЗ № 29-ФЗ «О качестве и биобезопасности пищевыхпродуктов» от 2 января 2000 г.
• В соответствии с этим законом правительство
Российской Федерации приняло постановление № 988
от 21 декабря 2000 г. «О государственной регистрации
новых пищевых продуктов, материалов и изделий». введены государственная регистрация новых пищевых
продуктов, материалов и изделий и государственный
реестр на перечисленные виды товаров, разрешенных
для изготовления, ввоза и оборота на территории
Российской Федерации.
• Осуществлять эту работу поручено Министерству здравоохранения
РФ, а относительно продуктов животного происхождения —
совместно с Министерством сельского хозяйства РФ.
• С 2001 г. в России установлена система обязательной
маркировки пищевых продуктов, полученных из
генетически модифицированных источников, введение
которой обеспечивает условия для выбора гражданами
товаров с учетом их генетической природы (5%)
• 1 июня 2004 г. новый пороговый уровень - более 0,9%.
123.
• Система государственного контроля в США в основесвоей не отличается от российской, но она имеет и свои
особенности.
• Так, в США за государственную регистрацию генетически
модифицированных организмов отвечают три ведомства
— Министерство здравоохранения, Министерство
сельского хозяйства и Министерство экологии. Решение о
регистрации модифицированных организмов каждое из
этих министерств принимает самостоятельно, независимо
от других. Положительное заключение может быть
принято только на основании согласия всех трех
ведомств.
• Департамент сельского хозяйства США (USDA), Служба
ветеринарной инспекции и зашиты растений (APHIS) в
соответствии с утвержденными правилами и процедурой
уведомления (нотификацией) принимают решение о
передвижении ГМО между штатами, импорте и выпуске их
в окружающую среду. Эти правила впервые были
опубликованы и вступили в силу в США еще в марте 1993
г.
124.
• В США создан и действует Национальный центр информации побиотехнологии. Главная задача - увеличение объема сбора,
хранения, поиска и распространения результатов исследований в
области биотехнологии и биоинженерии посредством применения
информационных систем.
• В США создана и действует Национальная комиссия по развитию
биотехнологий и Экспертный совет для оценки ГМО и получаемой из
них продукции.
• В исполнительной ветви федерального правительства создана
Комиссия по национальной стратегии в области биотехнологии, в
состав которой в качестве членов входят министры сельского
хозяйства, торговли, обороны, энергетики, председатель Комитета по
продуктам питания и медикаментам, руководитель Агентства по
экологии, директор Национального научного фонда, директора
многих научно-исследовательских институтов, департаментов и
отделов различных министерств и ведомств, другие должностные
лица и ведущие ученые биотехнологической науки.
• Комиссия имеет широкие полномочия: оценивает программы и
деятельность федерального правительства в области биотехнологии
и биоинженерии и представляет по мере необходимости свои
рекомендации президенту и конгрессу страны по всем основным
вопросам состояния и развития биотехнологии и биоинженерии в
США.
125.
Европарламент и правительство ЕЭС приняли ряд
специальных документов, ограничивающих и даже
запрещающих
выпуск
в
окружающую
среду
генетически модифицированных растений и других
организмов.
• По прогнозу, согласно Кельнскому Протоколу (2007
г.), к 2030 г. отношение к сельскохозяйственным ГМ
культурам изменится в сторону одобрения их
использования.













































































































 biology
biology








