Similar presentations:
Лекція_№16_Ферум_Залізо_80dcd0a5_19ab_4d88_b39f_76f77aa04762
1.
Лекція №16Тема:
Ферум.
Залізо та його сполуки.
КЗ ХБМФК ХОР
Циклова комісія
Хіміко-біологічних дисциплін
Голова ЦК Бочкарьова Т.В.
2.
Актуальність темиЗалізо — хімічна речовина, яка складається з феруму — хімічного елемента з
атомним номером 26, що позначається в хімічних формулах символом Fe (від англ.
Ferrum).
За поширеністю в природі ферум посідає друге місце серед металів (після
алюмінію). На нього припадає 5,10 % маси земної кори. За вмістом у земній корі
ферум посідає 4-е місце. Зустрічається він виключно у вигляді сполук. Вільне
залізо знаходять лише в метеоритах.
Ферум — поширений елемент метеоритної речовини: в кам'яних метеоритах
міститься до 25 %, а в залізних 90,85 мас.% Fe. Космічна поширеність заліза
близька до його вмісту в фотосфері Сонця — 627 г/т. Частка феруму в речовині
Землі досить велика — 38,8 %. Найбідніша на ферум поверхня Землі.
Використання заліза почалося набагато раніше, ніж його виробництво. Перші
залізні вироби мали космічне (метеоритне) походження і були виготовлені з
уламків метеоритів ще в III—II тис. до н. е.
Першими, хто почав на землях сучасної України виплавляти з болотної руди
залізо, були кіммерійці (VII ст. до н. е.). У IV—III ст. до н. е. більша частина арсеналу
зброї скіфських воїнів — мечі, кинджали, бойові сокири тощо було виготовлено з
заліза.
3.
План1.Загальна характеристика хімічного елемента
2.Поширеність Феруму в природі
3.Фізичні властивості заліза
4.Хімічні властивості заліза
5.Застосування заліза, його сплавів
та сполук Феруму
6.Біологічне значення Феруму
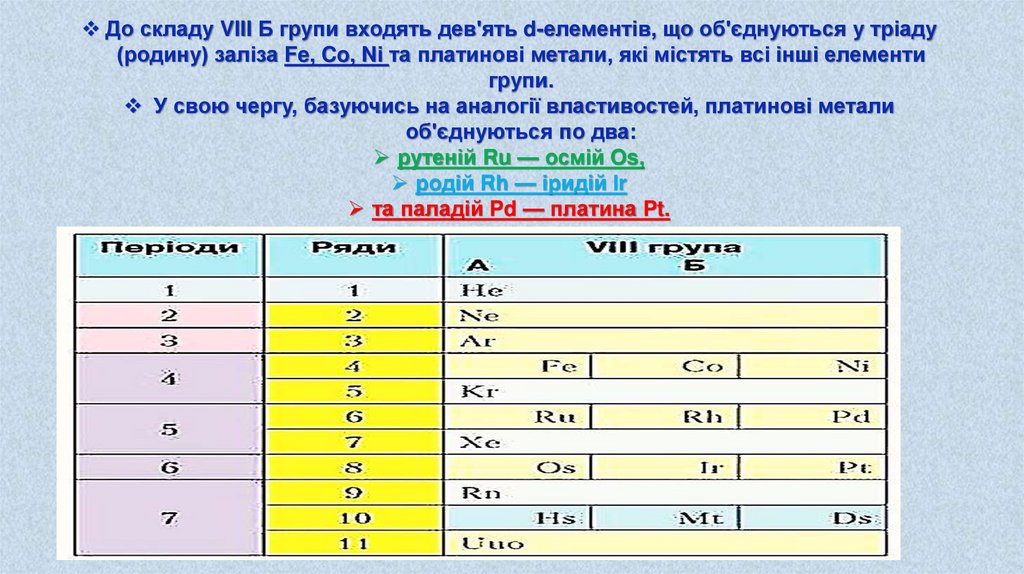
VIII Б група періодичної системи є особливою.
На відміну від інших груп вона містить по три елементи у кожному періоді.
Це метали, які, по-перше, не мають типових аналогів, а по-друге, не утворюють
сполук, ступінь окиснення в яких відповідав би повному числу валентних
електронів, а саме — восьми.
4.
До складу VIII Б групи входять дев'ять d-елементів, що об'єднуються у тріаду(родину) заліза Fe, Co, Ni та платинові метали, які містять всі інші елементи
групи.
У свою чергу, базуючись на аналогії властивостей, платинові метали
об'єднуються по два:
рутеній Ru — осмій Os,
родій Rh — іридій Іr
та паладій Pd — платина Pt.
5.
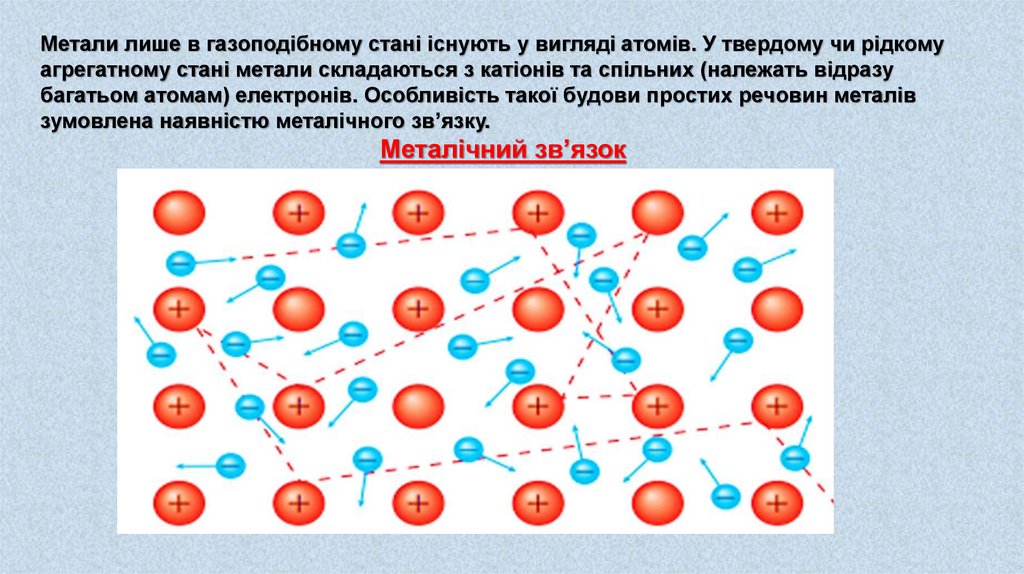
Метали лише в газоподібному стані існують у вигляді атомів. У твердому чи рідкомуагрегатному стані метали складаються з катіонів та спільних (належать відразу
багатьом атомам) електронів. Особливість такої будови простих речовин металів
зумовлена наявністю металічного зв’язку.
Металічний зв’язок
6.
Найбільше значення у фармацевтичній та медичній практиці маютьметали тріади заліза.
Ферум — металічний елемент. Він має відносно невелику електронегативність 1,83 (за
Полінгом), що характерно для більшості металічних елементів. За будовою електронної
оболонки атома він є d-елементом, оскільки в його атомів електронами заповнюється dпідрівень:
У більшості сполук Ферум виявляє два ступені окиснення. Втрачаючи два електрони
зовнішнього енергетичного рівя, його атоми набувають заряд +2:
У такому стані в йонах Fe(2+) на 3d-підрівні міститься шість електронів, але більш стабільним
є стан, коли 3d-підрівень буде заповнений наполовину. Для цього йону Fe(2+) необхідно
віддати один електрон. У такий спосіб утворюються йони Fe(3+), які мають стабільнішу
електронну конфігурацію:
7.
Поширення в природіЗа поширеністю у природі ферум посідає друге місце
серед металів (після алюмінію). На нього припадає 5,10 %
маси земної кори. За вмістом у земній корі ферум посідає
4-е місце.
Найважливішими природними сполуками феруму, що
мають промислове значення, є
магнітний залізняк Fe3O4,
червоний залізняк Fe2O3,
бурий залізняк Fe2O3 · nH2O
пірит FeS2.
Оксиди феруму служать рудами, з яких добувають залізо,
а пірит — сировиною для сульфатно-кислотного
виробництва.
У самородному стані Ферум не трапляється, але у вигляді
простої речовини залізо міститься у складі деяких
метеоритів, які іноді знаходять на поверхні Землі .
Вважають, що саме залізо становить більшу частину ядра
Землі та планет земної групи.
Гідротермальне
джерело
з високим вмістом
заліза
8.
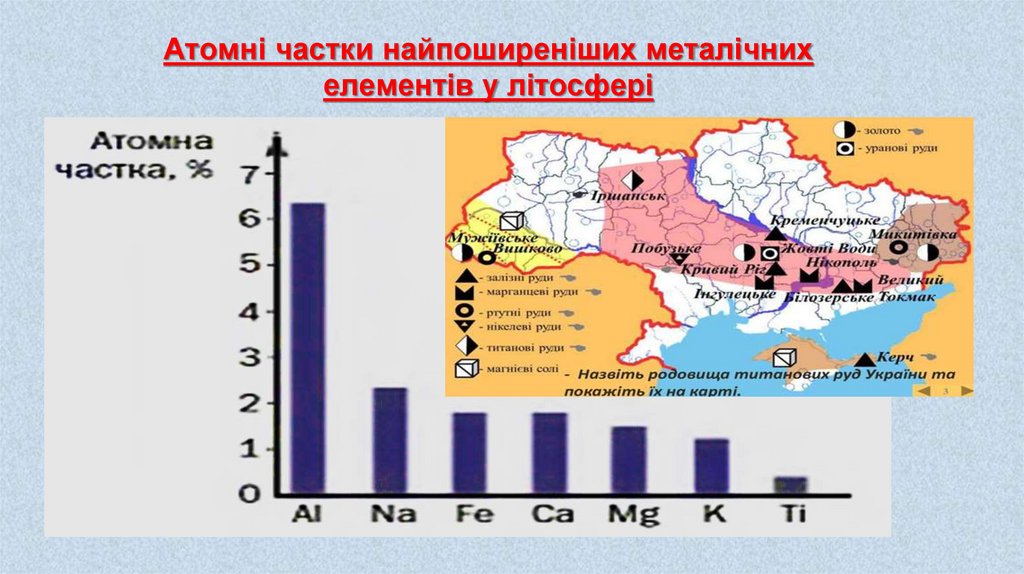
Атомні частки найпоширеніших металічнихелементів у літосфері
9.
магнітний залізняк(магнетит) Fe3O4
червоний залізняк
(гематит) Fe2O3
Залізний колчедан
У перекладі з шумерської «залізо» означає «те, що капнуло з неба». Можливо, назва
цього металу пояснюється тим, що перше відоме людству залізо було метеоритного
походження і дійсно падало з неба.
В Україні є великі поклади залізної руди — Криворізький, Кременчуцький,
Придніпровський залізорудні басейни тощо. Ці запаси оцінюють у майже 30 млрд тонн,
чого має вистачити на 180 років промислової розробки. За обсягами виробництва
залізної руди Україна посідає сьоме місце серед країн світу
Залізний колчедан (пірит) FeS2
10.
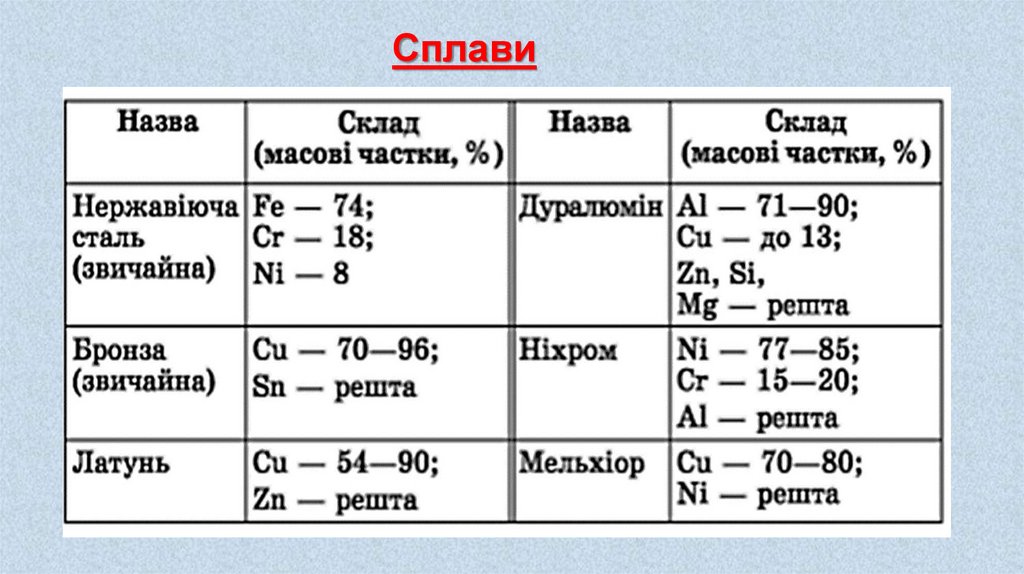
Сплави11.
Фізичні властивостіЗалізо — блискучий, сріблясто-сірий, важкий метал.
Густина його 7,86 г/см³;
температура плавлення 1538 °C,
температура кипіння 2862 °C.
Залізо досить пластичне. Воно легко кується,
штампується, витягується в дріт і вальцюється в тонкі
листи, легко намагнічується і розмагнічується.
Для заліза також характерне явище феромагнетизму —
воно зберігає намагніченість після усунення дії
зовнішнього магнітного поля.
Вище температури Кюрі (770 °C) втрачає феромагнітні
властивості.
До температури 912 °C існує в алотропній модифікації αзаліза з об'ємноцентрованою кубічною кристалічною
ґраткою, за вищої температури — γ-заліза із
гранецентрованою кубічною ґраткою, вище 1394 °C
знову змінює тип ґратки на об'ємноцентровану кубічну
(δ-залізо).
12.
Хімічні властивості заліза як простоїречовини
13.
Хімічні властивостіВ електрохімічному ряді напруг залізо стоїть лівіше від водню, тому
воно легко реагує з розведеними хлоридною і сульфатною
кислотами:
Fe + H2SO4 = FeSO4 + H2 ↑
З розведеною нітратною кислотою залізо теж легко реагує:
2 Fe + 8HNO3 = 2Fe (NO3)3 + 4H2O + 2NO ↑
Але з концентрованою нітратною і концентрованою сульфатною
кислотами без нагрівання залізо не реагує.
Воно стає «пасивним», вкриваючись тонкою оксидною плівкою, яка
не розчиняється в кислотах і ізолює метал від дії кислоти.
Завдяки цьому концентровані нітратну і сульфатну кислоту можна
зберігати і транспортувати в залізній тарі.
При нагріванні з кислотами-окисниками (концентрованими
сульфатною та нітратною кислотами) Ферум окиснюється до ступеня
окиснення +3.
2Fe + 6H2SO4(K) = Fe2(SO4)3 + 3SO2 + 6H2O
8Fe + 30HNO3(25%) = 8Fe(NO3)3+ 3NH4NO3 + 9H2O
14.
Хімічні властивостіУ сухому повітрі за звичайної температури залізо
досить стійке, але у вологому швидко іржавіє,
вкриваючись товстим шаром іржі.
Іржа є сумішшю оксидів і гідроксидів феруму.
Основну частину іржі складає сесквіоксид заліза
Fe2O3 і тригідроксид заліза Fe(OH)3.
Крім того, до її складу входить монооксид заліза
FeO, дигідроксид заліза Fe(OH)2 та інші сполуки.
Процес ржавіння заліза можна зобразити такими
приблизними рівняннями:
2Fe + O2 + 2Н2О = 2Fe(OH)2 ↓
4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3 ↓
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
15.
16.
Сполуки заліза (ІІ)Сполуки заліза (ІІ) одержують дією на метал кислот
неокисників або розбавлених розчинів кислот окисників,
наприклад:
Fe + H2SO4(p) = FeSO4 + Н2
Найбільш важливими сполуками заліза(ІІ) є його солі. При
випарюванні з водних розчинів зазвичай утворюються
кристалогідрати зеленого кольору, наприклад:
FeSO4 • 7Н2О (залізний купорос),
(NH4)2Fe(SO4)2•6Н2О (сіль Мора).
Сіль Мора найстійкіша на повітрі. Вона не втрачає воду, мало
окиснюється, її використовують для приготування
стандартних розчинів заліза(ІІ).
При додаванні лугів до розчинів, які містять Fe(2+), випадає
безбарвний (зеленкуватий) осад Fe(OH)2, який одразу
окиснюється у Fe(OH)3, тому осад швидко темніє:
4Fe(OH)2 ↓ + O2 + 2H2O = 4Fe(OH)3↓
Гідроксид заліза (ІІ) — основа середньої сили
17.
Сполуки заліза (ІІІ)Сполуки заліза (ІІІ) одержують дією окисників
на металічне залізо чи окисненням сполук двовалентного
заліза.
Найбільш поширеними сполуками заліза (ІІІ) є:
оксид Fe2O3,
гідрат оксиду Fe2O3 • xH2O;
солі FeCl3 • 6Н2О,
Fe2(SO4)3 • 10Н2О,
Fe(NO3)3 • 9Н2О,
NH4Fe(SO4)2 • 12Н2О — залізо-амонійні галуни.
Гідроксид заліза (III) Fe(OH)3 одержують дією
лугу на розчини солей заліза (III):
FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl
Гідроксид заліза (III) — слабка основа,
має амфотерні властивості.
18.
Цікаві перетворення сполук ФерумуЯкісні реакції на сполуки Fe2+ та Fe3+
Реакція солі тривалентного Феруму (Fe2(SO4)3) з
тіоцианатом (роданідом) калію (KSCN) настільки
видовищна, що її часто використовують для
імітації крові.
При взаємодії йонів Fe3+ та SCN- (часто пишуть
CNS- або NCS- ) утворюється комплекс (спрощено
можна записати його формулу як [Fe(SCN)3]), який
дуже нагадує кров (навіть за консистенцією!).
Fe(3⁺) + 3SCN‾ = Fe(SCN)3
Отже, цю реакцію можна використовувати не лише
для якісного визначення йонів Fe3+, а для імітації
крові. Реакція надзвичайно чутлива і за її
допомогою можна визначити навіть сліди Fe3+ у
воді з водогону.
Див. медіатека, відеоексперименти з неорганічної хімії
№152
Взаємодія
ферум(ІІІ) хлориду з
калій тіоцианатом
https://www.bing.com/search?pglt=297&q=%D1%8F%D
0%BA%D1%96%D1%81%D0%BD%D1%96+%D1%80%D0
%B5%D0%B0%D0%BA%D1%86%D1%96%D1%97+%D0%
BD%D0%B0+%D0%BA%D0%B0%D1%82%D1%96%D0%B
E%D0%BD%D0%B8+%D0%B7%D0%B0%D0%BB%D1%9
6%D0%B7%D0%B0&cvid=6066d3b757d24bedaf5caa46b9
d1241a&gs_lcrp=EgRlZGdlKgYIABBFGDkyBggAEEUYO
TIGCAEQABhAMgYIAhAAGEAyBggDEAAYQDIGCAQQA
BhAMgYIBRAAGEAyBggGEAAYQDIGCAcQABhAMgYIC
BAAGEDSAQk0MTAzOWowajGoAgiwAgE&FORM=ANNT
A1&PC=EDGEDSE
19.
Використання жовтої та червоної кров’яних солейЧервона кров’яна сіль (калій гексаціаноферат (ІІІ)
K3[Fe (CN)6] - реактив на Fe2+
Якісна реакція на солі
двовалентного
Феруму
в результаті реакції утворюється речовина синього
кольору «турнбулева синь».
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2КСl
або в йонному вигляді
Fe2+ + [Fe(CN)6]3− → Fe[Fe(CN)6]−
Жовта кров’яна сіль (калій гексаціаноферат (ІІ)
K4[Fe (CN)6] – реактив на Fe3+:
FeCl3 + K4[Fe (CN)6] = KFe[Fe (CN)6] + 3KCl
або в йонному вигляді
Fe3+ + [Fe(CN)6]4− → Fe[Fe(CN)6] −
Утворюється осад синього кольору , який
називають «берлінська лазур».
Якісна реакція на солі
тривалентного
Феруму
20.
Раніше вважали, що берлінська лазур і турнбулева синь – різніречовини, зараз вже відомо, що в обох випадках утворюється синій
3+ 2+
продукт однакового складу і будови KFe[Fe(CN)6], в процесі реакції
відбувається майже миттєва валентна перебудова.
«Берлінська лазур»
«Турнбулева синь»
21.
Солі ФерумуЭлемент Ферум утворює багато солей. Солі Феруму(ІІ) містять катіони Fe(2+), а в
солях Феруму(ІІІ) цей металічний елемент може перебувати у формі катіонів Fe(3+)
(FeF3, Fe2(SО4)3), або бути складником аніонів кислотних залишків (NaFeO2, K3FeО3).
Розчинні солі Феруму при випарюванні води з їх розчинів виділяються у вигляді
кристалогідратів —
FeSО4•7Н2О, FeCl3•6Н2О тощо.
Більшість солей Феруму(ІІ) зеленкувато-блакитні, а солі Феруму(ІІІ) мають різне забарвлення;
зокрема, сполука FeCl3•6Н2О — коричневий, Fe2(SО4)3•9Н2О — білий, Fe(NО3)3•9Н2О — блідобузковий. Солі Феруму зазнають гідролізу; їх розчини мають кисле середовище:
FeCl2 + H2O ↔ Fe(OH)Cl + H⁺ + CL‾ гідроксоферум(II) хлорид
22.
ЗастосуванняЧисте залізо має досить обмежене застосування.
Його використовують при виготовленні
сердечників електромагнітів та якорів
електромашин, як каталізатор хімічних процесів,
для виготовлення анодних пластин залізонікелевих акумуляторів. Карбонільне залізо
використовують для нанесення найтонших плівок
і шарів на магнітофонні стрічки і диски носіїв
постійної пам'яті.
Залізний порошок використовують при зварюванні, а також для цементації міді.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що
застосовується у всіх галузях промисловості.
Виробництво заліза та його сплавів становить більше 90 % виробництва всіх
металів і утворює окрему галузь промисловості — чорну металургію.
Сталі містять до 2,14 % карбону, чавун — понад 2,14 %.
Сьогодні сталь є головним конструкційним матеріалом. Зі сталі виготовляють
каркаси будинків, труби, корпуси транспортних засобів тощо. Для конкретного
застосування використовують певні марки сталі, створені з урахуванням
особливостей майбутніх виробів.
23.
Біологічна роль залізаФерум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в
рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі
фотосинтезу.
В організмі дорослої людини міститься десь 4 г Феруму. Основна частина Феруму
входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію
переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу.
Близько 20 % Феруму в організмі депоновано в печінці, селезінці, кістковому мозку, це
його «фізіологічний резерв». Ферум як складник гемоглобіну крові, потрібен для
«зчеплення» його з киснем.
Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково
треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, курагу
тощо.
24.
Цікаві факти про залізоЯкі істоти винні в кольорі Кривавого водоспаду в Антарктиді?
В Антарктиді з льодовика Тейлора часом виходить Кривавий
водоспад. Вода в ньому містить двовалентне залізо, яке,
з'єднуючись з атмосферним повітрям, окислюється і утворює
іржу. Це і надає водоспаду криваво-рудий колір. Однак
двовалентне залізо у воді виникає не просто так - його
виробляють бактерії, що живуть в ізольованому від
зовнішнього світу водоймі глибоко під льодом. Ці бактерії
зуміли організувати життєвий цикл при повній відсутності
сонячного світла і кисню. Вони переробляють залишки
органіки, а «дихають» тривалентні залізом з навколишніх
порід.
Різнобарвний метал з візерунком
Немає нічого незвичайного в тому, що будь-який з відомих нам металів,
піддаючись будь-якої обробці, може змінювати колір. Колір того чи іншого
металу залежить і від ступеня нагріву, і від самої обробки, і від хімічних
властивостей. Але неможливо уявити блакитне золото або червоне срібло.
Навпаки, залізо, а відповідно, і сталь, і чавун у всіх своїх «іпостасях» мають
незрівнянну ні з яким іншим металом колірну палітру. У холодному стані воно
може бути сірим і чорним, майже білим, блакитним і синім, золотавим і
червонуватим. Більше того, залізо є єдиним металом, який може сам себе
прикрашати декоративним орнаментом, що проступає як би зсередини. Варіанти
цього фактурного орнаменту нескінченні, і їх не можна зарахувати до жодного із
загальновідомих, так як цей малюнок народжується самим металом.
25.
Перше залізо, як метал, потрапило дорук людини «з неба».
Не дарма люди вважали залізо - небесним
металом, тому що вперше його добули з
падаючих на поверхню землі метеоритів. У
найдавніших предметах з заліза є істотна частка
домішок нікелю, саме таке залізо міститься в
метеоритах. Найбільший залізний метеорит
знайшли в 1920 році в південно-західній Африці.
Метеорит назвали «Гоба», він важив 60 тонн.
Залізо, у вигляді катіонів, в організм тварин і
людини надходить з їжею. Найбільш багаті
залізом такі продукти, як м'ясо, печінка, яйця,
бобові, крупи, хліб, буряк. Цікаво зауважити, що
колись у цей список був помилково внесено
шпинат (з причини друкарські помилки в записах
результатів аналізу, а саме був загублений
«зайвий» нуль після розділової коми).
26.
Залізна коло́на в Де́лі (столиця Індії)— Залізна коло́на заввишки 7,21 м, ,
діаметром чуть більше ніж півметра и вагою
близько шести с половиною тон, входить
до складу архітектурного ансамблю Кутб Мінара (звідти друга назва — Кутубова
колона), розташованого близько 20
кілометрів на південь від Старого Делі.
Монолітна колона виготовлена майже із
чистого (99,72 %) заліза, за 1600 років свого
існування вона практично не піддається
іржавінню.
Учені до цього часу не дійшли остаточної
думки про те, як в ті часи отримали залізо
такого ступеня чистоти.
27.
Виведення плями від іржі на тканині.Для того щоб вивести пляму від іржі на тканині, можна використати кислоту, яка
реагує з ферум(ІІІ) гідроксидом з утворенням розчинної солі. Проте ця кислота не
повинна руйнувати волокна тканини й діяти на барвник, якщо тканина кольорова.
Ці вимоги задовольняють органічні кислоти — лимонна, оцтова, щавлева, винна.
Спосіб 1. Забруднену ділянку білої тканини змочують концентрованим розчином
лимонної кислоти, наносять на неї тонкий шар дрібної кухонної солі і залишають на
кілька годин (іноді — на добу). Після виведення плями тканину промивають теплою
водою. Замість розчину лимонної кислоти можна використати сік лимона.
Спосіб 2. Розбавлений розчин оцтової кислоти (2 столові ложки оцту на склянку
води) нагрівають в емальованій посудині до 80— 90 °С і занурюють у нього на 3-5
хв. забруднену ділянку тканини. Якщо пляма іржі не зникає, процедуру
повторюють. Потім тканину промивають теплою водою, в яку додають нашатирний
спирт (одну столову ложку на 2 л води).
28.
Розв'язати задачі.1. Виведіть формулу оксиду Феруму, в якому масова частка металічного елемента
становить 70 %.
2. Яку масу ферум(ІІІ) нітрату потрібно взяти для добування 8г ферум(ІІІ) оксиду?
3. Визначте кількість молекул води у формулі солі FeCI2•nН2О, якщо масова частка
води у сполуці становить 36,2 %.
Список необхідної літератури
Основна:
1.Попель П. П. Хімія: підруч. Для 11 кл. закладів загальної середньої освіти (рівень
стандарту) П. П. Попель, Л. С. Крикля. — Київ: ВЦ «академія», 2018.
2. Чернобельська Г.М., Чертков И.Н. Хімія – М.: Медицина, 1993.
3. 3.Сухан В.В., Табунська Т.В., Хімія (посібник для вступників до вузів) – К.: Либідь 1993.
4. Електронний підручник з хімії:
https://sites.Google.Com/view/allhemi/ №43- тест
Тест https://naurok.com.ua/test/start/2733782
Див. медіатека, відеоексперименти з неорганічної хімії №152
Додаткова:
1. Луцевич Д.Д., Березан О.В. Конспект – довідник з хімії. – К.: Вища школа 1997.
2. Ярошенко О.Г., Новицька В.І. Збірник задач і вправ з хімії. – К.: Станіца 1996.
3. Буринська Н.М. Основи загальної хімії. 11 клас. 1997.
























 chemistry
chemistry








