Similar presentations:
Лекция 3.Строение атома.Теория Бора
1. Строение атома. Теория Бора
СТРОЕНИЕ АТОМА. ТЕОРИЯ БОРА2. План лекции
ПЛАН ЛЕКЦИИ• Модели атома. Модель атома Томсона.
• Модели атома. Опыты Резерфорда
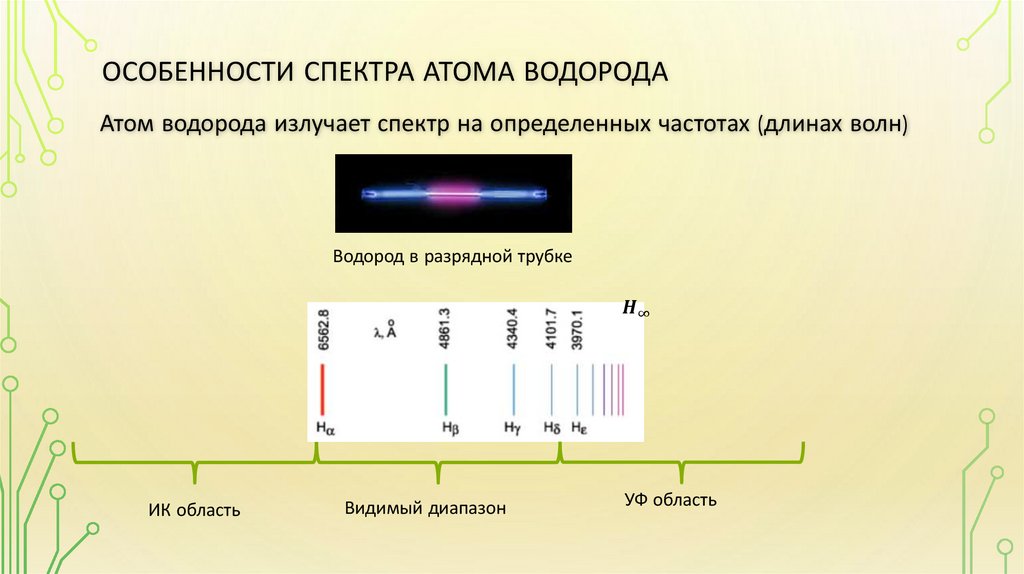
• Особенности спектра атома водорода
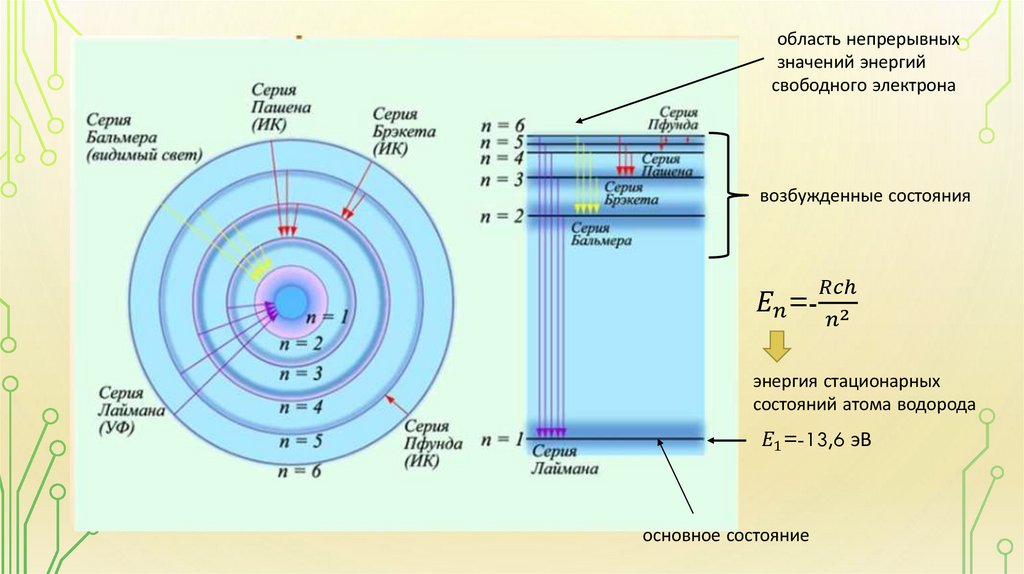
• Квантовые постулаты Бора
• Новые явления в квантовой физике
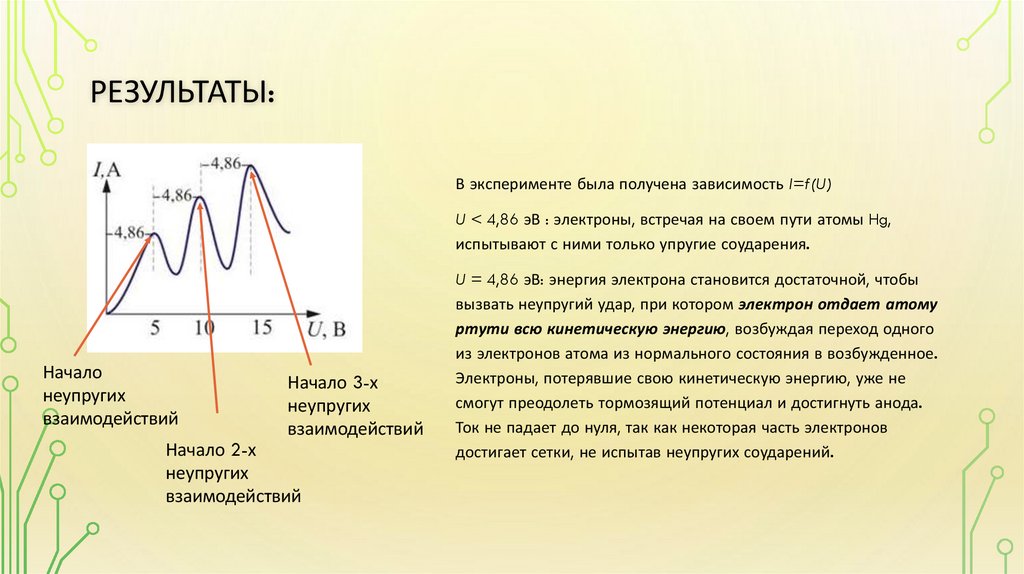
• Опыты Франка-Герца
3. Модели атома. Модель атома томсона.
МОДЕЛИ АТОМА. МОДЕЛЬ АТОМА ТОМСОНА.Первую модель строения атома придумал английский физик Д. Д. Томсон
(удостоенный Нобелевской премии за открытие электрона (1897)). В конечном
счёте она оказалась неверной, но сыграла важную роль, будучи стимулом
последующих экспериментальных исследований Резерфорда. Физики
называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером
порядка 10−10 м. По этому шару некоторым образом распределён
положительный заряд, а внутри шара, подобно изюминкам,
находятся электроны.
Недостатки модели:
1. Не объясняла дискретный характер излучения атомов и его устойчивость.
2. Не даёт возможности понять, что определяет размеры атома.
3. Оказалась в полном противоречии с опытами по исследованию распределения
положительного заряда в атоме (опыты проводимые Эрнестом Резерфордом)
4. Модели атома. Опыты Резерфорда (1911 г)
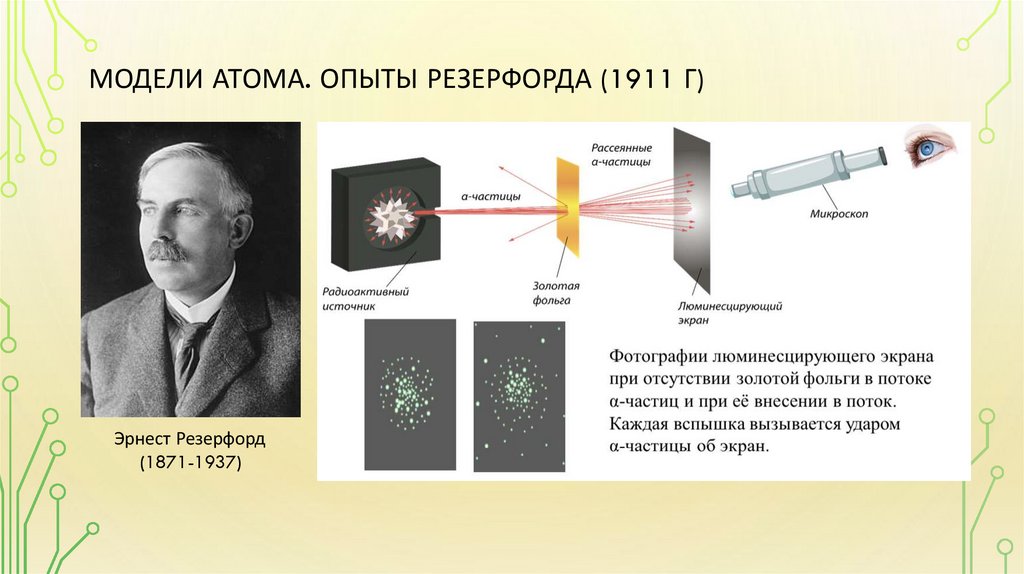
МОДЕЛИ АТОМА. ОПЫТЫ РЕЗЕРФОРДА (1911 Г)Эрнест Резерфорд
(1871-1937)
5. Модели атома. Опыты Резерфорда
МОДЕЛИ АТОМА. ОПЫТЫ РЕЗЕРФОРДАРезультат:
1. Большинство α-частиц пролетает сквозь фольгу не отклоняясь
2. Небольшое количество α-частиц отклоняется на небольшой угол
3. Есть α-частицы, которые отклоняются на угол 90º
Механизм рассеивания:
α-частица имеет положительный заряд, поэтому
отталкивается от положительного заряда,
расположенного где-то внутри атома.
При этом чем ближе будет проходить траектория αчастицы к положительному заряду атома – тем больше
сила действующая на нее, тем сильнее изменится ее
траектория.
6. Модели атома. Опыты Резерфорда
МОДЕЛИ АТОМА. ОПЫТЫ РЕЗЕРФОРДАВывод:
Учитывая то, что из 2000 испущенных α-частиц
только одна отбрасывалась назад Резерфорд сделал
вывод, что положительный заряд в атоме занимает
небольшое пространство, то есть в атоме есть
положительно заряженное ядро, а электроны
вращаются вокруг ядра.
Из опыта Резерфорда следует, что атом устроен следующим
образом: в центре атома расположено положительно заряженное
ядро размер которого от 104 до 105 раз меньше размера атома, а
по орбите вокруг ядра вращаются электроны.
Заряд ядра по величине равен заряду всех электронов, поэтому
атом нейтрален.
Планетарная модель атома
7.
Главные выводы:1. В результате исследований Резерфорда была предложена планетарная модель атома.
2. Атомное ядро — тело малых размеров, в котором сконцентрированы почти вся масса
и весь положительный заряд атома.
Диаметр ядра: ~10−14 — 10−15 м.
Диаметр атома: ~ 10−10 м.
3. Ядро атома водорода рассматривается, как элементарная частица и называется
протоном.
Ядро атома водорода (протон):

















 physics
physics








