Similar presentations:
Строение атома
1.
Открытие сложного строения атома —важнейший этап становления
современной физики, наложивший
отпечаток на всё её дальнейшее
развитие.
2.
Говорил, что существуетпредел деления — атом.
Демокрит
460–370 гг. до н.э.
3.
Считал, что делимостьвещества бесконечна.
Аристотель
384–322 гг. до н.э.
4.
События, послужившие толчком к подробномуизучению строение атома
Открытие в 1895 году рентгеновского излучения.
Открытие радиоактивности и новых радиоактивных элементов
в 1896 году Антуаном Анри Беккерелем и супругами Кюри.
Открытие электрона в 1896 году Джозефом Джоном Томсоном.
5.
ЯдроНейтрон
Протон
Электрон
Атом — наименьшая частица химического
элемента, являющаяся носителем его
свойств.
6.
-+
1,6 ∙ 10-19 Кл
7.
Zp = Ee = №где
Zp
— число протонов
Ee
— число электронов
№
— порядковый номер элемента
A = Zp + N
где
A
N
— атомная масса
— число нейтронов
8.
Английский физик.Предложил первую модель
атома.
Джозеф Джон Томсон
1856–1940 гг.
9.
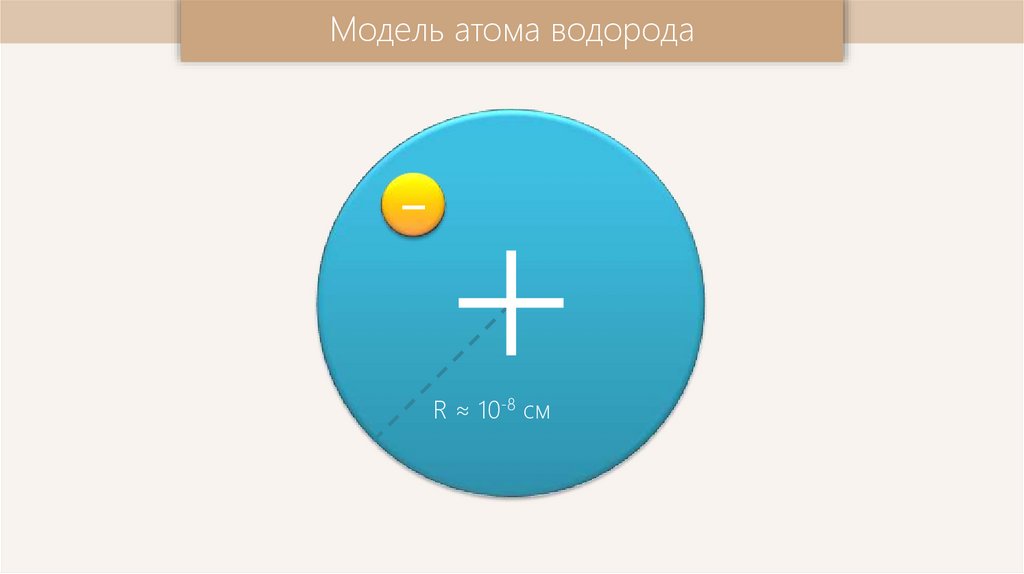
Модель атома водорода-
+
R ≈ 10-8 см
10.
Модель атома Томсона оказаласьв полном противоречии с опытами
по исследованию распределения
положительного заряда в атоме.
Джозеф Джон Томсон
1856–1940 гг.
11.
Великий английский физик.Своими экспериментальными
открытиями заложил основы
современного учения о строении
атома и радиоактивности. Он первым
исследовал состав излучения
радиоактивных веществ. Открыл
атомное ядро и впервые осуществил
искусственное превращение атомных
ядер.
Эрнест Резерфорд
1871–1937 гг.
12.
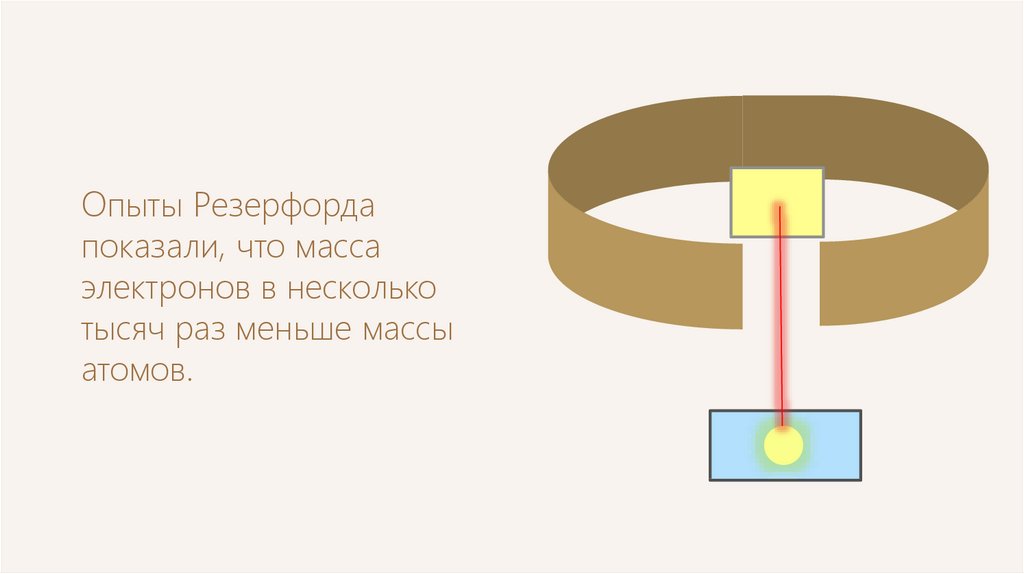
Опыты Резерфордапоказали, что масса
электронов в несколько
тысяч раз меньше массы
атомов.
13.
В 1906 году предложил применитьзондирование атома с помощью
α-частиц для экспериментального
исследования распределения
положительного заряда, а значит,
и массы внутри атома. Экран из сернистого
Испущенные
α-частицы
Свинцовый
коллиматор
Золотая
фольга
цинка
β
Эрнест Резерфорд
1871–1937 гг.
Свинцовый контейнер
с источником α-частиц
Микроскоп
Рассеянные
α-частицы
14.
Их масса примерно в 8000 разбольше массы электрона, а
положительный заряд равен
по модулю удвоенному заряду
электрона.
Радий
15.
Скорость α-частиц1/15
скорости
света
16.
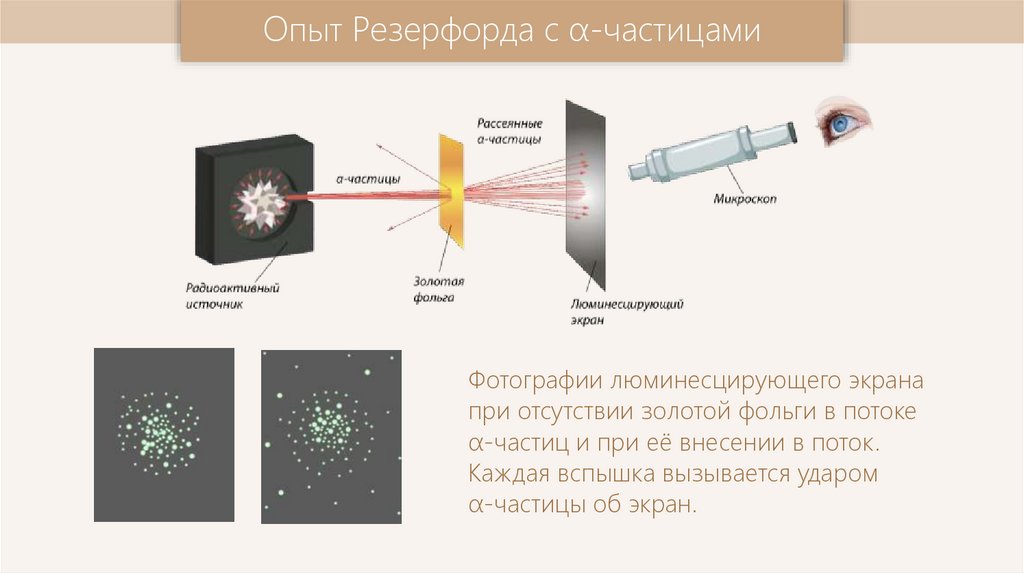
Опыт Резерфорда с α-частицамиФотографии люминесцирующего экрана
при отсутствии золотой фольги в потоке
α-частиц и при её внесении в поток.
Каждая вспышка вызывается ударом
α-частицы об экран.
17.
Продолжая опыты, Резерфорд и егопомощники обнаружили, что какая-то
часть α-частиц отклоняется на
довольно значительный угол от своего
первоначального направления, а
небольшая часть отражается от фольги.
Эрнест Резерфорд
1871–1937 гг.
18.
Обобщая результаты своих опытов,предложил ядерную (планетарную)
модель строения атома.
Ядро
Нейтрон
Эрнест Резерфорд
1871–1937 гг.
Протон
Электрон
19.
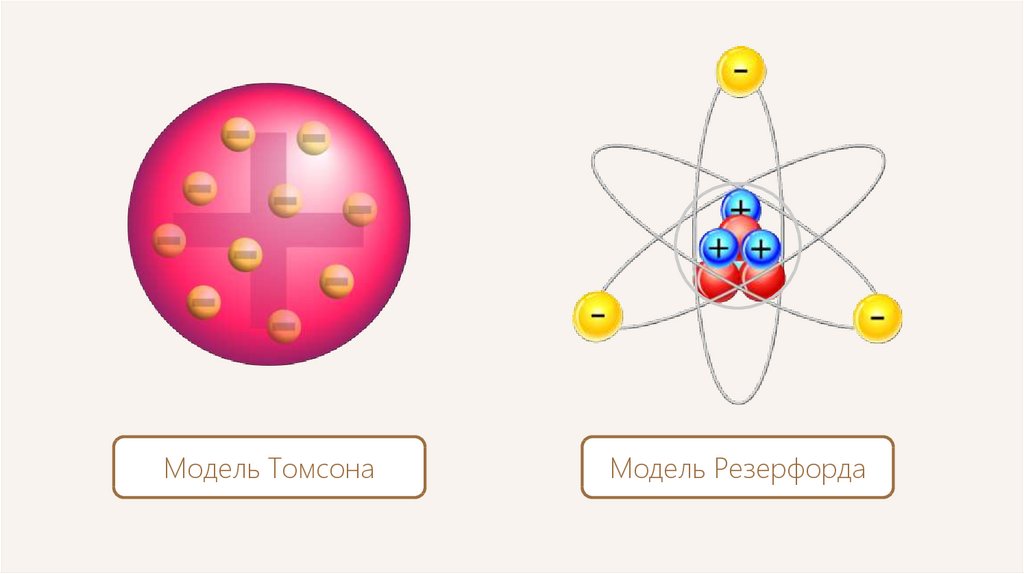
Модель ТомсонаМодель Резерфорда
20.
Закон КулонаМаксимальная сила
отталкивания определяется
по закону Кулона.
21.
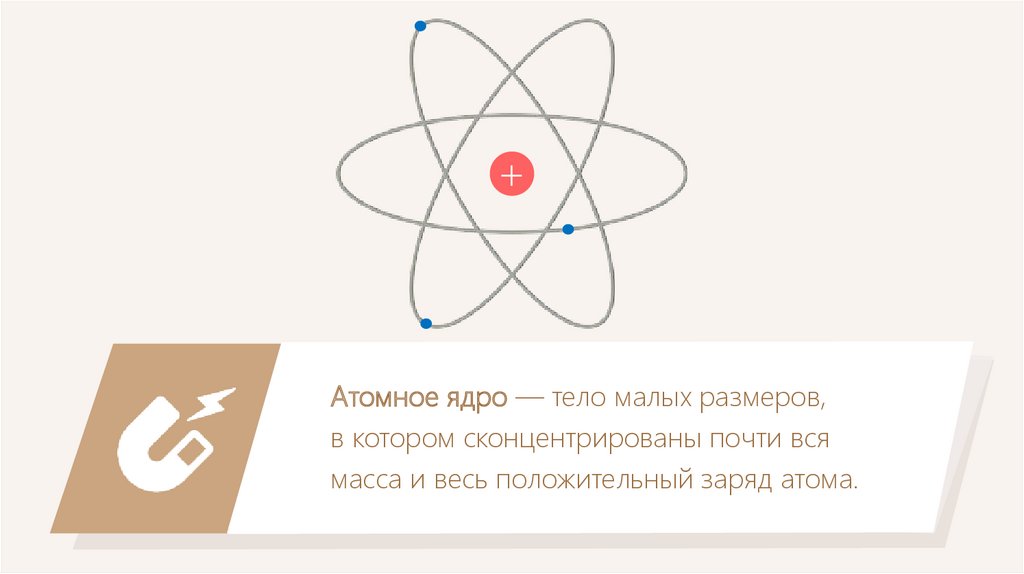
+Атомное ядро — тело малых размеров,
в котором сконцентрированы почти вся
масса и весь положительный заряд атома.
22.
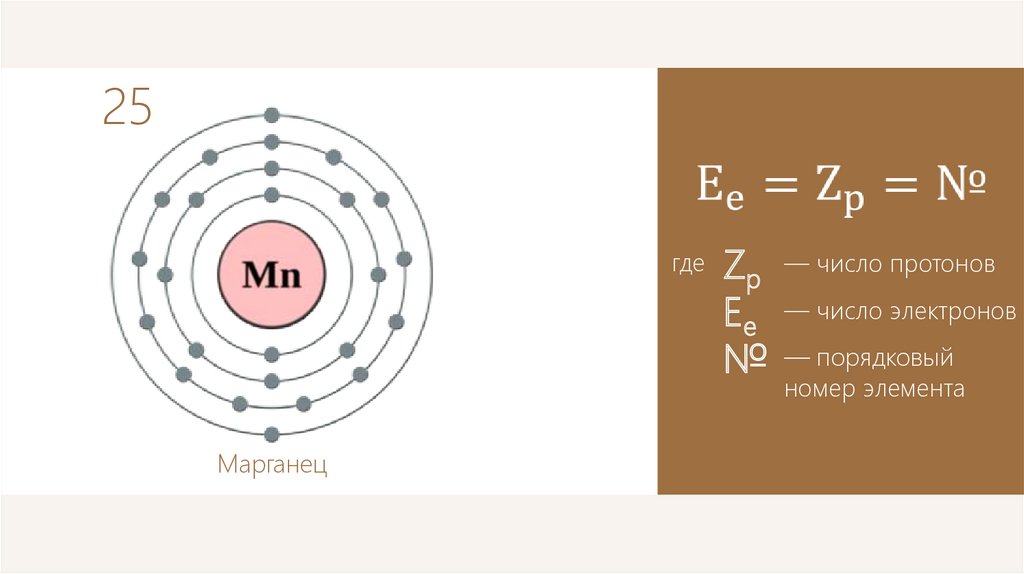
25где
Марганец
Zp
Ee
№
— число протонов
— число электронов
— порядковый
номер элемента
23.
+Строение атома
Строение Солнечной
системы
24.
Ядро атома водорода имеетположительный заряд, равный
по модулю заряду электрона, и
массу, примерно в 1836 раз
большую массы электрона.
Водород
25.
R+
Размер атома — это радиус орбиты его
электрона.
26.
Недостатки планетарной модели атомаМодель не согласуется с наблюдаемой
стабильностью атомов.
Модель не объясняет наблюдаемые
на опыте оптические спектры атомов.




















 physics
physics chemistry
chemistry








