Similar presentations:
алкены
1.
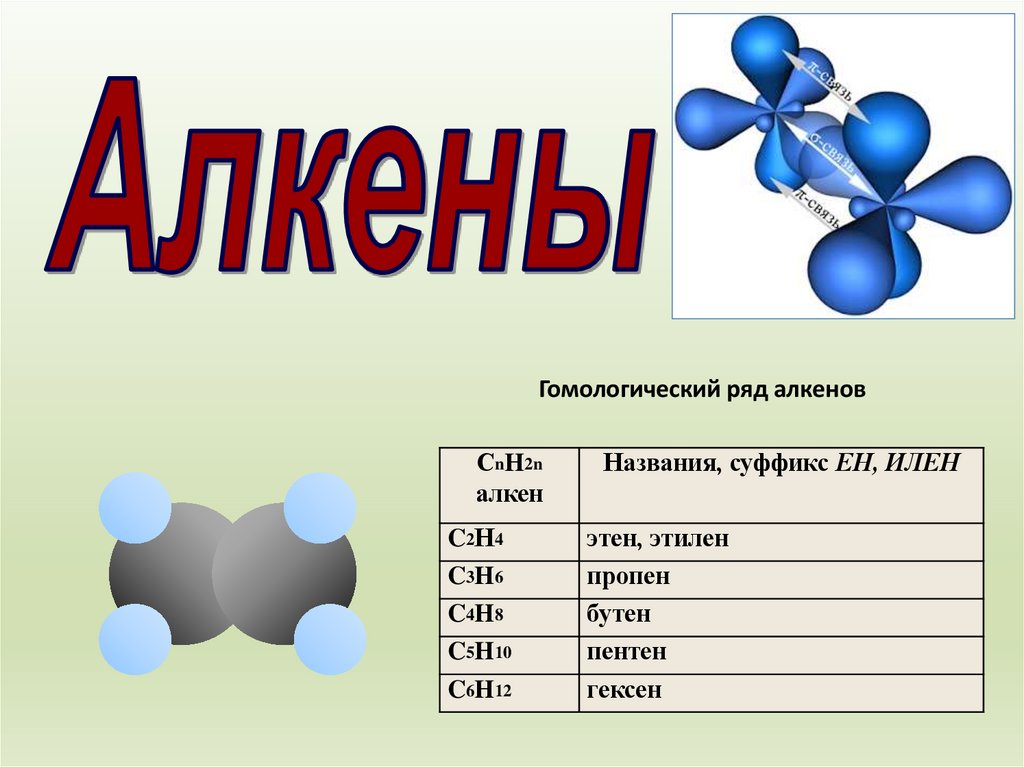
Гомологический ряд алкеновСnH2n
алкен
C2Н4
C3H6
C4H8
C5H10
C6H12
Названия, суффикс ЕН, ИЛЕН
этен, этилен
пропен
бутен
пентен
гексен
2.
НоменклатураСтроение
молекулы
Изомерия
Физические
свойства
CnH2n
Химические
свойства
Получение
Проверка
знаний
Применение
3.
CnH2nАлкены – ациклические
углеводороды, в молекуле
которых кроме одинарных
связей содержится одна двойная
связь между атомами углерода.
Общая формула: СnH2n
4.
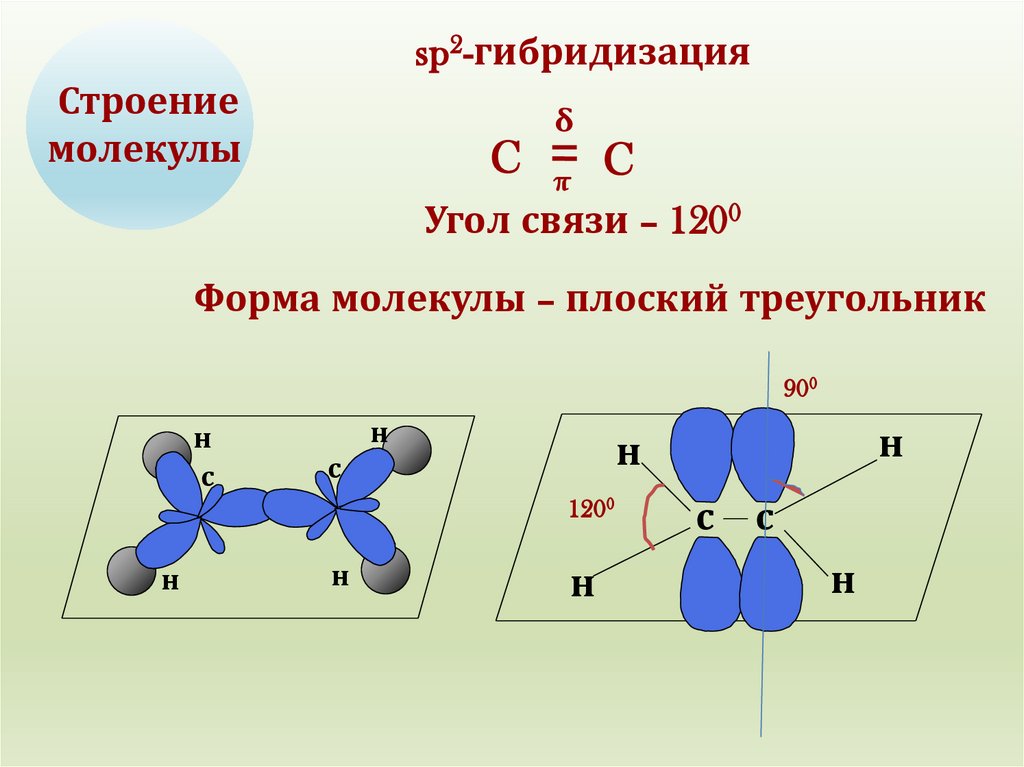
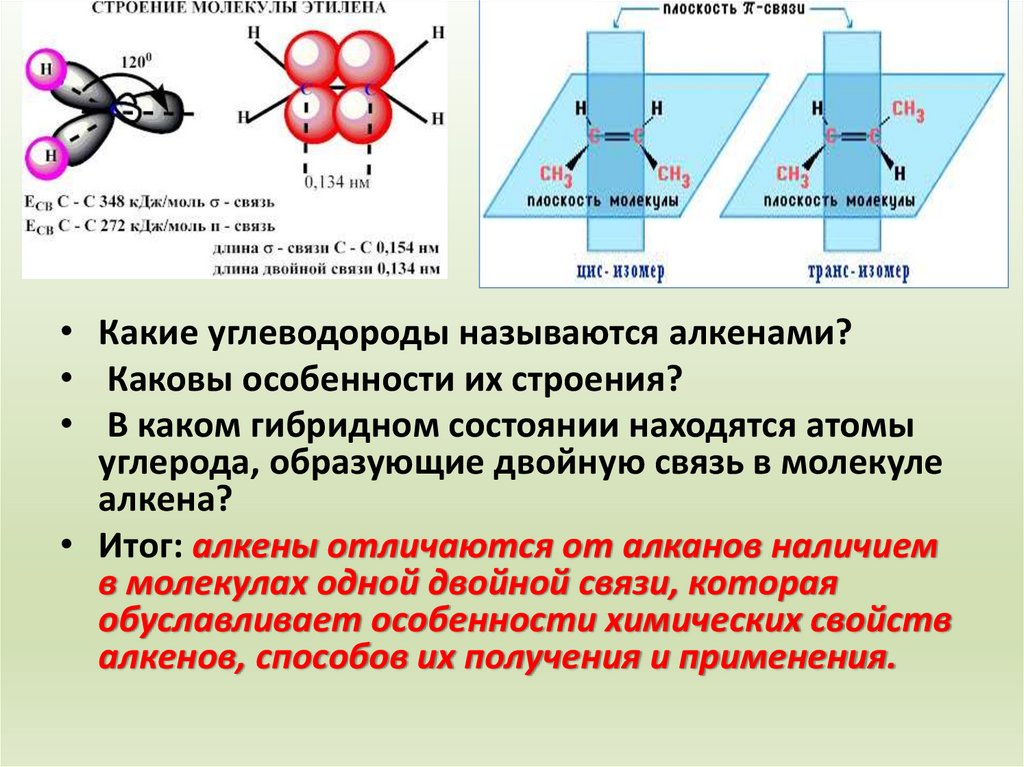
sp2-гибридизацияСтроение
молекулы
C
δ
C
π
Угол связи – 1200
Форма молекулы – плоский треугольник
900
н
с
н
1200
н
н
н
н
с
н
с
с
н
5.
1. Выбор главной цепи.С Н3 С Н С Н С Н С Н3
Номенклатура
СН3
2. Нумерация атомов главной цепи.
5
4
3
2
1
С Н3 С Н С Н С Н С Н3
СН3
3. Формирование названия.
С Н3 С Н С Н С Н С Н3
СН3
4пенте - 2
метил н
6.
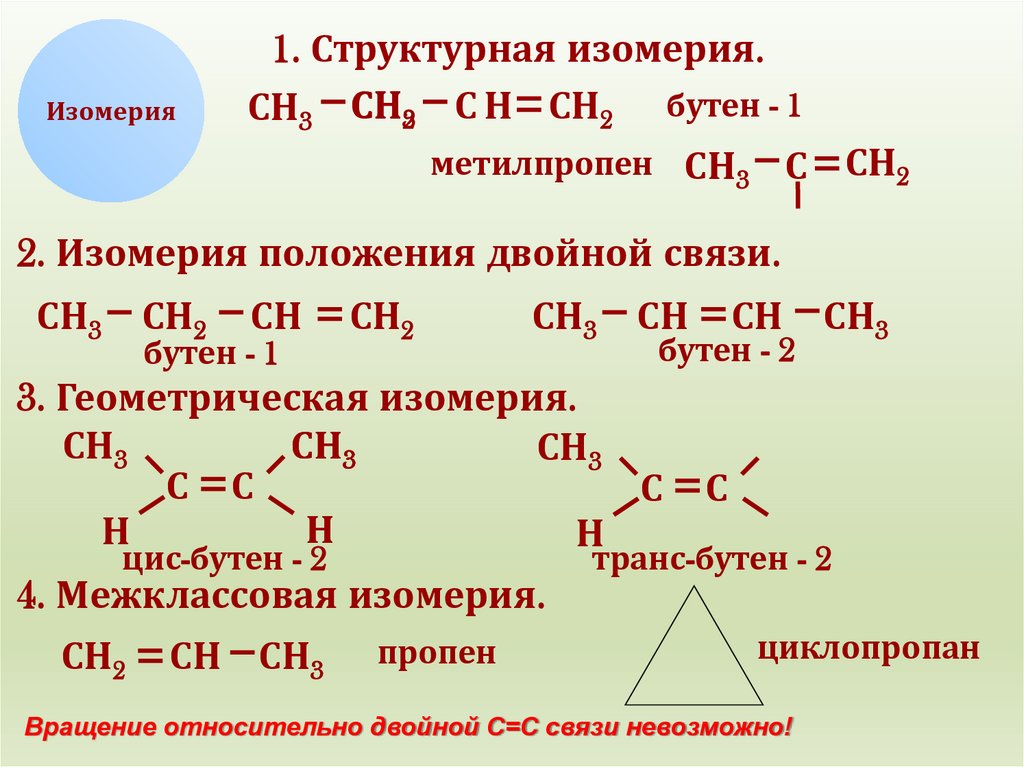
Изомерия1. Структурная изомерия.
СН3 СН32 С Н СН2 бутен - 1
метилпропен СН3 С СН2
2. Изомерия положения двойной связи.
СН3
СН2
СН
бутен - 1
СН2
СН3
СН
бутен - 2
3. Геометрическая изомерия.
СН3
СН3
СН3
С С
С
Н
Н
Н
цис-бутен - 2
4. Межклассовая изомерия.
СН2
СН СН3
пропен
СН
СН3
С
транс-бутен - 2
циклопропан
Вращение относительно двойной С=С связи невозможно!
7.
Агрегатное состояние:С2Н4 – С4Н8
С5Н10 – С18Н36
с С19Н38
Физические
свойства
газообразные
вещества;
жидкости;
твердые вещества
С увеличением молекулярной массы соединений
температуры кипения и плавления закономерно
повышаются.
Этилен С2Н4
Tпл = - 169,20С
Г, З нефтяной,
Tкип = - 103,70С
Ц
Плохо в
Н2О
Впервые получен в 1669 г. И.И.Бехером нагреванием этилового
спирта с конц. серной кислотой (как катализатором впервые!),
назван «газ Бехера», потом «олефином» (рождающий масло)
8.
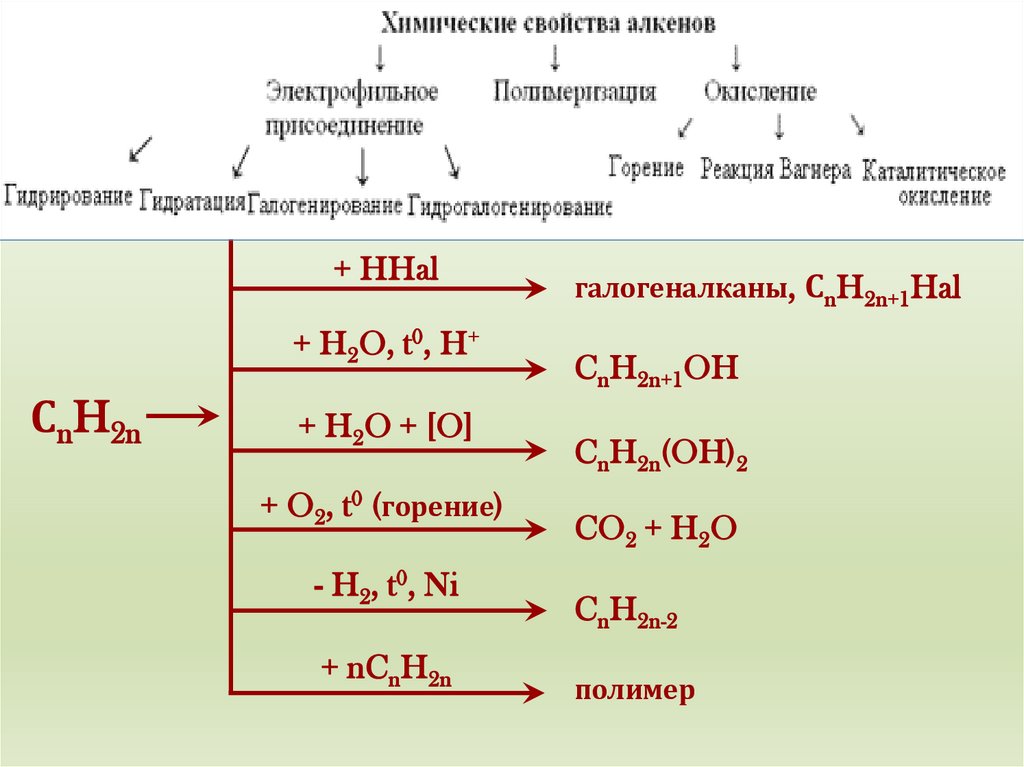
этиленХимические
свойства
+ Н2, t0, Ni
+ Hal2
+ HHal
+ H2O, t0, H+
СnH2n
+ H2O + [O]
+ O2, t0 (горение)
- H2, t0, Ni
+ nCnH2n
CnH2n+2
дигалогеналканы, СnH2nHal2
галогеналканы, СnH2n+1Hal
CnH2n+1OH
CnH2n(OH)2
CO2 + H2O
CnH2n-2
полимер
9.
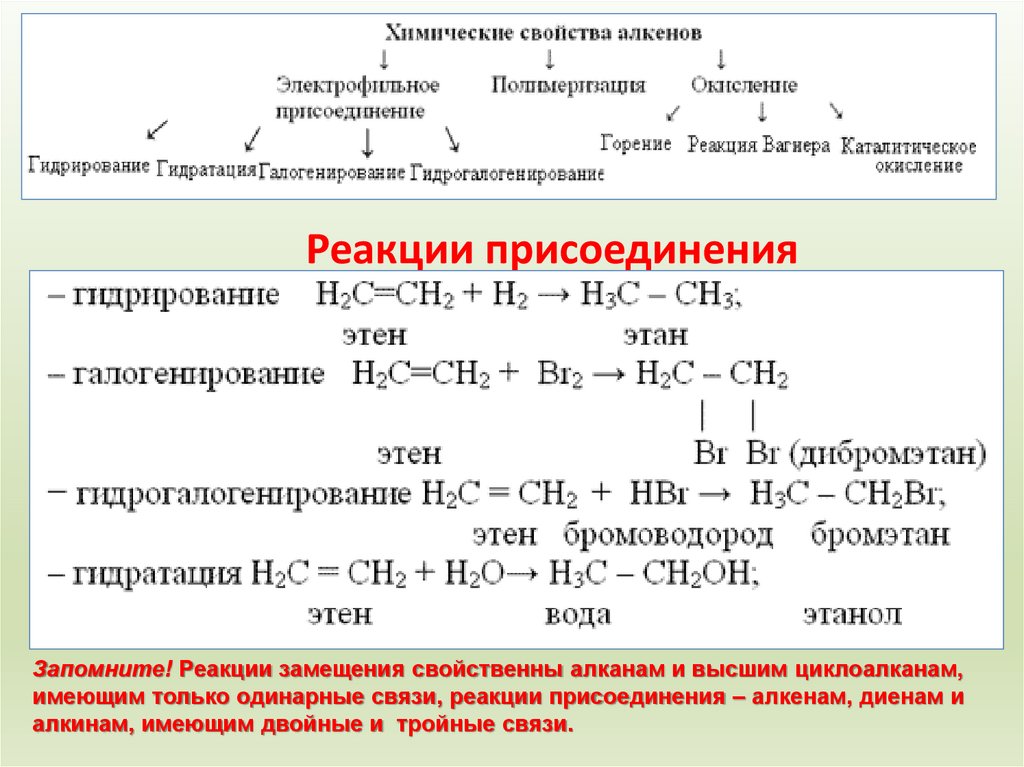
главная1. Гидрирование: СН2
СН2 + Н2
2. Галогенирование: СН2
СН3
Pt, t
СН2 + Br2
СН2Вr
3. Гидрогалогенирование: СН2 СН2 + НСl
4. Гидратация: СН2
СН2 + Н2О
5. Мягкое окисление: СН2
6. Горение: СН2
t, Н3РО4
CН3
2Н2О
2СО2
СН2Вr
CН3
СН2 + [О] +Н2О
СН2 + 3О2
СН3
СН2Сl
СН2ОН
СН2
СН2
ОН
ОН
7. Дегидрирование: СН2
СН2
t, Ni
СН
СН + Н2
8. Полимеризация: nСН2
СН2
cat
(…
СН2
СН2
…)n
10.
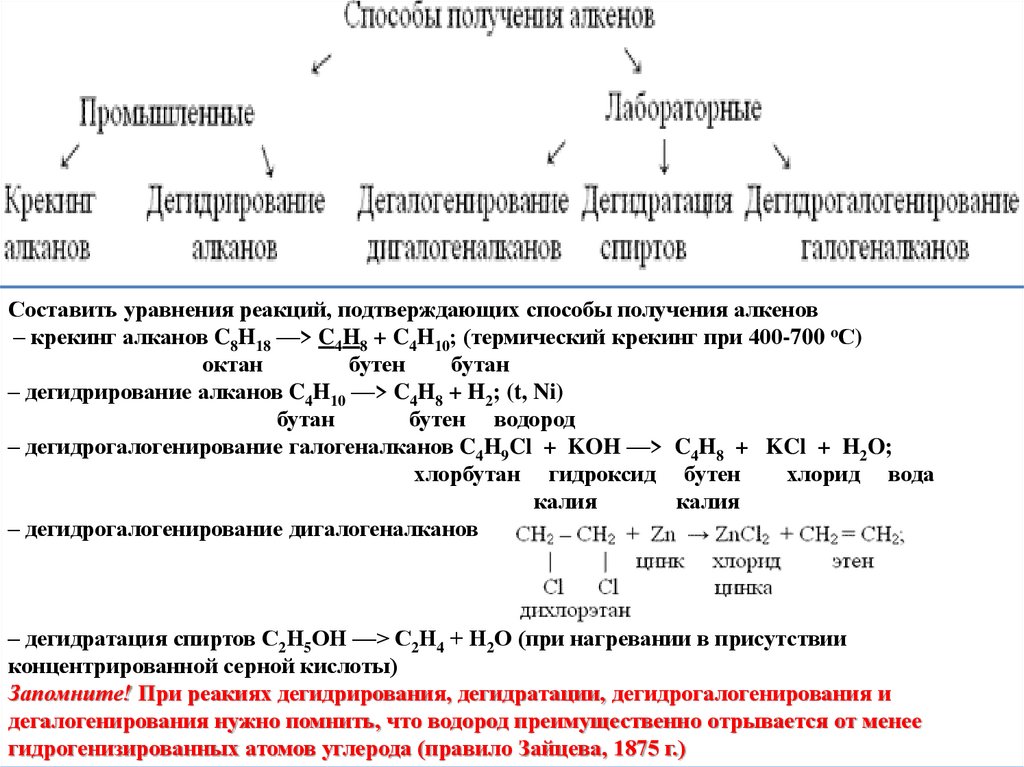
1. Крекинг нефтепродуктов:С16Н34
С8Н18 + С8Н16
Получение
2. Дегидрирование предельных углеводородов:
СН2
СН СН2 СН3 + Н2
СН3
СН2 СН2 СН3
СН3
СН
СН СН3 + Н2
3. Дегидратация спиртов (отщепление воды):
Н2SО4 , 140 – 1500С
СН3
СН2 ОН
СН2
СН2 + Н2О
4. Дегидрогалогенирование (отщепление
галогеноводорода):
СН3 СН СН2 СН3 + NaОН спирт, t СН3 СН СН СН3 +NaBr
Br
+Н2О
5. Дегалогенирование:
СН3 СН СН СН3 +Zn СН3 СН СН СН3 +ZnBr2
Br
Br
11.
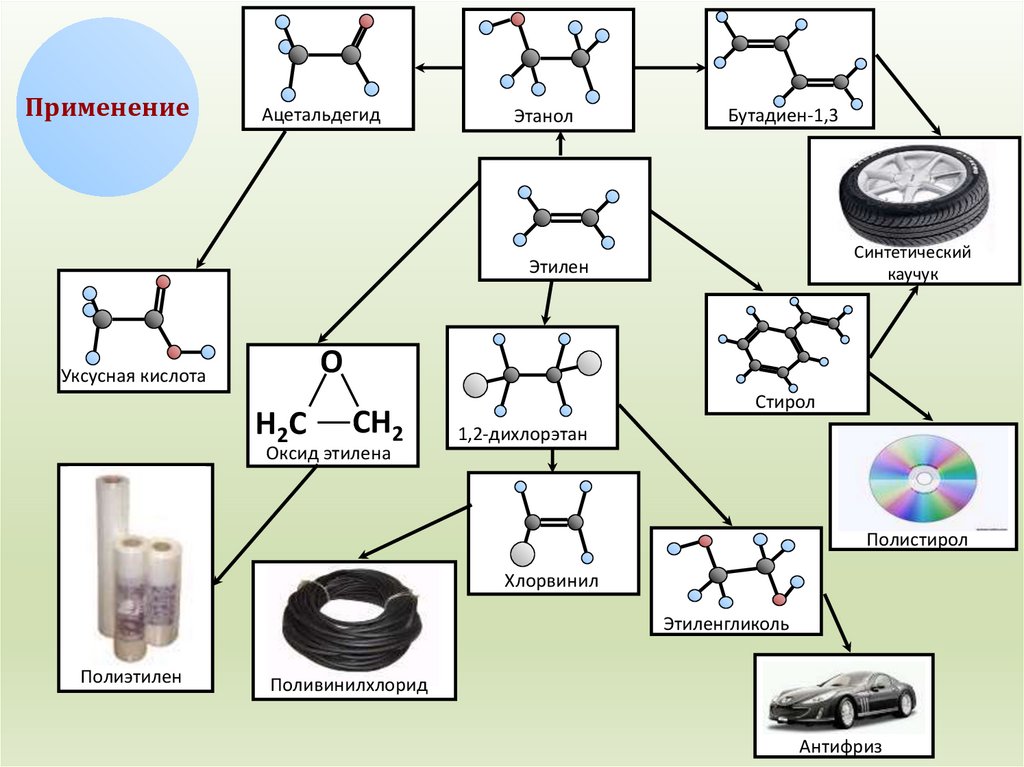
ПрименениеАцетальдегид
Этанол
Бутадиен-1,3
Синтетический
каучук
Этилен
О
Уксусная кислота
Н2С
СН2
Оксид этилена
Стирол
1,2-дихлорэтан
Полистирол
Хлорвинил
Этиленгликоль
Полиэтилен
Поливинилхлорид
Антифриз
12.
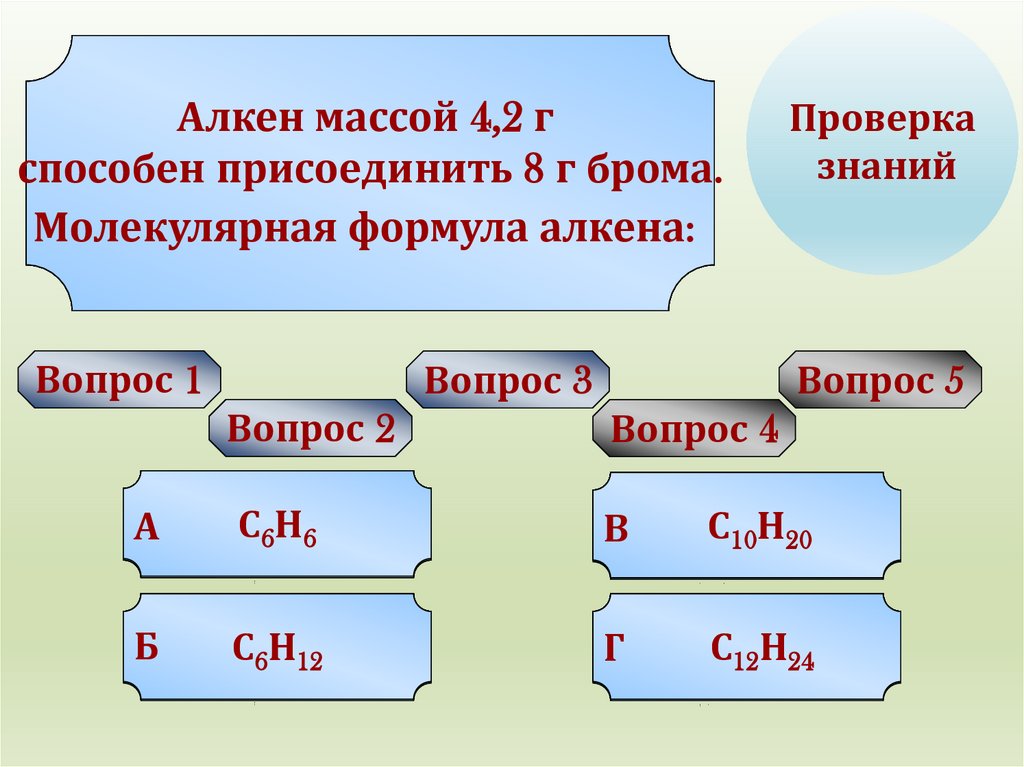
Типгибридизации
Алкен
массой 4,2 г
Алкенам
Какой
тип
не
характерны
изомерии
способен
присоединить
8 г брома.
атомов
углерода
Общая
формула
алкенов
отсутствует
реакции
у алкенов
Молекулярная
формула
в пропене алкена:
Проверка
знаний
Вопрос 1
Вопрос 5
Вопрос 3
Вопрос 2
Вопрос 4
углеродного
Попробуй
Попробуй
2С
2,sp2
Н
spCскелета
,sp
H
А замещения
УРА!
6
n 6 2n+2
еще
еще
положения
2Попробуй
3
функциональной
СПопробуй
Н
Вприсоединения
УРА!
20
n10еще
2n
еще
группы
положения
Попробуй
2
окисления
Бкратной
С
НУРА!
sp,sp,sp
Cn6H
12
2n-6
связи
еще
Попробуй
Попробуй
2
2,sp3
геометрическая
полимеризации
С
Н
Г spC,sp
H
УРА!
24
n 12еще
2n-2
еще
spC,sp,sp
H
13.
Составить уравнения реакций, подтверждающих способы получения алкенов– крекинг алканов C8H18 ––> C4H8 + C4H10; (термический крекинг при 400-700 oС)
октан
бутен
бутан
– дегидрирование алканов C4H10 ––> C4H8 + H2; (t, Ni)
бутан
бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH ––> C4H8 + KCl + H2O;
хлорбутан гидроксид бутен
хлорид вода
калия
калия
– дегидрогалогенирование дигалогеналканов
– дегидратация спиртов С2Н5ОН ––> С2Н4 + Н2О (при нагревании в присутствии
концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и
дегалогенирования нужно помнить, что водород преимущественно отрывается от менее
гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
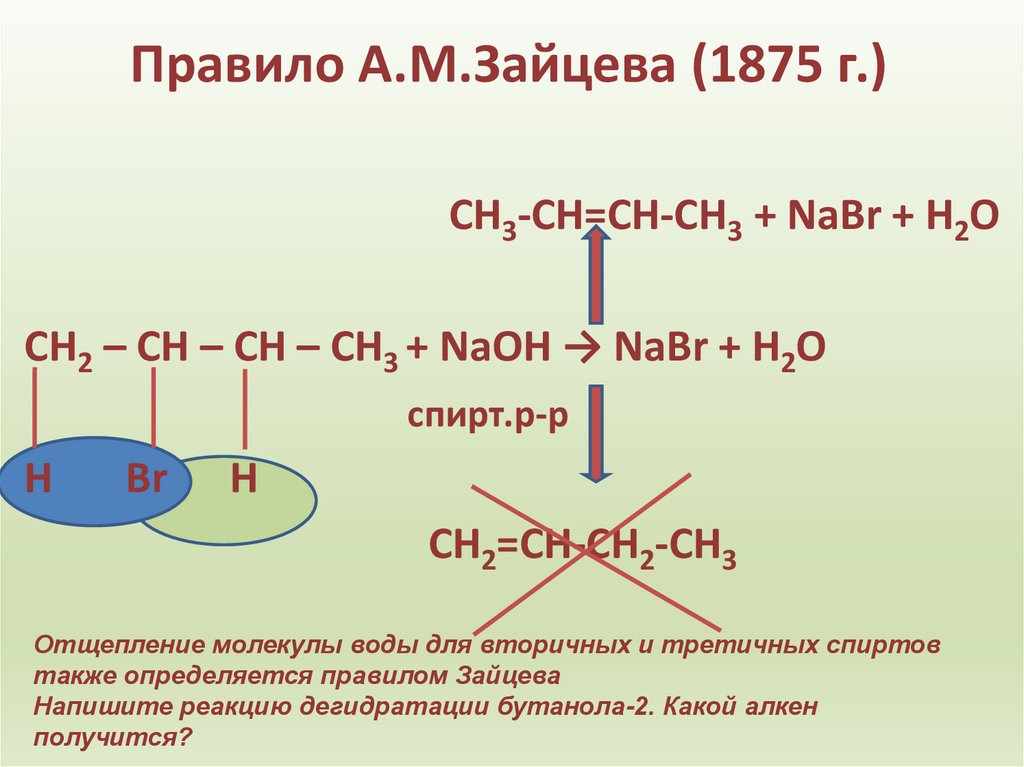
14. Правило А.М.Зайцева (1875 г.)
СН3-СН=СН-СН3 + NaBr + H2OСН2 – СН – СН – СН3 + NaOH → NaBr + H2O
спирт.р-р
H
Br
H
CH2=CH-CH2-CH3
Отщепление молекулы воды для вторичных и третичных спиртов
также определяется правилом Зайцева
Напишите реакцию дегидратации бутанола-2. Какой алкен
получится?
15. Химические свойства алкенов
• Характер углерод – углеродной связи определяет типхимических реакций, в которые вступают органические
вещества.
• Наличие в молекулах этиленовых углеводородов двойной
углерод – углеродной связи обуславливает следующие
особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к
ненасыщенным соединениям. Превращение их в
насыщенные возможно только в результате реакций
присоединения, что является основной чертой химического
поведения олефинов;
– двойная связь представляет собой значительную
концентрацию электронной плотности, поэтому реакции
присоединения носят электрофильный характер;
– двойная связь состоит из одной - и одной -связи, которая
достаточно легко поляризуется.
16.
Реакции присоединенияЗапомните! Реакции замещения свойственны алканам и высшим циклоалканам,
имеющим только одинарные связи, реакции присоединения – алкенам, диенам и
алкинам, имеющим двойные и тройные связи.
17. Правило В.В.Марковникова (1869 г.)
В реакции присоединения полярныхмолекул (НГ, воды) к несимметричным
алкенам атом водорода
преимущественно присоединяется к
наиболее гидрированному атому углерода
по двойной связи.
• Напишите уравнения реакций
присоединения HBr к пропену, H2O к
бутену-1
18. Запомните! Возможны следующие механизмы разрыва пи-связи:
Запомните! Возможны следующиемеханизмы разрыва пи-связи:
• а) если алкены и реагент – неполярные соединения, то π-связь
разрывается с образованием свободного радикала:
H2C = CH2 + H : H ––> [H2C· – CH2·] + [H·] + [H·]
• б) если алкен и реагент – полярные соединения, то разрыв πсвязи приводит к образованию ионов:
• в) при соединении по месту разрыва π-связи реагентов,
содержащих в составе молекулы атомы водорода, водород
всегда присоединяется к более гидрированному атому
углерода (правило Марковникова, 1869 г.).
• – реакция полимеризации
nCH2 = CH2 ––> n – CH2 – CH2 –– > (– CH2 – CH2 –)n
этен
полиэтилен
19. Реакции полимеризации
• 1938 г., Р.Планкеттn CF2 = CF2 (- CF2 – CF2 - ) n
Тетрафторэтилен
политетрафторэтилен, тефлон
n CН2 = CНСl (- CH2 – CH - ) n
хлорэтилен
Cl
Винилхлорид
ПВХ, поливинилхлорид
20. Реакция окисления
• Лабораторный опыт. Получить этилен и изучить его свойства• Инструкция по получению этилена и опытов с ним
• 1. Поместите в пробирку 2 мл концентрированной серной
кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и
нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с
перманганатом калия. Обратите внимание на изменение цвета
раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите
внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
• C2H4 + 3O2 ––> 2CO2 + 2H2O
(при полном окислении продуктами реакции являются
углекислый газ и вода)
21. Качественная реакция: «мягкое окисление (в водном растворе)»
• – алкены обесцвечивают растворперманганата калия (реакция Вагнера)
• При более жёстких условиях в кислой среде
продуктами реакции могут быть карбоновые
кислоты, например (в присутствии кислот):
CH3– CH = CH2 + 4 [O] ––> CH3COOH + HCOOH
• – каталитическое окисление
22. Запомните главное!
1. Непредельные углеводороды активно вступают вреакции присоединения.
2. Реакционная активность алкенов связана с тем,
что π- связь под действием реагентов легко
разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp2 – в sp3- гибридное состояние.
Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давлением или в присутствии
катализатора их отдельные молекулы соединяются в
длинные цепочки – полимеры. Полимеры (полиэтилен,
полипропилен) имеют большое практическое
значение.
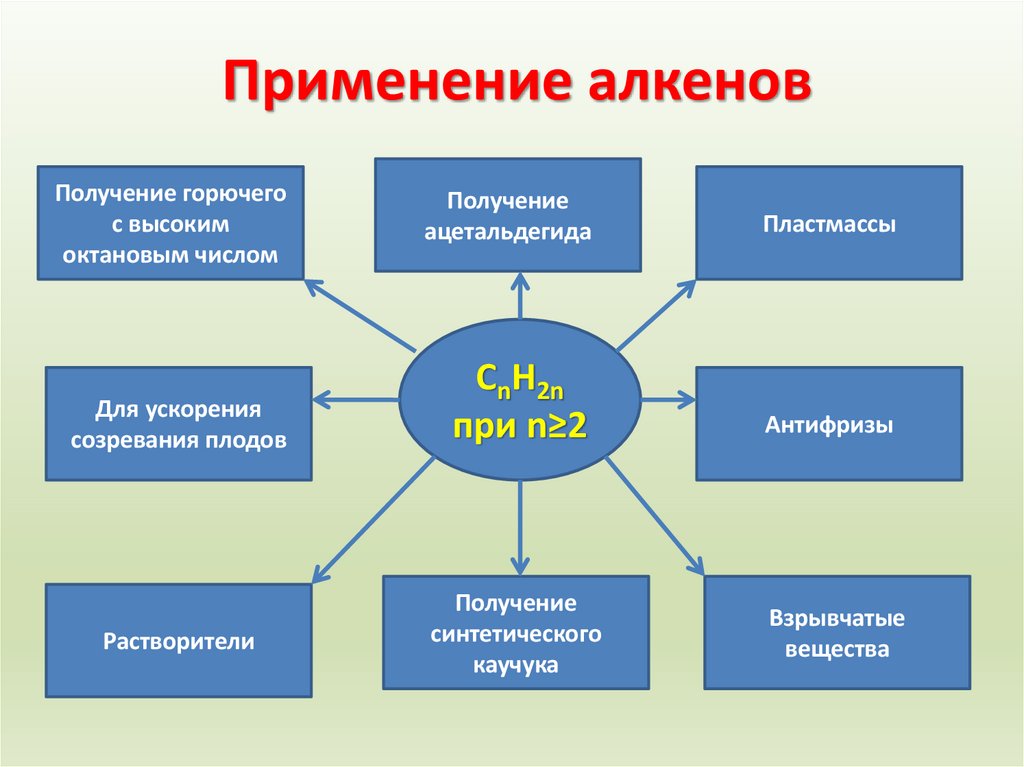
23. Применение алкенов
Получение горючегос высоким
октановым числом
Для ускорения
созревания плодов
Растворители
Получение
ацетальдегида
Пластмассы
CnH2n
при n≥2
Антифризы
Получение
синтетического
каучука
Взрывчатые
вещества
24.
• Какие углеводороды называются алкенами?• Каковы особенности их строения?
• В каком гибридном состоянии находятся атомы
углерода, образующие двойную связь в молекуле
алкена?
• Итог: алкены отличаются от алканов наличием
в молекулах одной двойной связи, которая
обуславливает особенности химических свойств
алкенов, способов их получения и применения.
25. Задания
1. Напишите структурные формулы УВ:цис-бутен-2, 2-метилпентен-2, транс-гексен-3, 2,3диметилбутен-1, транс-4-метилпентен-2, цис-4-метил-4этилгексен-2
2. Напишите структурные формулы всех возможных
изомеров пентена или гексена, назовите УВ по
международной номенклатуре
3. Плотность паров этиленового УВ по водороду равна 28.
определите его молекулярную формулу. Сколько
изомеров имеет данный алкен?
4. Массовая доля углерода в УВ составляет 85,7%, его пары
в 2,41 раза тяжелее воздуха. Определите
молекулярную формулу УВ, приведите формулы двух
его гомологов.
26. Задания
1. Какие алкены получатся при дегидробромированииследующих галогеналканов:
а) 1-бромпропан; б) 3-бромпентан; в) 2-метил-3-бромбутан?
Напишите уравнения реакций, укажите условия их протекания.
2. Напишите реакции получения перечисленных алкенов
дегидратацией соответствующих спиртов и
дегидрогалогенированием галогеналканов:
а) пропен; б) 2-метилбутен-2; в) 2,3-диметилбутен-1
Укажите условия проведения реакций.
27. Задания
• С помощью каких реакций можно осуществить следующиепревращения? При необходимости укажите условия протекания
реакций:
А) 1-хлорпропан →пропен → 2-бромпропан
Б) С2Н6 →С2Н5Br → С2Н4 → С2Н4Cl2
В) СН2Br-CH2Br →CH2=CH2 →(-CH2-CH2-)n
Г) пропанол-1 → пропен → 2-хлорпропан → 2,3-диметилбутан → 2,3диметилбутен-2→ 2,3-диметилбутандиол-2,3
Д) гексен → гексан → пропен → полипропилен
Е) пропанол-1 → Х → пропанол-2
• Этиленовый УВ массой 7 г обесцвечивает 640 г бромной воды с
массовой долей брома 2,5%. Определите молекулярную формулу
алкена.
• Какова структурная формула этиленового УВ, если 11,2 г его при
взаимодействии с избытком бромоводорода превращается в 27,4 г
бромалкана с положением галогена у третичного атома углерода?
















 chemistry
chemistry








