Similar presentations:
ЧухлебоваО.Презентация
1.
КАФЕДРА ХИМИИ ВГАУIV Международный конкурс
творческих работ старшеклассников
«Химия — основа жизни»
Кальций – ионы здоровья
Автор:
Чухлебова Оксана Евгеньевна,
ученица 10 класса
МКОУ Таловской СОШ
Руководитель:
Коновалова Ирина Митрофановна,
учитель химии ВКК
МКОУ Таловской СОШ
2.
АктуальностьКальций — это важнейший макроэлемент в организме человека,
который выполняет множество жизненно необходимых функций. Он
содержится в каждой клетке человеческого организма. Кальций
необходим каждому человеку в любом возрасте. Его недостаток
вызывает около 150 болезней! Поэтому даже профилактический
прием
кальция
может
существенно
снизить
опасность
возникновения болезней.
Однако, восстановить нарушения обмена кальция удается с
трудом, так как применяемые медициной препараты плохо
усваиваются организмом.
Поэтому изучение биологической роли ионов кальция и поиск
источников оптимального насыщения ими организма являются
актуальными.
Знания о макроэлементе кальции помогут каждому сохранить его
здоровье!
3.
Цель:изучение биологической роли ионов кальция
и поиск источников оптимального
насыщения ими организма.
Задачи:
1) Изучить биологическую роль кальция по источникам информации.
2) Рассмотреть список продуктов питания, богатых кальцием.
3) Выяснить причины плохого усвоения кальция организмом человека.
4) Теоретически исследовать химический состав кальцийсодержащих
медицинских препаратов по инструкциям; определить биодоступные.
5) Исследовать яичную скорлупу как идеальный природный источник
кальция:
провести теоретический анализ имеющейся информации;
выполнить эксперимент по определению химического состава
яичной скорлупы;
определить рН раствора скорлупы яиц;
приготовить биодоступный препарат кальция в домашних условиях.
4.
Кальций в организме человекаСодержание кальция в организме человека
Содержание кальция в организме взрослого человека (масса тела
70 кг) составляет 1 кг. Основная масса кальция находится в костной и
зубной тканях в виде соединений Са3(РO4)2 (80%) и СаСО3 (13 %).
Остальной кальций входит в состав крови и других тканей как в виде
ионов, так и в связанном состоянии. Содержание его в сыворотке
крови строго постоянно – 1% от общего состава крови.
Норма содержания кальция в крови
Кальций - жизнеобеспечивающее вещество для организма. Норма
содержания кальция в крови обеспечивает человеку активность,
бодрость и уравновешенность. Поэтому для поддержания
достаточного его количества нужно знать его норму.
Нормой Ca в крови считаются показатели:
у взрослого человека от 2,2 до 2,5 ммоль/л;
у детей до 12 лет - эти показатели выше – до 2,75 ммоль/л.
Рекомендуемая Норма Потребления –
РНП в сутки кальция: взрослыми людьми должна быть
в пределах от 800 до 1200 мг, детьми – 800 мг.
5.
Биологическая роль кальцияВажно, чтобы уровень кальция поддерживался в относительно
постоянных
значениях,
ведь
он
участвует
во
многих
жизнеобеспечивающих биологических процессах внутри организма.
Является строительным материалом для
образования костей и зубов.
Ощелачивает организм.
Важен для регуляции процессов роста и
деятельности клеток всех видов тканей.
Влияет на обмен веществ.
Важен для нормальной деятельности
мышечной и нервной систем.
Обеспечивает нормальную
свертываемость крови.
Оказывает противовоспалительное
действие.
Обеспечивает устойчивость организма к
внешним неблагоприятным факторам:
резкой смене погоды и инфекциям.
6.
Роль кальция в кислотнощелочном балансе организмаЧеловеческий организм на 70 % состоит из жидкостей, поэтому все
вещества, изменяющие их состав и кислотность, оказывают глобальное
воздействие на организм в целом.
Практически все жидкости, находящиеся в системе человеческого
организма, являются либо нейтральными, либо слабощелочными, за
исключением желудочного сока: рН желудочного сока составляет 1,0, здоровой
крови — 7,4, здоровой лимфы — 7,5, слюны — 7,4. Сдвиг равновесия в
сторону повышения кислотности системы является одной из основных
причин многих заболеваний.
Организм с трудом удаляет избыток кислот, и когда чрезмерно повышается
кислотность крови или лимфы, и это продолжается длительное время —
возникают различные заболевания. В кислой среде интенсивно размножаются
многие вирусы и бактерии, вызывающие различные заболевания, в щелочной
же среде они, как правило, погибают. Когда система организма
ощелачивается и возвращается нормальный кислотно-щелочной баланс,
человек начинает выздоравливать.
Кальций, помещенный в любую жидкость, нейтрализует избыточную
кислотность, а значит, повышает значение рН. При ежедневном
употреблении кальция все жидкости нашего тела становятся более щелочными,
а значит, и весь организм в целом.
7.
Роль кальция в онкологииНемецкий биохимик и физиолог Отто Варбург в 1932
году получил Нобелевскую премию по химии за то, что
доказал, что процесс развития рака является анаэробным. А
это означает, что рак развивается только тогда, когда
организм испытывает недостаток кислорода в крови.
Именно недостаток кислорода делает жидкости организма
кислотными. То есть, естественный кислотно-щелочной
баланс организма (рН=7,5) нарушен в сторону закисления,
и, следовательно, именно в кислой среде развиваются
злокачественные клетки. Да и не только, почти все болезни
имеют первоосновой именно эту причину. Сделать
щелочную среду — и с злокачественной опухолью можно
бороться!
Отто Варбург открыл, что рак можно излечивать с
помощью … кальция (именно кальция!), так как этот
элемент создает щелочную среду в организме человека и
связывает кислотные радикалы!
Дальнейшие исследования у онкобольных подтвердили,
что у всех диагностируется критическая нехватка кальция.
Было установлено, что именно кальций может
излечивать рак!
8.
Нарушения кальциевого обмена и его количества неизбежно приводят кзаболеваниям в организме человека
ГИПОКАЛЬЦИЕМИЯ (недостаток кальция в организме) - это заболевание,
вызванное снижением содержания активного (ионизированного) кальция в
сыворотке крови, ведущее к нарушению процессов в мембранах клеток из-за
сбоев в обмене веществ. Это одно из самых распространенных нарушений
обмена веществ: рахит и неправильный рост зубов у детей, искривление
позвоночника, хрупкость костей у пожилых людей. Расстройство кальциевого
обмена часто сопровождается малокровием, подверженностью простудам,
аллергией, герпесом на губах, понижением сопротивляемости действию
радиации.
ГИПЕРКАЛЬЦИЕМИЯ (избыток кальция в организме) – это заболевание,
связанное со стойким нарушением метаболизма кальция в крови в сторону
увеличения от нормы. Реакция организма на избыток кальция: избыточное
поступление кальция в клетки соединительной ткани частично обезвоживает
их, в результате чего клетки увядают, снижается их физиологическая
активность; нервная система становится более возбудимой; развивается
мочекаменная болезнь, что связано с образованием нерастворимых солей
кальция и магния: оксалатов и уратов, которые обладают свойством отлагаться
и концентрироваться в суставной жидкости, в хрящах, уменьшая их
подвижность и вызывая заболевание — подагру. В особенно тяжелых случаях
приводит к кальцинозу (отложение солей) в различных тканях и органах.
9.
Продукты, богатые кальцием10.
Причины минимальногоусвоения кальция организмом
Почему плохо усваивается органический кальций?
1) При термообработке овощей, фруктов и других продуктов (например,
молоко, кисломолочные продукты, детские смеси), содержащийся в них
органический кальций мгновенно переходит в неорганическое состояние и
практически не усваивается организмом.
Кальций усваивается охотно организмом только из продуктов питания, не
подвергающихся тепловой обработке.
2) Вторая причина неусвоения организмом кальция - нехватка витамина D,
именно того витамина, который вырабатывается самим организмом под
действием ультрафиолета, то есть солнечных лучей. Недостаток этого
витамина лучше принимать в естественном виде - а именно в рыбьем жире,
который почти целиком усваивается организмом.
3) Несбалансированность минерального обмена.
Кальций будет усваиваться охотно организмом, если соблюдены простейшие
правила содержания в организме и других элементов, а именно: фосфора,
магния, стронция (не должно быть переизбытка этих элементов), йода
(помогает кальцию «обустроиться» в организме).
11.
Препараты, которые назначают принедостатке кальция в организме
С лечебной целью назначают препараты, содержащие соли кальция. Было
изучено более 30 препаратов и выявлено, что основной частью их являются
кальцийсодержащие соединения (таблица 1).
Таблица 1. Содержание кальция (элемента) в различных солях кальция
Название соли кальция
Карбонат кальция
Хлорид кальция
Цитрат кальция
Глицерофосфат кальция
Лактат кальция
Глюконат кальция
Фосфат кальция трехосновной
Химическая
формула соли
CaCO3
CaCl2
Ca3(C6H5O7)2
C3H7CaO6P
2(C3H5O3)·Ca
C12H22CaO14
Ca3(PO4)2
Содержание кальция (элемента)
в мг на 1 г соли кальция
400
270
211
191
130
90
400
12.
Какой кальций нужен организму?Прежде всего — легкоусвояемый!
Назначить принимать кальциевые препараты — это одно, а вот получить
желаемый результат — совершенно другое. Как видно из табл.1, больше всего
кальция содержится в карбонате и трехосновном фосфате (40 %), но всасывание
этих солей зависит от состояния желудочной секреции и уменьшается с
возрастом. Ионы Са2+ усваиваются (всасываются в кишечнике) лишь на 50%.
Для усвоения карбоната кальция требуется огромное количество соляной
кислоты, выделяемой желудком. В молодом возрасте это не проблема, желудок
довольно свободно усваивает тяжелый карбонат кальция, но при любых
хронических заболеваниях выделение соляной кислоты становится
уменьшенным и карбонат кальция не усваивается, а выводится организмом как
шлак.
Наилучшим всасыванием в желудочно-кишечном тракте при наименьшем
риске образования камней характеризуется цитрат кальция (кальциевая соль
лимонной кислоты). Поэтому карбонат кальция советуют запивать лимонным
соком.
Цитрат кальция входит в ряд препаратов кальция,
состоящих из смеси нескольких солей кальция.
Препараты с цитратом кальция не требуют
кислотности желудочного сока.
13.
Са2+Волшебная скорлупка
Ученые давно уже подтвердили, что скорлупа яиц – идеальный источник
кальция, который легко усваивается организмом. Уникальность скорлупки – в
её «естественной природе». Яичная скорлупка – это кальциевый препарат,
который исключительно талантливо создала сама природа. Именно этим
предопределено идеальное усвоение яичной скорлупы организмом.
Химический состав яичной скорлупы
Скорлупа яиц состоит на 90 % из кальцита – одной из кристаллических
форм карбоната кальция CaCO3, причем этот карбонат, в отличие от мела,
усваивается почти стопроцентно за счет того, что уже проходил синтез в
организме птицы из органического кальция в неорганический.
Кроме того, скорлупа содержит все необходимые для организма
микроэлементы, в том числе медь, фтор, железо, марганец, молибден,
фосфор, серу, кремний, селен, цинк и другие — всего 27 элементов!
По химическому составу яичная скорлупа сходна с тканью костей и
зубов человека.
14.
Исследование химического составаяичной скорлупы
Экспериментальное определение кальция
Для определения кальция в яичной скорлупе применили метод,
разработанный для анализа карбонатных пород в геологической практике:
метод нейтрализации в сочетании с оксалатным и перманганатометрический
метод.
1) Навеску яичной скорлупы (0,2 г) растворили
в 25 мл соляной кислоты (0,2 моль/л):
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
MgCO3 + 2HCl = MgCl2 + H2O + CO2↑
Избыток кислоты оттитровали щелочью:
HCl + NaOH = NaCl + H2O
По результатам кислотно-основного титрования
вычислили массовую долю углекислого газа:
15.
2) Осадили ионы кальция оксалатом аммония:CaCl2 + (NH4)2C2O4 = CaC2O4 ↓ + NH4Cl
Оттитровали фильтрат раствором перманганата калия в кислой среде:
(NH4)2C2O4 + H2SO4 = H2C2O4 + (NH4)2SO4
5 H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 + K2SO4 + 8H2O
По результатам перманганатометрии вычислили массовую долю оксида
кальция:
Расчет состава скорлупы
Вычислили массовую долю СО2, связанного с соответствующим количеством
СаО в CaCO3:
В результате проведенного исследования были получены следующие данные
по химическому составу (ω, %):
CO2 - 42%; СаО – 52%; CaCO3 – 93%; Са – 37,2%.
16.
Приготовление биодоступногоцитрата кальция из яичной скорлупы
I. ПОЛУЧЕНИЕ МОЛОТОЙ ЯИЧНОЙ СКОРЛУПЫ
1. Промыть скорлупу под водой. Отделить тонкую пленку.
2.Прокипятить скорлупу в воде 5-10 минут.
3. Просушить.
4. Измельчить как можно мельче!
17.
II. РАСЧЕТ СУТОЧНОЙ ДОЗЫ ПОРОШКАСкорлупа 1 среднего яйца имеет массу ~5 г.
Содержание чистого кальция в 1 скорлупе рассчитаем по формуле:
m(Ca) = 5г · ω(СаСО3) · ω(Са) = 5г· 0,9 · 0,4= 1,8 г = 1800 мг
Скорлупа 1 среднего яйца = 1 ч. л. порошка с горкой = 1800 мг кальция.
Суточная норма потребления кальция составляет от 800 до 1200 мг.
Суточная доза порошка яичной скорлупы: ~1/2 ч.л.
III. ПРИГОТОВЛЕНИЕ ЦИТРАТА КАЛЬЦИЯ
Для того, чтобы организм более охотно усваивал кальций, яичную
скорлупу заливают лимонным соком (лимонной кислотой). Идет обычная
химическая реакция с выделением углекислого газа и образованием новой
соли — цитрата кальция, который активно высвобождает ионы:
2C6H8O7 + 3CaCO3 = Ca3(C6H5O7)2 + 3CO2 + 3H2O
И вот именно этот цитрат кальция (пищевая добавка Е333) идеально
усваивается организмом, не требуя кислотности желудочного сока!
18.
«Скорлупочно-кальциевая» водаПольский натуропат доктор Вацлав Крешник изучал воду с растворенной в
ней яичной скорлупой, а именно, влияние её на кислотно-щелочной баланс.
Оказалось, что помещенный в любую некарбонатную жидкость порошок
яичной скорлупы моментально вступает с ней в соединение и в течение 3–5
минут отдает ей свои уникальные свойства и насыщает ее ионами кальция.
Такая «скорлупочно-кальциевая» вода очень эффективно решает проблемы,
связанные с дефицитом кальция. Кальций, содержащийся в воде, быстро и легко
усваивается организмом, поскольку находится в ионной, готовой для усвоения
форме. Одновременно он прекрасно очищает воду: дезактивирует хлор,
сорбирует соли тяжелых металлов и вредные микроорганизмы, то есть,
воздействуя на воду, он эффективно снижает ее вредные воздействия.
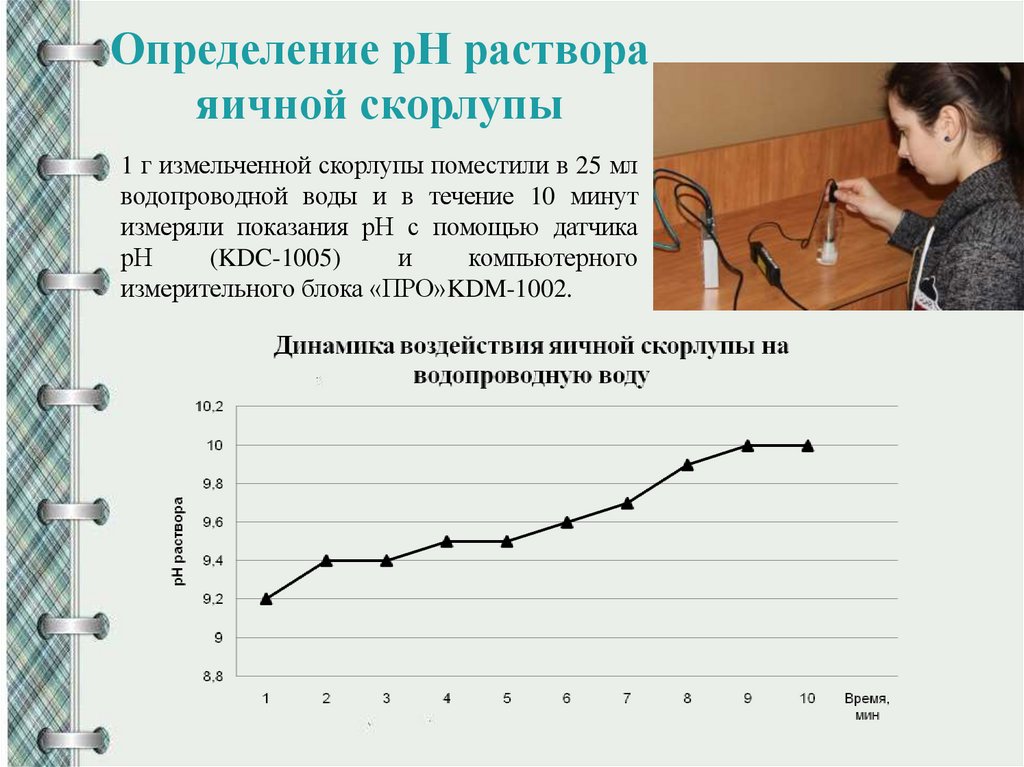
При воздействии на воду скорлупка превращает ее в щелочную, то есть
может повышать уровень водородного показателя рН до 9,8–10,0 единиц.
Употребление такой воды за счет ощелачивания организма обеспечивает лучшее
усвоение поступающих в него компонентов и, что очень важно, усвоение
кислорода в щелочной среде увеличивается многократно.
«Кальциевая вода» усваивается намного лучше, чем измельченная
яичная скорлупа.
19.
Определение рН раствораяичной скорлупы
1 г измельченной скорлупы поместили в 25 мл
водопроводной воды и в течение 10 минут
измеряли показания рН с помощью датчика
рН
(KDC-1005)
и
компьютерного
измерительного блока «ПРО»KDM-1002.
20.
Выводы1. Кальций — это важнейший макроэлемент в организме человека. Нарушения
кальциевого обмена неизбежно приводят к заболеваниям в организме
человека. Именно поэтому кальций называют ионами здоровья!
2. Многие продукты питания содержат кальций, однако люди часто
испытывает его недостаток, так как он плохо усваивается организмом.
Основные
причины
этого:
термическая
обработка
продуктов,
несбалансированность минерального обмена, недостаток витамина D.
3. Недостаток кальция в организме восполняется с помощью медицинских
препаратов,
содержащих
различные
соли
кальция.
Наибольшей
биодоступностью обладает цитрат кация.
4. Идеальным природным источником кация является яичная скорлупа,
которая может использоваться в виде порошка или «кальциевой» воды.
5. В ходе эксперимента определен количественный химический состав яичной
скорлупы (93% СаСО3), что подтверждает целесообразность её использования
для насыщения организма кальцием.
6. Проведен опыт по определению рН растора сколупы яиц, результаты
которого позволяют рекомендовать данный раствор для ощелачивания
организма.
7. Практически приготовлен биодоступный препарат (цитрат кальция) из
яичной скорлупы в домашних условиях, который используется в народной
медицине.
21.
Источники информацииКоррея Л.Х., Корнараки В.В., Фельдман А.Л. Биологическая
ценность яичной скорлупы для производства продуктов питания//
Птицеводство. 1987. - № 6. - с. 15.
Штелле А.Л. Куриное яйцо: вчера, сегодня, завтра. - М.:
Агробизнес-центр, 2004. - 196 с, ил.
Штелле А.Л. Рассказы о курином яйце. – М.: Колос, 1980.
http://www.chem.msu.su Портал фундаментального
химического образования России. Химический факультет МГУ
им. М.В. Ломоносова. Ю.В. Морачевский. Анализ карбонатных
пород в геологии.
http://www.nnre.ru/zdorove/kalcii_iony_zdorovja/p2.php
http://www.new-med.info Медицинский портал