Similar presentations:
Лекция 6_ Растворы
1.
2. План лекции
1.2.
3.
4.
Вода и ее значение как природного растворителя.
Растворы.
Водородный показатель (рН).
Жесткость воды.
Литература
1. Глинка Н.Л. Общая химия: Главы 7-8.
2.
Общая химия. Под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузия. М.,
Изд-во Московского университета, 1980. – с. 239-247, с. 262-268.
3.
Лучинский Г.П. Курс химии: Учебник для инженерно-технических
(нехимических) вузов. – М.: Высшая школа, 1985. – с. 169-174.
3. Домашнее задание
1.2.
3.
Внимательно прочитать учебник Глинка Н.Л. «Общая химия»: Глава 7.
Задачник Глинка Н.Л. – задачи № 396 и № 404.
Привести в тетради по 5 примеров кислых растворов, нейтральных и
щелочных.
4.
Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможноописать, тобой наслаждаются, не ведая, что ты такое. Нельзя
сказать, что ты необходима для жизни, ведь ты – сама жизнь! Ты
наполняешь нас радостью, которую не объяснишь нашими чувствами.
С тобой возвращаются к нам силы, с которыми мы уже простились.
Ты – самое большое богатство на свете!
(А. де Сент-Экзюпери)
5. Основанием всех растворов в природе является вода! Это уникальное явление, без которого жизнь не возможна нигде во вселенной.
ВОДА И ЕЕ ЗНАЧЕНИЕ, КАК ПРИРОДНОГО РАСТВОРИТЕЛЯОснованием всех растворов в природе является вода!
Это уникальное явление, без которого жизнь не возможна нигде во вселенной. Вода –
наиболее распространенное на планете вещество (занимает 2/3 от ее поверхности).
Однако не меньше воды находится и в газообразном состоянии в атмосферном воздухе.
В недрах Земли и в почве также находится вода.
Природная вода не бывает абсолютно чистой, т.е. чистой Н2О нет. Это всегда
«коктейль» из минералов, солей, различных примесей и т.п.
Именно вода является основным носителем составов и растворов на Земле. И это
определяется строением ее молекулы и ее способностью к диссоциации (т.е. распаду
на ионы):
Н2О(ж) Н+ + ОНТак что же такое раствор?
6. РАСТВОРЫ
Растворы — это однородные смеси переменного состава, состоящие издвух и более компонентов: растворителя и растворённого вещества (или
растворённых веществ).
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды,
в которой эти вещества равномерно распределены в виде молекул или ионов.
Растворитель — это вещество, которое находится в том же агрегатном
состоянии, что и раствор. Если оба вещества имеют одно агрегатное
состояние, то растворителем, как правило, считают вещество, масса которого
больше. В случае с водными растворами обычно растворителем считают воду,
независимо от соотношения масс веществ.
7. РАСТВОРИМОСТЬ. КОНЦЕНТРАЦИЯ РАСТВОРА
бывают :Концентрация раствора — это характеристика, которая
показывает, в каком соотношении находятся растворенное вещество и
растворитель.
(г/л или в моль/л)
СМ = η / V
где η – это количество вещества, V – объем растворителя.
Растворы с низким содержанием растворенного вещества называются
разбавленными, а с высоким – концентрированными.
8.
Массовая доля — это отношение (обычно процентное, %) массырастворенного вещества к массе раствора. Например, 15% (масс.) водный
раствор хлорида натрия – это такой раствор, в 100 единицах массы которого
содержится 15 единиц массы NaCl и 85 единиц массы Н2О.
Молярная концентрация или молярность — это отношение
количества растворенного вещества к объему раствора. Обычно
обозначается См или М. Так, 2М H2SO4 означает раствор, в каждом литре
которого содержится 2 моля серной кислоты (H2SO4), т.е. См = 2 моль/л.
Нормальная (эквивалентная) концентрация или нормальность — это
отношение числа эквивалентов растворенного вещества к объему
раствора. Обычно обозначается Сн или Н. Так, 2Н H2SO4 означает раствор, в
каждом литре которого содержится 2 эквивалента серной кислоты (H2SO4), т.е.
Сн = 2 моль/л.
Задание: определите способ выражения состава растворов
1) 1Н КСl
2) 2М СаSO4
3) 3% H2O2
9.
3. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН)Важной особенностью жидкой воды является ее способность к самопроизвольной
диссоциации по реакции:
Н2О(ж) Н+(водн) + ОН-(водн)
Константа данного ионного произведения равна 10-14 , т.е. в водных растворах на
катион водорода Н+ приходится от 0 до 7 частей ионного произведения, а на анион ОНприходится от 7 до 14 частей ионного произведения молекулы воды.
При добавлении кислот, концентрация [Н+] увеличивается, т.е. равновесие
смещается влево, а концентрация [ОН-] уменьшается. И наоборот, при добавлении
щелочей [ОН-] концентрация [Н+] уменьшается. Т.е. меняется константа ионного
произведения.
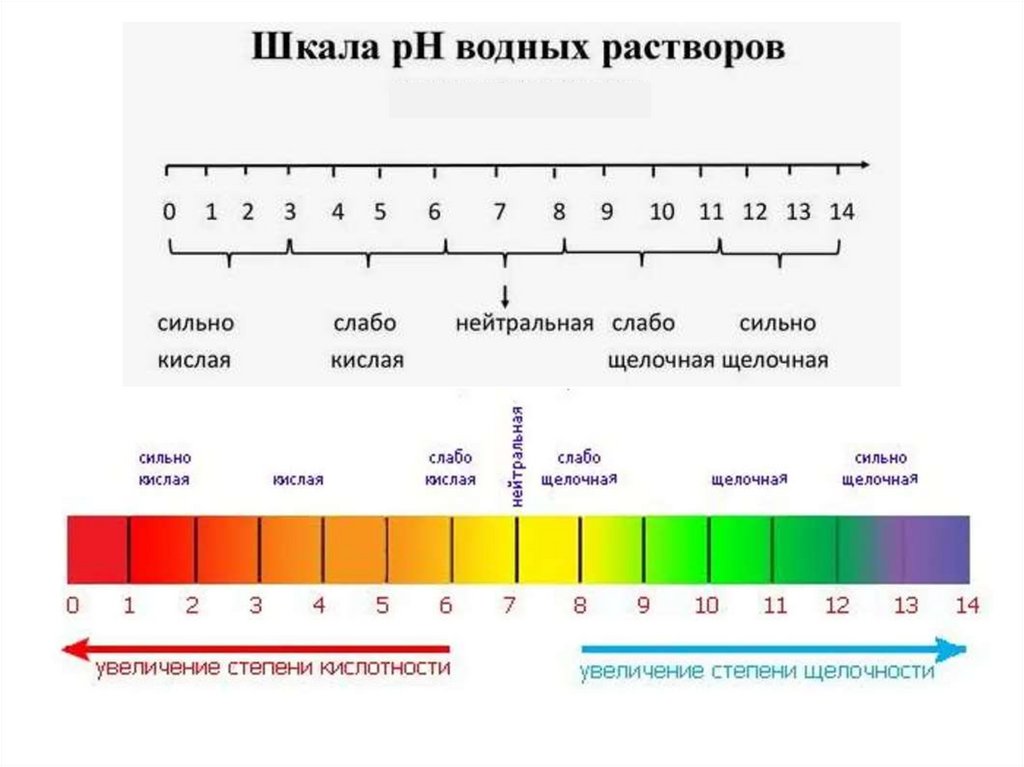
В кислой среде [H+] ˂ 10-7 моль/л, т.е. рН меньше 7 (от 0 до7)
В щелочной среде [ОН-] > 10-7 моль/л, т.е. рН больше 7 (от 7 до 14).
В нейтральной среде находится равное количество [H+] и [ОН-].
Поэтому все растворы разделяются на кислые, нейтральные и щелочные.
Нейтральные
рН = 7
Растворы :
Кислые
рН < 7
Щелочные
рН > 7
10.
11.
Рассмотрим примеры формирования водных растворов различной кислотности.Например, кислая среда (рН от 0 до 7) содержит в водных растворах катион
водорода [H+], поэтому в состав кислот входит [H+]:
2SO2 + 2H2O + O2 → 2H2SO4 (рH = 1, т.е. кислая среда)
4NO2 + H2O + O2 → 4HNO3 (рH = 1,5, т.е. кислая среда)
Щелочная среда (рН от 7 до 14) содержит в водных растворах гидроксо-анион
[ОH-], поэтому в состав оснований (щелочей) входит [ОH-]:
FeO+ H2O → Fe(OH)2 (рH = 9, т.е. щелочная среда)
2Na + 2H2O → 2NaOH (рH = 14, т.е. щелочная среда)
12.
ЗНАЧЕНИЕ ПОКАЗАТЕЛЯ рНПоказатель
рН
используется
чрезвычайно широко в науке и
промышленности.
В
медицине
величина
рН
биологических жидкостей служит для
определения патологий. Например, в
норме
рН
сыворотки
крови
составляет 7,4; слюны – 6,3..6,8;
желудочного сока – 0,9..1,1; слез –
7,4.
В
сельском
хозяйстве
рН
характеризует кислотность почв,
экологическое состояние природных
вод и т.д.
В
пищевой
промышленности
определяет качество продукта или
питьевой воды и т.д.
13.
МЕТОДЫ ИЗМЕРЕНИЯ КИСЛОТНОСТИ СРЕДЫ (рН)Индикаторная бумага
Электронные портативные рН-метры
Стеклянные и стационарные рН-метры
Жидкие индикаторы
14. Индикаторы кислотности
Кислотно-основными индикаторами называются химические соединения,изменяющие свою окраску в зависимости от рН среды, в которой они находятся.
Вы, наверное, обращали внимание на то, как меняется цвет чая, если в него
положить лимон – это пример действия кислотно-основного индикатора, а именно,
действие лимонной кислоты, как индикатора, на таниновые комплексы чайного листа.
Индикаторы, как правило, представляют собой слабые органические кислоты или
основания. Для того или иного типа раствора существуют различные индикаторы,
например:
Название
индикатора
рН < 7
рН = 7
рН > 7
(кислая среда)
(нейтральная среда)
(щелочная среда)
Метилоранж
красный
оранжевый
желтый
Фенолфталеин
бесцветный
бесцветный
малиновый
красный
фиолетовый
синий
Лакмус
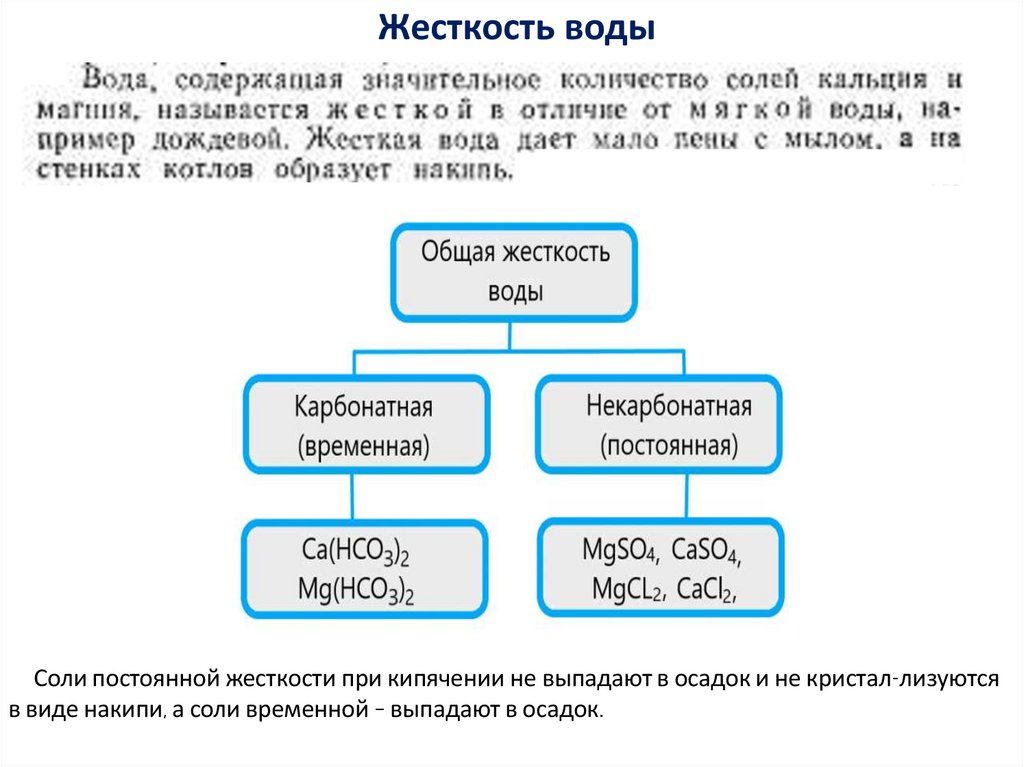
15. Жесткость воды
Соли постоянной жесткости при кипячении не выпадают в осадок и не кристал-лизуютсяв виде накипи, а соли временной – выпадают в осадок.
16.
Избавиться от жесткости можно несколькими способами. Самый простой – этофильтрация и кипячение воды. Фильтры бывают природными (глина, зола, уголь) и
созданными человеком (фильтры, обратный осмос и т.п.).
Когда мы кипятим воду – мы видим на дне чайника или кастрюли белый налет –
это и есть осажденные соли Mg и Ca.
Согласно методам определения жесткости воды по гидрохимии считается:
1. 0-4 мг-экв./л – мягкая вода.
2. 4-8 мг-экв./л – средней жесткости.
3. 8-12 мг-экв./л – жесткая вода.
4. Больше 12 мг-экв./л – очень жесткая.
Наша вода в Донбассе имеет жесткость 12-17 мг-экв./л, поэтому она ОЧЕНЬ
жесткая.
17.
Лекция окончена.Благодарю за внимание!















 chemistry
chemistry








