Similar presentations:
Лекция 2.2 Тема 2.2. (1)
1. Лекция 2. Электролитическая диссоциация и ионный обмен
2. Теория электролитической диссоциации
Основные понятияo Электролиты. К ним относятся:
Соли
Кислоты
Основания
o Неэлектролиты
o Электролитическая диссоциация
o Ионы:
Катионы
Анионы
Механизм диссоциации
o Вода — полярный растворитель. Молекулы
воды (диполи) ориентируются вокруг
заряженных частиц кристалла.
o Гидратация — процесс взаимодействия ионов с
молекулами воды.
o Энергия гидратации превышает энергию
кристаллической решётки → ионы переходят в
раствор.
Основные положения ТЭД
o При растворении в воде (или расплавлении)
электролиты распадаются (диссоциируют) на
положительно и отрицательно заряженные
ионы
o Под действием электрического тока ионы
движутся направленно:
Катод (–)
Анод (+)
o Диссоциация — обратимый процесс
o Степень диссоциации (α)
α = 0 — нет диссоциации
0 < α < 3% — слабый электролит
3% < α < 30% — электролит средней силы
α > 30% — сильный электролит
3.
Диссоциация кислот, оснований, солей:o Кислоты — диссоциируют на катион водорода H⁺
и анион кислотного остатка.
HCl → H⁺ + Cl⁻
o Основания — диссоциируют на катион металла и
гидроксид-анион OH⁻.
KOH → K⁺ + OH⁻
o Соли — диссоциируют на катион металла и анион
кислотного остатка.
Al₂(SO₄)₃ → 2Al³⁺ + 3SO₄²⁻
Сильные и слабые электролиты
o Сильные электролиты в разбавленных растворах
диссоциируют практически полностью.
Используется знак →.
Примеры: HCl, HBr, HI, HNO₃, H₂SO₄ (разб.), HClO₄,
щёлочи, почти все соли.
o Слабые электролиты диссоциируют частично,
устанавливается равновесие. Используется знак ⇄.
Примеры:
CH₃COOH ⇄ CH₃COO⁻ + H⁺
NH₃·H₂O ⇄ NH₄⁺ + OH⁻
Константа диссоциации (Kд)
Для слабых электролитов:
[Катион][Анион]
Kд =
[Недиссоциированные молекулы]
Чем меньше Kд, тем слабее электролит.
Ионно-молекулярные уравнения реакций
o Правила: сильные электролиты записываются в
виде ионов, слабые — в виде молекул, газы,
осадки, малодиссоциирующие вещества — в
молекулярной форме.
Пример:
Молекулярное уравнение: HCl + NaOH → NaCl + H₂O
Полное ионное уравнение: H⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ +
Cl⁻ + H₂O
Сокращённое ионное уравнение: H⁺ + OH⁻ → H₂O
4. Ионы
Ионы — это заряженные частицы (атомы илигруппы атомов), которые образуются в результате
отдачи или присоединения электронов.
Заряд иона возникает из-за неравенства числа
протонов в ядре и электронов вокруг него.
Химическим путём :
o В ионной связи: Атом-металл отдает электроны
атому-неметаллу.
2Na⁰ + Cl₂⁰ → 2Na⁺Cl⁻
o В реакциях электролитической диссоциации:
При растворении кислот, оснований и солей в
полярных растворителях они распадаются на
ионы.
HCl → H⁺ + Cl⁻
Na₂SO₄ → 2Na⁺ + SO₄²⁻
o Физическим путём:
Под действием электрического тока или
высокой температуры.
Классификация ионов
o По знаку заряда:
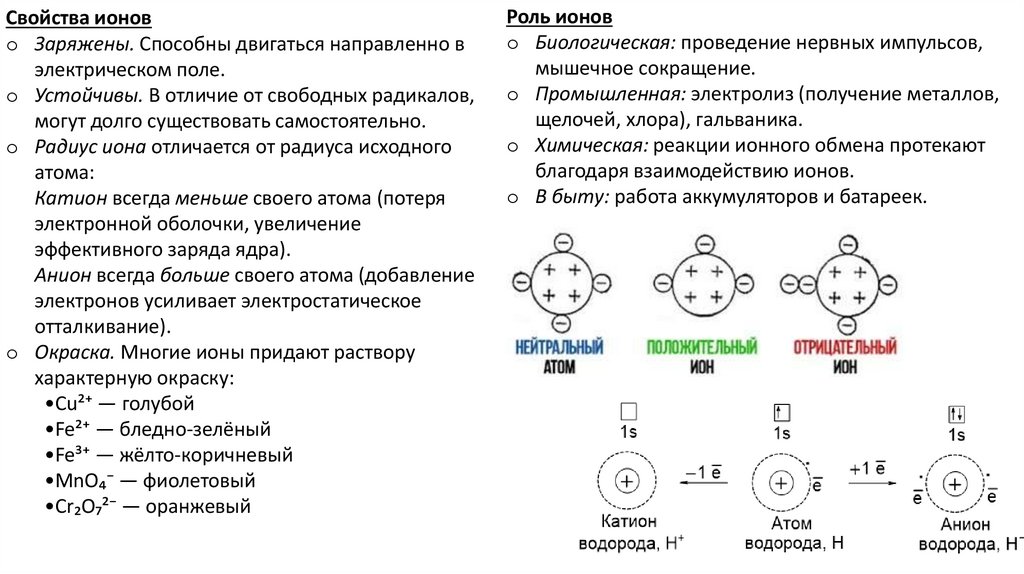
Катионы — ионы с положительным зарядом.
Как образуются: Атом отдает один или несколько
внешних электронов.
Анионы — ионы с отрицательным зарядом.
Как образуются: Атом принимает один или
несколько электронов на свой внешний уровень.
o По составу:
Простые ионы: Образованы одним атомом.
Сложные ионы: Образованы группой атомов,
связанных ковалентными связями и имеющих
общий заряд.
o По наличию гидратной оболочки:
Гидратированные ионы — окружены прочно
связанными молекулами воды.
Негидратированные ионы — существуют в
кристаллической решётке или в газовой фазе.
5.
Свойства ионовo Заряжены. Способны двигаться направленно в
электрическом поле.
o Устойчивы. В отличие от свободных радикалов,
могут долго существовать самостоятельно.
o Радиус иона отличается от радиуса исходного
атома:
Катион всегда меньше своего атома (потеря
электронной оболочки, увеличение
эффективного заряда ядра).
Анион всегда больше своего атома (добавление
электронов усиливает электростатическое
отталкивание).
o Окраска. Многие ионы придают раствору
характерную окраску:
•Cu²⁺ — голубой
•Fe²⁺ — бледно-зелёный
•Fe³⁺ — жёлто-коричневый
•MnO₄⁻ — фиолетовый
•Cr₂O₇²⁻ — оранжевый
Роль ионов
o Биологическая: проведение нервных импульсов,
мышечное сокращение.
o Промышленная: электролиз (получение металлов,
щелочей, хлора), гальваника.
o Химическая: реакции ионного обмена протекают
благодаря взаимодействию ионов.
o В быту: работа аккумуляторов и батареек.
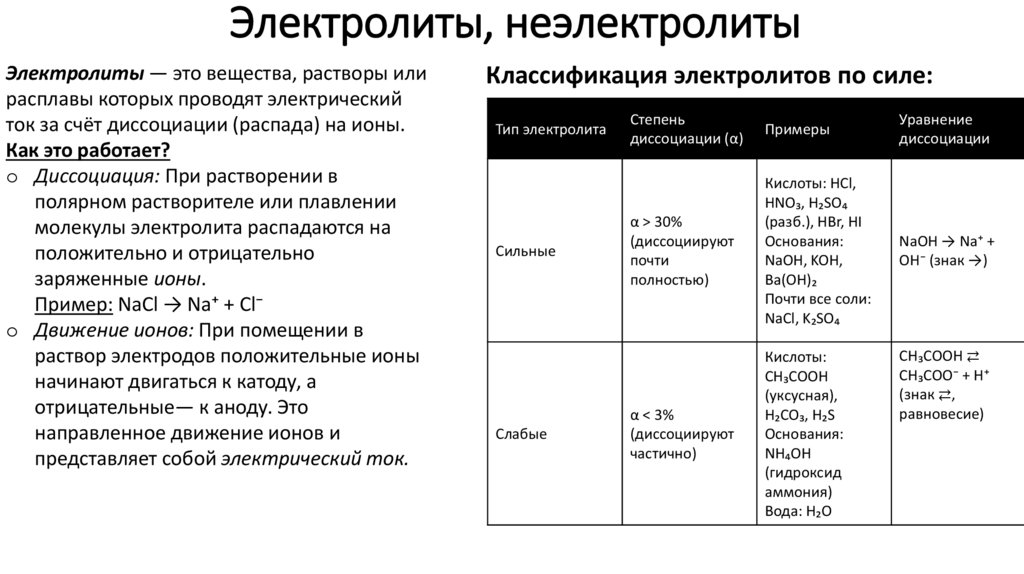
6. Электролиты, неэлектролиты
Электролиты — это вещества, растворы илирасплавы которых проводят электрический
ток за счёт диссоциации (распада) на ионы.
Как это работает?
o Диссоциация: При растворении в
полярном растворителе или плавлении
молекулы электролита распадаются на
положительно и отрицательно
заряженные ионы.
Пример: NaCl → Na⁺ + Cl⁻
o Движение ионов: При помещении в
раствор электродов положительные ионы
начинают двигаться к катоду, а
отрицательные— к аноду. Это
направленное движение ионов и
представляет собой электрический ток.
Классификация электролитов по силе:
Тип электролита
Сильные
Слабые
Степень
диссоциации (α)
Примеры
Уравнение
диссоциации
α > 30%
(диссоциируют
почти
полностью)
Кислоты: HCl,
HNO₃, H₂SO₄
(разб.), HBr, HI
Основания:
NaOH, KOH,
Ba(OH)₂
Почти все соли:
NaCl, K₂SO₄
NaOH → Na⁺ +
OH⁻ (знак →)
α < 3%
(диссоциируют
частично)
Кислоты:
CH₃COOH
(уксусная),
H₂CO₃, H₂S
Основания:
NH₄OH
(гидроксид
аммония)
Вода: H₂O
CH₃COOH ⇄
CH₃COO⁻ + H⁺
(знак ⇄,
равновесие)
7.
Неэлектролиты — это вещества, растворы и расплавы которых не проводят электрический ток.Почему они не проводят ток?
Их молекулы не распадаются на ионы при растворении в воде или плавлении. Они могут растворяться, но
остаются нейтральными молекулами, не создающими заряженных частиц, способных переносить заряд.
Пример: Молекула сахарозы C₁₂H₂₂O₁₁ в воде не диссоциирует, а просто окружены молекулами воды
8. Реакции ионного обмена
Реакции ионного обмена — это реакции междуионами в растворе электролитов, протекающие без
изменения степеней окисления элементов.
Общий вид реакции:
AB + CD → AD + CB
где A, C — катионы, B, D — анионы.
Правила составления ионных уравнений
o Сильные электролиты записывают в виде
ионов.
o Слабые электролиты, газы и осадки
записывают в виде молекул.
Этапы составления:
o Записать молекулярное уравнение (уравнение в
молекулярной форме).
o Записать полное ионное уравнение (сильные
электролиты — как ионы).
o Записать сокращённое ионное уравнение, убрав
ионы-наблюдатели (ионы, не участвующие в
реакции).
Реакция идет до конца, если образуется хотя бы один
из трёх видов продуктов:
o Осадок
o Газ
o Малодиссоциирующее вещество (например, вода
или слабая кислота)
Если таких продуктов не образуется, реакция не идет.
9.
Примеры реакций с разборомo Образование малодиссоциирующего вещества
o Образование осадка.
— реакция нейтрализации
Реакция: AgNO₃ + NaCl → NaNO₃ + AgCl↓
Реакция: NaOH + HCl → NaCl + H₂O
Молекулярное уравнение:
Молекулярное уравнение:
AgNO₃ + NaCl → NaNO₃ + AgCl↓
NaOH + HCl → NaCl + H₂O
Полное ионное уравнение:
Полное ионное уравнение:
Ag⁺ + NO₃⁻ + Na⁺ + Cl⁻ → Na⁺ + NO₃⁻ + AgCl↓
Na⁺ + OH⁻ + H⁺ + Cl⁻ → Na⁺ + Cl⁻ + H₂O
Сокращённое ионное уравнение:
Сокращённое ионное уравнение:
Ag⁺ + Cl⁻ → AgCl↓
H⁺ + OH⁻ → H₂O
Условие выполняется: Образовался
Условие выполняется: Образовалась вода —
нерастворимый осадок хлорида серебра (AgCl).
типичный слабый электролит.
o Образование газа
o Реакция, которая не идет
Реакция: Na₂CO₃ + 2HCl → 2NaCl + H₂CO₃
Реакция: NaCl + KNO₃ → NaNO₃ + KCl
H₂CO₃ → H₂O + CO₂↑
Проверка: Все возможные продукты являются
Молекулярное уравнение:
растворимыми солями. Осадка, газа или слабого
Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂↑
электролита нет.
Полное ионное уравнение:
Вывод: Реакция не протекает. Фактически, в
2Na⁺ + CO₃²⁻ + 2H⁺ + 2Cl⁻ → 2Na⁺ + 2Cl⁻ + H₂O + CO₂↑
растворе просто находятся ионы Na⁺, Cl⁻, K⁺, NO₃⁻,
Сокращённое ионное уравнение:
которые не взаимодействуют друг с другом.
2H⁺ + CO₃²⁻ → H₂O + CO₂↑
Условие выполняется: Образовался газ CO₂ и
малодиссоциирующее вещество — вода.
10. Кислотно-основные реакции
Кислотно-основная реакция — это реакция междукислотой и основанием, в результате которой
образуются соль и вода.
Общий вид:
Кислота + Основание → Соль + Вода
Пример:
HCl + NaOH → NaCl + H₂O
Сущность реакции (Ионный вид)
С позиций ТЭД, кислоты диссоциируют с
образованием катионов водорода (H⁺), а основания
— с образованием гидроксид-анионов (OH⁻).
Суть реакции нейтрализации — это взаимодействие
ионов H⁺ и OH⁻ с образованием молекул слабого
электролита — воды (H₂O).
Сокращенное ионное уравнение:
H⁺ + OH⁻ → H₂O
Это уравнение является универсальным для всех
реакций нейтрализации между сильной кислотой и
сильным основанием.
11.
Этапы составления уравнения реакции нейтрализацииo Пример 1: Сильная кислота + сильное основание
H₂SO₄ + 2KOH → K₂SO₄ + 2H₂O
Полное ионное уравнение:
2H⁺ + SO₄²⁻ + 2K⁺ + 2OH⁻ → 2K⁺ + SO₄²⁻ + 2H₂O
Сокращенное ионное уравнение:
2H⁺ + 2OH⁻ → 2H₂O или, сокращая на 2, H⁺ + OH⁻ → H₂O
o Пример 2: Сильная кислота + нерастворимое основание
2HCl + Cu(OH)₂ ↓ → CuCl₂ + 2H₂O
Полное ионное уравнение:
2H⁺ + 2Cl⁻ + Cu(OH)₂ ↓ → Cu²⁺ + 2Cl⁻ + 2H₂O
Сокращенное ионное уравнение:
2H⁺ + Cu(OH)₂ ↓ → Cu²⁺ + 2H₂O
Суть: ионы H⁺ растворяют осадок Cu(OH)₂, образуя воду и растворимую соль.
o Пример 3: Слабая кислота + сильное основание
CH₃COOH + NaOH → CH₃COONa + H₂O
Полное ионное уравнение:
CH₃COOH + Na⁺ + OH⁻ → Na⁺ + CH₃COO⁻ + H₂O
Сокращенное ионное уравнение:
CH₃COOH + OH⁻ → CH₃COO⁻ + H₂O
Суть: гидроксид-ион "забирает" протон у слабой кислоты.
12.
Протонная теория Брёнстеда-ЛоуриКислота — это донор протона.
Основание — это акцептор протона.
Кислотно-основная реакция — это процесс передачи протона (H⁺) от кислоты к основанию.
Пример:
HCl + NH₃ → NH₄⁺ + Cl⁻
HCl (кислота) отдает H⁺.
NH₃ (основание) принимает H⁺, превращаясь в ион аммония (NH₄⁺).
В этой теории реакция не обязательно требует наличия ионов OH⁻ и может протекать без образования воды.
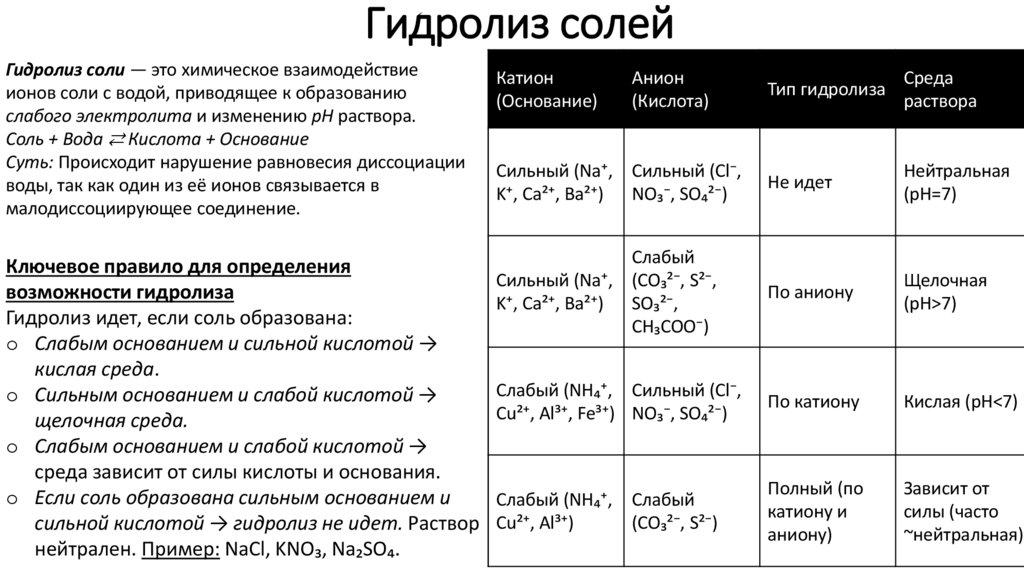
13. Гидролиз солей
Гидролиз соли — это химическое взаимодействиеионов соли с водой, приводящее к образованию
слабого электролита и изменению pH раствора.
Соль + Вода ⇄ Кислота + Основание
Суть: Происходит нарушение равновесия диссоциации
воды, так как один из её ионов связывается в
малодиссоциирующее соединение.
Катион
(Основание)
Ключевое правило для определения
возможности гидролиза
Гидролиз идет, если соль образована:
o Слабым основанием и сильной кислотой →
кислая среда.
o Сильным основанием и слабой кислотой →
щелочная среда.
o Слабым основанием и слабой кислотой →
среда зависит от силы кислоты и основания.
o Если соль образована сильным основанием и
сильной кислотой → гидролиз не идет. Раствор
нейтрален. Пример: NaCl, KNO₃, Na₂SO₄.
Анион
(Кислота)
Тип гидролиза
Среда
раствора
Сильный (Na⁺, Сильный (Cl⁻,
K⁺, Ca²⁺, Ba²⁺) NO₃⁻, SO₄²⁻)
Не идет
Нейтральная
(pH=7)
Слабый
Сильный (Na⁺, (CO₃²⁻, S²⁻,
K⁺, Ca²⁺, Ba²⁺) SO₃²⁻,
CH₃COO⁻)
По аниону
Щелочная
(pH>7)
Слабый (NH₄⁺, Сильный (Cl⁻,
Cu²⁺, Al³⁺, Fe³⁺) NO₃⁻, SO₄²⁻)
По катиону
Кислая (pH<7)
Слабый (NH₄⁺,
Cu²⁺, Al³⁺)
Полный (по
катиону и
аниону)
Зависит от
силы (часто
~нейтральная)
Слабый
(CO₃²⁻, S²⁻)
14.
Гидролиз по аниону (соль слабой кислоты и сильногооснования)
Пример: Ацетат натрия (CH₃COONa)
Диссоциация соли: CH₃COONa → Na⁺ + CH₃COO⁻
Взаимодействие аниона с водой:
Анион слабой уксусной кислоты (CH₃COO⁻) связывает ион H⁺ из
воды:
CH₃COO⁻ + H₂O ⇄ CH₃COOH + OH⁻
Результат: В растворе появляется избыток OH⁻ → среда
щелочная.
Сокращенное ионное уравнение:
CH₃COO⁻ + H₂O ⇄ CH₃COOH + OH⁻
Гидролиз по катиону (соль сильной кислоты и слабого
основания)
Пример: Хлорид аммония (NH₄Cl)
Диссоциация соли: NH₄Cl → NH₄⁺ + Cl⁻
Взаимодействие катиона с водой:
Катион слабого основания (NH₄⁺) связывает ион OH⁻ из воды:
NH₄⁺ + H₂O ⇄ NH₃·H₂O + H⁺
Результат: В растворе появляется избыток H⁺ → среда кислая.
Сокращенное ионное уравнение:
NH₄⁺ + H₂O ⇄ NH₃·H₂O + H⁺
Совместный гидролиз (соль слабой
кислоты и слабого основания)
Пример: Ацетат аммония (CH₃COONH₄)
Гидролизуются и катион, и анион:
CH₃COO⁻ + NH₄⁺ + H₂O ⇄ CH₃COOH + NH₃·H₂O
Результат: Среда близка к нейтральной,
так как образуются слабые электролиты
одинаковой силы.
Важно: Если образующаяся кислота или
основание — нерастворимые или летучие,
гидролиз может идти необратимо.
Пример (необратимый гидролиз):
2Al³⁺ + 3S²⁻ + 6H₂O → 2Al(OH)₃↓ + 3H₂S↑
Al₂S₃ + 6H₂O → 2Al(OH)₃↓ + 3H₂S↑











 chemistry
chemistry