Similar presentations:
1_ВВЕДЕНИЕ_В_КВАНТОВУЮ_БИОФИЗИКУ_6_10_25
1. ВВЕДЕНИЕ В КВАНТОВУЮ БИОФИЗИКУ
1. Фотобиологические процессы и их классификация2. Энергетические уровни атомов и молекул.
3. Абсорбционная спектроскопия белков. Закон Бугера
– Ламберта – Бера.
4. Размен энергии возбужденного состояния молекулы.
2. ФОТОБИОЛОГИЧЕСКИЕ ПРОЦЕССЫ И ИХ КЛАССИФИКАЦИЯ
Фотобиологическим называют процесс, которыйначинается с поглощения квантов света
молекулами и заканчивается реакцией
организма.
3.
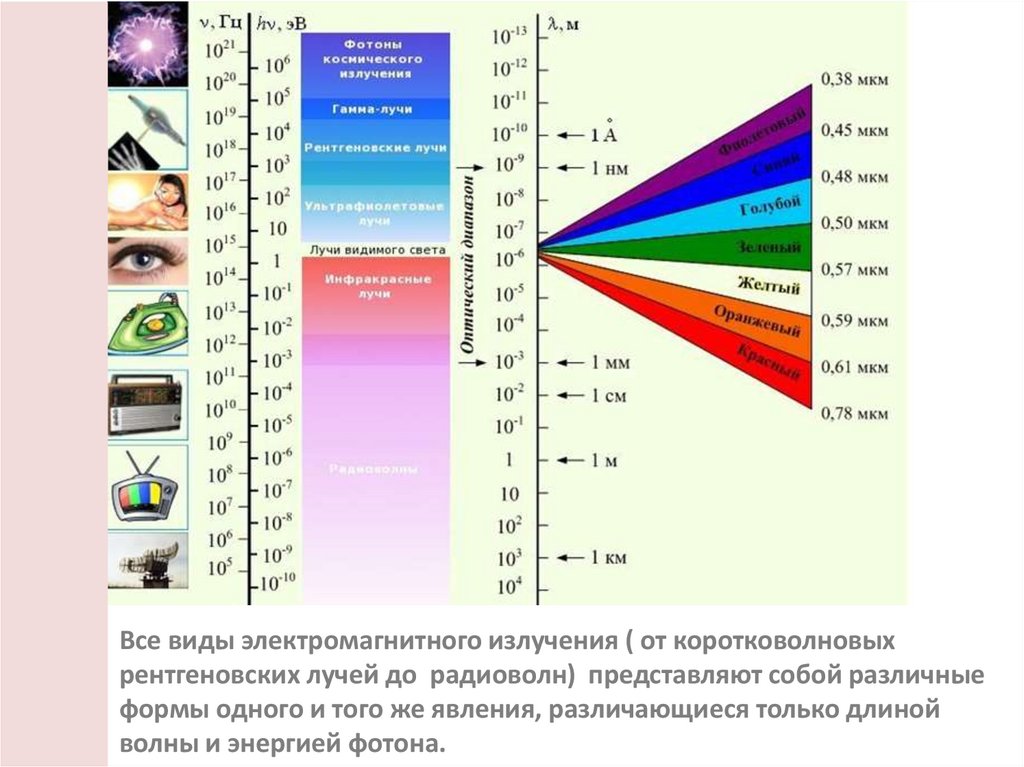
Все виды электромагнитного излучения ( от коротковолновыхрентгеновских лучей до радиоволн) представляют собой различные
формы одного и того же явления, различающиеся только длиной
волны и энергией фотона.
4.
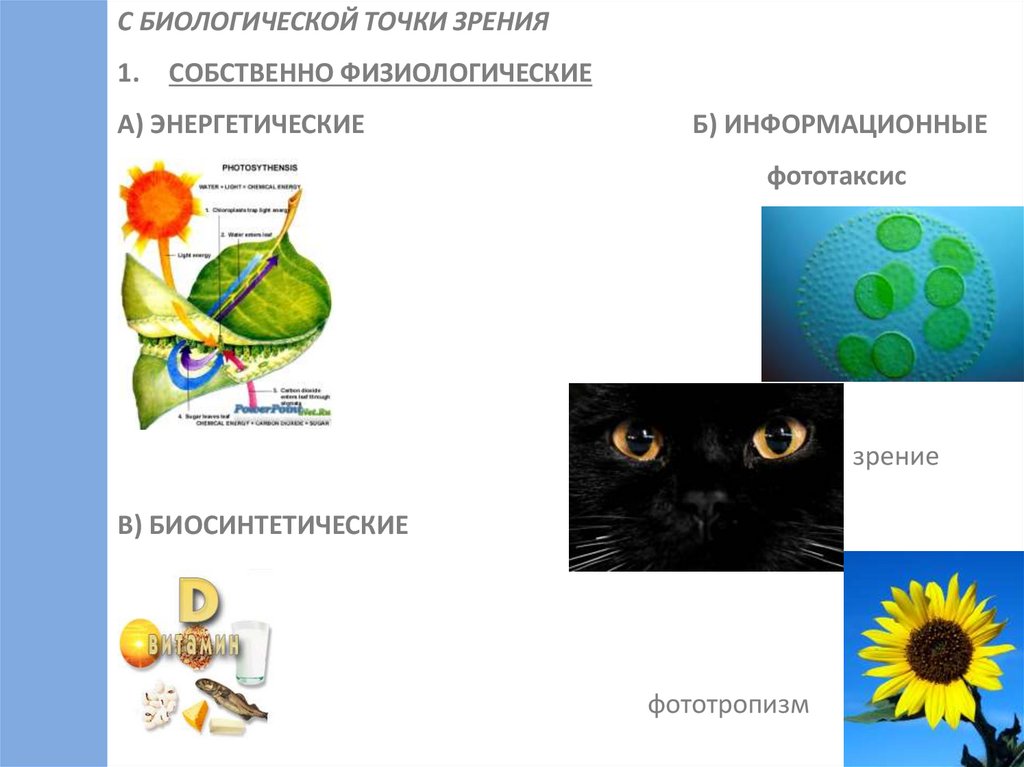
С БИОЛОГИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ1.
СОБСТВЕННО ФИЗИОЛОГИЧЕСКИЕ
А) ЭНЕРГЕТИЧЕСКИЕ
Б) ИНФОРМАЦИОННЫЕ
фототаксис
зрение
В) БИОСИНТЕТИЧЕСКИЕ
фототропизм
5.
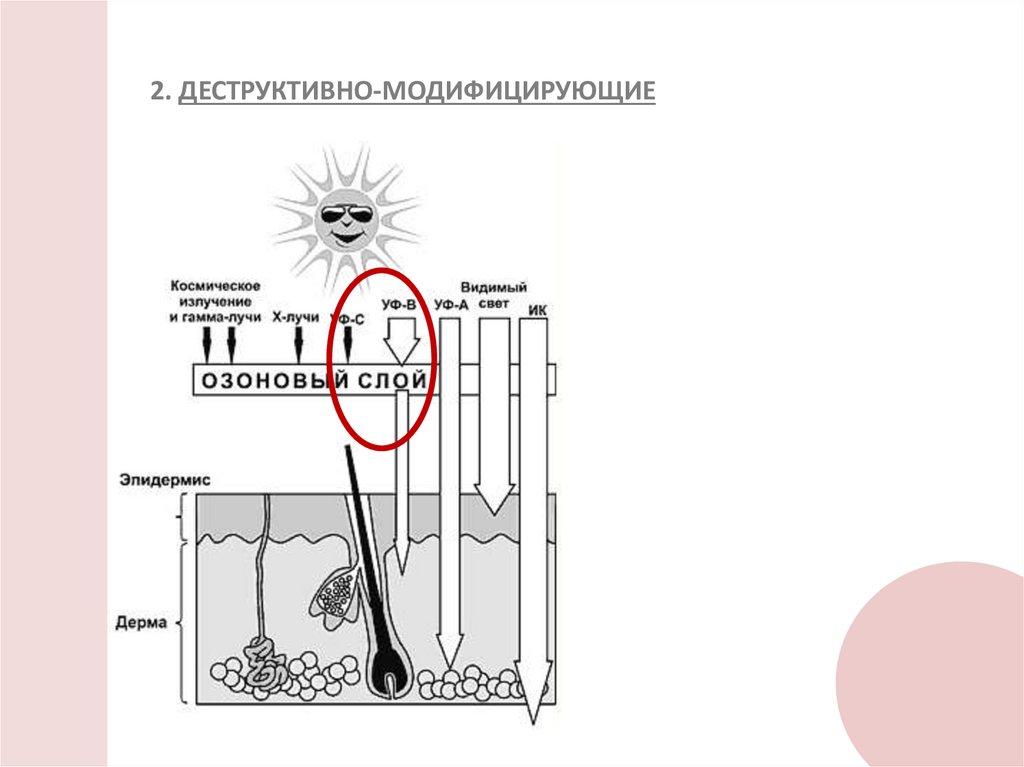
2. ДЕСТРУКТИВНО-МОДИФИЦИРУЮЩИЕ6.
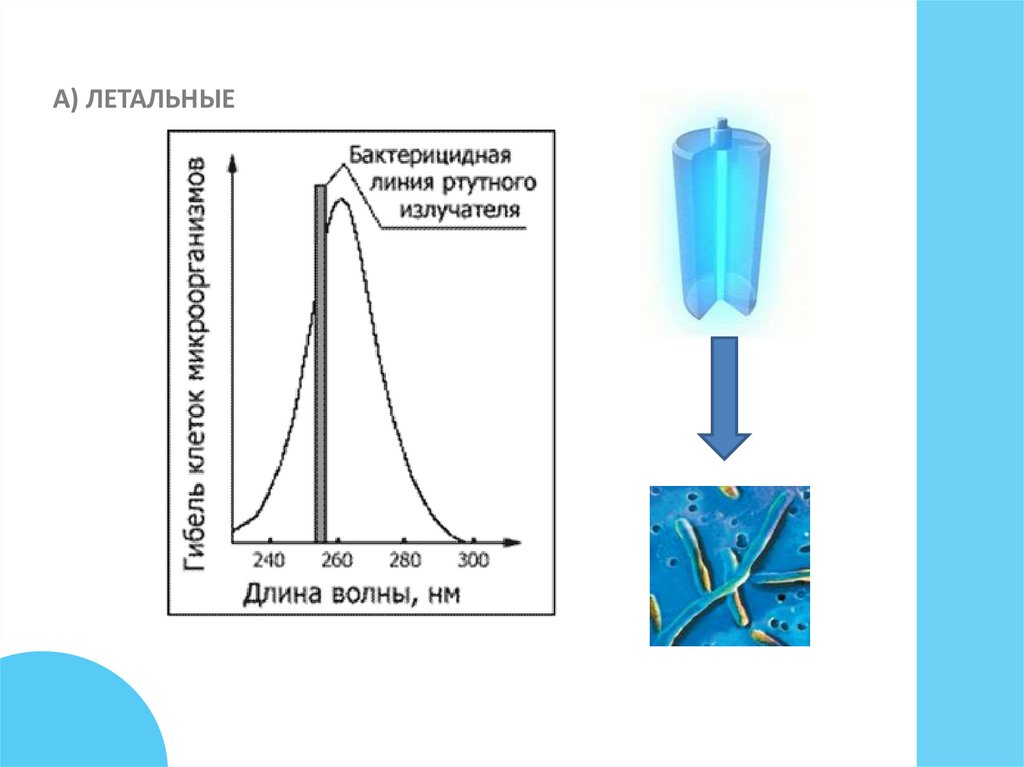
А) ЛЕТАЛЬНЫЕ7.
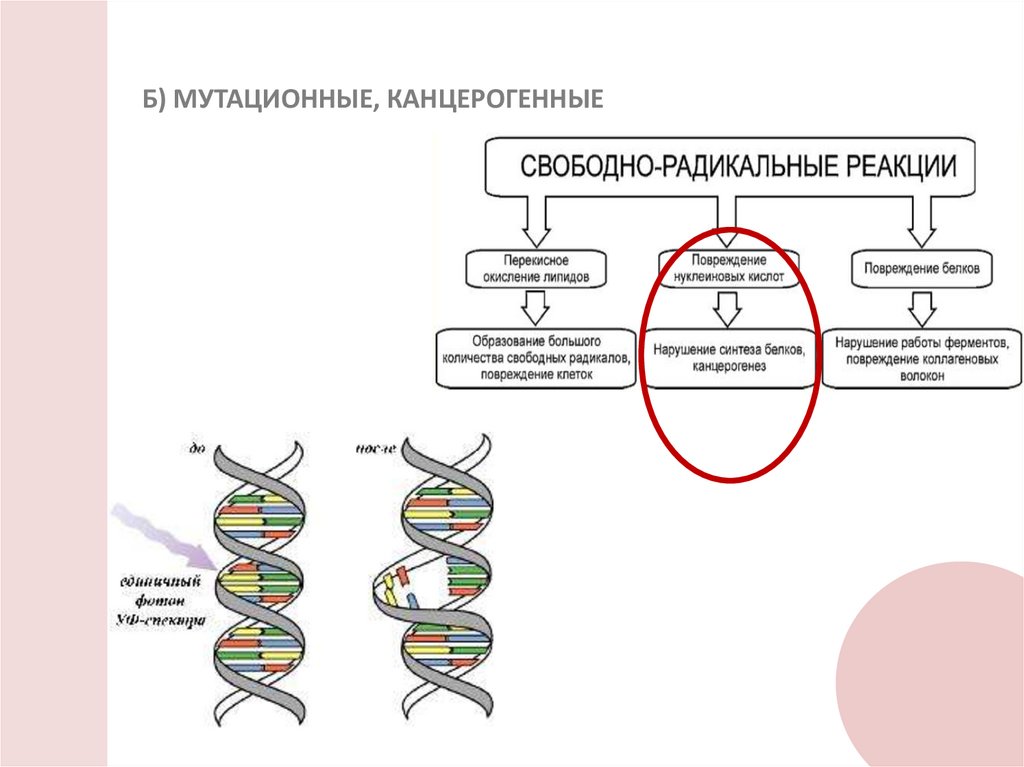
Б) МУТАЦИОННЫЕ, КАНЦЕРОГЕННЫЕ8.
В) ПАТОФИЗИОЛОГИЧЕСКИЕЭритема (стойкое воспалительное
покраснение кожи, возникающее
вследствие расширения кровеносных
сосудов)
9.
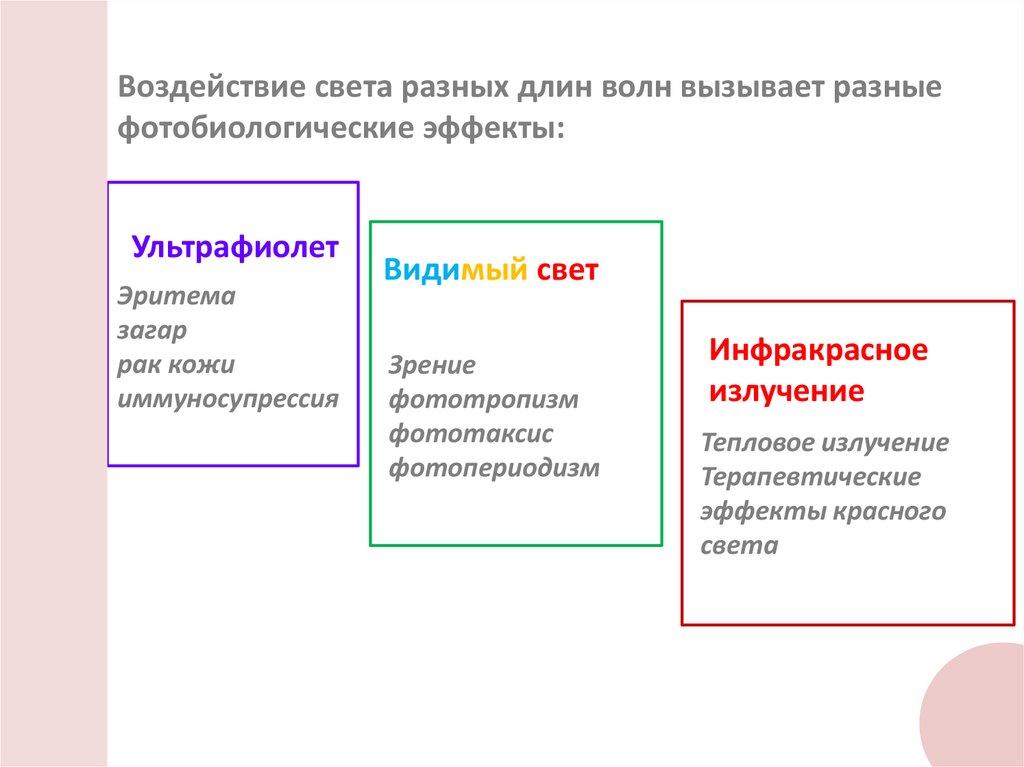
Воздействие света разных длин волн вызывает разныефотобиологические эффекты:
Ультрафиолет
Эритема
загар
рак кожи
иммуносупрессия
Видимый свет
Зрение
фототропизм
фототаксис
фотопериодизм
Инфракрасное
излучение
Тепловое излучение
Терапевтические
эффекты красного
света
10.
Стадии фотобиологического процесса:поглощение кванта света;
внутримолекулярные процессы размена энергией
(фотофизические процессы);
межмолекулярные процессы переноса энергии
возбужденного состояния;
первичный фотохимический акт;
темновые реакции, заканчивающиеся образованием
стабильных продуктов;
биохимические реакции с участием фотопродуктов;
общефизиологический ответ на действие света.
11. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМОВ И МОЛЕКУЛ
Состояние, которому соответствует наименьшая энергия,возможная для данной системы, называют основным: все
остальные состояния называют возбужденными.
Квантовые переходы
- переходы системы из одного квантового состояния в
другое. Такие переходы могут приводить как к изменению
энергетического состояния системы, так и к ее
качественному изменению.
Переходы могут происходить под действием излучения.
12.
Переходы в квантовых системах подчиняютсяопределенным правилам отбора, т.е. правилам,
устанавливающим, как могут меняться при переходе
квантовые числа, характеризующие состояние
системы.
13.
Принцип минимума энергииЭлектроны занимают, в первую очередь, орбитали,
имеющие наименьшую энергию.
Принцип Паули
Ограничивает число электронов, которые могут
находиться на одной орбитали.
На любой орбитали может находиться не более двух
электронов и то лишь в том случае, если они имеют
противоположные спины (неодинаковые спиновые
числа). Поэтому в атоме не должно быть двух
электронов с одинаковыми четырьмя квантовыми
числами (n, l, ml, ms).
14.
ЭНЕРГЕТИЧЕСКИЕ УРОВНИ МОЛЕКУЛОсновные типы движений в молекулах:
Электронное (движение каждого электрона в
молекуле происходит в электрическом поле атомных
ядер и в поле всех других электронов)
15.
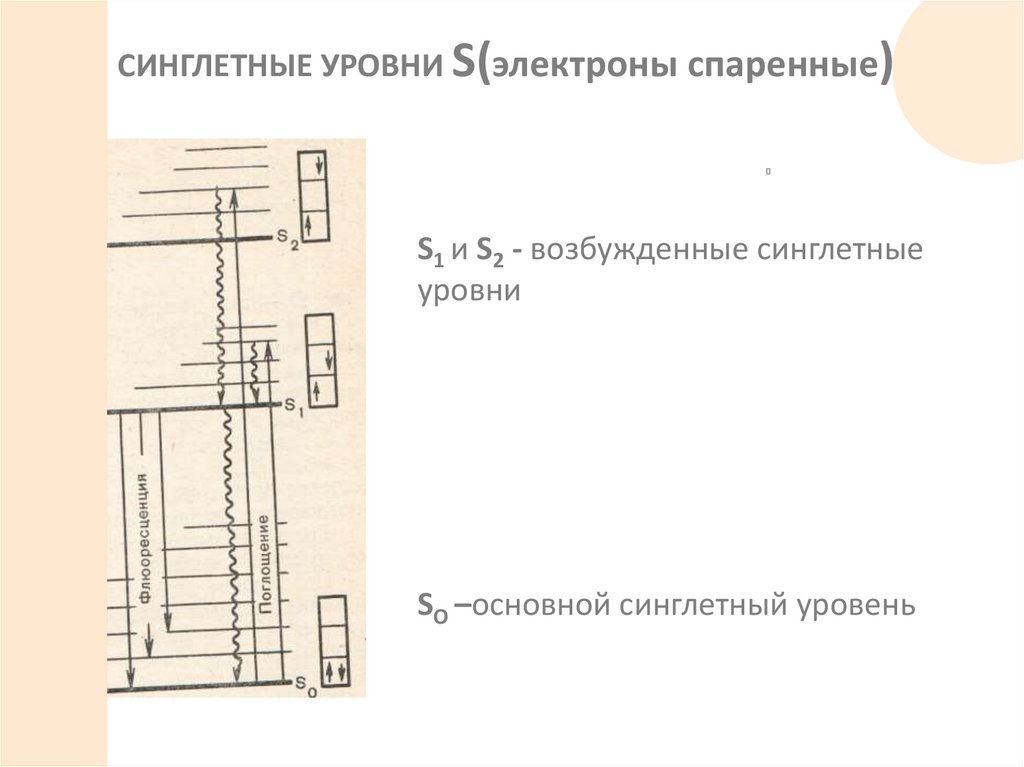
СИНГЛЕТНЫЕ УРОВНИ S(электроны спаренные)S1 и S2 - возбужденные синглетные
уровни
SO –основной синглетный уровень
16.
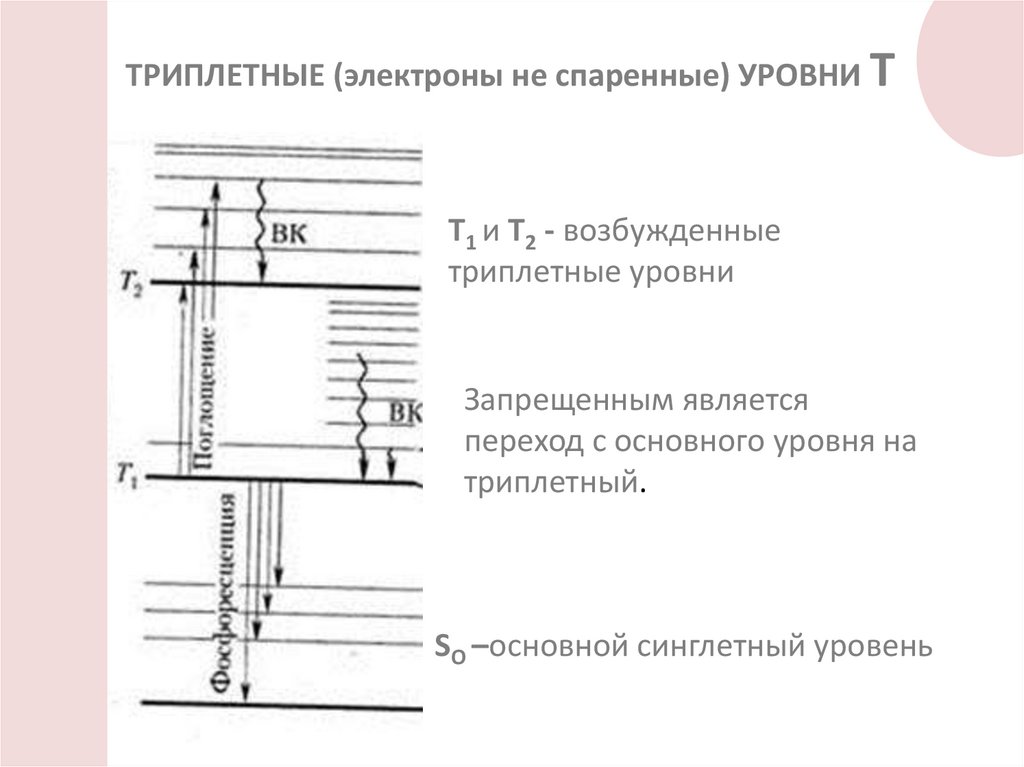
ТРИПЛЕТНЫЕ (электроны не спаренные) УРОВНИ ТТ1 и Т2 - возбужденные
триплетные уровни
Запрещенным является
переход с основного уровня на
триплетный.
SO –основной синглетный уровень
17.
КолебательноеКолебательные движения ядер: периодическое
изменение длин связей и валентных углов относительно
их равновесных значений
Колебательное движение квантуется, что приводит к
возникновению дискретного колебательного
энергетического спектра
18.
ВращательноеВращательное движение молекулы как целого можно
приближенно рассматривать как повороты твердого
тела вокруг некоторой оси. Вращательное движение
квантуется, что приводит к возникновению дискретного
вращательного энергетического спектра
19.
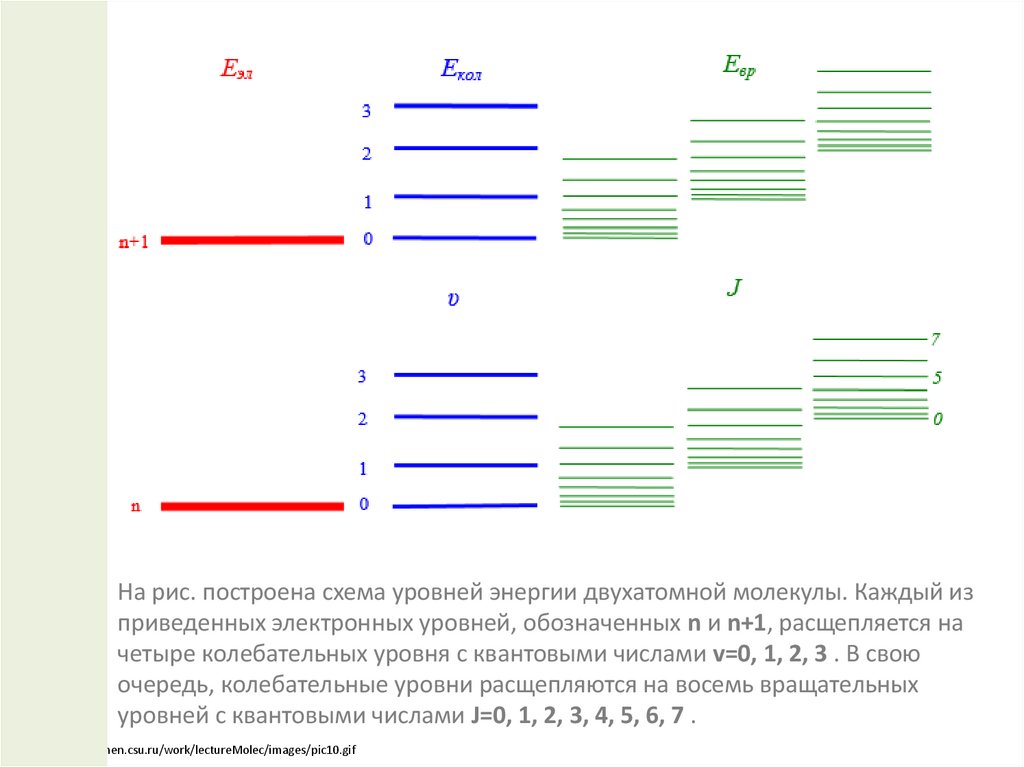
На рис. построена схема уровней энергии двухатомной молекулы. Каждый изприведенных электронных уровней, обозначенных n и n+1, расщепляется на
четыре колебательных уровня с квантовыми числами v=0, 1, 2, 3 . В свою
очередь, колебательные уровни расщепляются на восемь вращательных
уровней с квантовыми числами J=0, 1, 2, 3, 4, 5, 6, 7 .
http://teachmen.csu.ru/work/lectureMolec/images/pic10.gif
20. АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ БЕЛКОВ
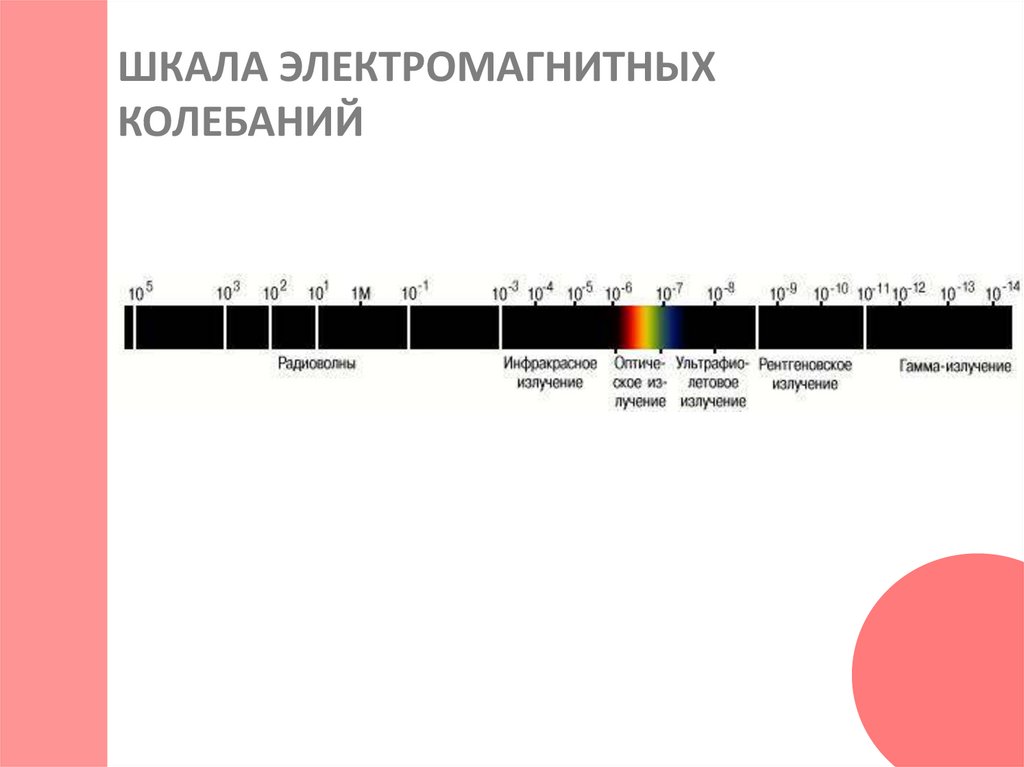
21. ШКАЛА ЭЛЕКТРОМАГНИТНЫХ КОЛЕБАНИЙ
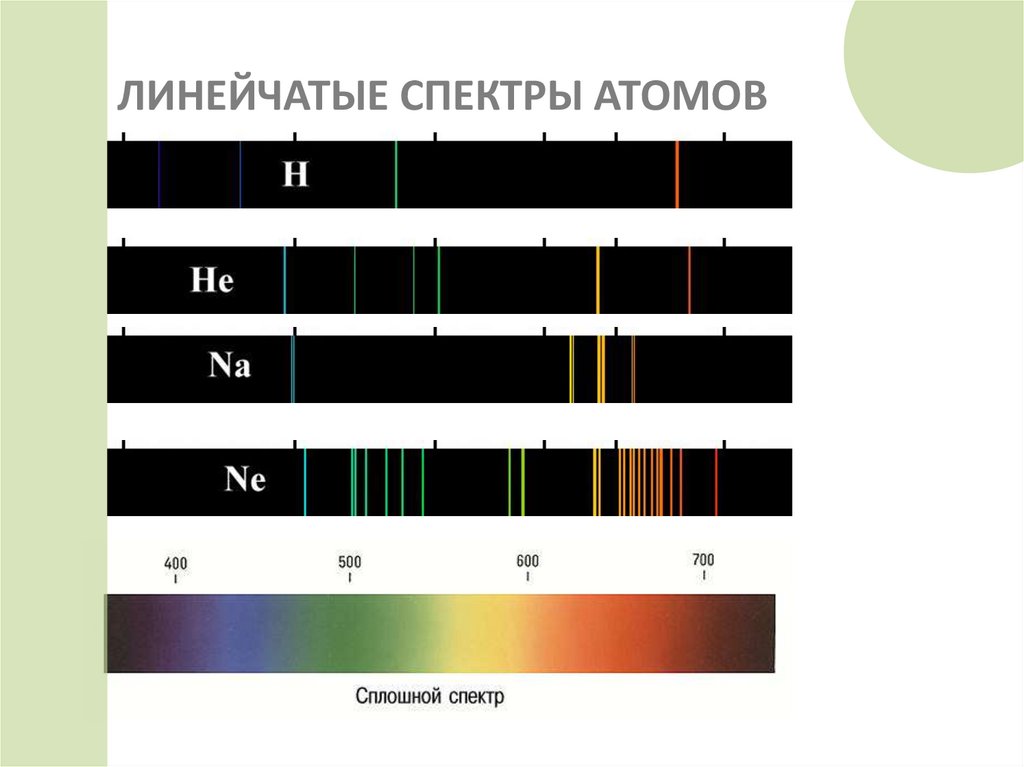
22. ЛИНЕЙЧАТЫЕ СПЕКТРЫ АТОМОВ
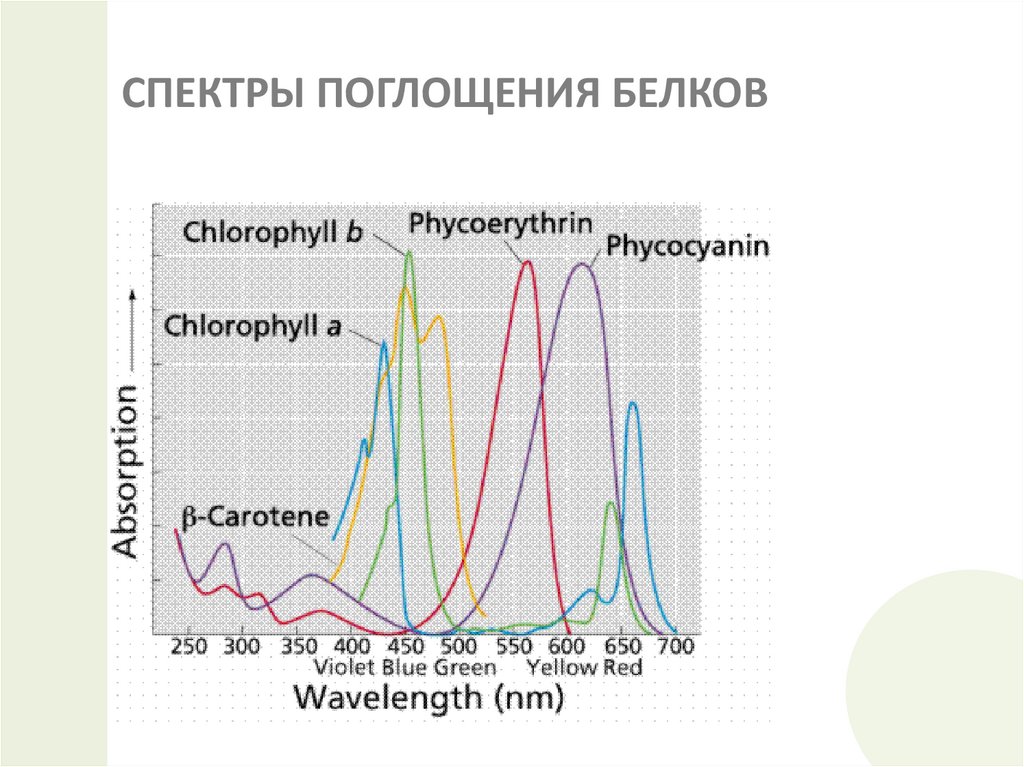
23. СПЕКТРЫ ПОГЛОЩЕНИЯ БЕЛКОВ
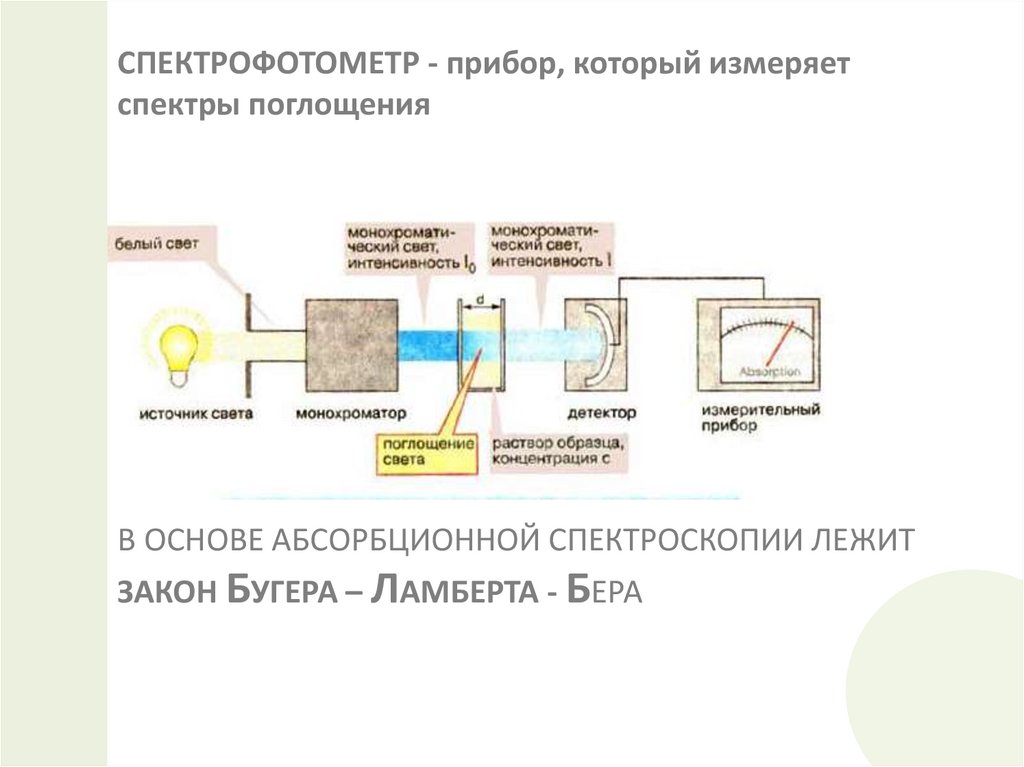
24.
СПЕКТРОФОТОМЕТР - прибор, который измеряетспектры поглощения
В ОСНОВЕ АБСОРБЦИОННОЙ СПЕКТРОСКОПИИ ЛЕЖИТ
ЗАКОН БУГЕРА – ЛАМБЕРТА - БЕРА
25. ЗАКОН БУГЕРА – ЛАМБЕРТА – БЕРА
Пьер Бугер (Буге)(1698-1758)
ЗАКОН БУГЕРА – ЛАМБЕРТА – БЕРА
Иоганн Генрих Ламберт
1728-1777
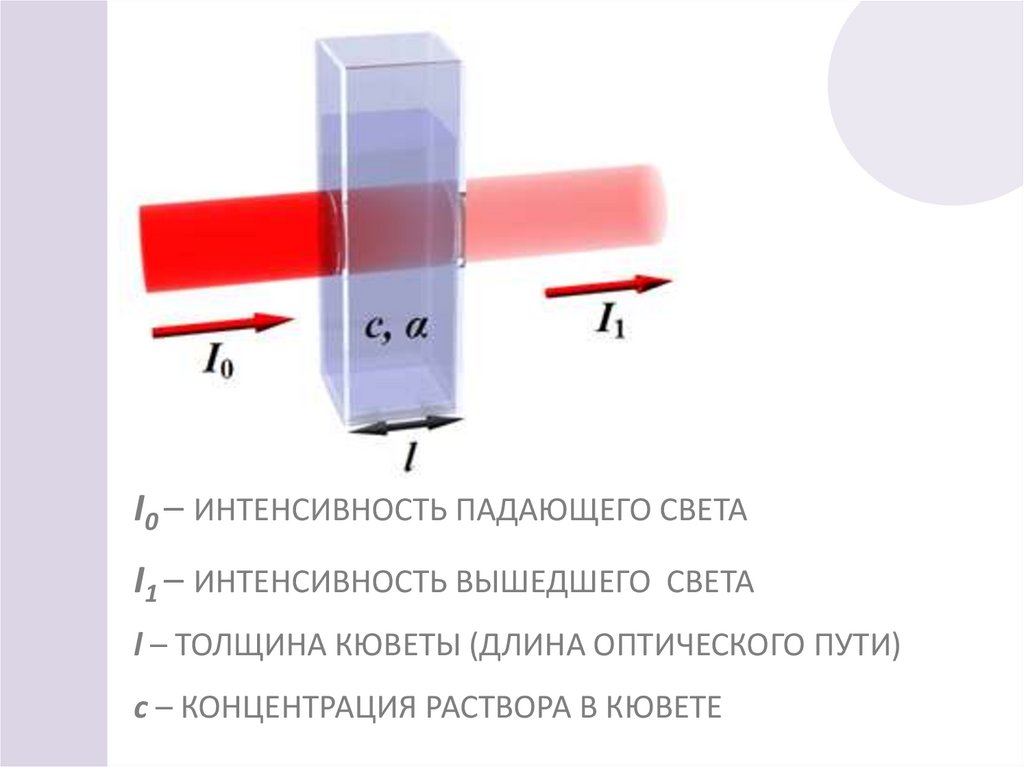
26.
I0 – ИНТЕНСИВНОСТЬ ПАДАЮЩЕГО СВЕТАI1 – ИНТЕНСИВНОСТЬ ВЫШЕДШЕГО СВЕТА
l – ТОЛЩИНА КЮВЕТЫ (ДЛИНА ОПТИЧЕСКОГО ПУТИ)
с – КОНЦЕНТРАЦИЯ РАСТВОРА В КЮВЕТЕ
27.
dI kIcdldI
kcdl
I
ln I kcl C
При начальных условиях l =0 и С=lnI 0
ln I kcl ln I 0
I
ln kcl
Io
28.
В экспоненциальнойформе
I
kcl
e
I0
Отсюда
I I 0 e kcl
ЗАКОН БУГЕРА – ЛАМБЕРТА – БЕРА
ИНТЕНСИВНОСТЬ СВЕТА, ПРОШЕДШЕГО ЧЕРЕЗ ОБРАЗЕЦ,
ЭКСПОНЕНЦИАЛЬНО УМЕНЬШАЕТСЯ В ЗАВИСИМОСТИ ОТ
КОНЦЕНТРАЦИИ РАСТВОРА И ДЛИНЫ ОПТИЧЕСКОГО ПУТИ
29.
Перепишем уравнение еще раз в логарифмическойформе и избавимся от минуса
ln
I0
I
k c l
Заменим натуральные логарифмы десятичными и
получим
D lg
I0
c l
I
D- оптическая плотность, - молярный коэффициент
поглощения, с – концентрация раствора, l – длина
оптического пути
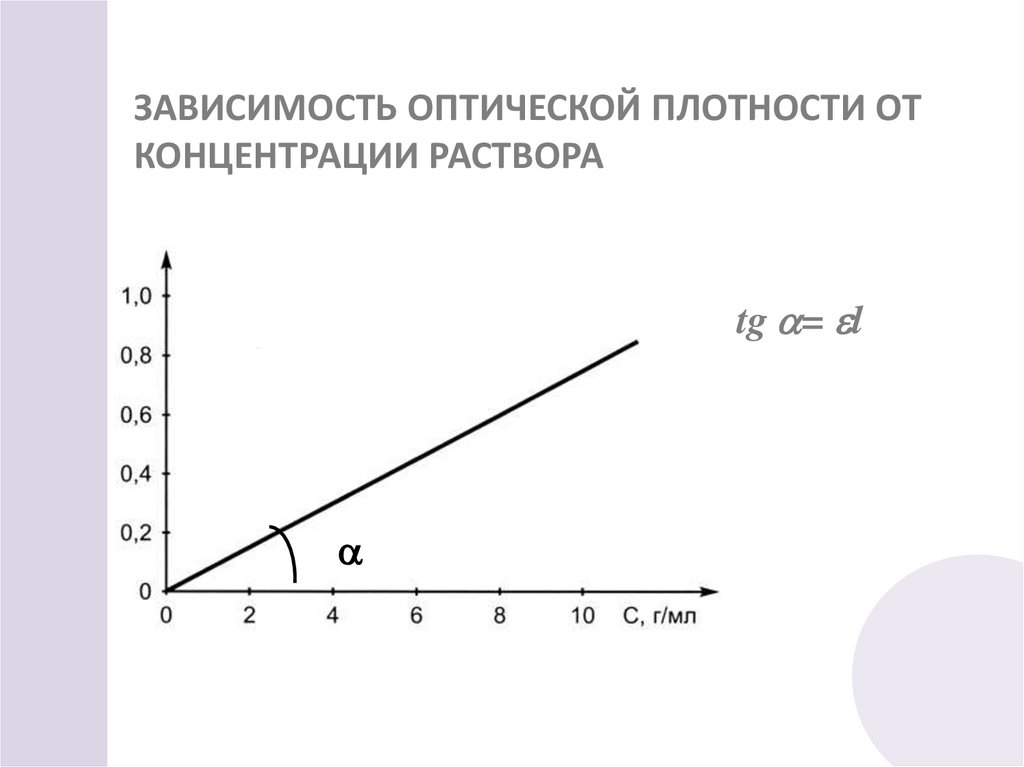
30. ЗАВИСИМОСТЬ ОПТИЧЕСКОЙ ПЛОТНОСТИ ОТ КОНЦЕНТРАЦИИ РАСТВОРА
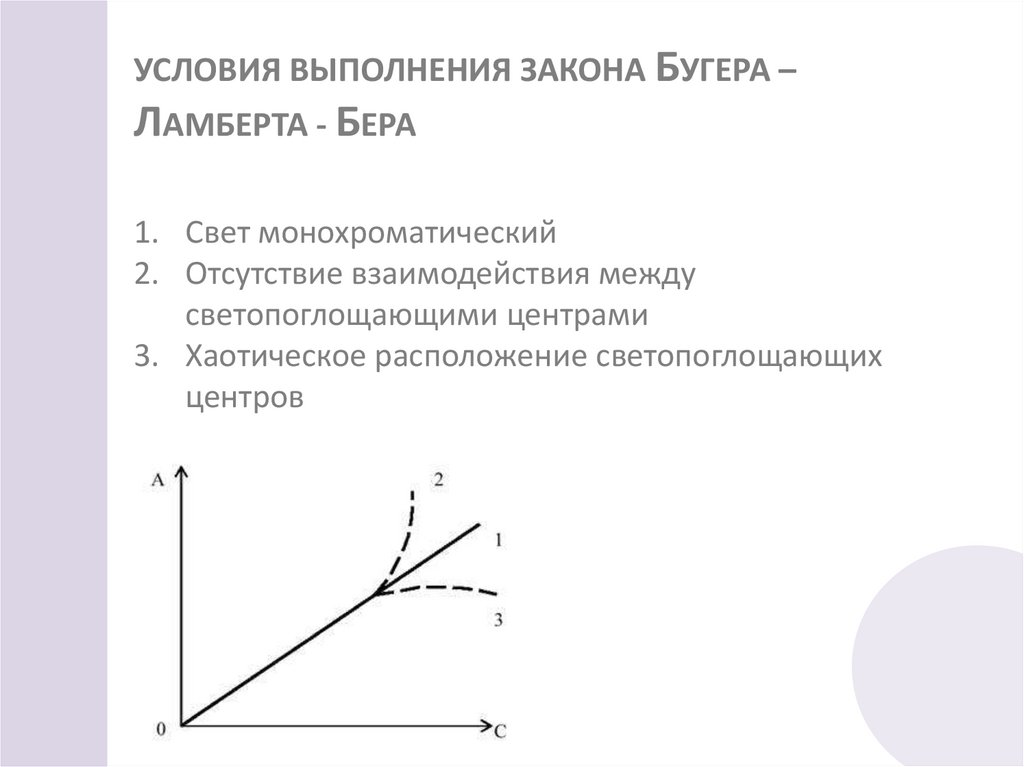
tg = l31. УСЛОВИЯ ВЫПОЛНЕНИЯ ЗАКОНА БУГЕРА – ЛАМБЕРТА - БЕРА
1. Свет монохроматический2. Отсутствие взаимодействия между
светопоглощающими центрами
3. Хаотическое расположение светопоглощающих
центров
32.
Особенности спектроскопиибиополимеров
Использование растворов
Узость температурного интервала, в котором биополимеры
не денатурируют
33.
ПОГЛОЩЕНИЕ БЕЛКОВХромофор - функциональная группа, с которой
связано возбуждение молекулы посредством
поглощения света в видимой и ближней УФобласти.
34.
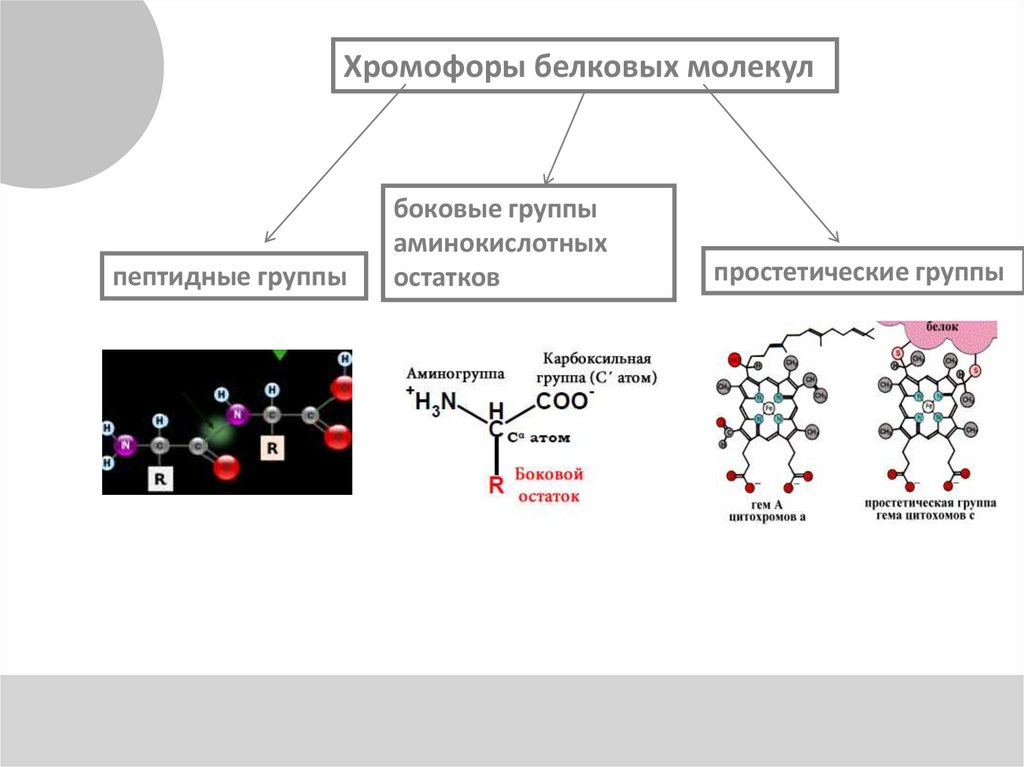
Хромофоры белковых молекулпептидные группы
боковые группы
аминокислотных
остатков
простетические группы
35.
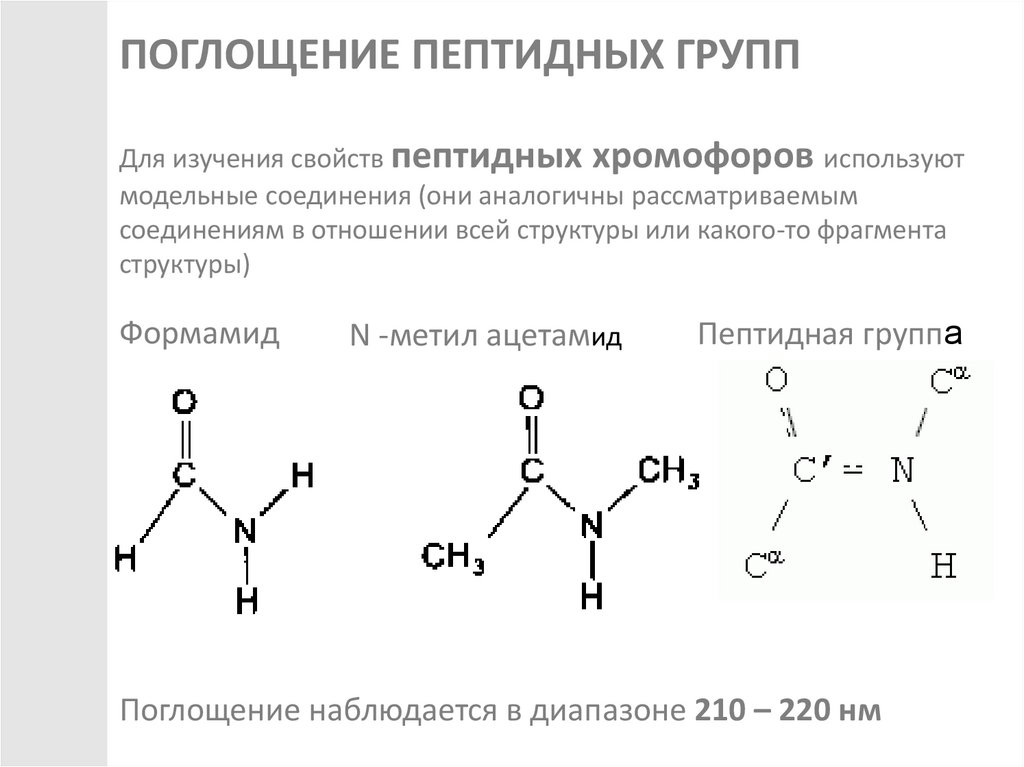
ПОГЛОЩЕНИЕ ПЕПТИДНЫХ ГРУППДля изучения свойств пептидных хромофоров используют
модельные соединения (они аналогичны рассматриваемым
соединениям в отношении всей структуры или какого-то фрагмента
структуры)
Формамид
N -метил ацетамид
Пептидная группа
Поглощение наблюдается в диапазоне 210 – 220 нм
36.
ПОГЛОЩЕНИЕ АМИНОКИСЛОТНЫХОСТАТКОВ
Для боковых групп многих аминокислот (Asp, Glu, Asn, Gln,
Arg и His) зарегистрировать электронные переходы в белках
или полипептидах практически нельзя.
ПРИЧИНЫ
Эти электронные переходы маскируются интенсивным
поглощением пептидной группы.
Они уступают по интенсивности электронному переходу
пептидной группы
Число соответствующих боковых радикалов обычно
меньше, чем число пептидных групп.
37.
Интерес представляют только те хромофоры белковыхмолекул, которые поглощают при длинах волн больше 230
нм, где вклад в поглощение пептидных групп
пренебрежимо мал.
Такими свойствами обладают Phe, Туг и Тгр, а также
гистидиновый фрагмент и дисульфидный мостик цистеина.
38.
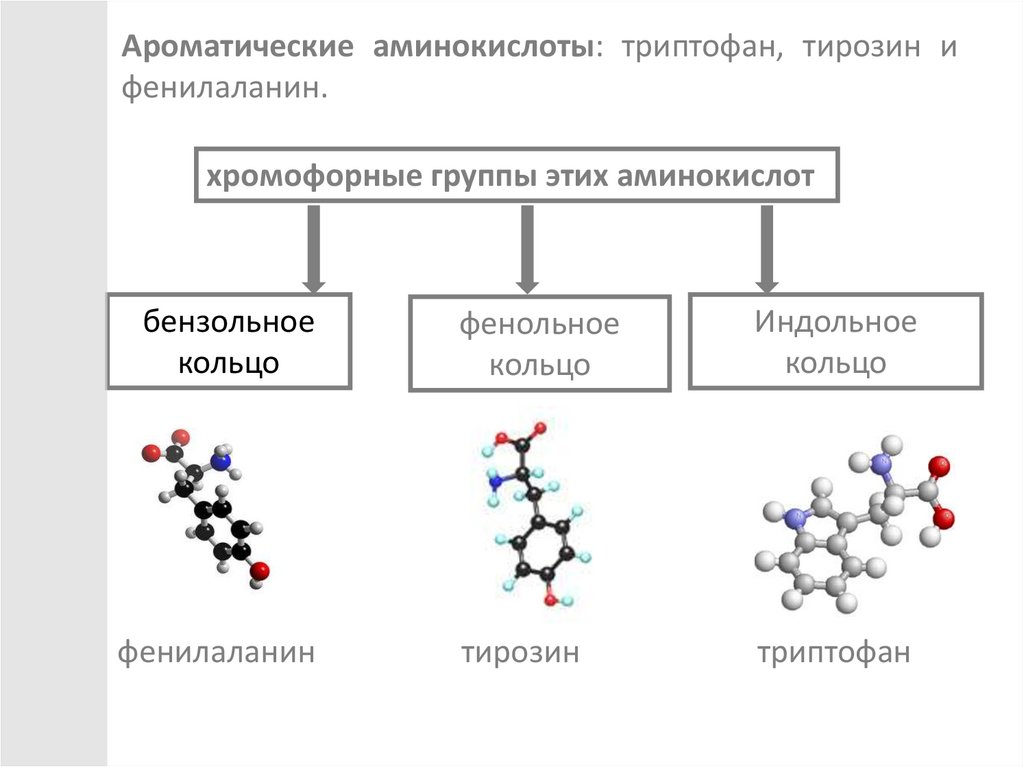
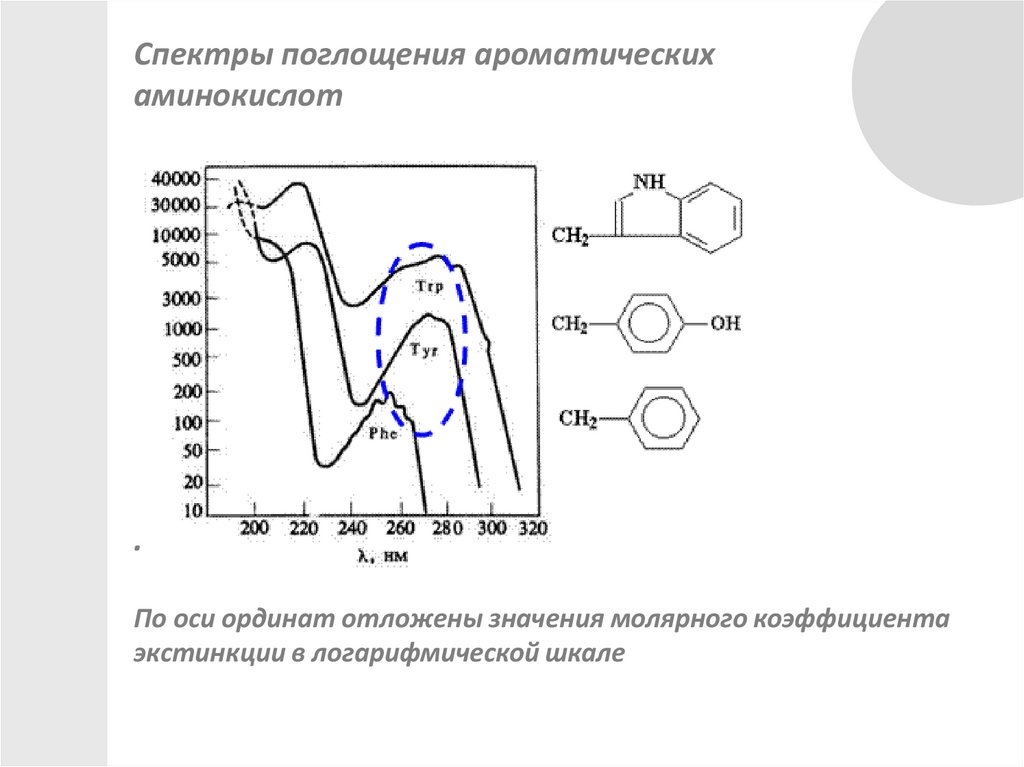
Ароматические аминокислоты: триптофан, тирозин ифенилаланин.
хромофорные группы этих аминокислот
бензольное
кольцо
фенольное
кольцо
Индольное
кольцо
фенилаланин
тирозин
триптофан
39.
Спектры поглощения ароматическихаминокислот
.
По оси ординат отложены значения молярного коэффициента
экстинкции в логарифмической шкале
40.
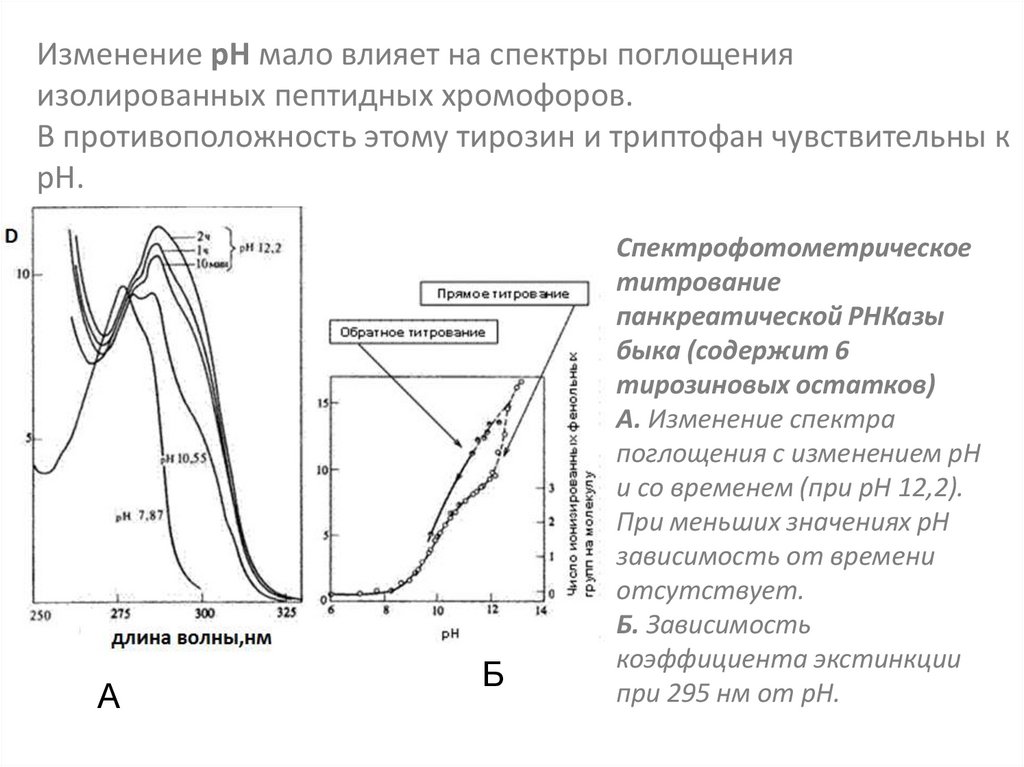
Изменение рН мало влияет на спектры поглощенияизолированных пептидных хромофоров.
В противоположность этому тирозин и триптофан чувствительны к
рН.
А
Б
Спектрофотометрическое
титрование
панкреатической РНКазы
быка (содержит 6
тирозиновых остатков)
А. Изменение спектра
поглощения с изменением рН
и со временем (при рН 12,2).
При меньших значениях рН
зависимость от времени
отсутствует.
Б. Зависимость
коэффициента экстинкции
при 295 нм от рН.
41.
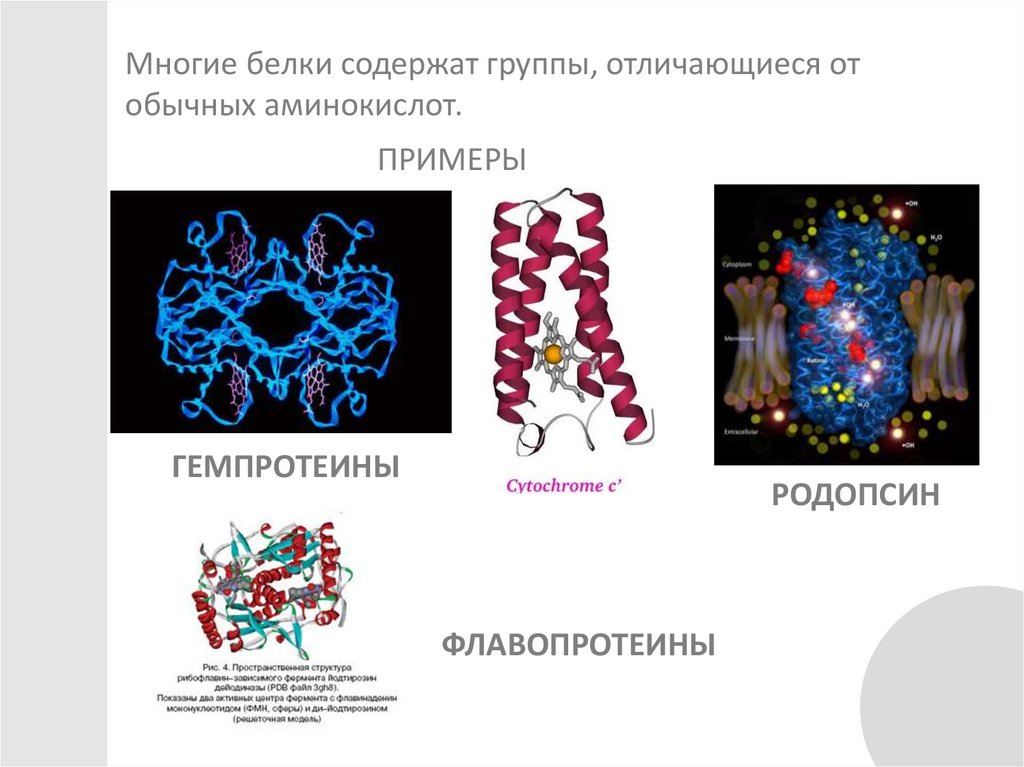
Многие белки содержат группы, отличающиеся отобычных аминокислот.
ПРИМЕРЫ
ГЕМПРОТЕИНЫ
РОДОПСИН
ФЛАВОПРОТЕИНЫ
42.
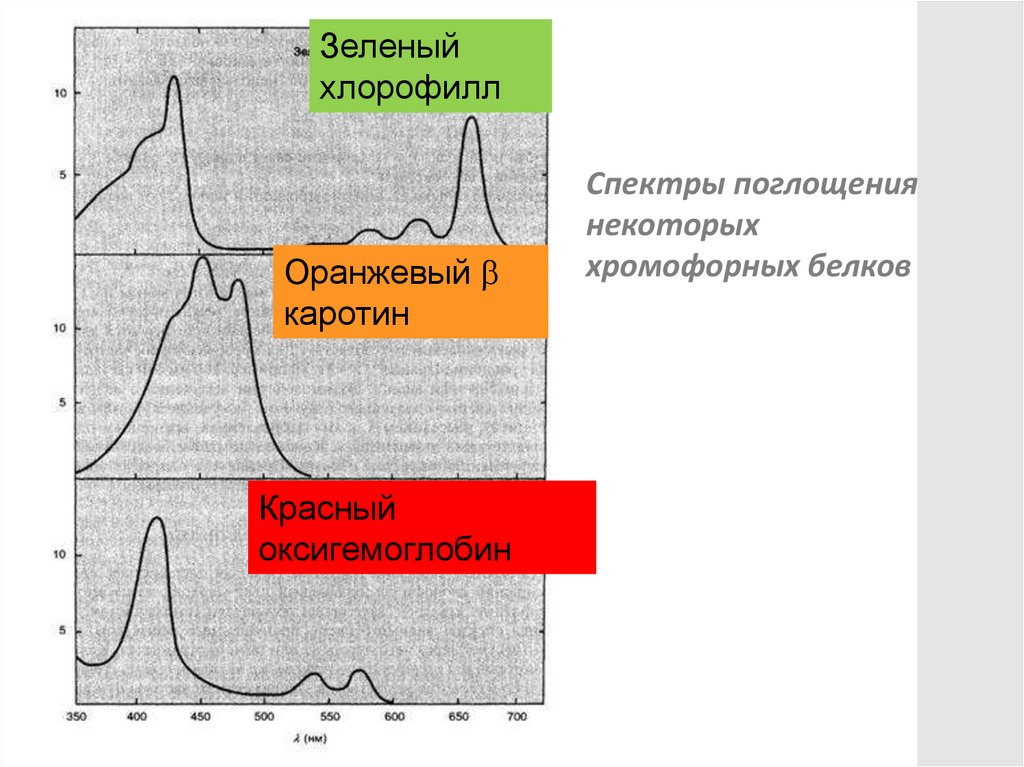
Зеленыйхлорофилл
Оранжевый
каротин
Красный
оксигемоглобин
Спектры поглощения
некоторых
хромофорных белков
43.
ХАРАКТЕРИСТИКИ ЭЛЕКТРОННО-ВОЗБУЖДЕННЫХСОСТОЯНИЙ
ОПРЕДЕЛЕННАЯ ЭНЕРГИЯ
ВРЕМЯ ЖИЗНИ
СТРУКТУРНЫЕ СВОЙСТВА
44.
ПОЛНАЯ ЭНЕРГИЯ МОЛЕКУЛЫE Eэл Екол Евр
ПРИ ПОГЛОЩЕНИИ КВАНТА СВЕТА МОЛЕКУЛОЙ
ПРОИСХОДИТ ПЕРЕХОД ЭЛЕКТРОНОВ С ОСНОВНОГО
СИНГЛЕТНОГО
SO УРОВНЯ НА ВОЗБУЖДЕННЫЕ УРОВНИ
S*
ВОЗБУЖДЕННОЕ СОСТОЯНИЕ С ТОЧКИ ЗРЕНИЯ
ТЕРМОДИНАМИКИ – НЕРАВНОВЕСНОЕ СОСТОЯНИЕ.
ИЗБЫТОЧНАЯ ЭНЕРГИЯ ДОЛЖНА РАСТРАТИТЬСЯ НА
РАЗЛИЧНЫЕ ПРОЦЕССЫ.
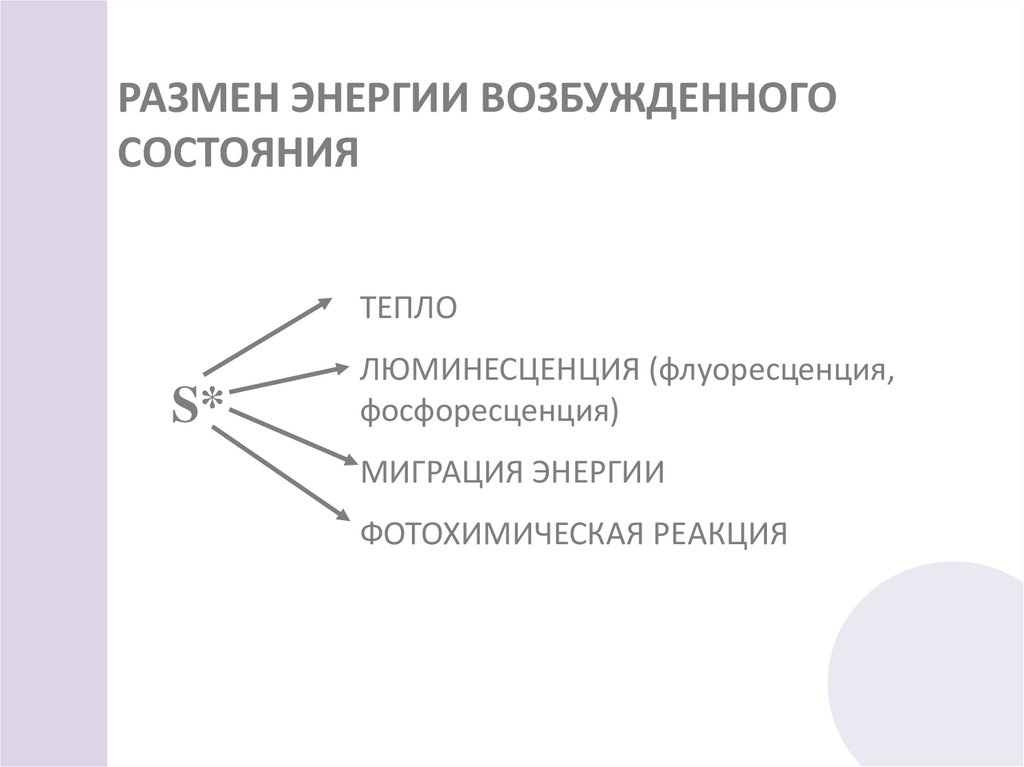
45. РАЗМЕН ЭНЕРГИИ ВОЗБУЖДЕННОГО СОСТОЯНИЯ
ТЕПЛОS*
ЛЮМИНЕСЦЕНЦИЯ (флуоресценция,
фосфоресценция)
МИГРАЦИЯ ЭНЕРГИИ
ФОТОХИМИЧЕСКАЯ РЕАКЦИЯ












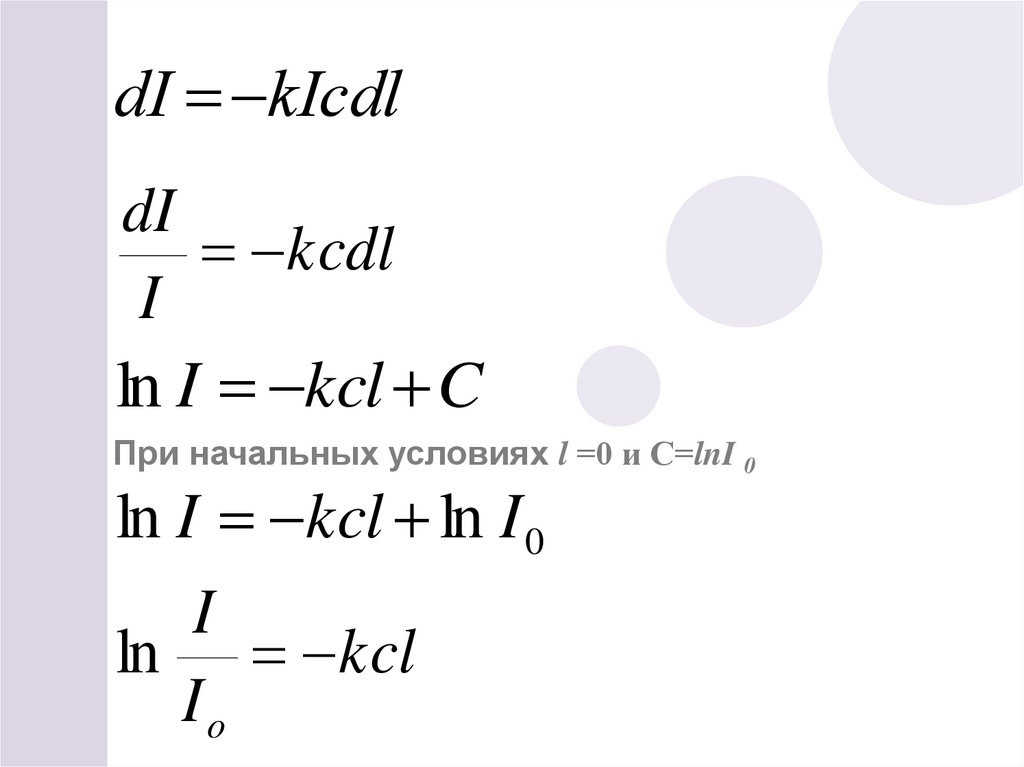








 physics
physics








