Similar presentations:
№ 7 Реализация генетической информации - 2024
1.
«РЕАЛИЗАЦИЯГЕНЕТИЧЕСКОЙ
ИНФОРМАЦИИ У
ПРОКАРИОТ И ЭУКАРИОТ»
2.
Актуальность темы: молекулярная биология изучает явления жизни науровне макромолекул в субклеточных структурах, в вирусах, в
клетках, установление роли и механизма функционирования этих
макромолекул на основе знания их структуры и свойств.
Молекулярная биология главное внимание сосредоточивает на
изучении способа хранения наследственной информации, механизма
ее передачи дочерним клеткам и реализации этой информации. Начав
с изучения биологических процессов на атомно-молекулярном уровне,
молекулярная биология перешла к сложным надмолекулярным
клеточным структурам и в настоящее время успешно решает
проблемы генетики, физиологии, эволюции и экологии.
Цель занятия: изучить молекулярные
механизмы процесса трансляции,
определить возможности регуляции на
трансляционном и пострансляционном
уровнях.
3.
Вопросы для самоподготовкиРекогниция – подготовительный этап трансляции:
активация и транспорт аминокислот
Трансляция как матричный процесс: инициация,
элонгация, терминация
Сходство и отличие процесса трансляции у прокариот и
эукариот (строение рибосом про- и эукариот, стартовый
кодон, факторы трансляции)
Механизмы регуляции на уровне трансляции
Пострансляционная модификация белков (фолдинг и
процессинг). Шапероны и шаперонины, их роль в
пострансляционной модификации белка.
Механизмы и пути траспорта белка в клетке
Деградация
белков
как
способ
регуляции
на
пострансляционном уровне
4.
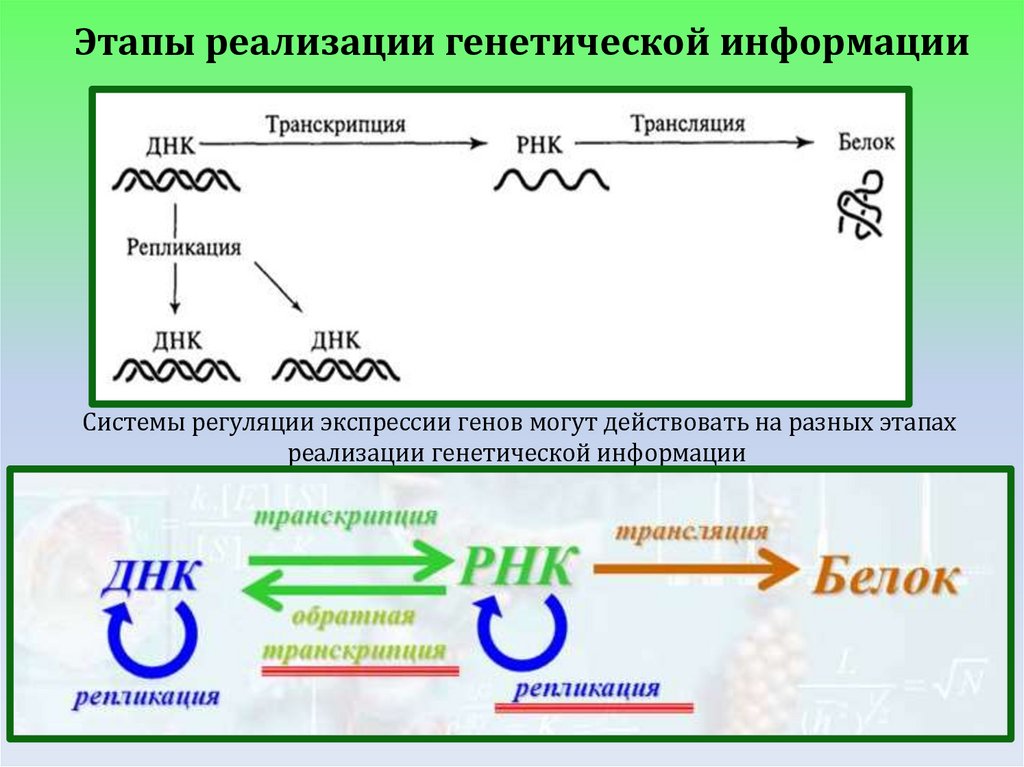
Этапы реализации генетической информацииСистемы регуляции экспрессии генов могут действовать на разных этапах
реализации генетической информации
5.
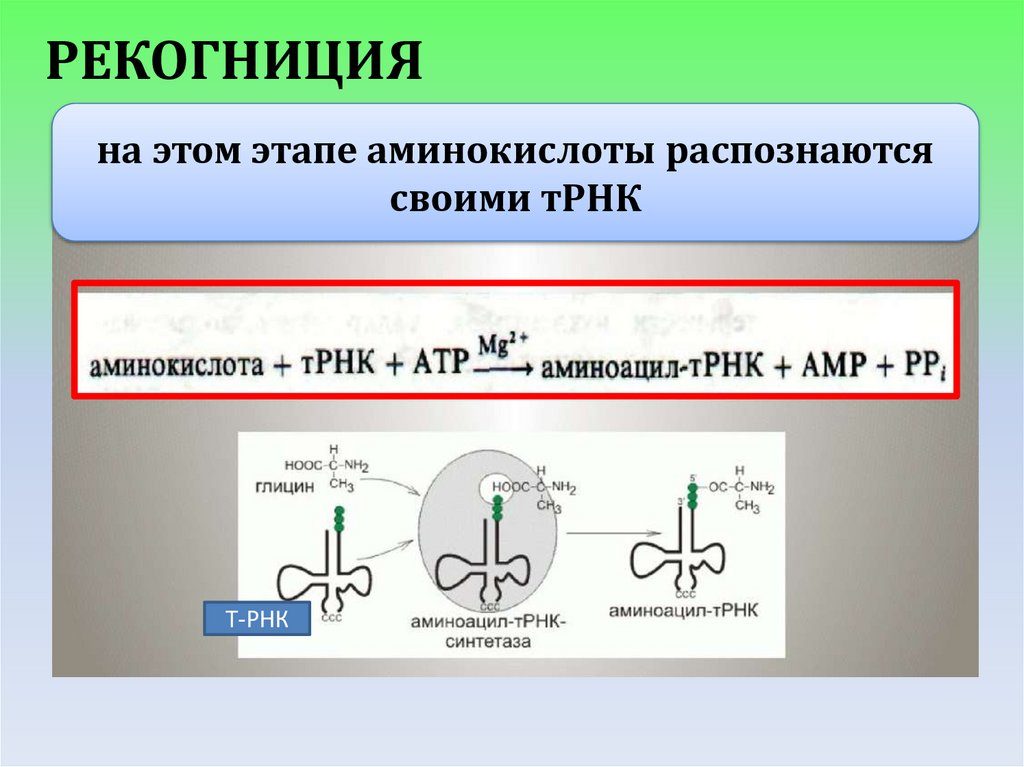
РЕКОГНИЦИЯна этом этапе аминокислоты распознаются
своими тРНК
Т-РНК
6.
Аминоацил-тРНК-синтетазаДля каждой аминокислоты существует своя т-РНК,
20 аминокислот кодирует 61 кодон,
значит существует 61 т-РНК
Аминокислота ковалентно присоединяется к 3'концу
молекулы с помощью специфичного для каждого типа тРНК фермента – аминоацил-тРНК-синтетазы
Для каждой аминокислоты существует своя
аминоацил-тРНК-синтетаза
7.
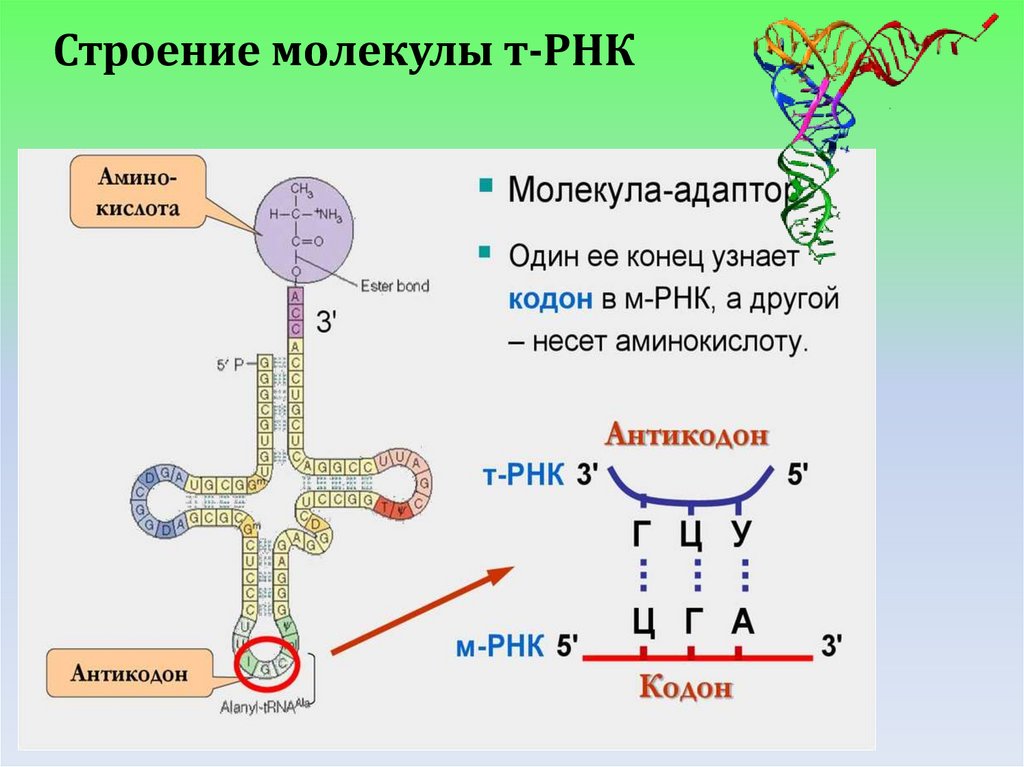
Строение молекулы т-РНК8.
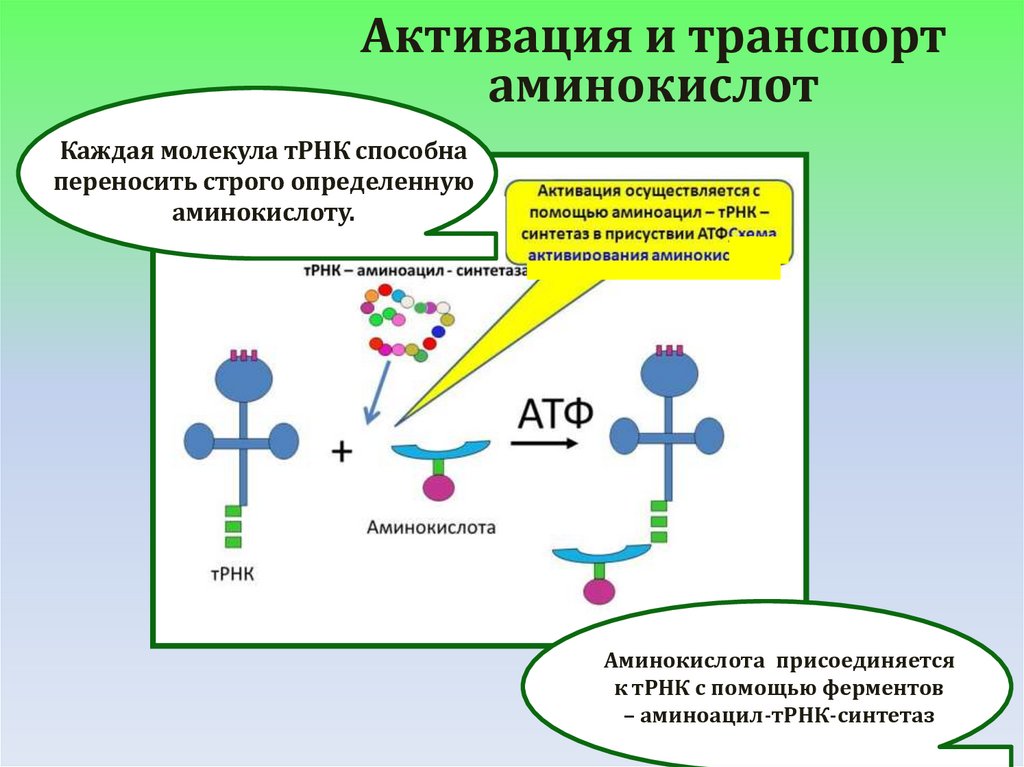
Активация и транспортаминокислот
Каждая молекула тРНК способна
переносить строго определенную
аминокислоту.
Аминокислота присоединяется
к тРНК с помощью ферментов
– аминоацил-тРНК-синтетаз
9.
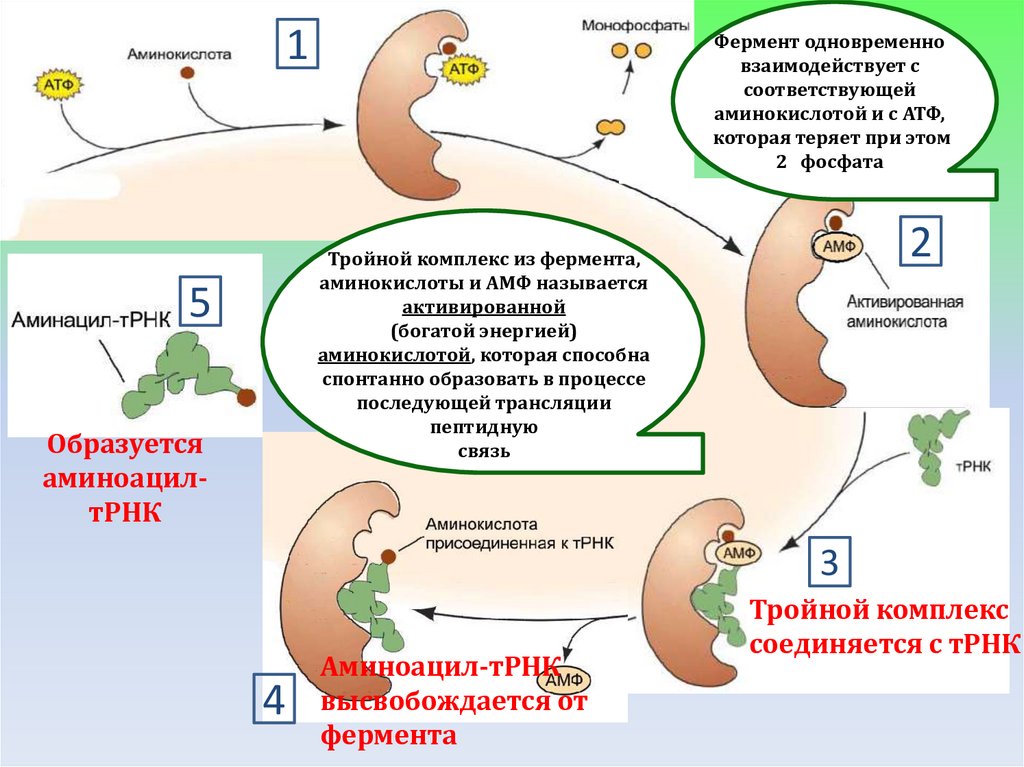
1Фермент одновременно
взаимодействует с
соответствующей
аминокислотой и с АТФ,
которая теряет при этом
2 фосфата
2
Тройной комплекс из фермента,
аминокислоты и АМФ называется
активированной
(богатой энергией)
аминокислотой, которая способна
спонтанно образовать в процессе
последующей трансляции
пептидную
связь
5
Образуется
аминоацилтРНК
3
4
Аминоацил-тРНК
высвобождается от
фермента
Тройной комплекс
соединяется с тРНК
10.
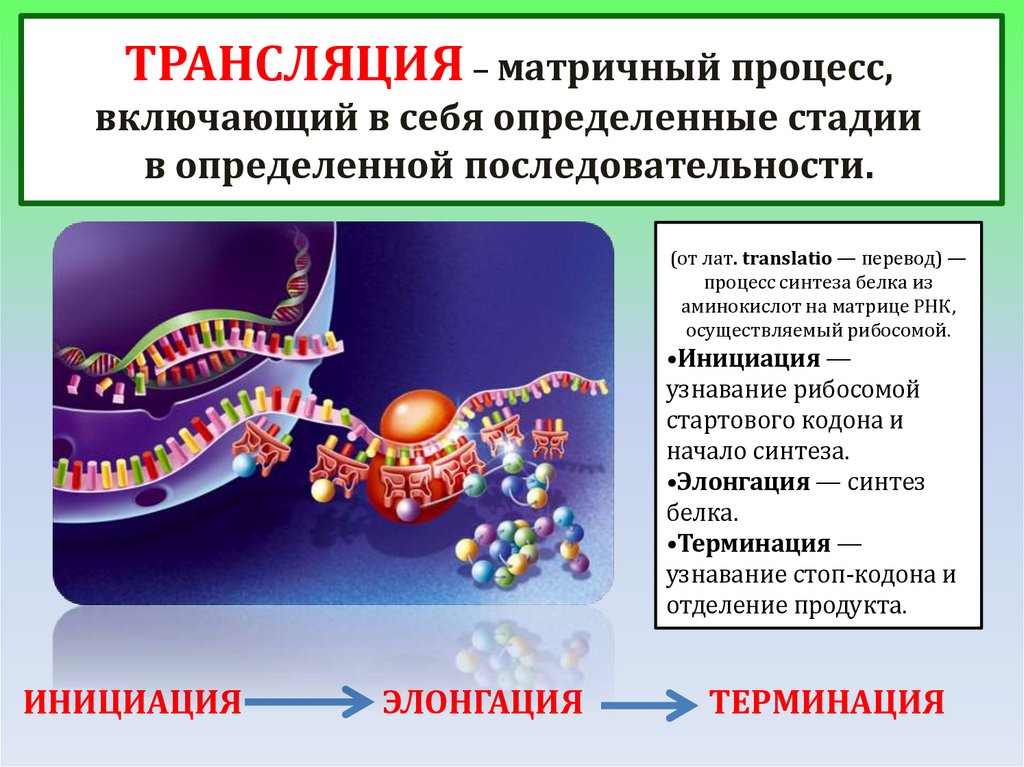
ТРАНСЛЯЦИЯ – матричный процесс,включающий в себя определенные стадии
в определенной последовательности.
(от лат. translatio — перевод) —
процесс синтеза белка из
аминокислот на матрице РНК,
осуществляемый рибосомой.
•Инициация —
узнавание рибосомой
стартового кодона и
начало синтеза.
•Элонгация — синтез
белка.
•Терминация —
узнавание стоп-кодона и
отделение продукта.
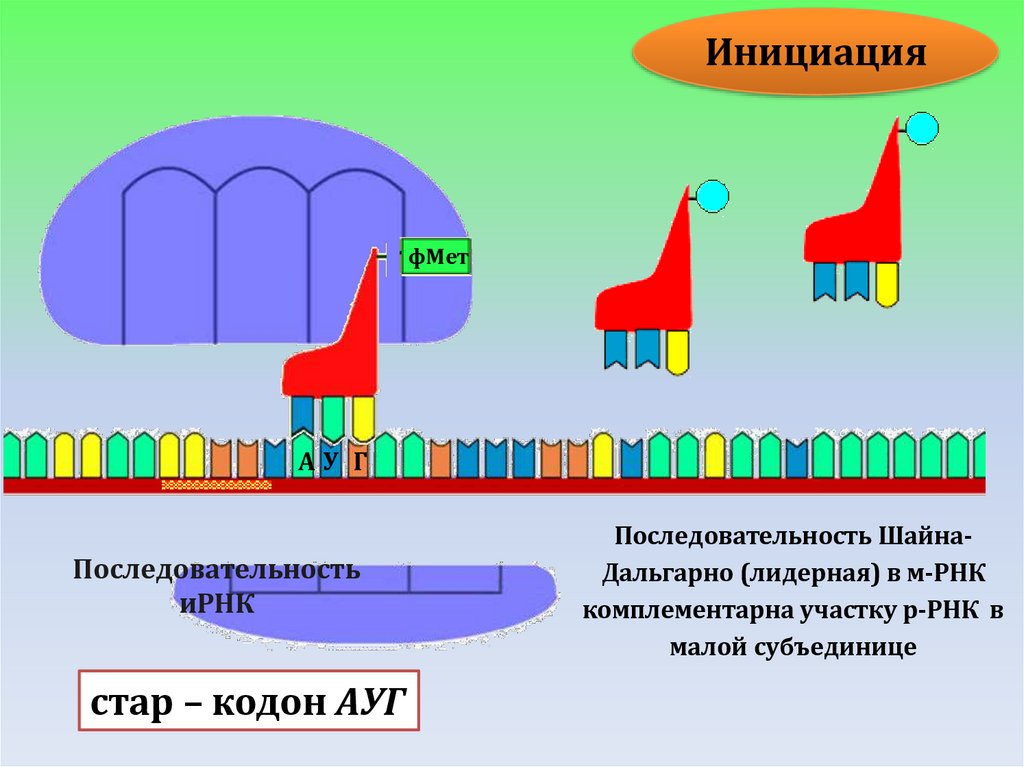
ИНИЦИАЦИЯ
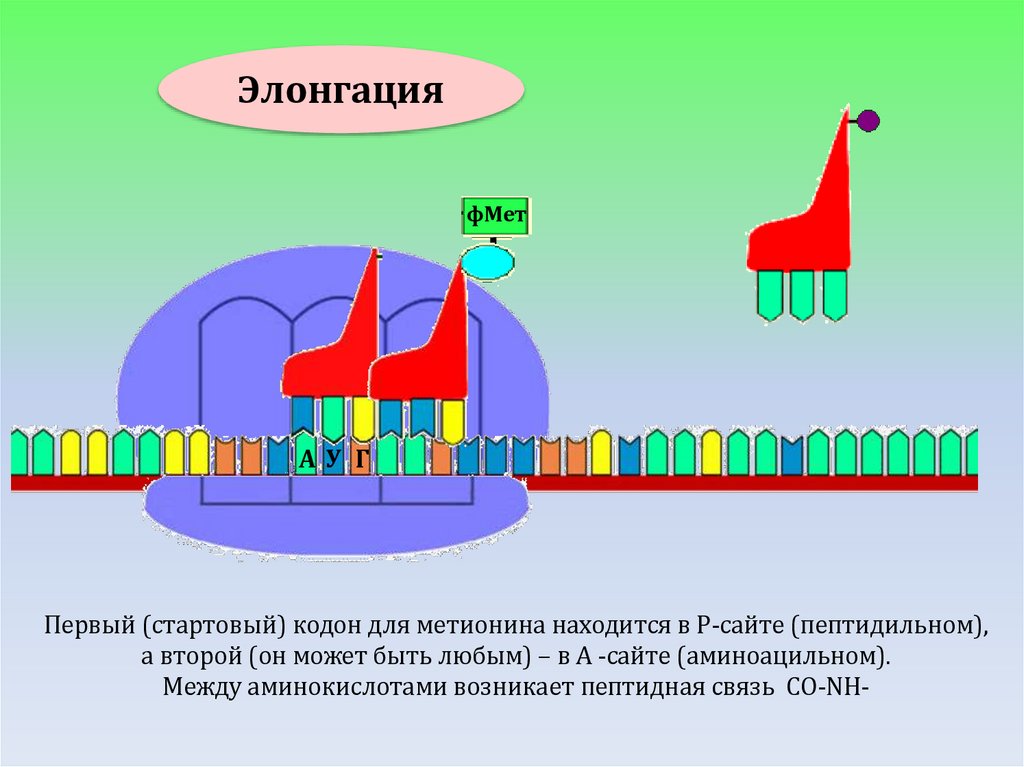
ЭЛОНГАЦИЯ
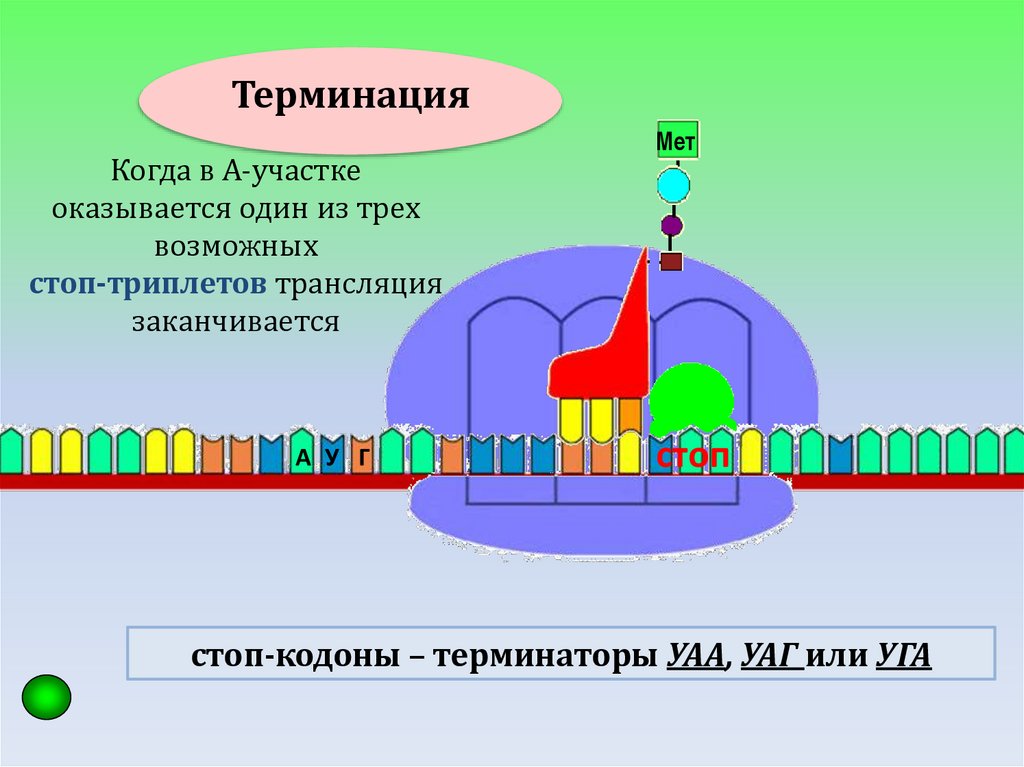
ТЕРМИНАЦИЯ
11.
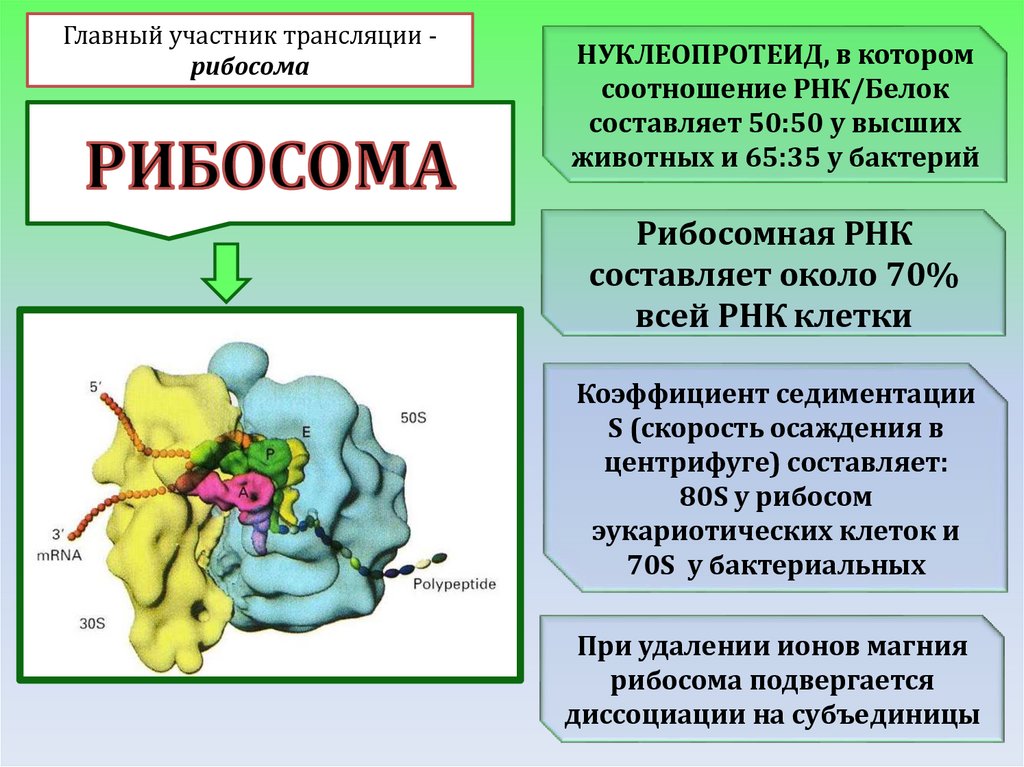
Главный участник трансляции рибосомаНУКЛЕОПРОТЕИД, в котором
соотношение РНК/Белок
составляет 50:50 у высших
животных и 65:35 у бактерий
Рибосомная РНК
составляет около 70%
всей РНК клетки
Коэффициент седиментации
S (скорость осаждения в
центрифуге) составляет:
80S у рибосом
эукариотических клеток и
70S у бактериальных
При удалении ионов магния
рибосома подвергается
диссоциации на субъединицы
12.
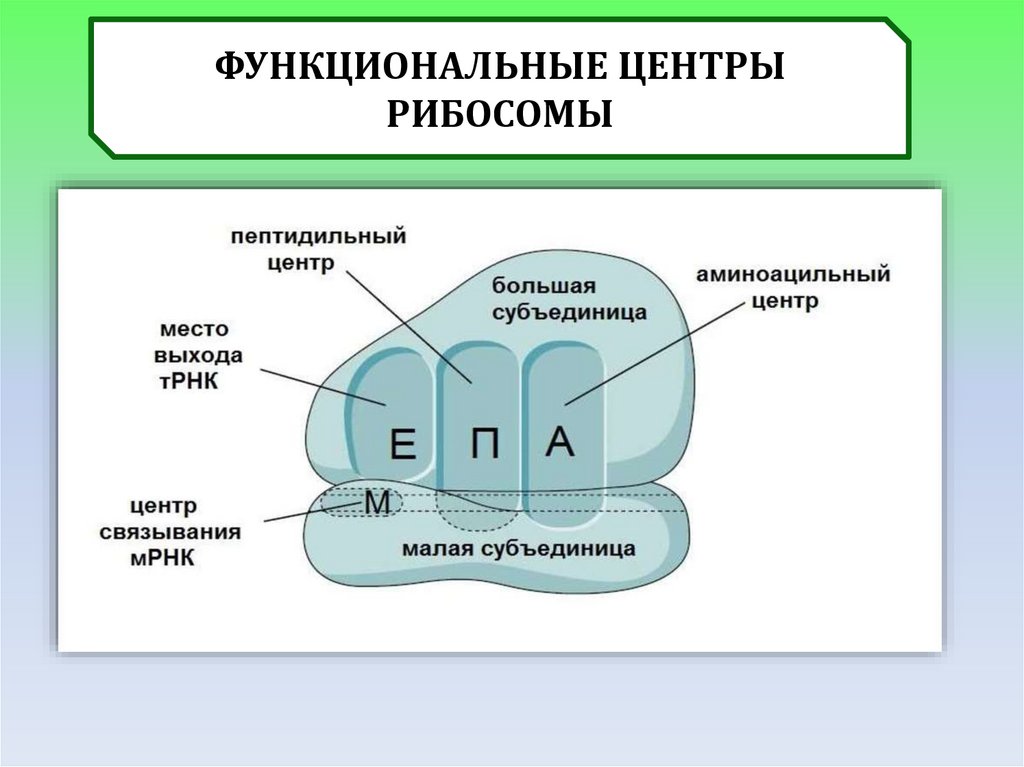
ФУНКЦИОНАЛЬНЫЕ ЦЕНТРЫРИБОСОМЫ
13.
Инициация трансляцииНа стадии инициации в процессе трансляции у бактерий
E.coli участвуют белковые факторы: IF-1, IF-2 и IF-3.
14.
ИнициацияфМет
АУ Г
Последовательность
иРНК
стар – кодон АУГ
Последовательность ШайнаДальгарно (лидерная) в м-РНК
комплементарна участку р-РНК в
малой субъединице
15.
ЭлонгацияфМет
фМет
АУ Г
Первый (стартовый) кодон для метионина находится в Р-сайте (пептидильном),
а второй (он может быть любым) – в А -сайте (аминоацильном).
Между аминокислотами возникает пептидная связь СО-NH-
16.
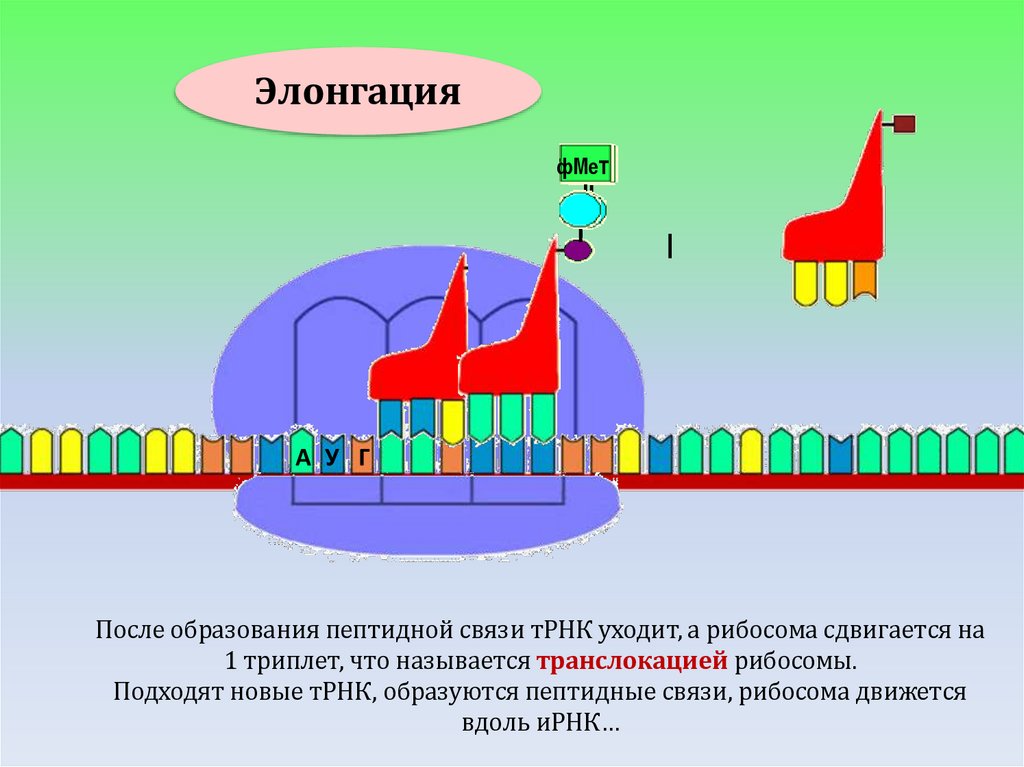
ЭлонгацияфМет
фМе
т
А У Г
После образования пептидной связи тРНК уходит, а рибосома сдвигается на
1 триплет, что называется транслокацией рибосомы.
Подходят новые тРНК, образуются пептидные связи, рибосома движется
вдоль иРНК…
17.
ЭлонгацияфМет
А У Г
стоп
18.
ТерминацияКогда в А-участке
оказывается один из трех
возможных
стоп-триплетов трансляция
заканчивается
А У Г
Мет
стоп
стоп-кодоны – терминаторы УАА, УАГ или УГА
19.
Трансляция«считывание» генетической информации с иРНК и создание (сборка)
полимерной цепи белка на рибосомах
20.
Информация:Терминация трансляции у прокариот
• Факторы терминации:
•RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и
UAG;
•RF-2 действует аналогичным образом при считывании UAA и UGA,
•EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
•В А-участке оказывается один из трех терминирующих кодонов – UAG, UAA
или UGA.
•Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК
остается связанной с Р-участком.
•RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК,
отделение их обоих от рибосомы, а 70S-рибосомы – от мРНК.
•RF-1 узнает в А-участке кодон UAA или UAG
•RF-2 включается в том случае, когда в А-участке оказывается UAA или UGA;
•RF-3 облегчает работу двух других факторов.
•Если терминирующим кодоном является UAA, то эффективность процесса
терминации оказывается наибольшей, поскольку этот кодон узнают оба
фактора – RF-1 и RF-2.
21. Информация: Терминация трансляции у эукариот
• У эукариот найден только один фактор терминациитрансляции – eRF, способный «читать» все три
терминирующих кодона
• Терминирующие кодоны дрожжей по частоте их
использования можно расположить в следующий ряд:
UAA(53%) > UGA(27%) > UAG(20%).
• Если анализировать только активно экспрессирующиеся
гены, то частота использования UAA оказывается еще
большей - 87%.
22.
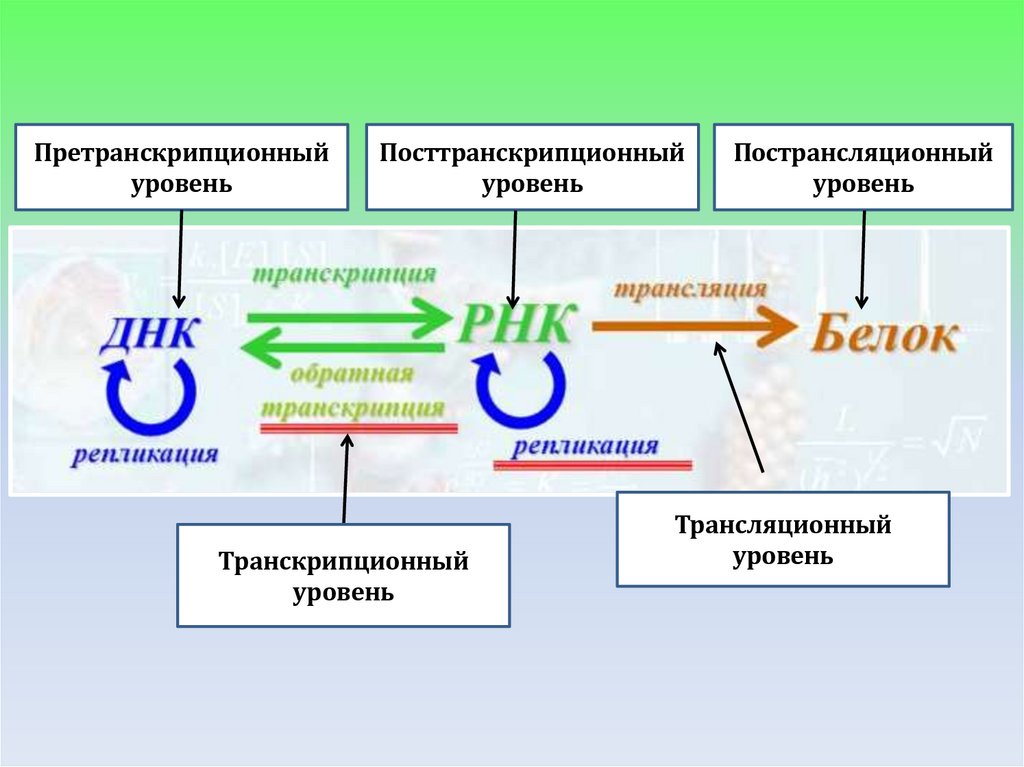
Претранскрипционныйуровень
Посттранскрипционный
уровень
Транскрипционный
уровень
Пострансляционный
уровень
Трансляционный
уровень
23.
Пострансляционная модификациябелка
Изменение первичной структуры полипептидной цепи после
это изменение первичной
структуры
полипептидной
цепи после завершения ее
завершения
ее синтеза
рибосомами;
синтеза рибосомами
Химические превращения,
изменяющие ковалентную
структуру полипептидной цепи
1. Катализируется специфическими ферментами;
2. Может происходить во время синтеза
полипептидной цепи и после окончания синтеза;
3. Нематричные процессы, отсюда – образование
множественных форм белков;
4. Некоторые реакции характерны для очень
многих белков, а некоторые – для отдельных
белков;
5. Более 5% генов в геноме в геноме человека
кодируют ферменты, участвующие в
пострансляционной модификации белков.
24.
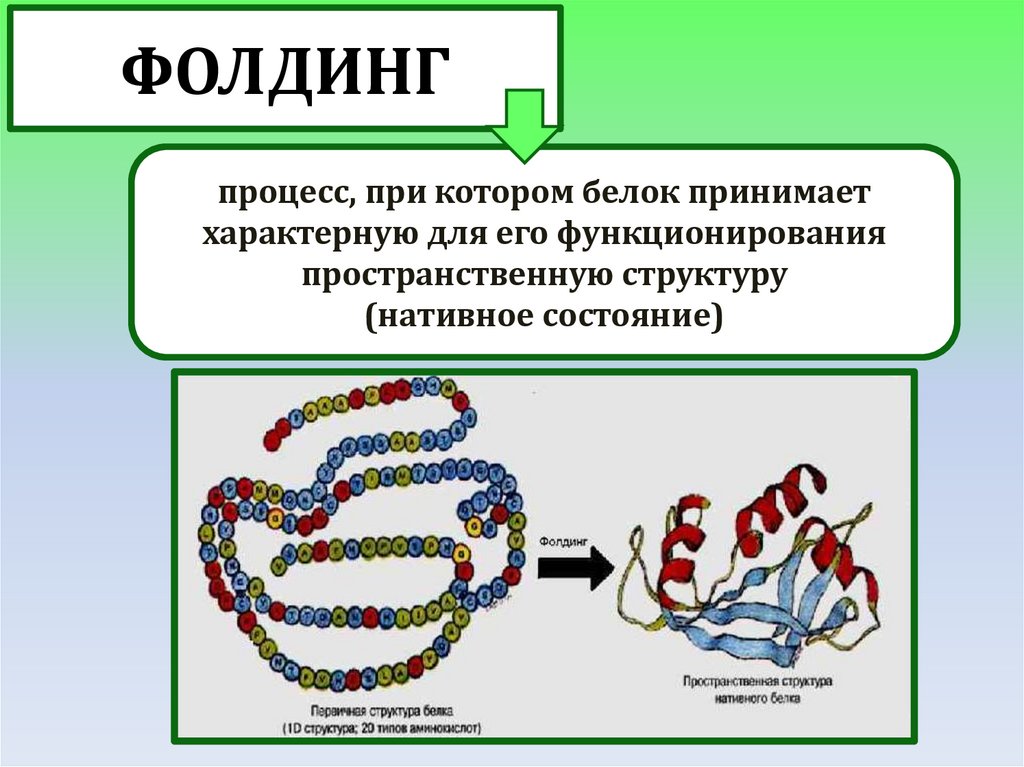
ФОЛДИНГпроцесс, при котором белок принимает
характерную для его функционирования
пространственную структуру
(нативное состояние)
25.
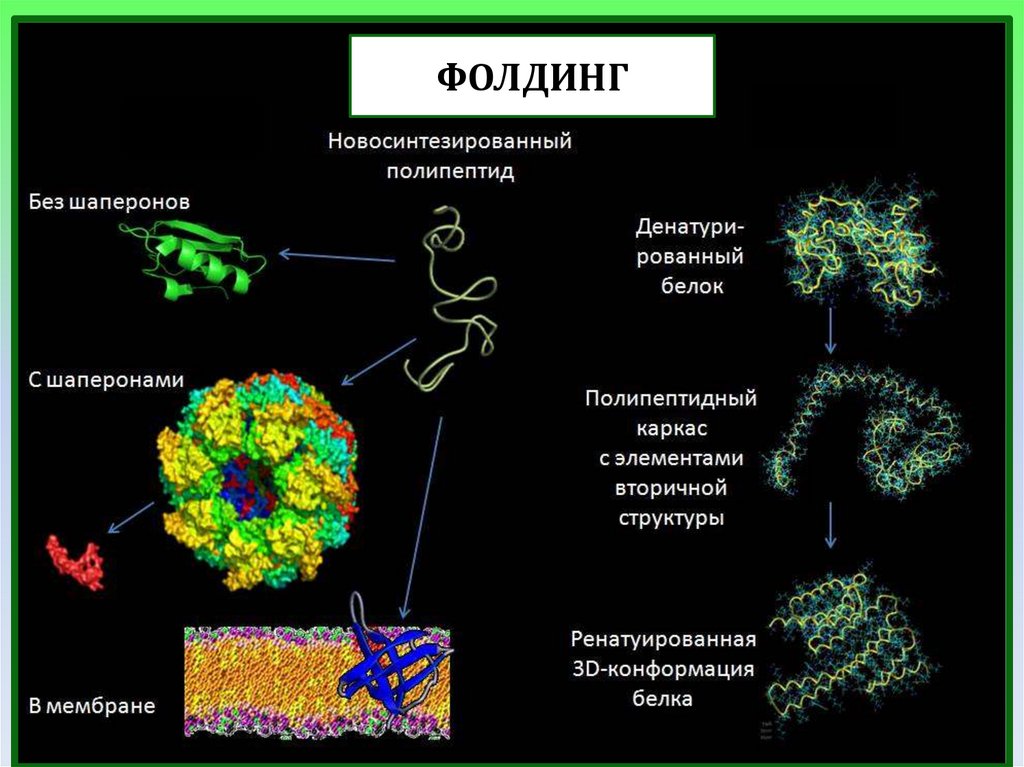
ФОЛДИНГ26.
Факторы и Ферменты ФОЛДИНГАШАПЕРОНЫ
ШАПЕРОНИНЫ
27.
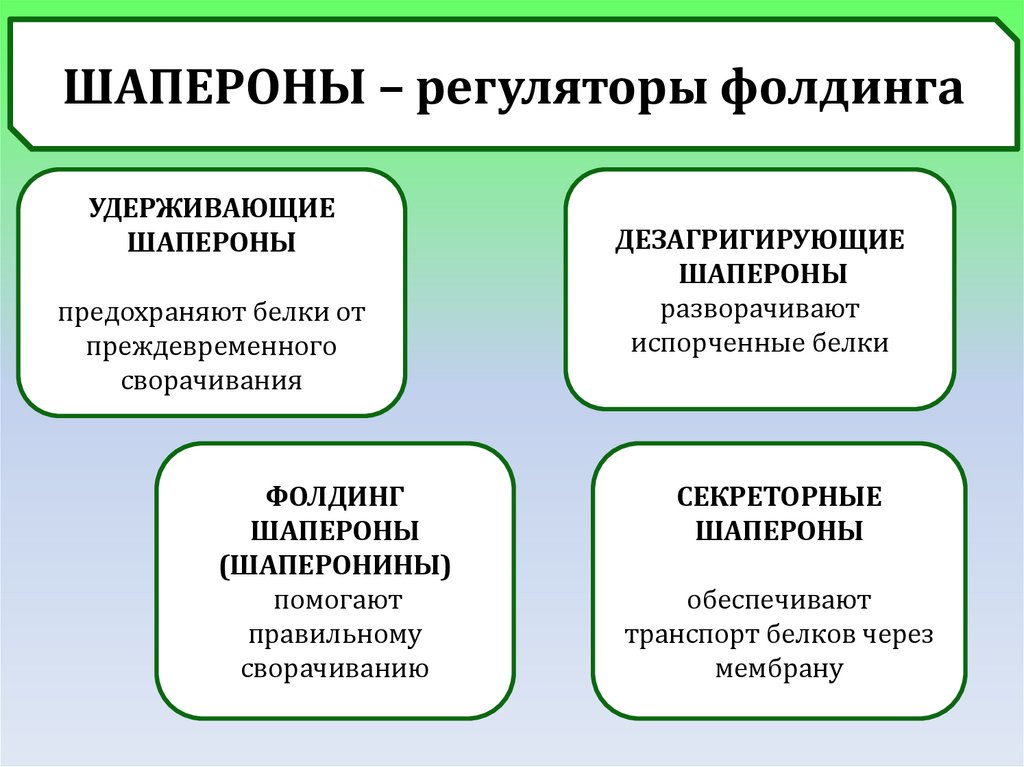
ШАПЕРОНЫ – регуляторы фолдингаУДЕРЖИВАЮЩИЕ
ШАПЕРОНЫ
предохраняют белки от
преждевременного
сворачивания
ФОЛДИНГ
ШАПЕРОНЫ
(ШАПЕРОНИНЫ)
помогают
правильному
сворачиванию
ДЕЗАГРИГИРУЮЩИЕ
ШАПЕРОНЫ
разворачивают
испорченные белки
СЕКРЕТОРНЫЕ
ШАПЕРОНЫ
обеспечивают
транспорт белков через
мембрану
28.
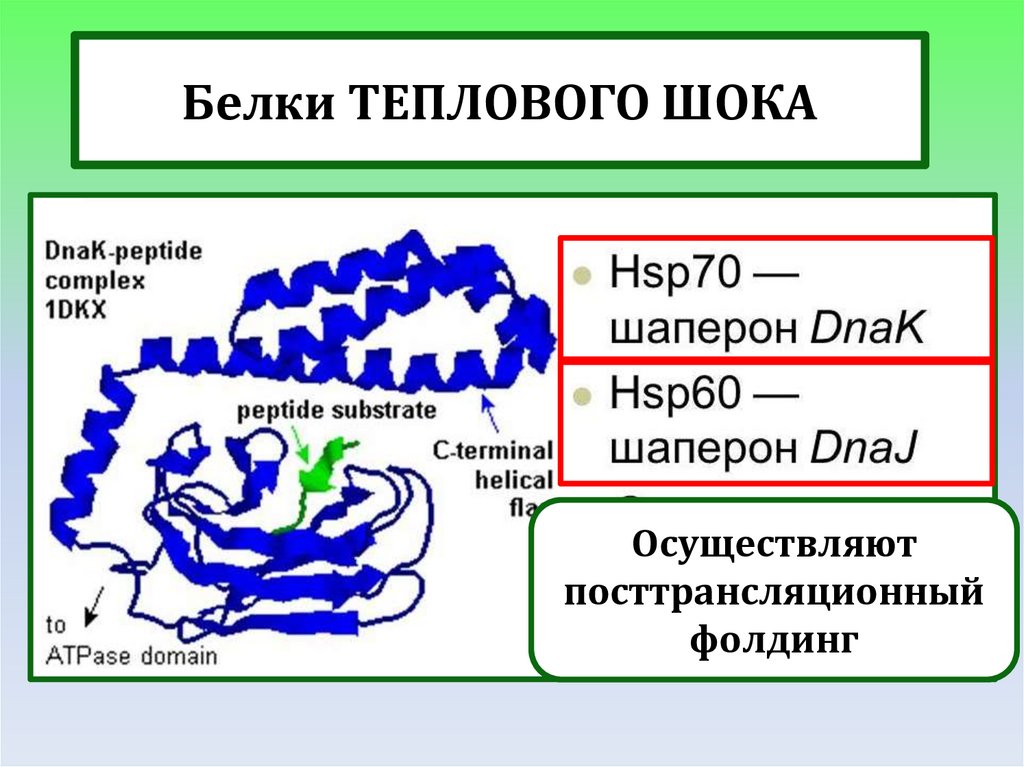
Белки ТЕПЛОВОГО ШОКАОсуществляют
посттрансляционный
фолдинг
29.
ПАТОЛОГИИ ФОЛДИНГА30.
КУРУ – «смеющаяся» СМЕРТЬМозжечковые расстройства
Нарушение походки
Дрожание конечностей,
нарушение артикуляции
Повышенная возбудимость
Эйфория, беспричинный
смех
Прогрессирующее
слабоумие
Встречается почти исключительно в
высокогорных районах Новой Гвинеи,
преимущественно у лиц,
практикующих каннибализм
31.
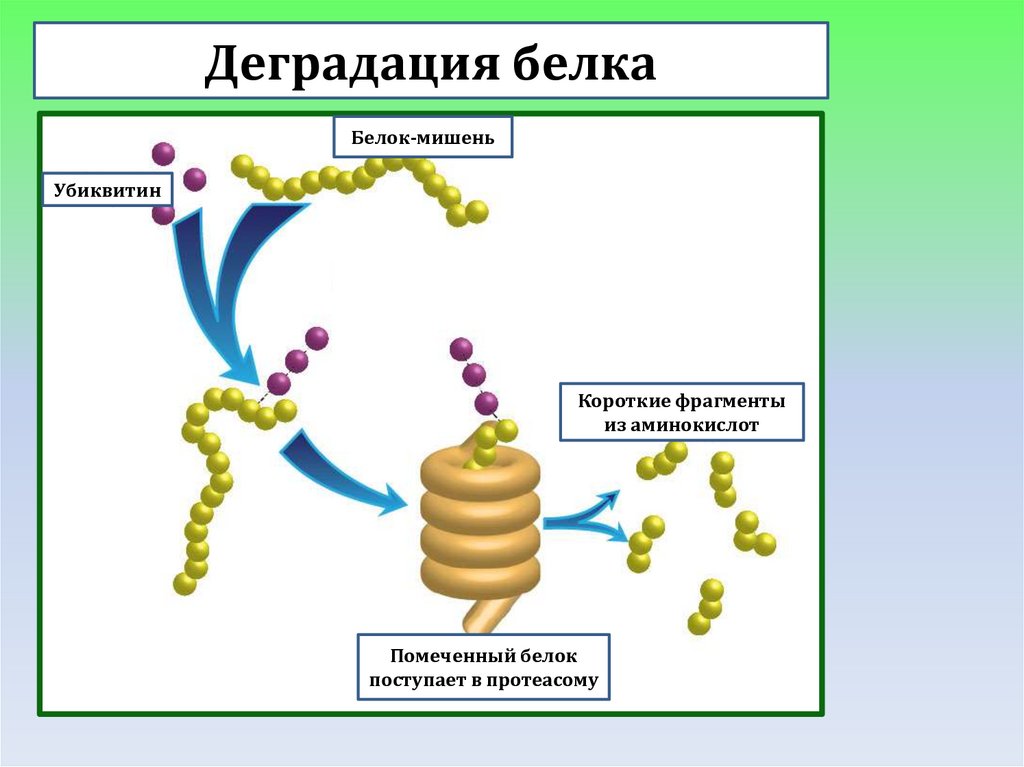
Деградация белкаБелок-мишень
Убиквитин
Короткие фрагменты
из аминокислот
Помеченный белок
поступает в протеасому
32.
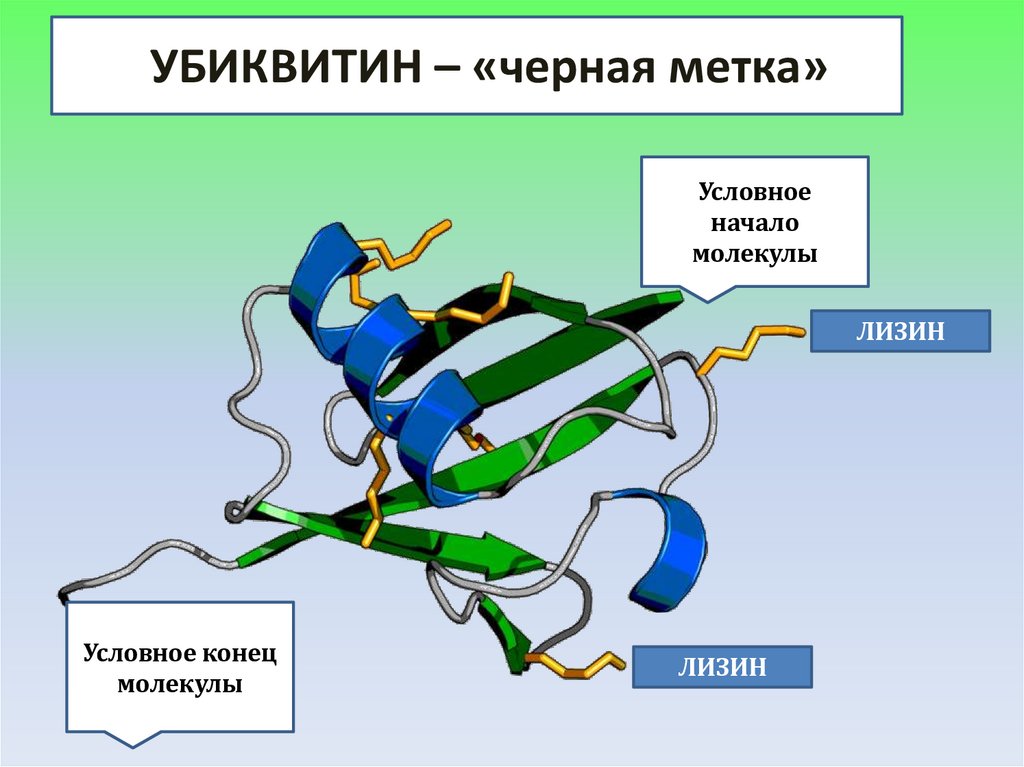
УБИКВИТИН – «черная метка»Условное
начало
молекулы
ЛИЗИН
Условное конец
молекулы
ЛИЗИН
33.
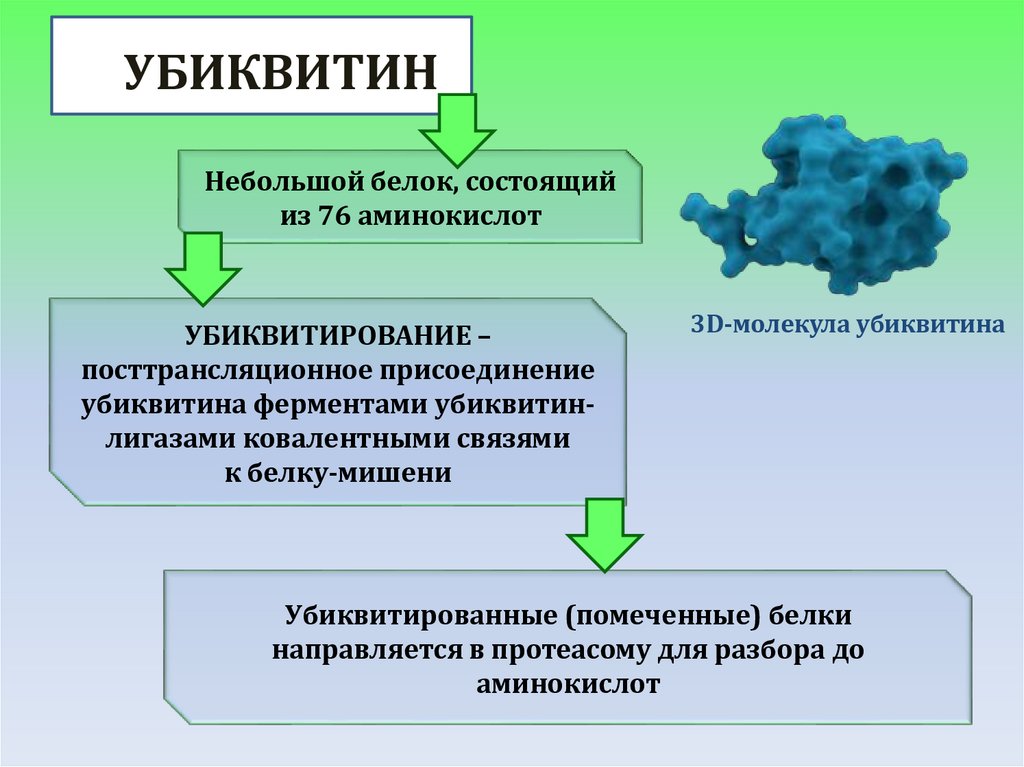
УБИКВИТИННебольшой белок, состоящий
из 76 аминокислот
УБИКВИТИРОВАНИЕ –
посттрансляционное присоединение
убиквитина ферментами убиквитинлигазами ковалентными связями
к белку-мишени
3D-молекула убиквитина
Убиквитированные (помеченные) белки
направляется в протеасому для разбора до
аминокислот
34.
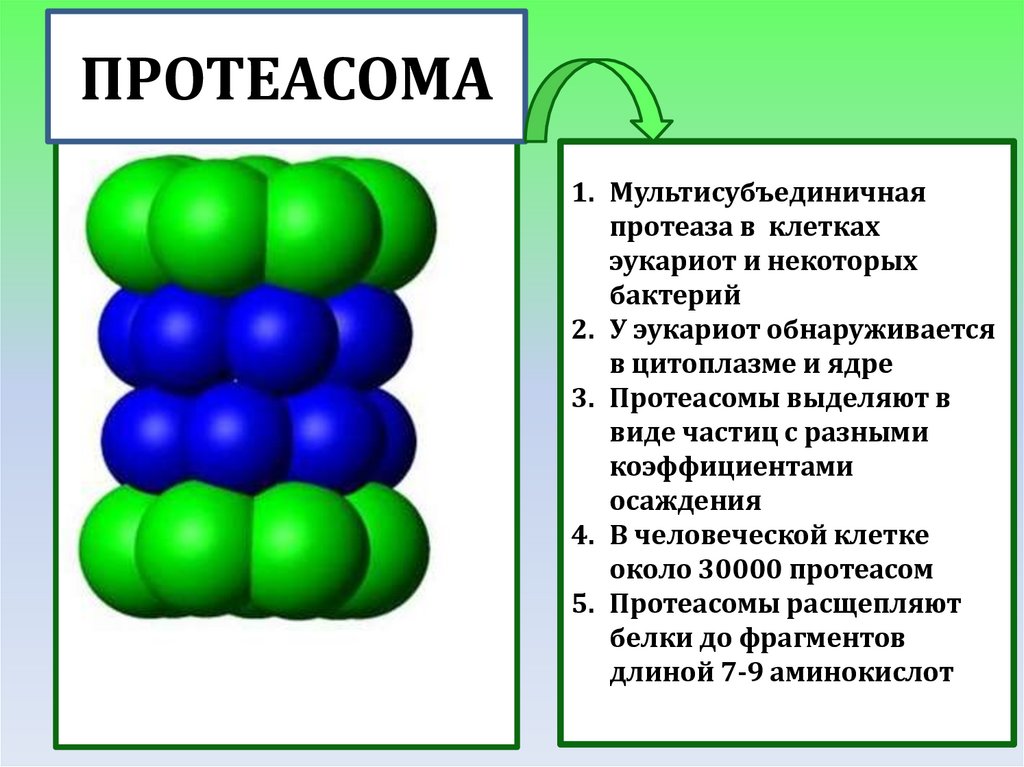
ПРОТЕАСОМА1. Мультисубъединичная
протеаза в клетках
эукариот и некоторых
бактерий
2. У эукариот обнаруживается
в цитоплазме и ядре
3. Протеасомы выделяют в
виде частиц с разными
коэффициентами
осаждения
4. В человеческой клетке
около 30000 протеасом
5. Протеасомы расщепляют
белки до фрагментов
длиной 7-9 аминокислот
35.
Решениезадач
36.
37.
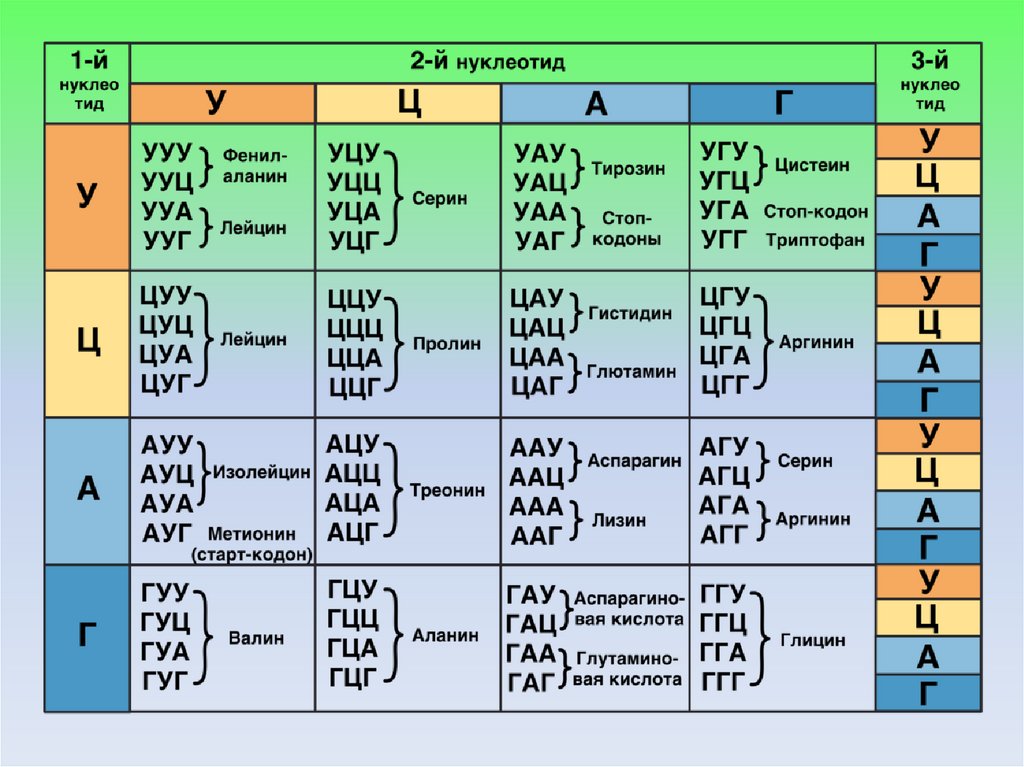
РАБОТА 1. Определение строения молекулы белка поструктуре ДНК, РНК
Задача
1.
Фрагмент
одной
цепи
ДНК
имеет
последовательность нуклеотидов: 5' … Г Т А Т Ц Т А А А Ц А
Т … 3'.
Определите последовательность нуклеотидов на второй
цепи ДНК, на и-РНК и последовательность аминокислот во
фрагменте
молекулы
белка,
используя
таблицу
генетического кода. В молекулярной генетике принято
смысловую ДНК писать сверху, транскрибируемую – снизу.
Пример решения и правильной записи задачи:
ДНК смысловая:
5'… Г Т А Т Ц Т А А А Ц А Т …3'
ДНК транскрибируемая: 3'… Ц А Т А Г А Т Т Т Г Т А … 5'
и-РНК:
5' ГУА – УЦУ – ААА – ЦАУ 3'
белок:
вал – сер – лиз – гис
38.
РАБОТА 2. Определение изменения в строении молекулыбелка после мутаций
Задача 8. Какие изменения произойдут в строении белка, если
в кодирующем его участке ДНК: 3ʹ ТАА-ЦАА-АГА-АЦА-ААА 5ʹ
между 10-м и 11-м нуклеотидами включить цитозин, между 13м и 14-м – тимин, а на конце прибавить еще один аденин.
Пример решения и правильной записи задачи:
ДНК: 3ʹ ТАА – ЦАА – АГА – АЦА – ААА 5ʹ
и-РНК: 5ʹ АУУ – ГУУ – УЦУ – УГУ – УУУ 3ʹ
белок: иле – вал – сер – цис – фен
ДНК (мут.) 3ʹ ТАА – ЦАА – АГА – АЦЦ – ААА – ТАА 5ʹ
и-РНК (мут.) 5ʹ АУУ – ГУУ – УЦУ – УГГ – УУУ – АУУ 3ʹ
белок (мут.) иле – вал – сер – три – фен – иле
Первые три аминокислоты останутся прежними, затем порядок
и состав аминокислот в составе молекулы белка изменятся изза произошедшей мутации.
39.
РАБОТА 3. Определение молекулярной массы молекулы белкаЗадача 18. Гены эукариотических клеток имеют «мозаичное» строение и состоят из
кодирующих элементов (экзонов) и некодирующих участков (интронов). По завершении
транскрипции образуется «незрелый» (первичный) транскрипт, «зрелая» иРНК1 состоит
из 5700 п.н., иРНК2 – из 3600 п.н., иРНК3 из 4200 п.н. Ген, кодирующий белок состоит из 4
экзонов: 1 экзон – 1500 п.н, 2 экзон - 2100 п.н., 3 экзон – 900 п.н., 4 экзон – 1200 п.н.
Рассчитайте молекулярную массу белков, полученных в ходе трансляции, где матрицей
являлись альтернативно сплайсированные иРНК, если молекулярная масса
аминокислотного остатка 110.
Пример решения и правильной записи задачи:
1. первичный транскрипт (пре иРНК): Кэп – 1 экзон – интрон – 2 экзон – интрон – 3
экзон – интрон – 4 экзон ААА
2. Зрелые иРНК:
иРНК1: Кэп – 1 экзон – 2 экзон – 3 экзон – 4 экзон ААА
иРНК1: 1500+2100+900+1200 п.н.= 5700
иРНК2: 5700-3600 = 2100 п.н, след. не включен 2 экзон
иРНК2: Кэп – 1 экзон – 3 экзон – 4 экзон ААА
иРНК3: 5700 – 4200 = 1500 п.н., след не включен 1 экзон.
иРНК3: Кэп – 2 экзон – 3 экзон – 4 экзон ААА
3. Находим массу белков
Белок 1: 1500 + 2100 + 900 + 1200 = 5700 п.н.
5700 : 3 = 1900 аминокислот × 110=209000 Д (масса белка 1)
Белок 2: 1500 + 900 + 1200 = 3600 п.н
3600 : 3 = 1200 аминокислот ×110= 132000 Д (масса белка 2)
Белок 3: 2100 + 900 + 1200 = 4200 п.н.
















 biology
biology








