Similar presentations:
Урок_ХУ_Закон сохр массы
1.
§10. Химические уравнения.Законсохранения массы веществ
2.
Цель урока. Формирование понятия «химическоеуравнение» как условной записи химической реакции с
помощью химических формул на основе закона
сохранения массы веществ.
Проблемный вопрос урока.
Как на «химическом языке» можно записать химическую
реакцию? В чем причина равенства масс исходных
веществ и продуктов реакции?
3.
Э-2. Актуализация знаний1) В чем заключается главное отличие химических явлений от
физических? Приведите примеры химических явлений. Поясните,
почему вы относите их к химическим явлениям.
2) Каковы признаки протекания химических реакций?
3) Какие реакции называются реакциями горения? Приведите
примеры использования реакций горения в промышленности, в
быту.
4) Какие условия необходимы для того, чтобы протекала
химическая реакция? Все ли из этих условий являются
обязательными? Приведите соответствующие примеры.
4.
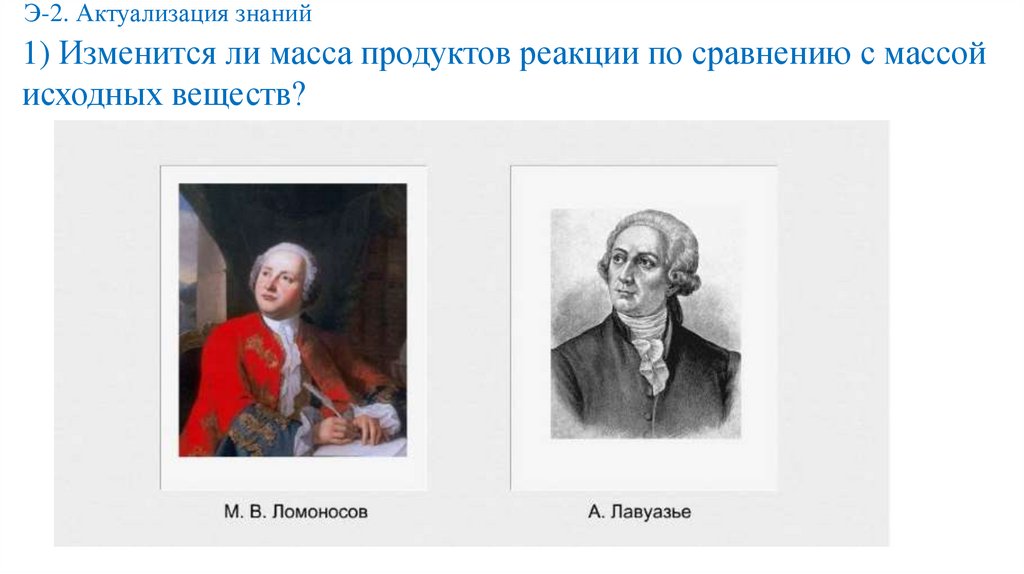
Э-2. Актуализация знаний1) Изменится ли масса продуктов реакции по сравнению с массой
исходных веществ?
5.
Э-2. Актуализация знаний1) Изменится ли масса продуктов реакции по сравнению с массой
исходных веществ?
6.
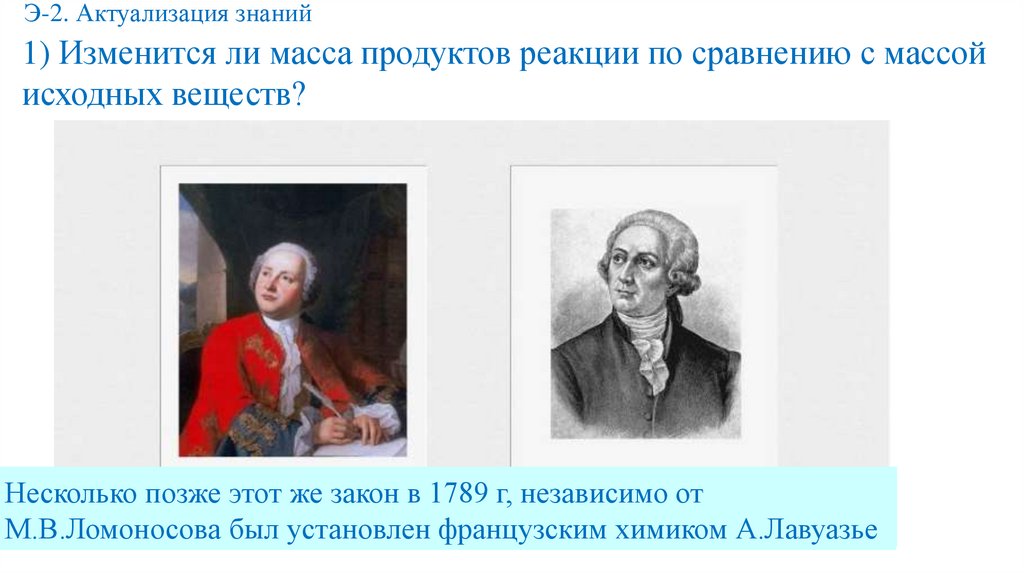
Э-2. Актуализация знаний1) Изменится ли масса продуктов реакции по сравнению с массой
исходных веществ?
Закон сохранения
массы
впервые
сформулировал
в 1748г и
Несколько
позже этот
же веществ
закон в 1789
г, независимо
от
экспериментальнобыл
подтвердил
в 1756г
М.В.Ломоносов
М.В.Ломоносова
установлен
французским
химиком А.Лавуазье
7.
8.
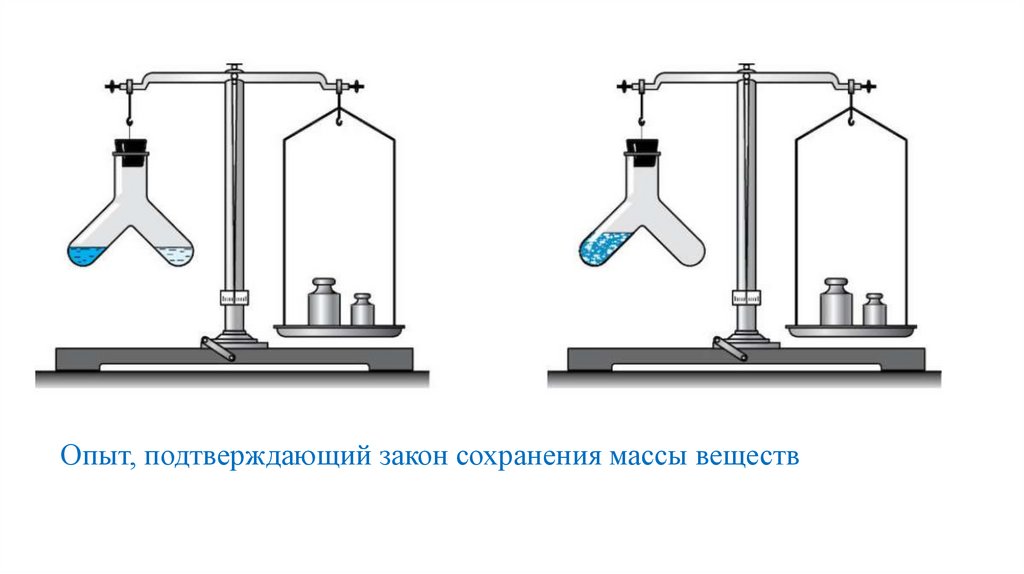
Опыт, подтверждающий закон сохранения массы веществ9.
Растворение гидроксида меди в соляной кислоте10.
Э-2. Химические уравненияЗаписи в тетради
Закон сохранения массы веществ (М. В. Ломоносов, 1748 г.):
При химических реакциях атомы не образуются и не разрушаются, а
происходит лишь их перегруппировка.
11.
Составлениеуравнений реакций
12.
Алгоритм составления уравнений реакций2 Н2 + О2 = 2Н2О
13.
Алгоритм составления уравнений реакций2 Н2 + О2 = 2Н2О
14.
Алгоритм составления уравнений реакций2 Н2 + О2 = 2Н2О
15.
Алгоритм составления уравнений реакций2 Н2 + 0,5 О2 = 2 Н2О
16.
Алгоритм составления уравнений реакцийУмножаем все уравнение на 2
2 Н2 + 0,5 О2 = 2 Н2О
17.
Алгоритм составления уравнений реакцийУмножаем все уравнение на 2
2 Н2 + 0,5 О2 = 2 Н2О
2 Н2 + О2 = 2 Н2О
18.
Алгоритм составления уравнений реакцийУмножаем все уравнение на 2
2 Н2 + 0,5 О2 = 2 Н2О
2 Н2 + О2 = 4 Н2О
19. Взаимодействие оксида железа (III) с алюминием
20.
Fe2O3 + Al=21.
Fe2O3 + Al=22.
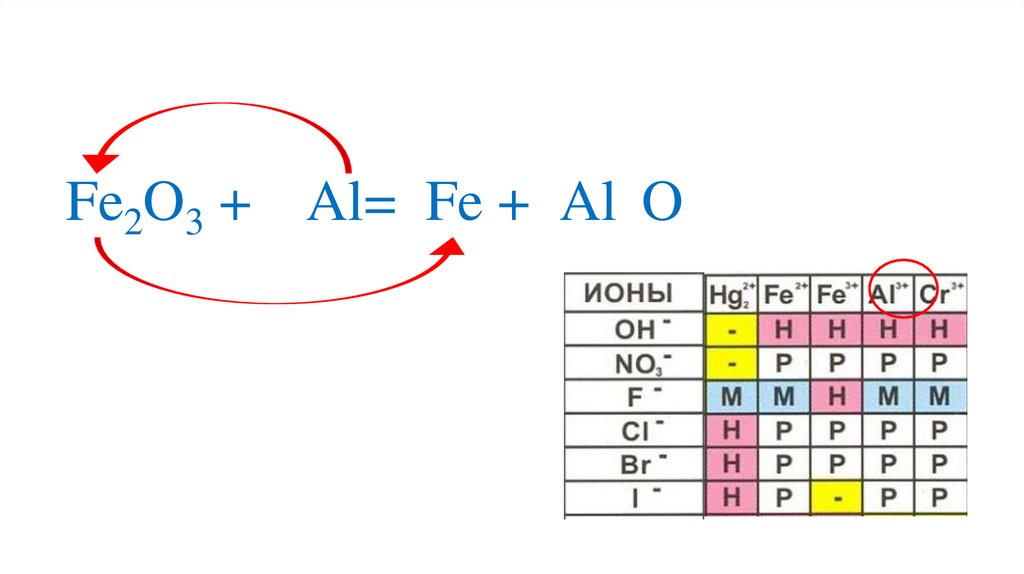
Fe2O3 + Al= Fe +23.
+3-2
Fe2O3 + Al= Fe +2Al O
24.
IIIII
Fe2O3 + Al= Fe + 2Al O
25.
6III
II
Fe2O3 + Al= Fe + 2Al O
26.
6III
Fe2O3 + Al= Fe + 2Al2 O
II
3
27.
6III
II
Fe2O3 + Al= Fe + 2Al2 O3
28.
+3-2
Fe2O3 + Al=2Fe + 2Al2 O3
29.
+3-2
Fe2O3 + Al=2Fe + 2Al2 O3
30.
+3-2
Fe2O3 + Al=2Fe + 2Al2 O3
31.
+3-2
Fe2O3 + Al=2Fe + 2Al2 O3
32.
+3-2
Fe2O3 + 2Al=2Fe + 2Al2 O3
33.
+3-2
Fe2O3 + 3Al=2Fe + 2Al2 O3
34.
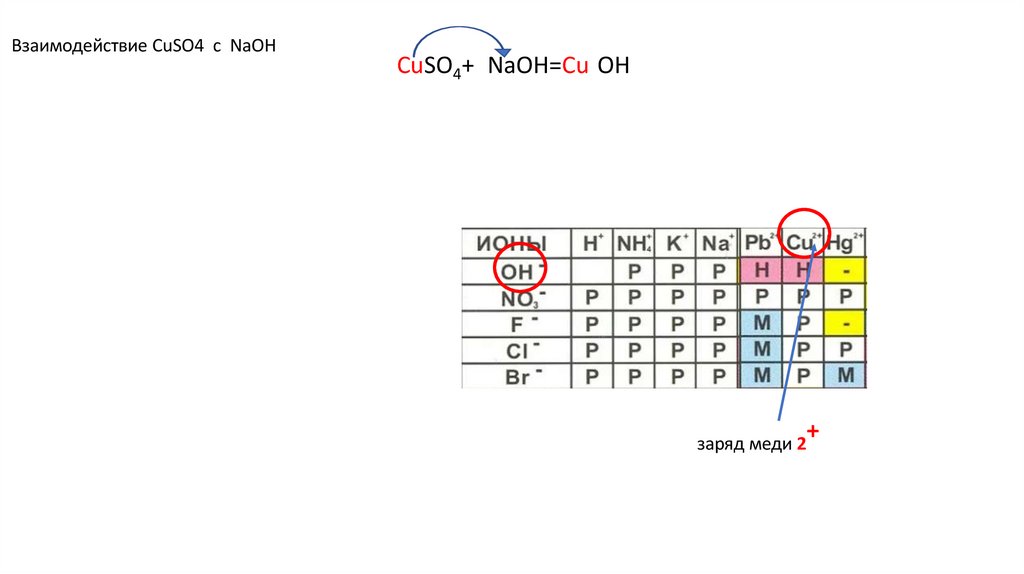
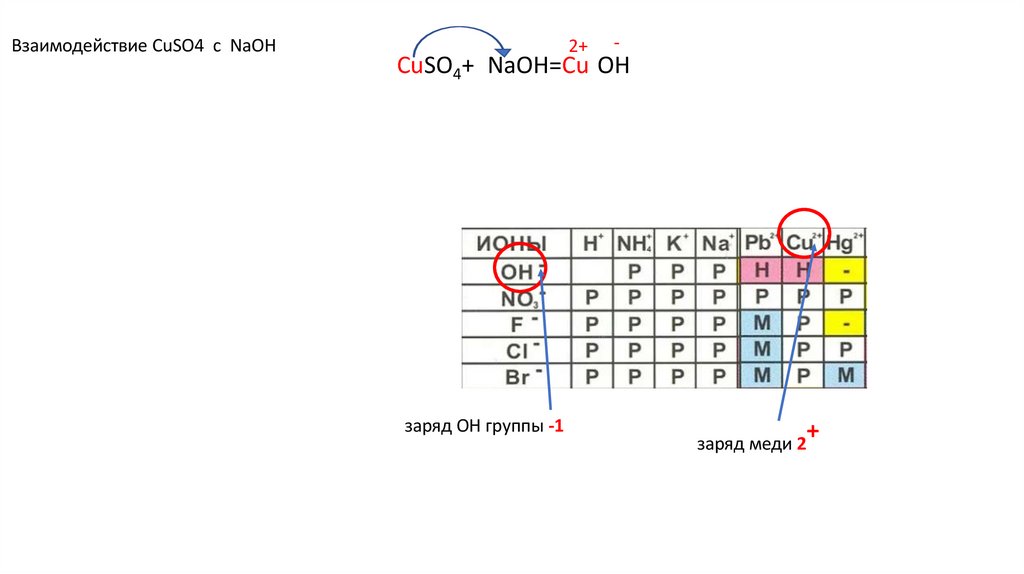
Взаимодействие CuSO4 с NaOHCuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
+
заряд меди 2
35.
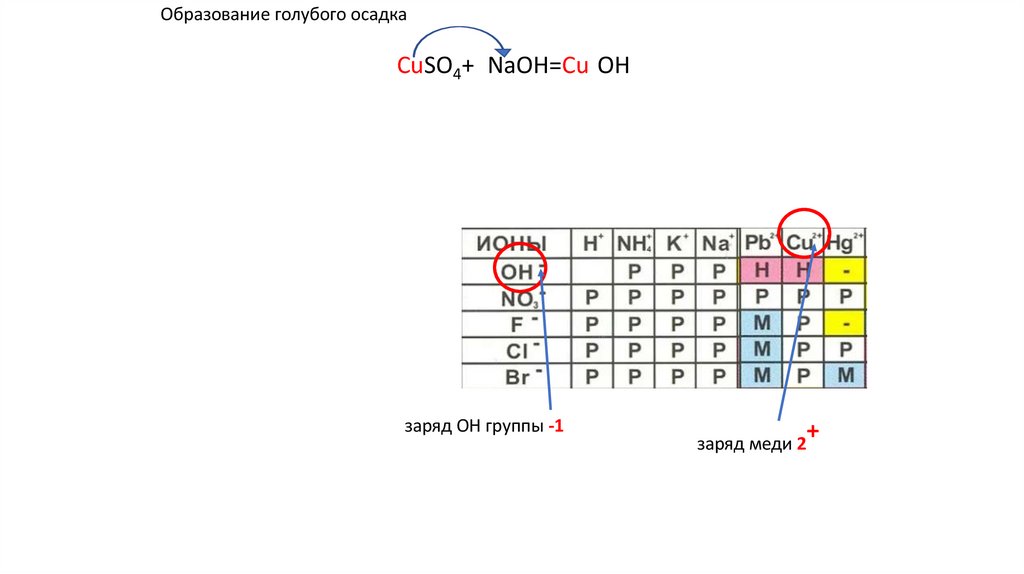
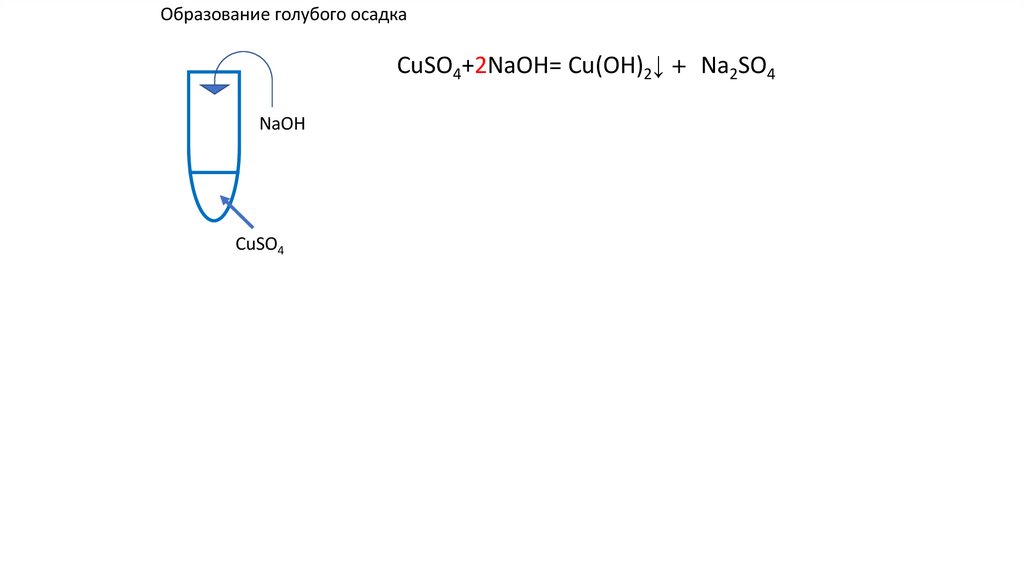
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
заряд OH группы -1
+
заряд меди 2
36.
Взаимодействие CuSO4 с NaOH2+
-
CuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
заряд OH группы -1
+
заряд меди 2
37.
Образование голубого осадка2+
-
CuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
38.
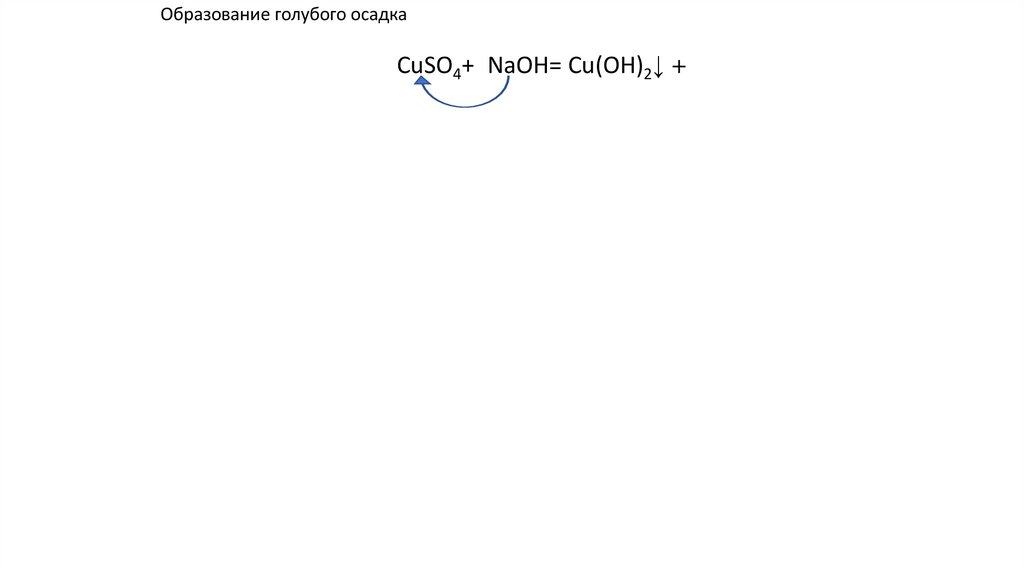
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2↓ u(OH)2+ u(OH)2+
39.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2↓ u(OH)2+ u(OH)2+
40.
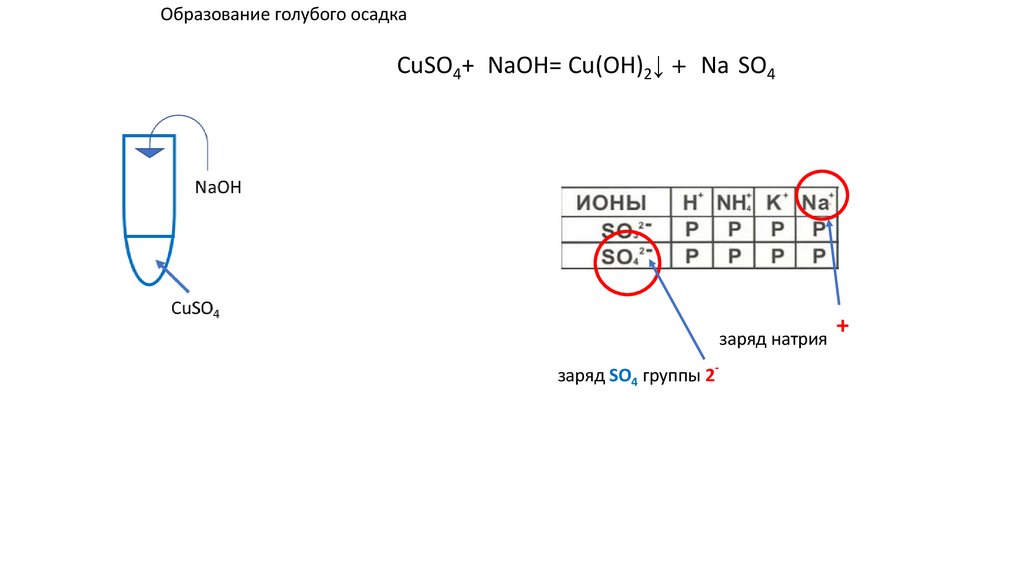
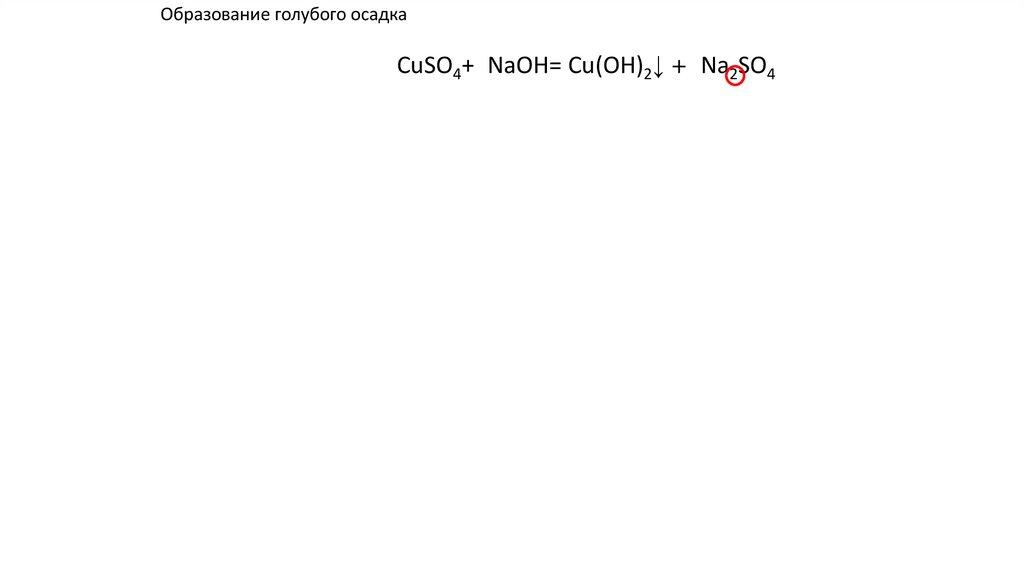
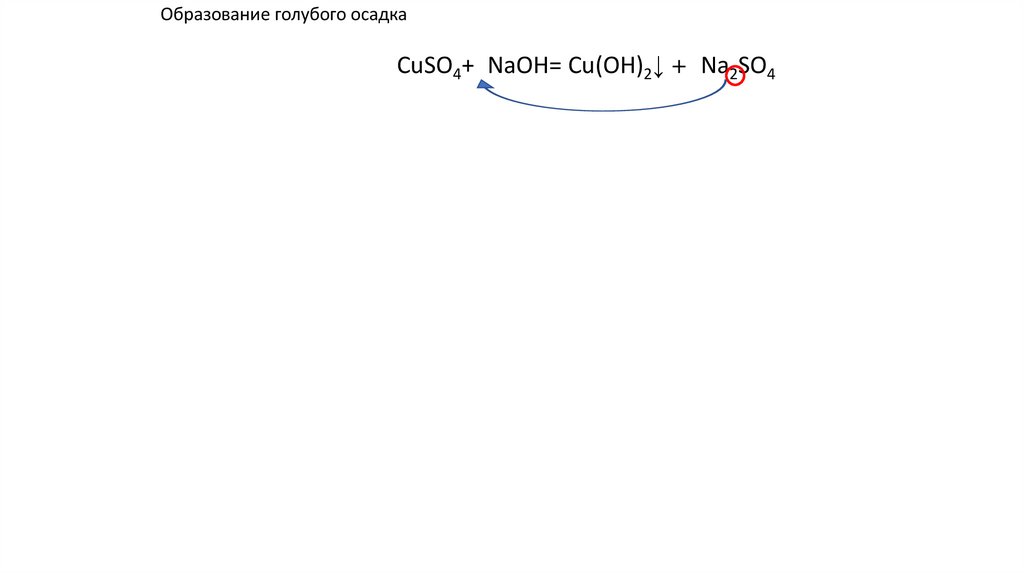
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
41.
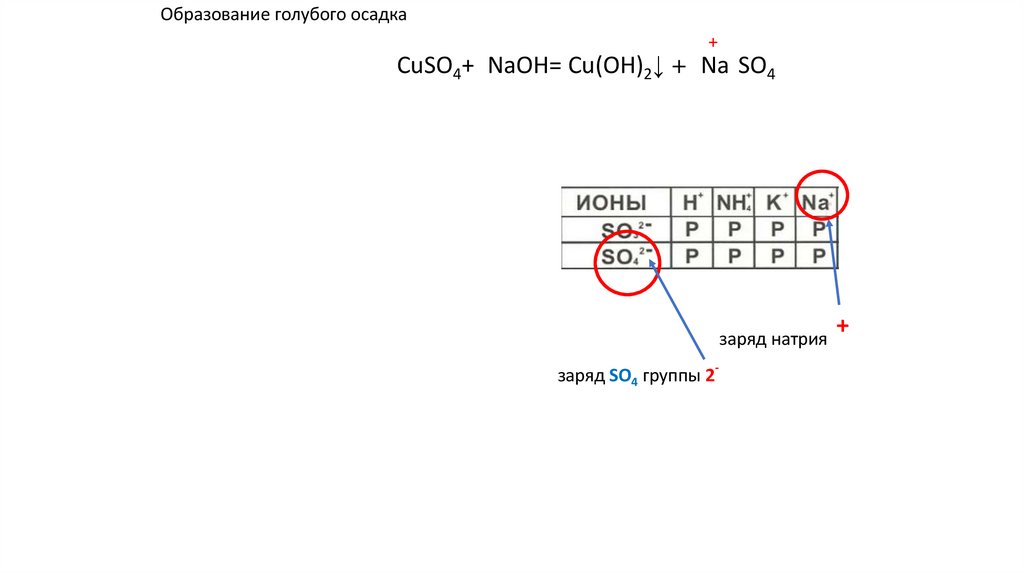
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
заряд натрия
заряд SO4 группы 2-
+
42.
Образование голубого осадка+
CuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
заряд натрия
заряд SO4 группы 2-
+
43.
Образование голубого осадка+
2-
CuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
заряд натрия
заряд SO4 группы 2-
+
44.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
45.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
46.
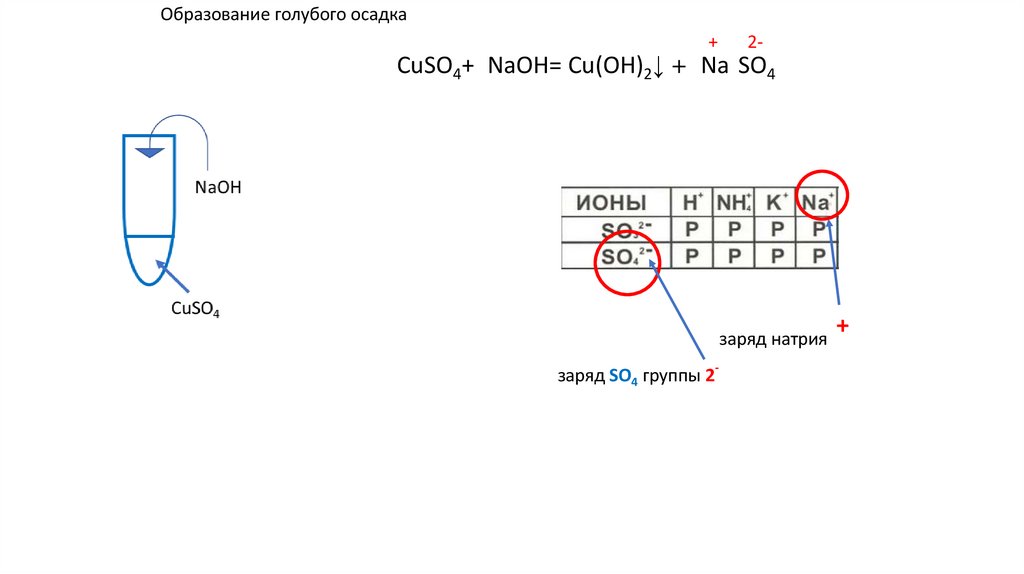
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
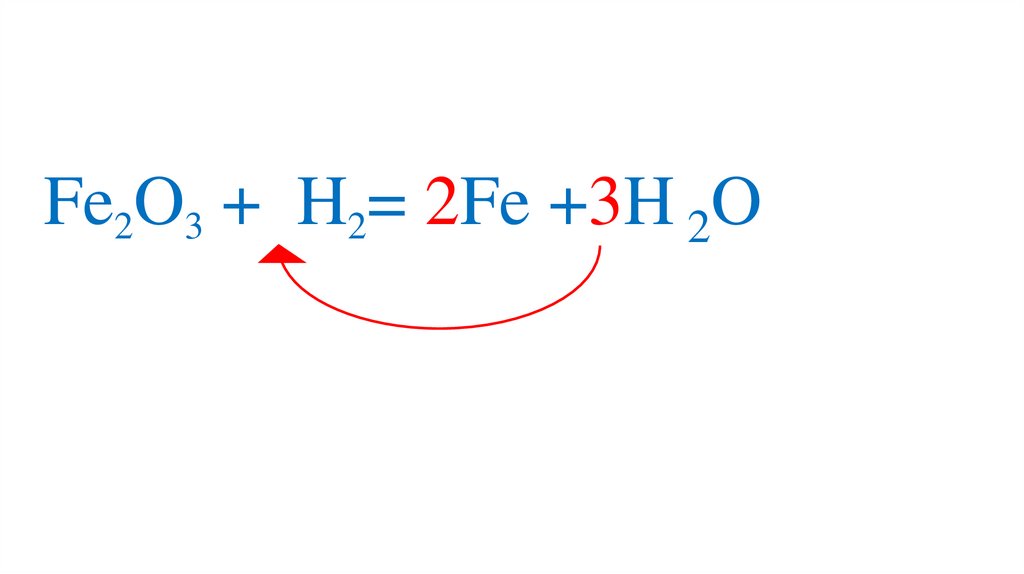
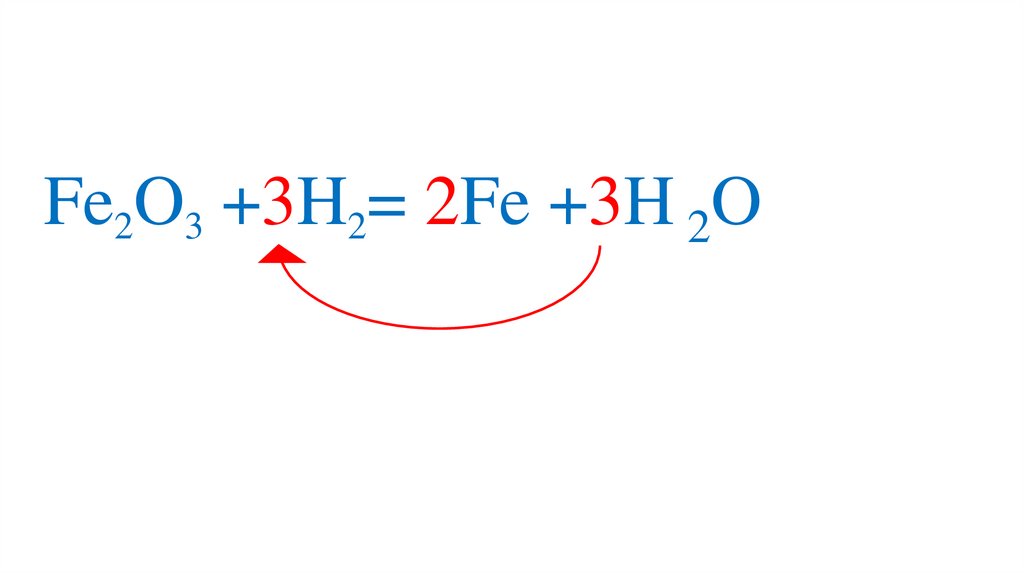
47. Взаимодействие оксида железа (III) с водородом
48.
Fe2O3 +3H2= 2Fe +3H2O49.
Fe2O3 +3H2= 2Fe +3H2O50.
Fe2O3 +3H2= 2Fe +3H2O51.
Fe2O3 +3H2= 2Fe +3H2O52.
III
Fe2O3 +3H2= 2Fe +3H 2O
53.
2I
II
Fe2O3 +3H2= 2Fe +3H 2O
54.
2I
II
Fe2O3 +3H2= 2Fe +3H 2O
55.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
56.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
57.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
58.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
59.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
60.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
61.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
62.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
63.
+-2
Fe2O3 +3H2= 2Fe +3H 2O
64. Взаимодействие хлорида меди(II) с алюминием
65.
CuCl2 + Al=66.
CuCl2 + Al=67.
CuCl2 + Al= Cu+68.
CuCl2 + Al= Cu+ AlCl69.
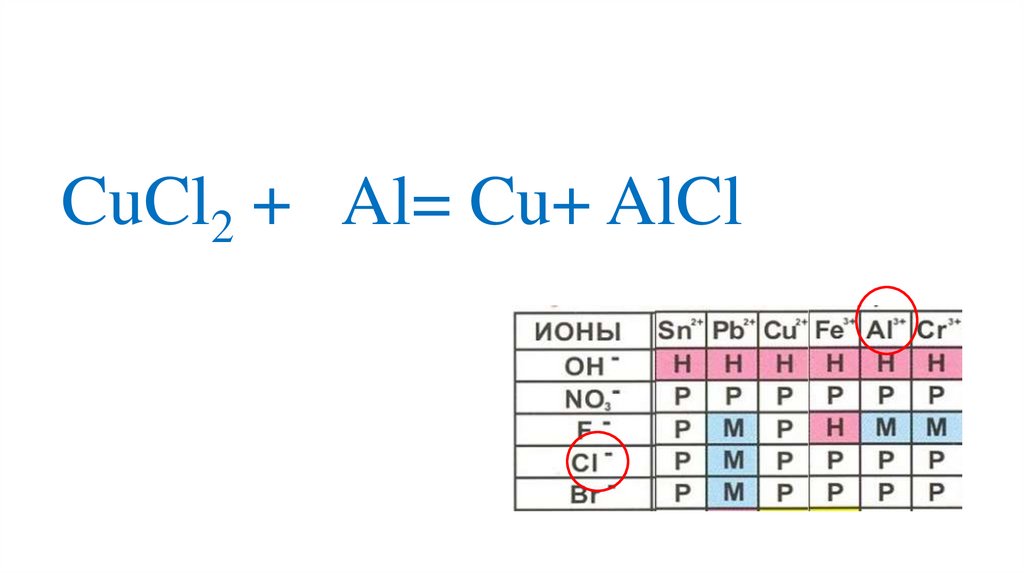
CuCl2 + Al= Cu+ AlCl70.
+3CuCl2 + Al= Cu+ Al Cl
-
В соединениях заряды пишут так, чтобы плюс и минус был
перед цифрой-это связанные ионы
71.
3+3
CuCl2 + Al= Cu+ Al Cl
-
72.
3+
CuCl2 + Al= Cu+ Al Cl3
-
73.
CuCl2 + Al= Cu + AlCl374.
CuCl2 + Al= Cu+ AlCl375.
6CuCl2 + Al= Cu+ AlCl3
76.
63CuCl2 +
Al= Cu+ AlCl3
77.
63CuCl2 +
Al= Cu+2AlCl3
78.
3CuCl2 + Al= Cu+2AlCl379.
3CuCl2 + Al= Cu+2AlCl380.
3CuCl2 + 2Al= Cu+2AlCl381.
3CuCl2 + 2Al= Cu+2AlCl382.
3CuCl2 + 2Al= 3Cu+2AlCl33
83.
3CuCl2 + 2Al= Cu+2AlCl3Проверяем количество каждого элемента в правой
и левой частях уравнения
84.
3CuCl2 + 2Al= 3Cu+2AlCl33
85.
3CuCl2 + 2Al= 3Cu+2AlCl36
86.
3CuCl2 + 2Al= 3Cu+2AlCl36
6
87.
3CuCl2 + 2Al= 3Cu+2AlCl388.
3CuCl2 + 2Al= 3Cu+ 2AlCl389.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
90.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
91.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
92.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
93.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
94.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
95.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
96.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
4
97.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
4
3
98.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
99.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
Умножаем все
уравнение на 2
100.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
2С2Н6 + 3,5О2=2СО2+3Н2О
Умножаем все
уравнение на 2
101.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
2С2Н6 + 7О2=2СО2+3Н2О
Умножаем все
уравнение на 2
102.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
2С2Н6 + 7О2=4СО2+3Н2О
Умножаем все
уравнение на 2
103.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
2С2Н6 + 7О2=4СО2+6Н2О
104.
Составить уравнение реакции горения этанаС2Н6 + 3,5О2=2СО2+3Н2О
2С2Н6 + 7О2=4СО2+6Н2О
105.
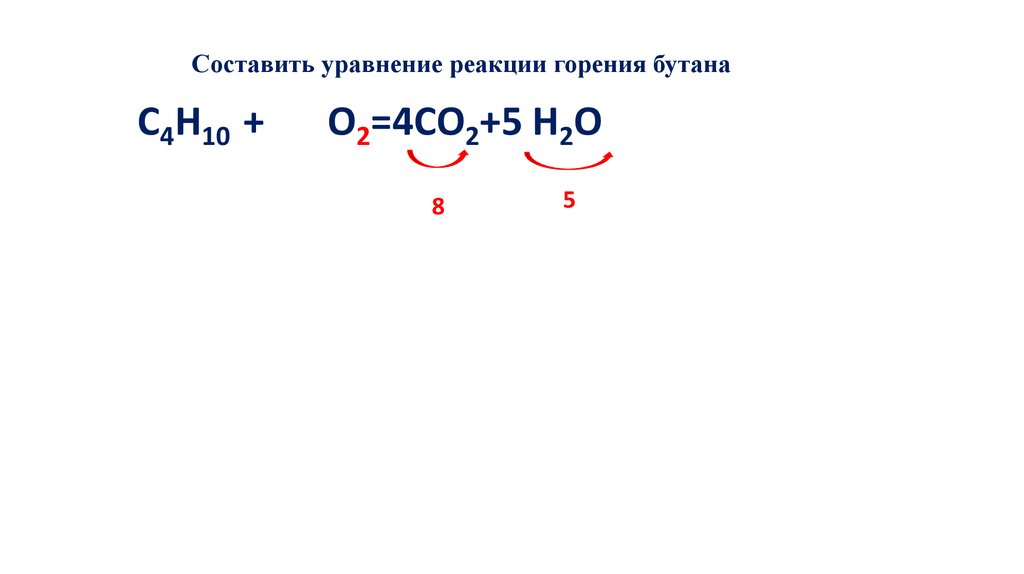
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=8СО2+10 Н2О
106.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=8СО2+10 Н2О
107.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=8СО2+10 Н2О
108.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=8СО2+10 Н2О
109.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+10 Н2О
110.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+10 Н2О
111.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+5 Н2О
112.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+5 Н2О
113.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+5 Н2О
8
114.
Составить уравнение реакции горения бутанаС4Н10 + 13 О2=4СО2+5 Н2О
8
5
115.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
8
5
116.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
Умножаем все
уравнение на 2
117.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
2С4Н10 + 6,5 О2=4СО2+5 Н2О
Умножаем все
уравнение на 2
118.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
2С4Н10 + 13 О2=4СО2+5 Н2О
Умножаем все
уравнение на 2
119.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
2С4Н10 + 13 О2=8СО2+5 Н2О
Умножаем все
уравнение на 2
120.
Составить уравнение реакции горения бутанаС4Н10 + 6,5 О2=4СО2+5 Н2О
2С4Н10 + 13 О2=8СО2+10 Н2О
Умножаем все
уравнение на 2
121.
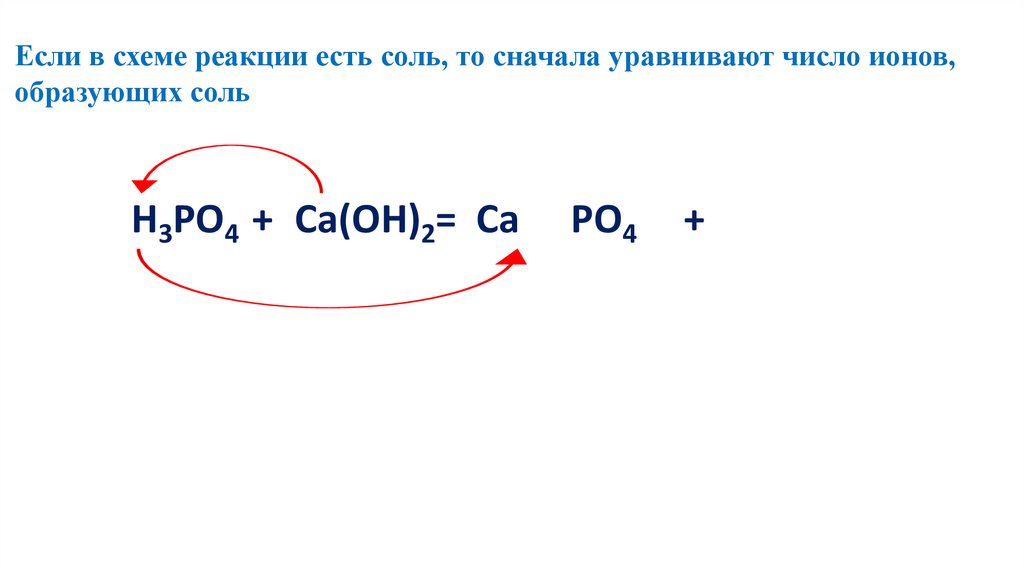
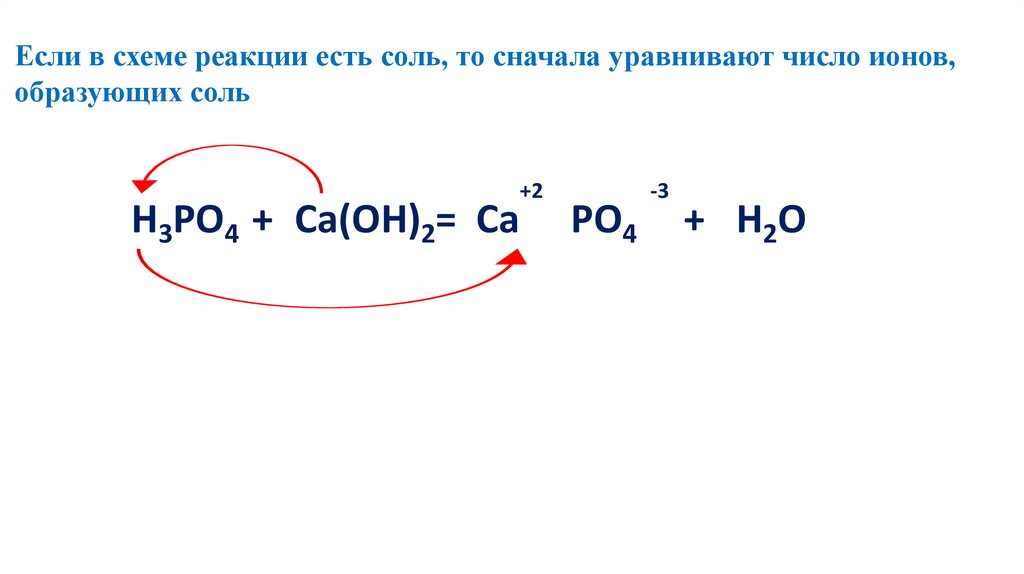
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
2 2Н3РО4 3+3Са(ОН)2=Са3(РО4)2+ 6H
6 2O
122.
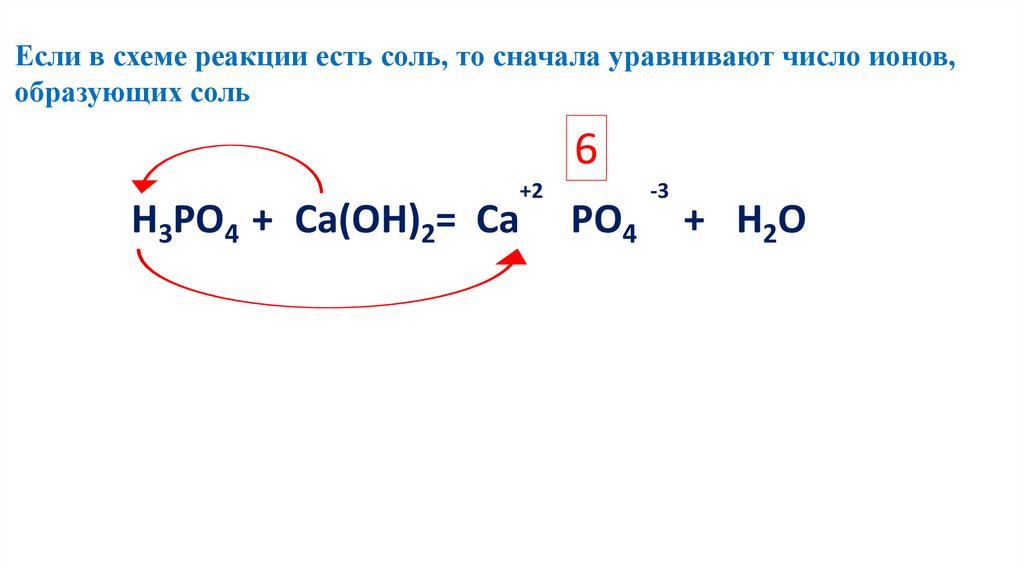
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
2 2Н3РО4 3+3Са(ОН)2=Са3(РО4)2+ 6H
6 2O
123.
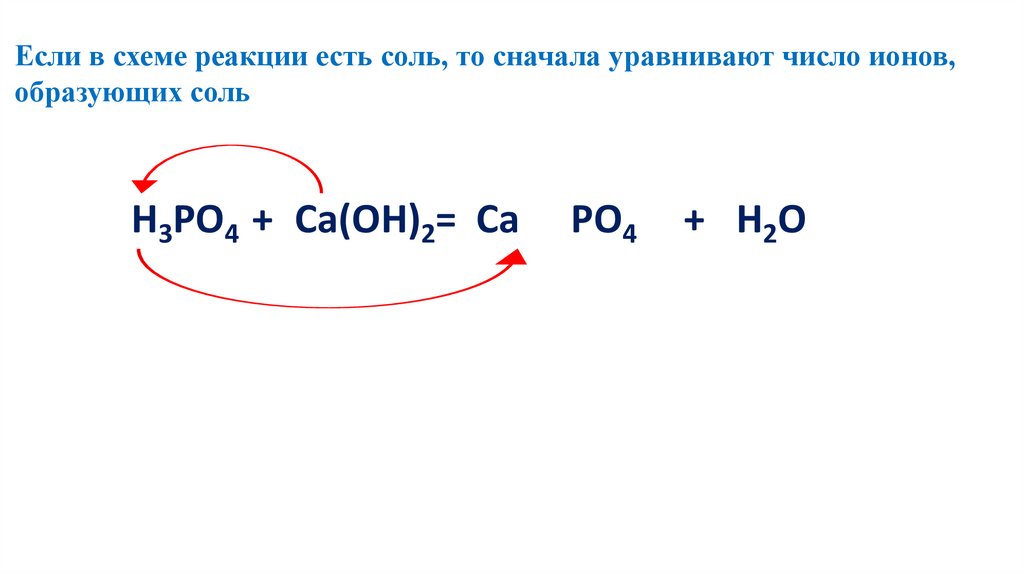
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+
6H2O
124.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
125.
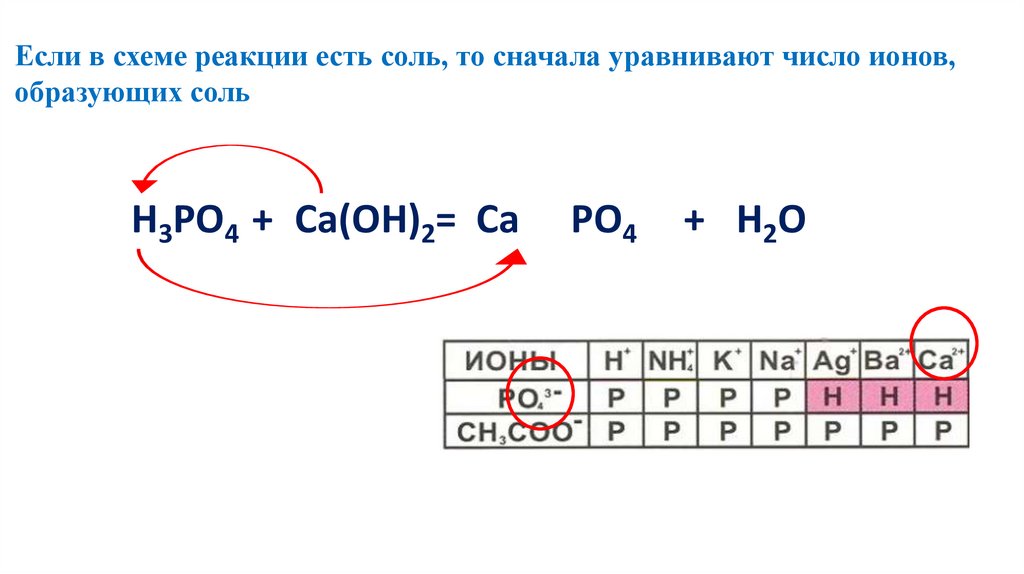
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
126.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
127.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
6
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
128.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
6
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
129.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
6
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
130.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
131.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
132.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
133.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
134.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
135.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
136.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
6
137.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
6
6
138.
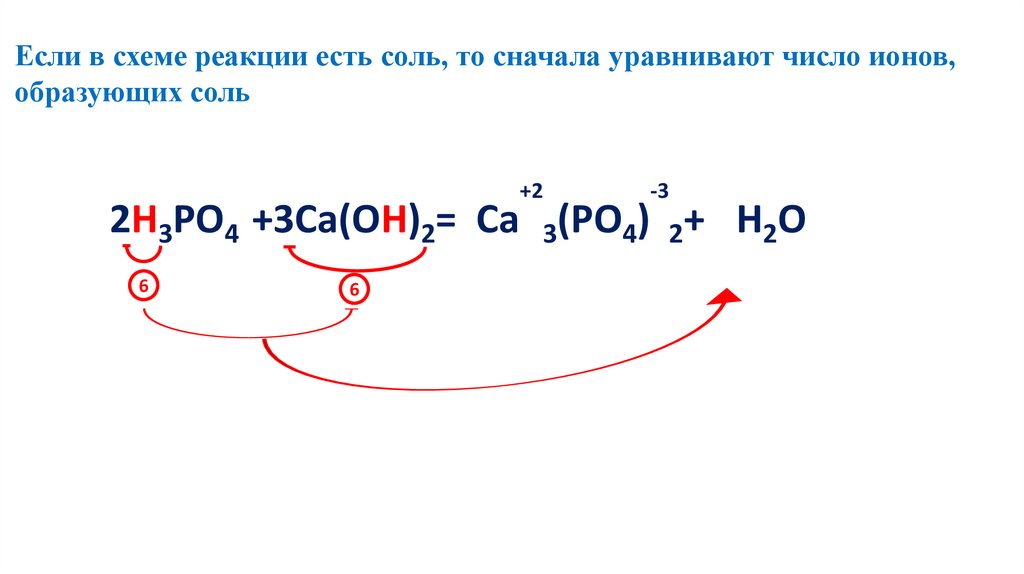
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
6
6
139.
Если в схеме реакции есть соль, то сначала уравнивают число ионов,образующих соль
+2
-3
2 2Н3РО4 3+3Са(ОН)2= Са 3(РО4) 26+ 6H2O
140.
III. Систематизация пройденного материалаIV. Подведение итогов
В чем заключается сущность химической реакции?
Э-4.Домашнее задание: § 10, выполнить задания № 1-4 после
§ 10
















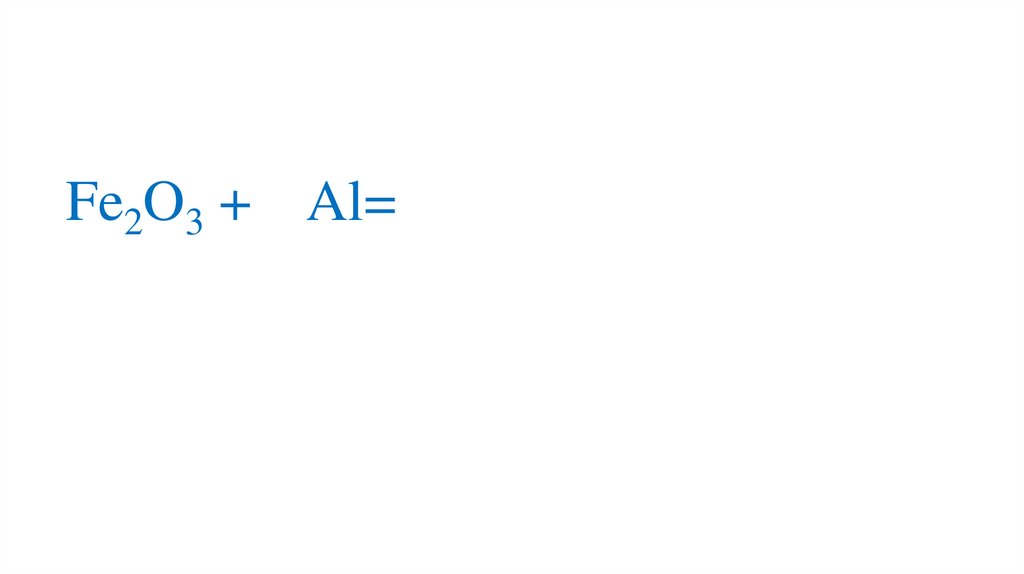
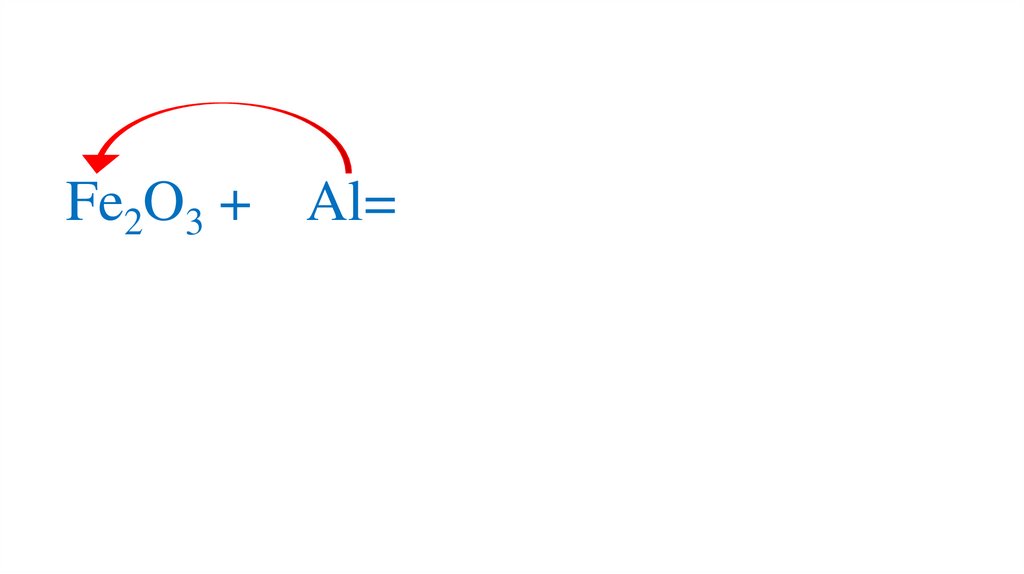
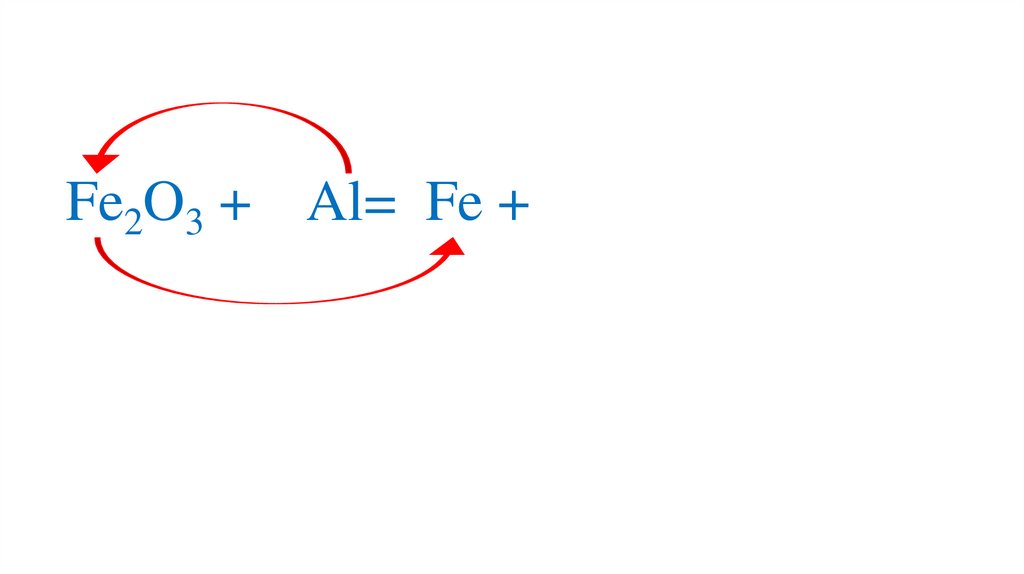
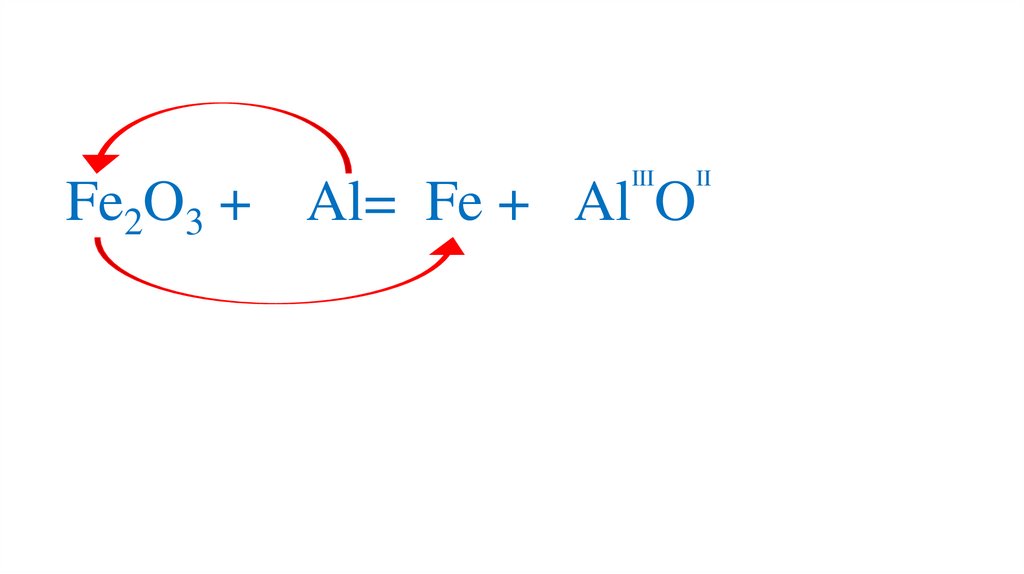



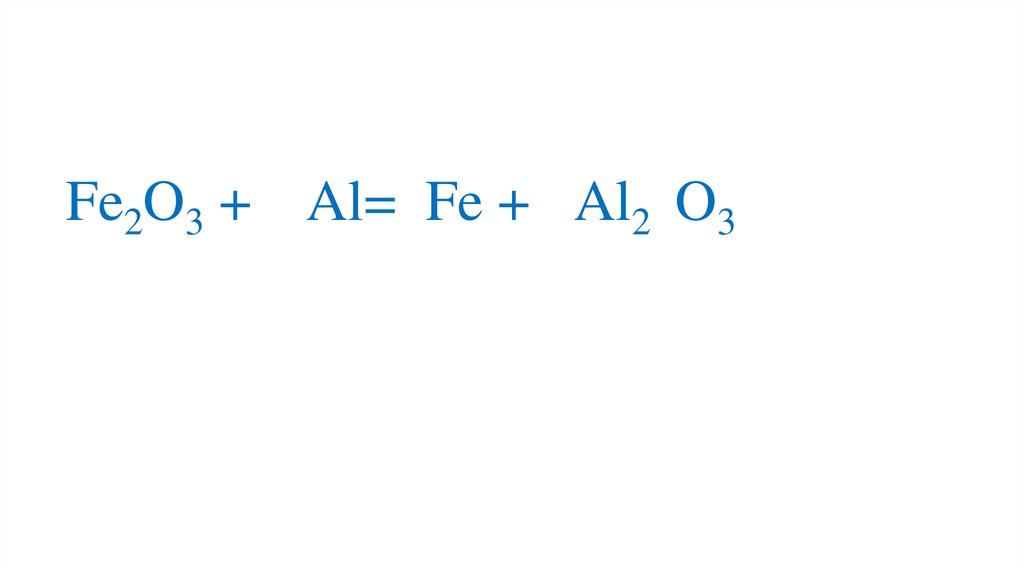
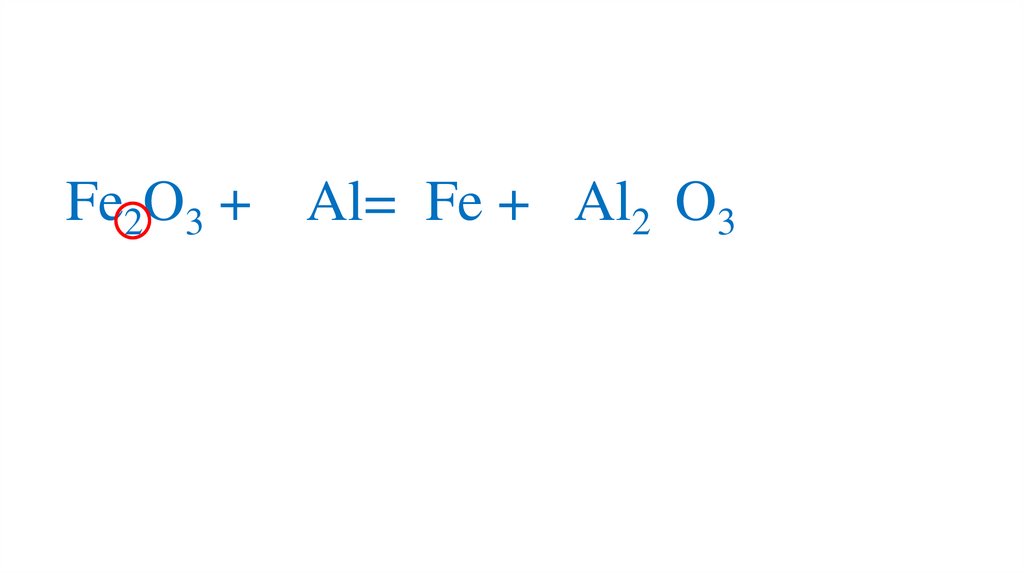
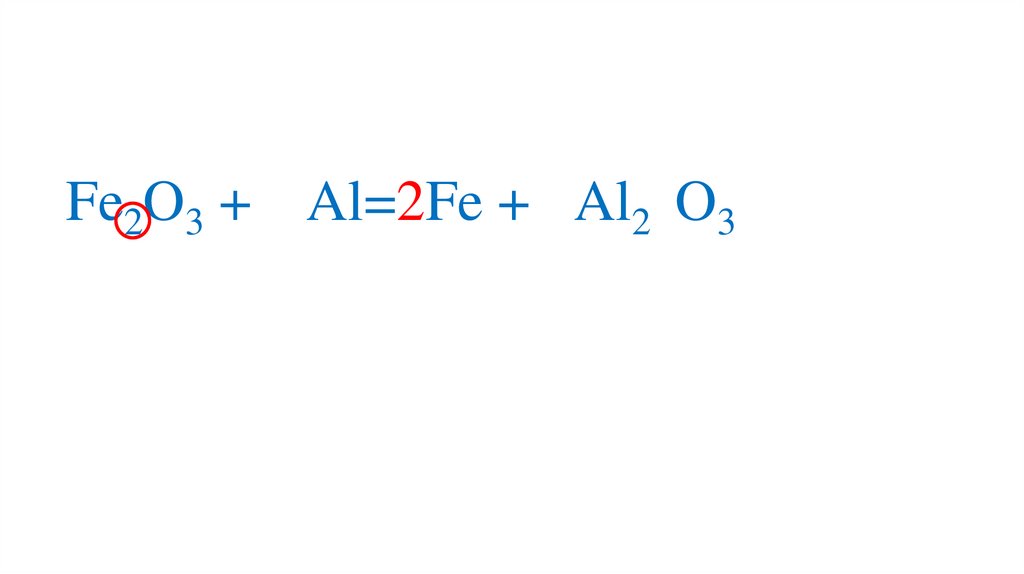
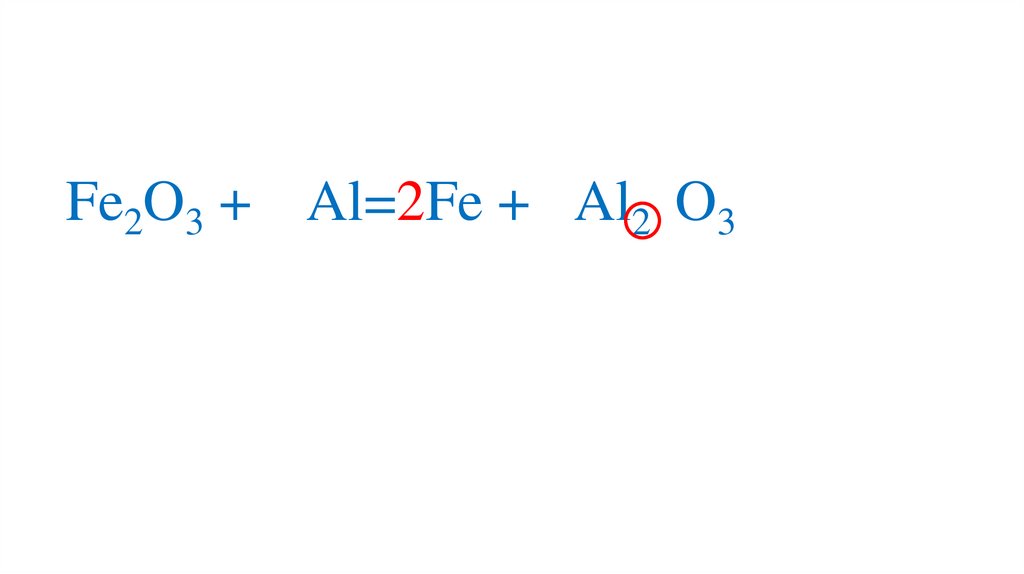
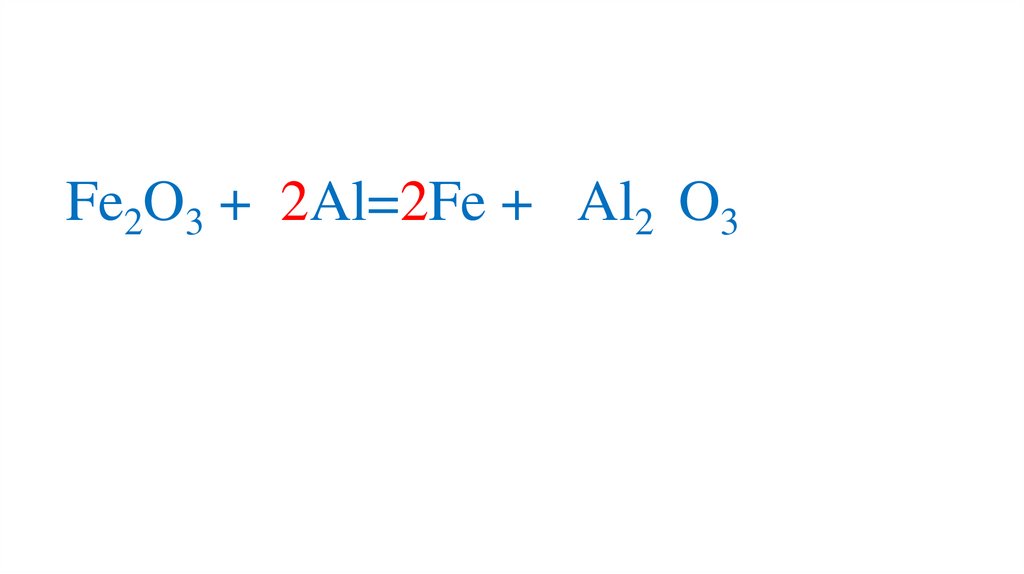
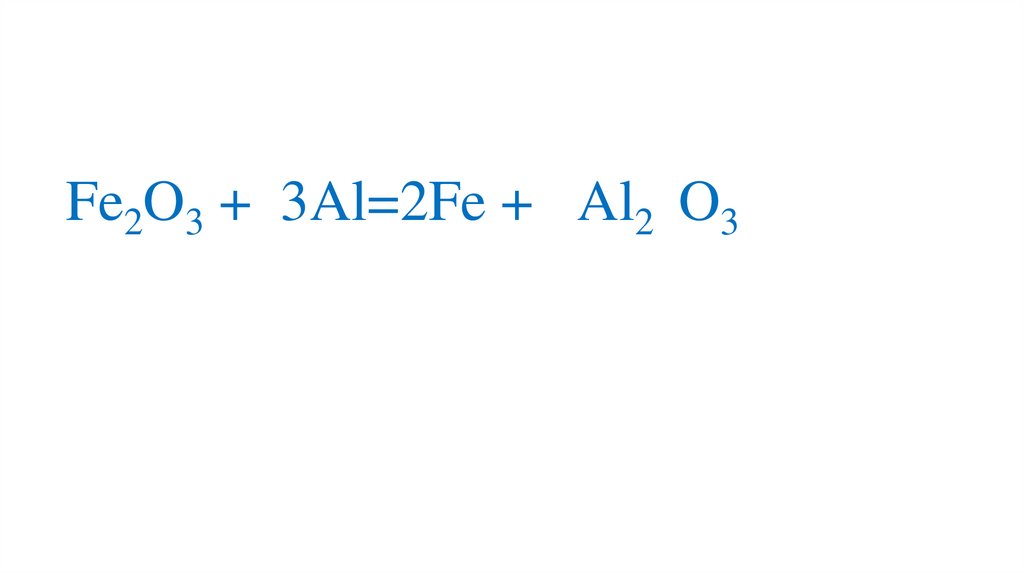



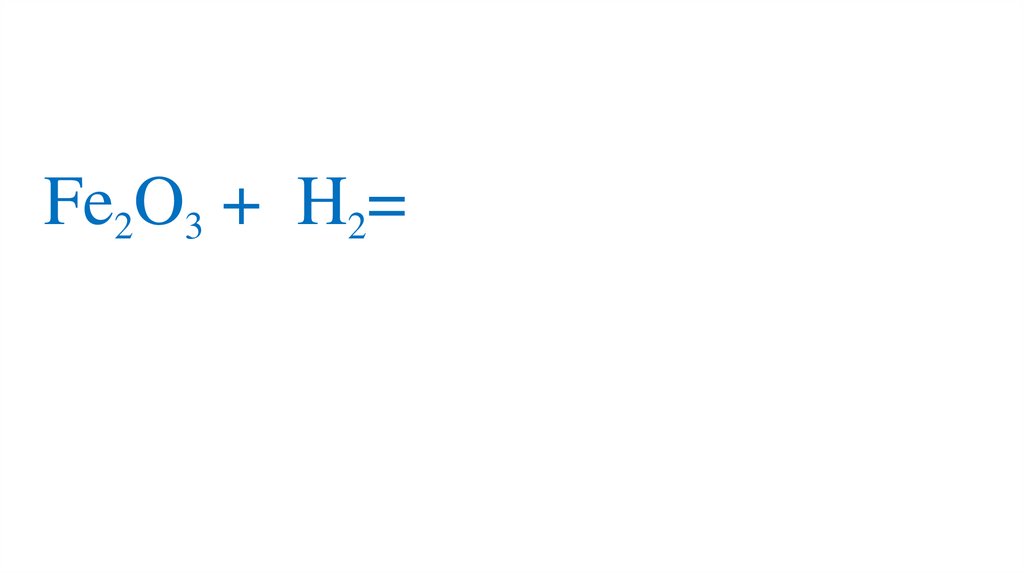
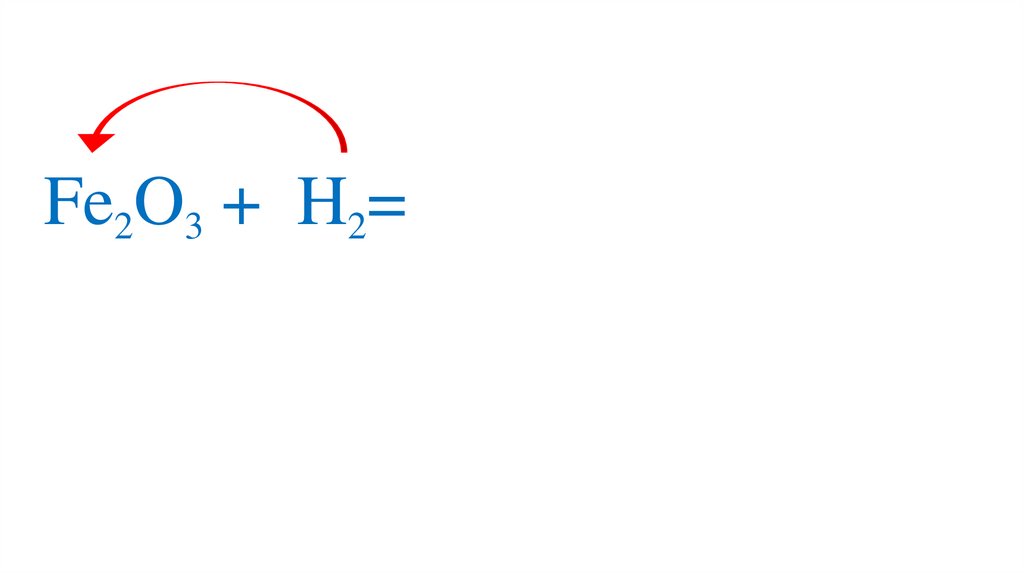
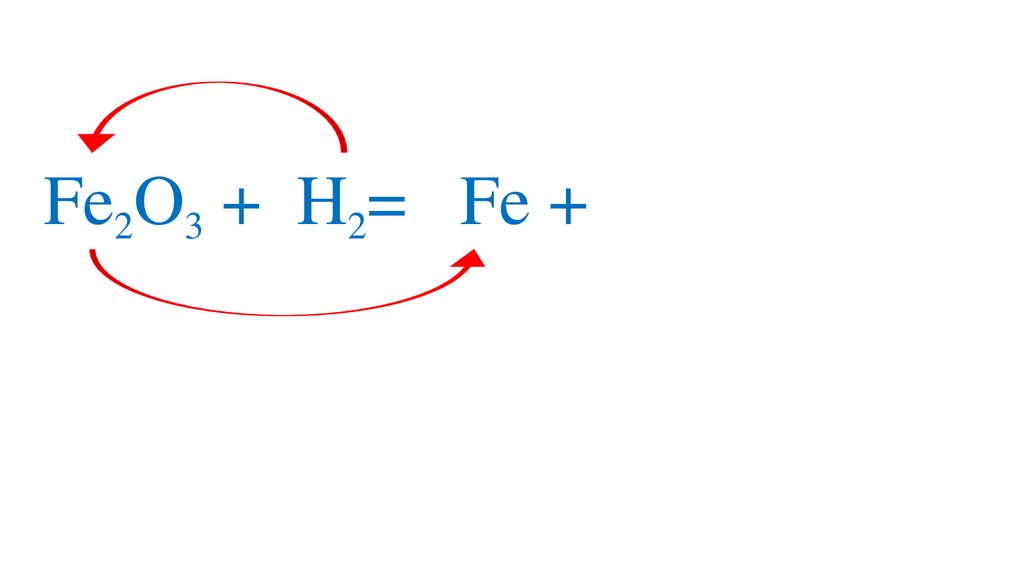
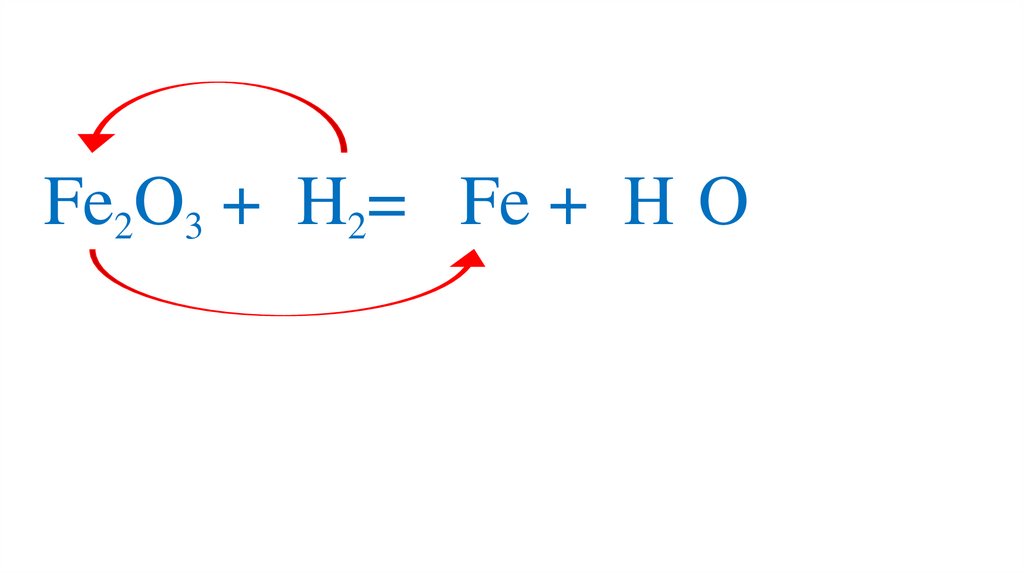
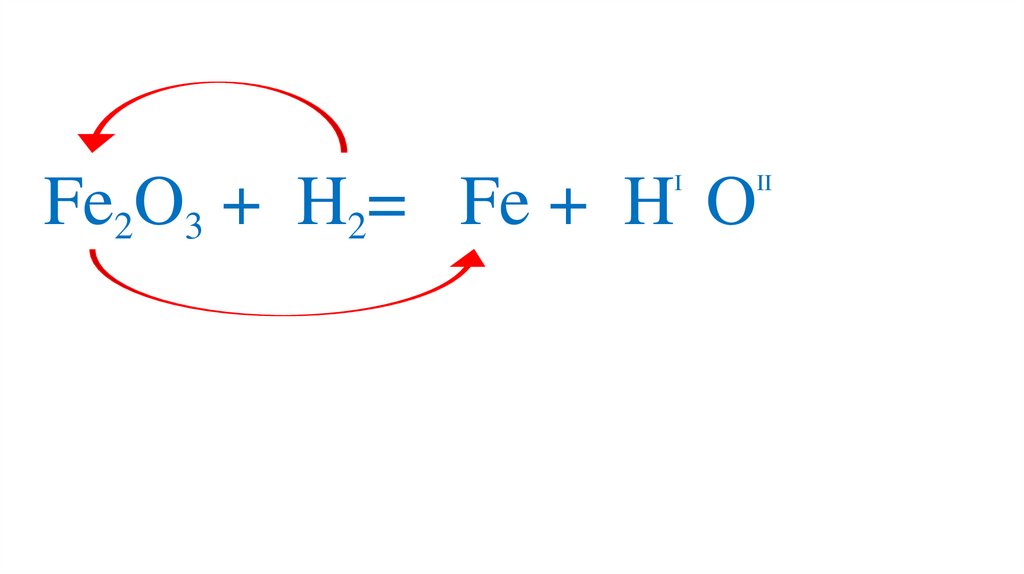
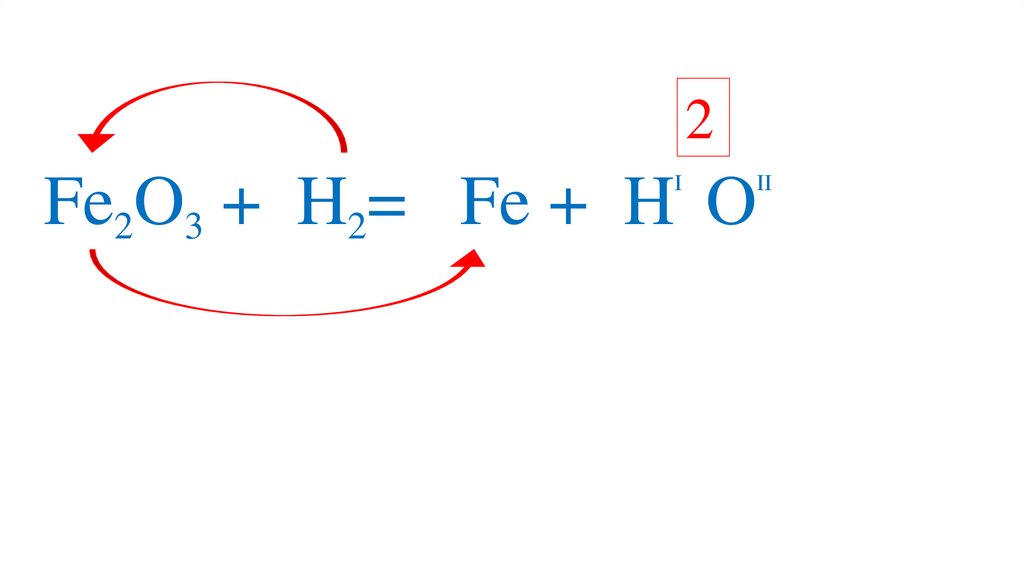
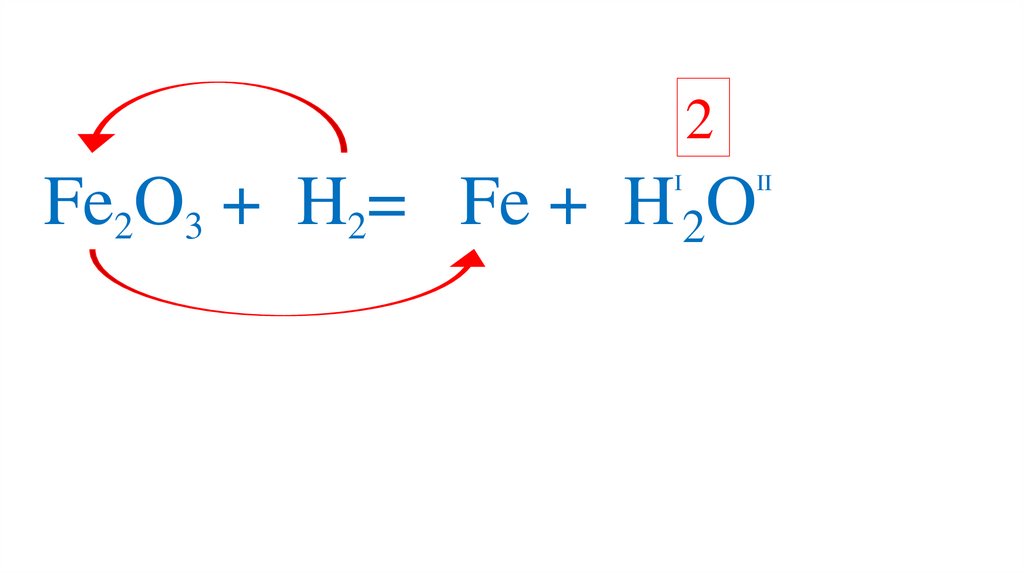
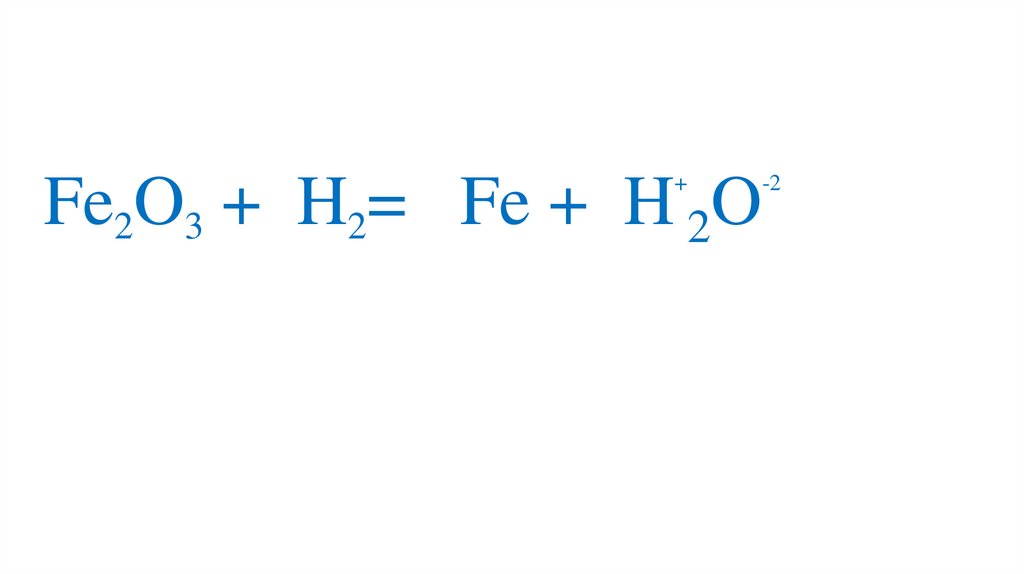
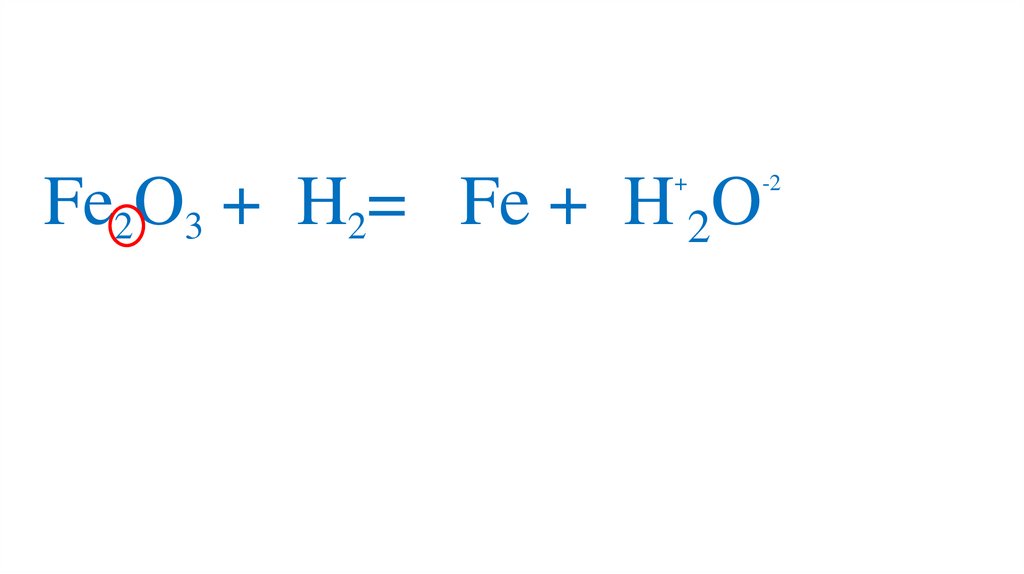
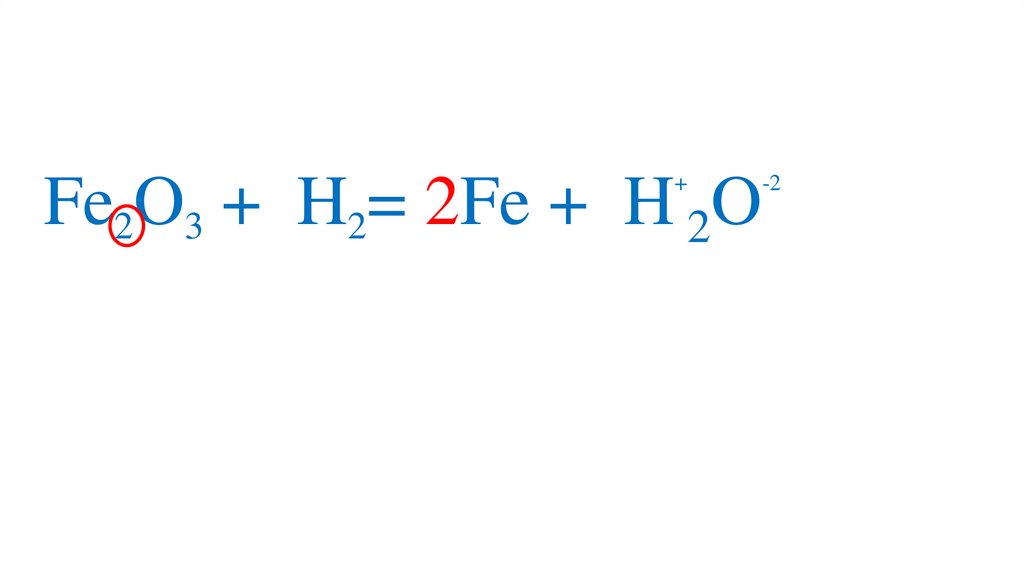
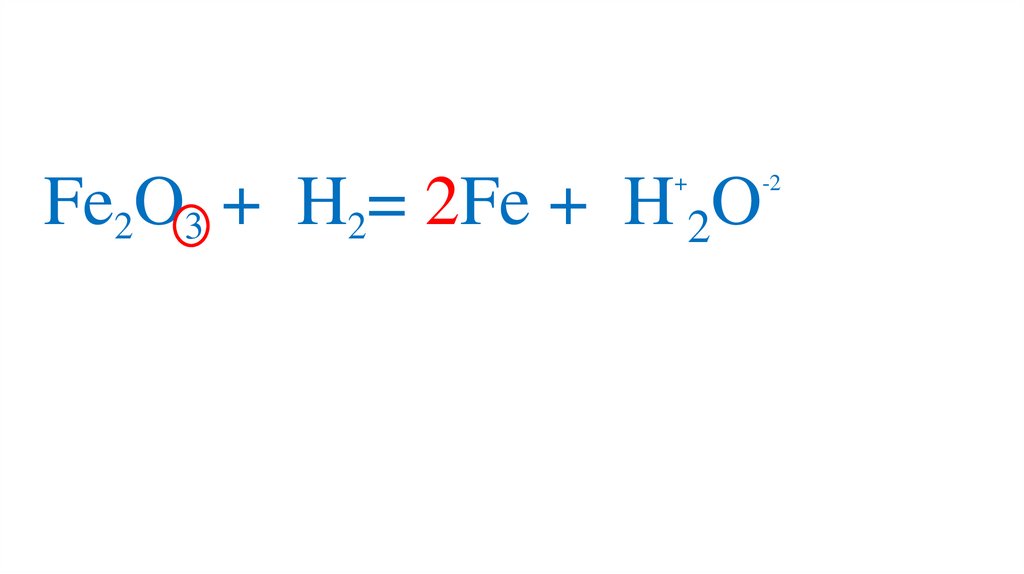
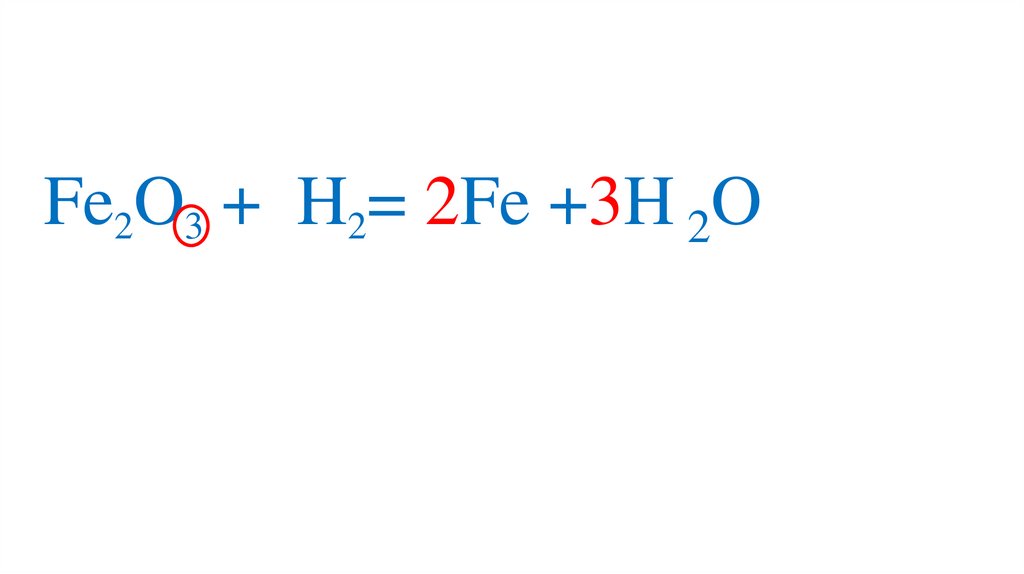
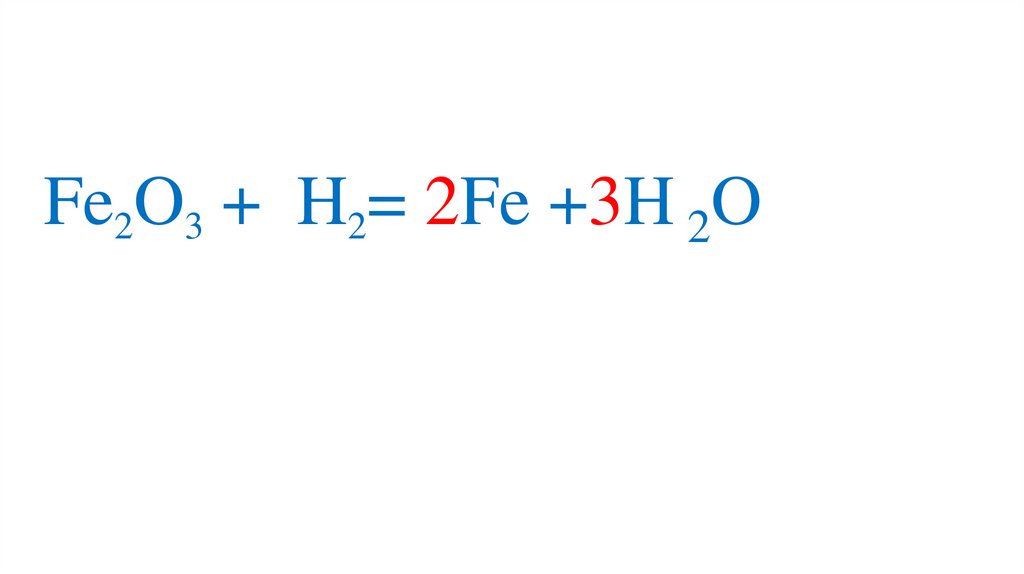
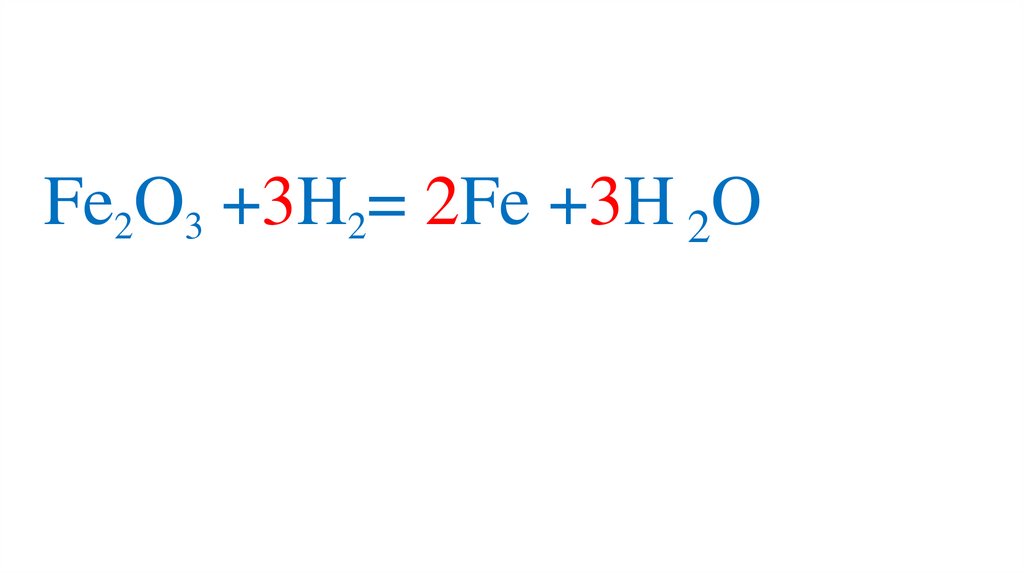

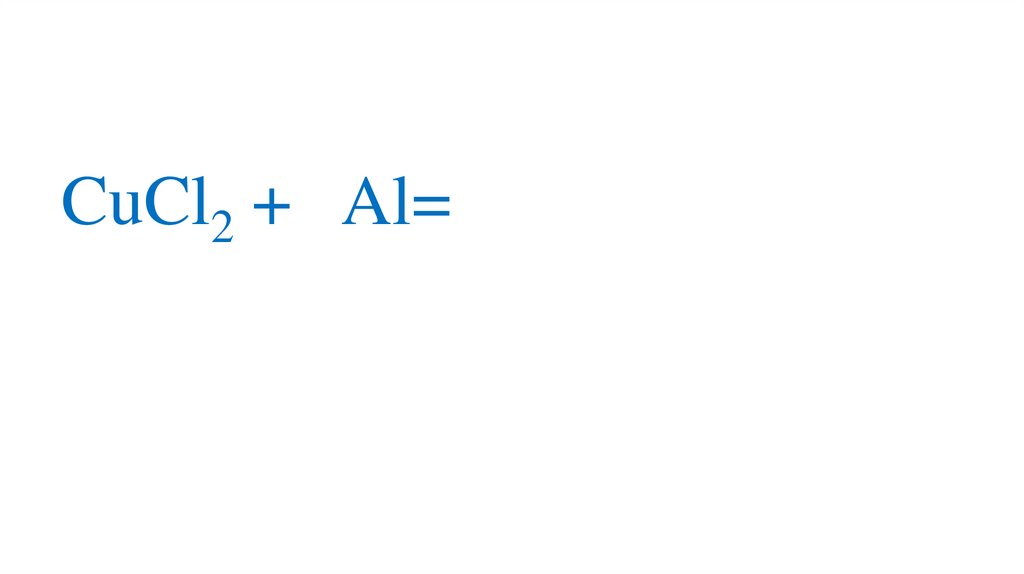
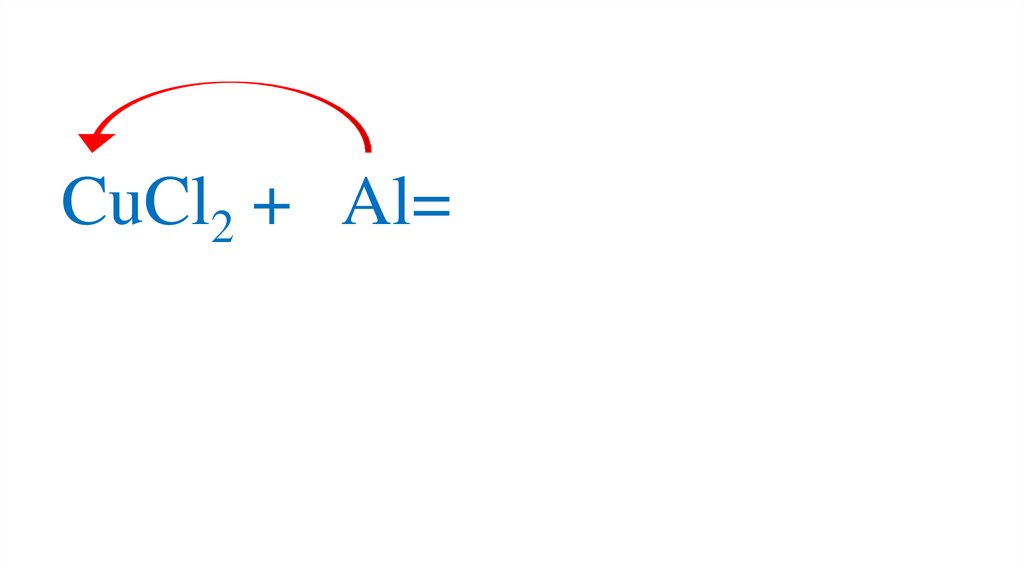
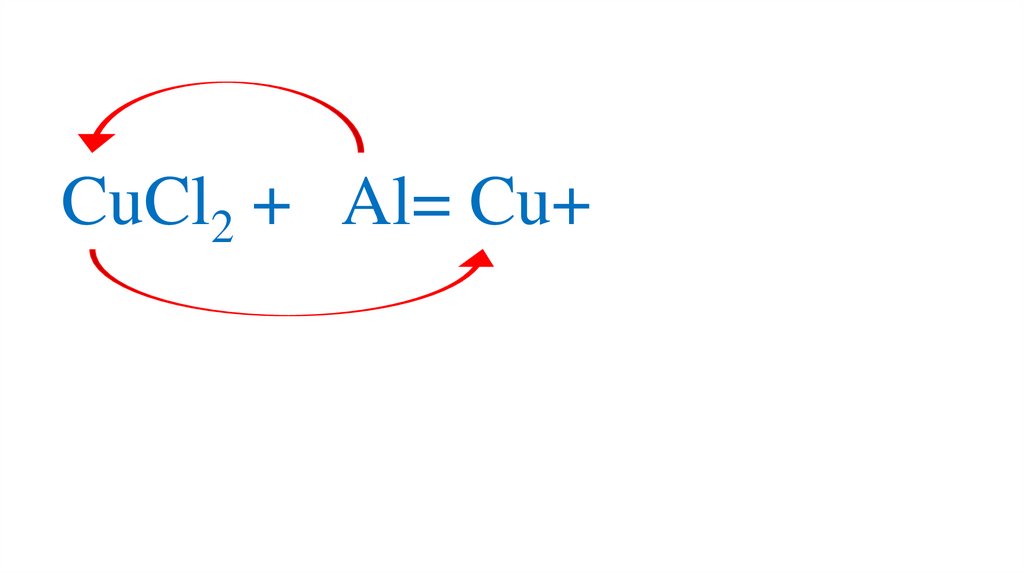
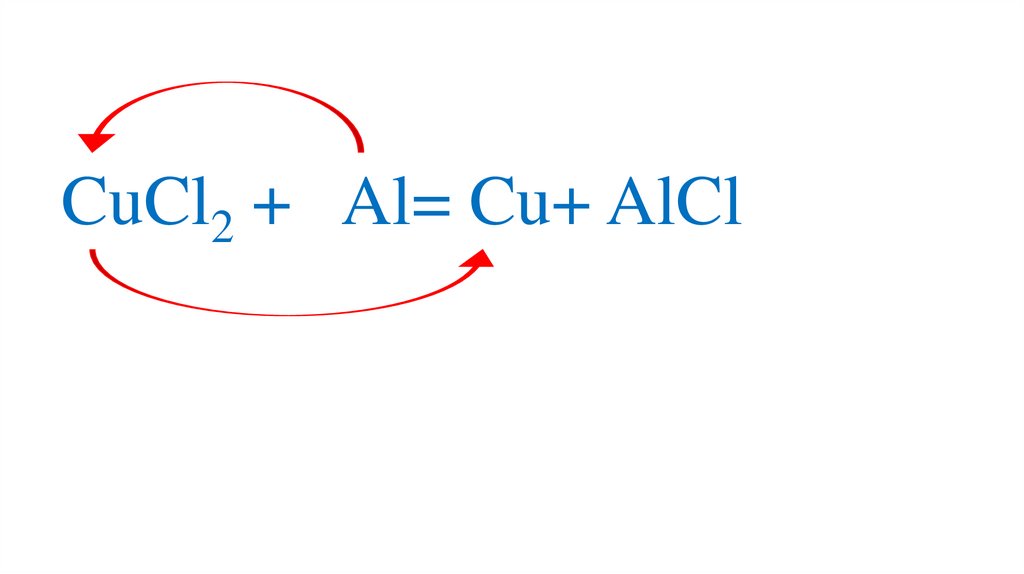
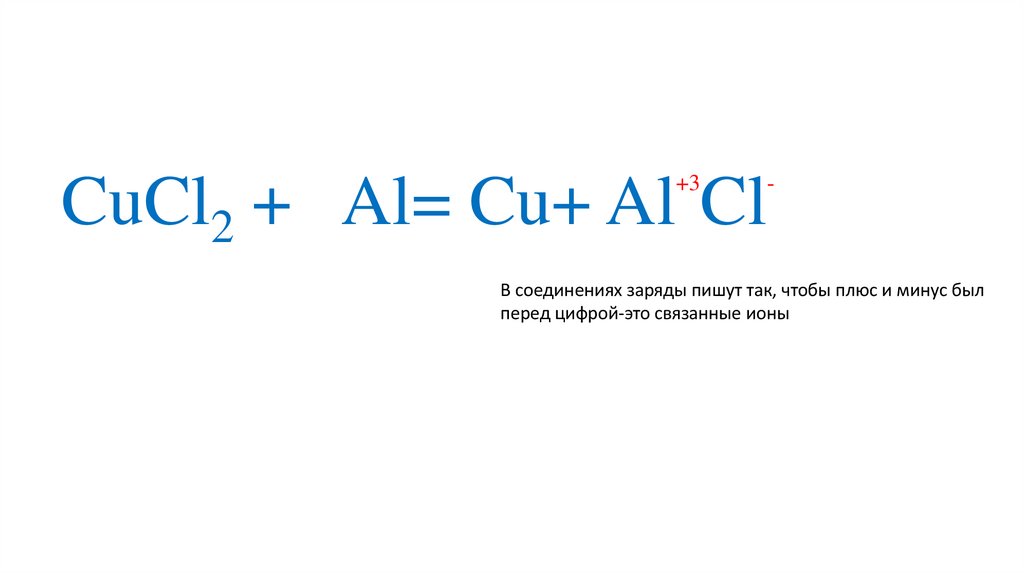
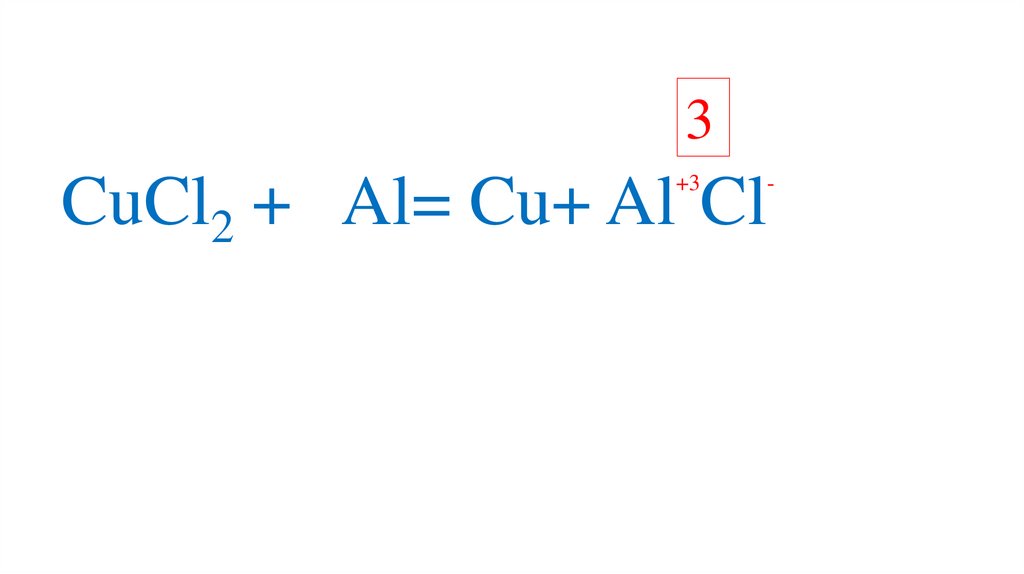
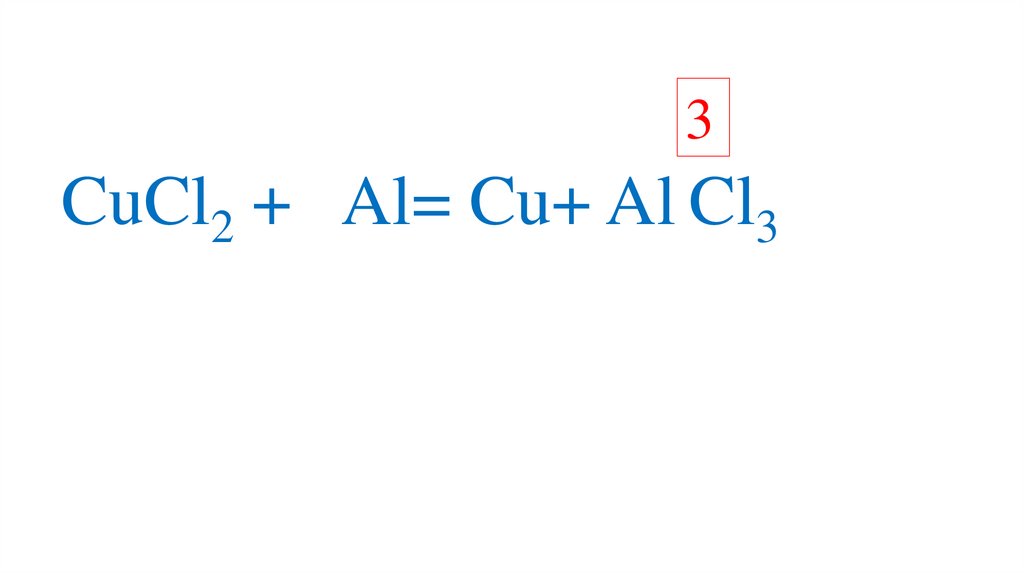
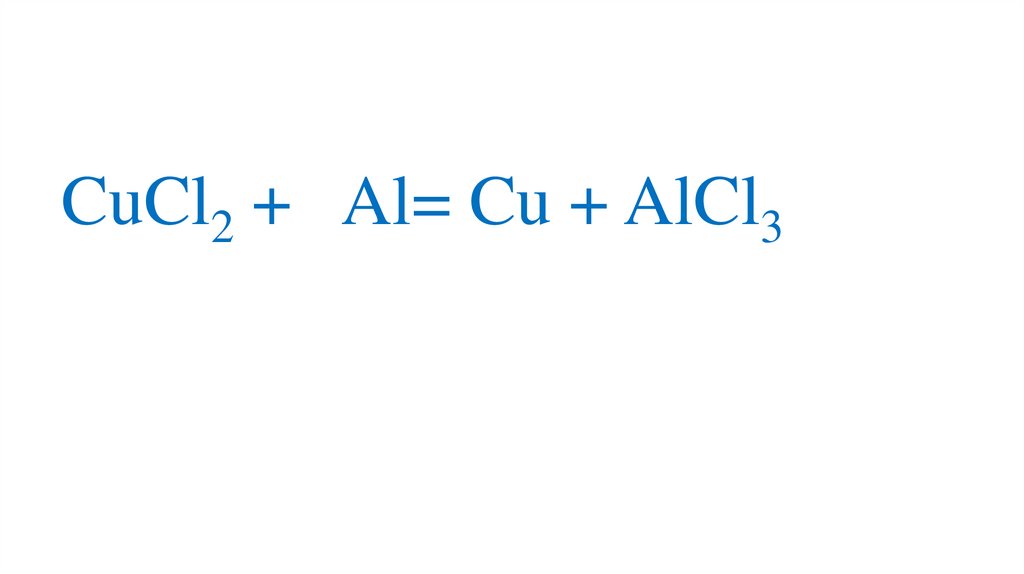
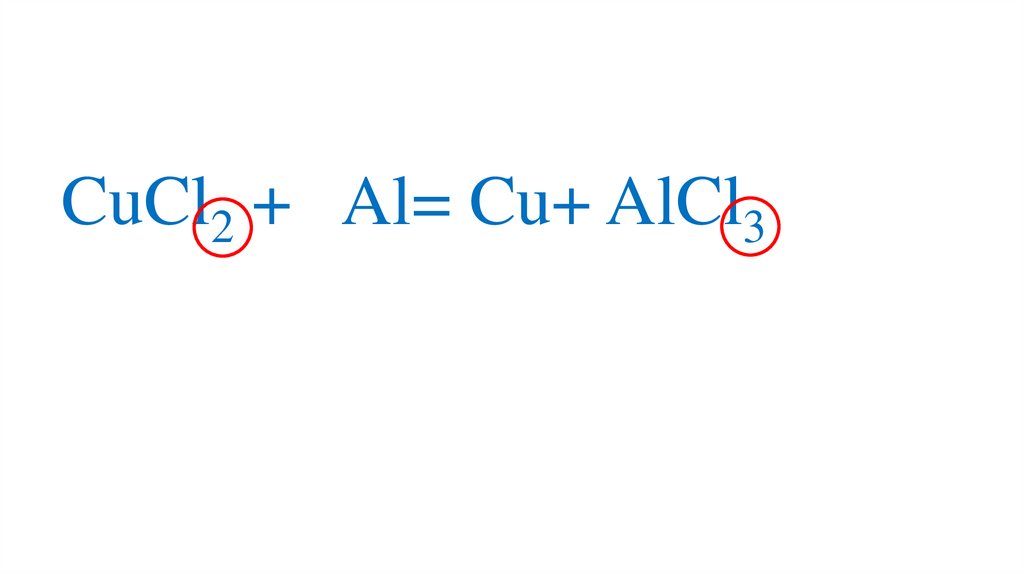
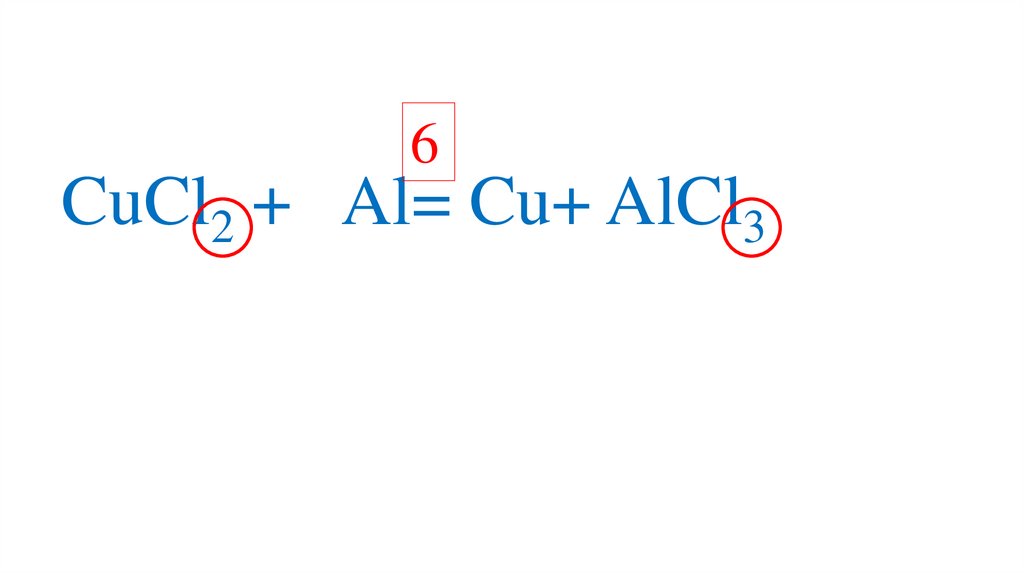
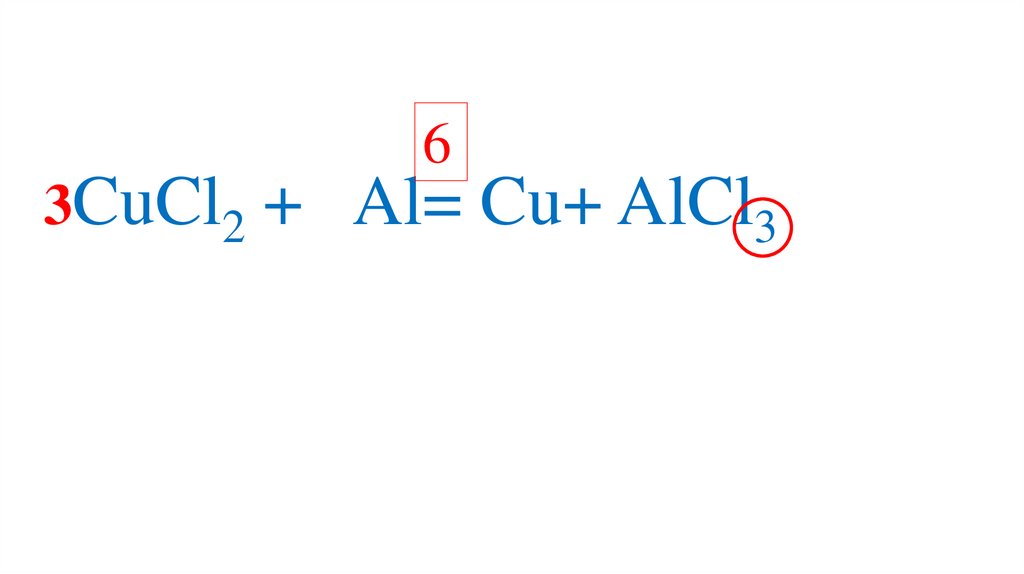
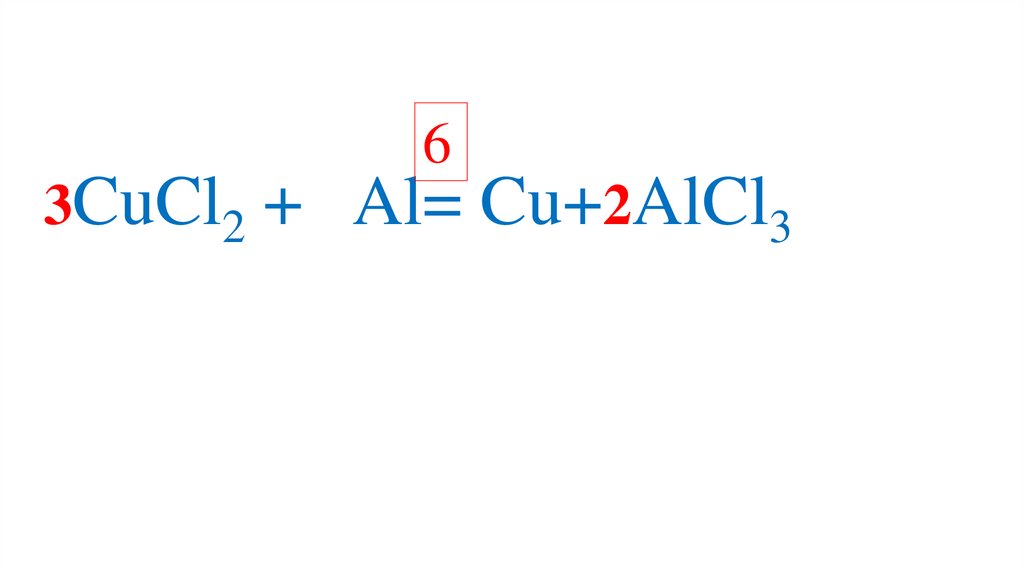
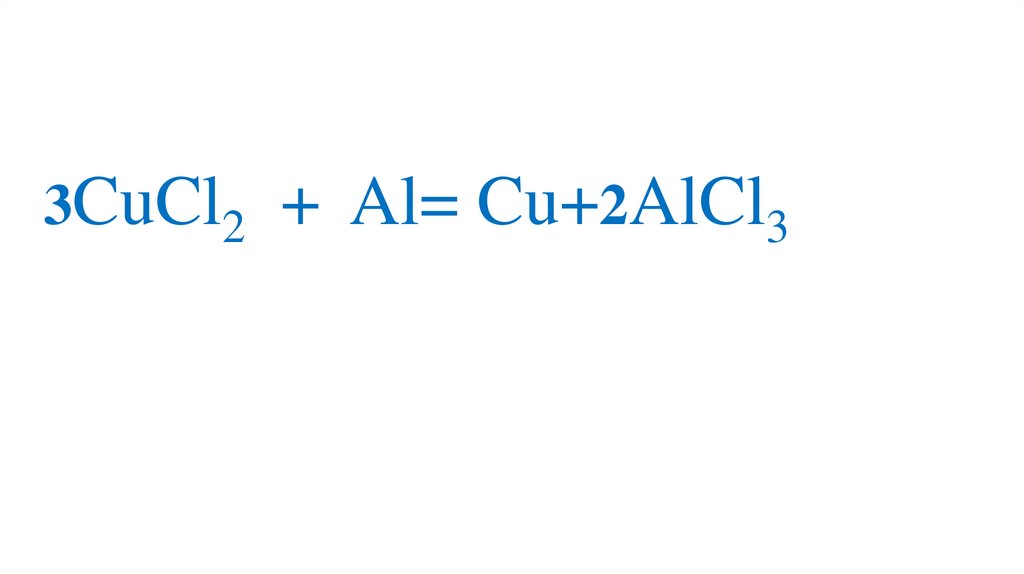
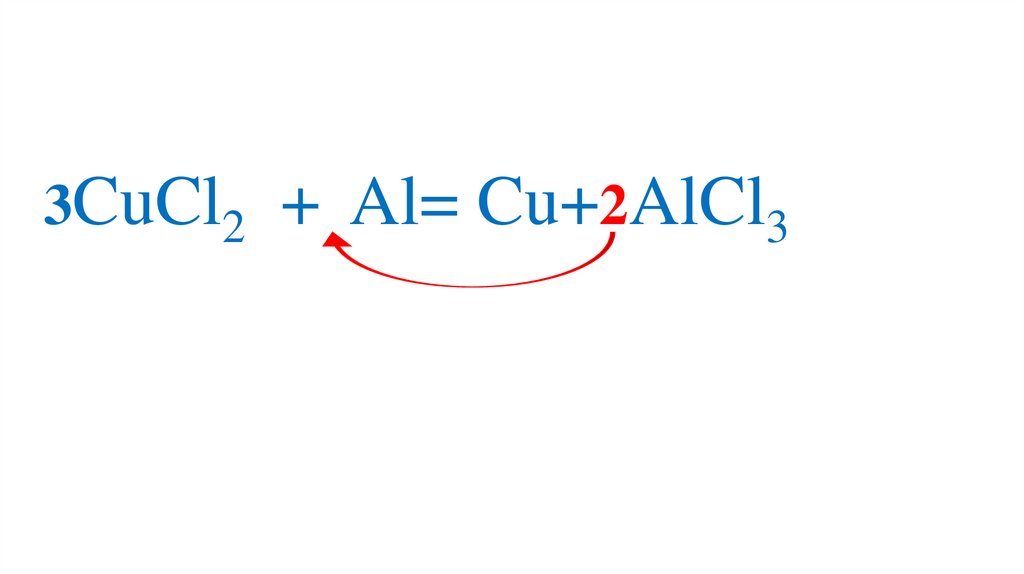
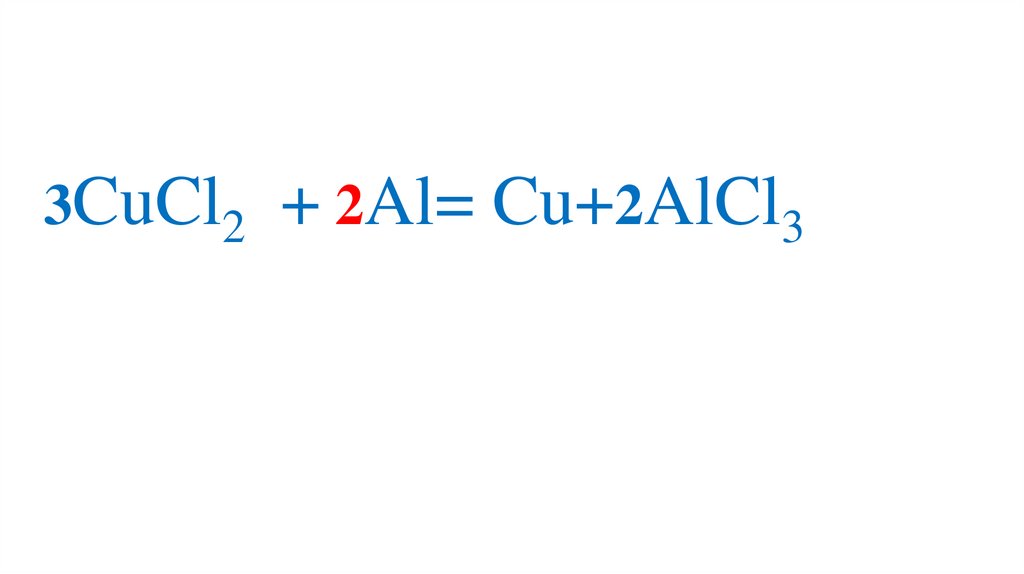
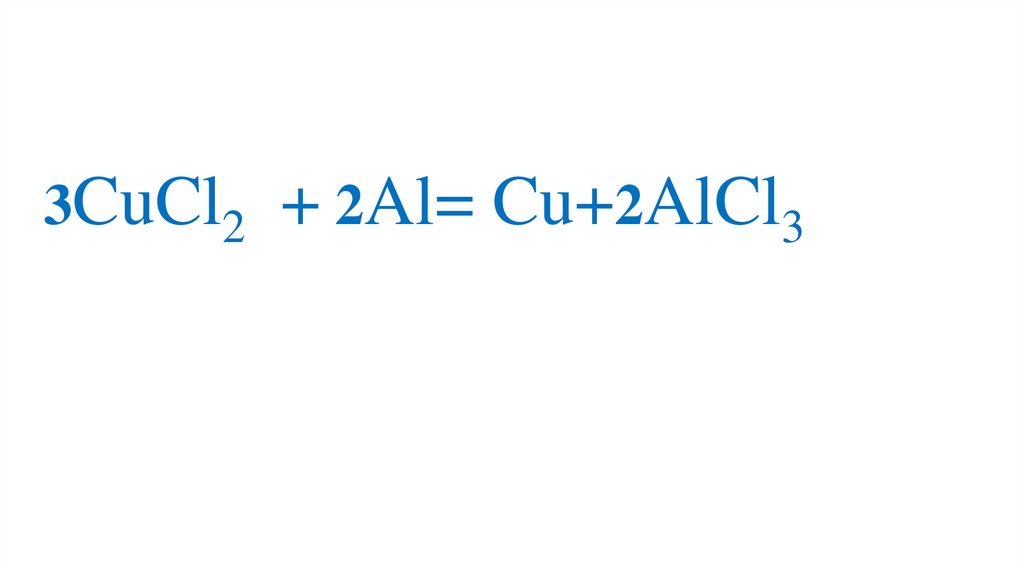
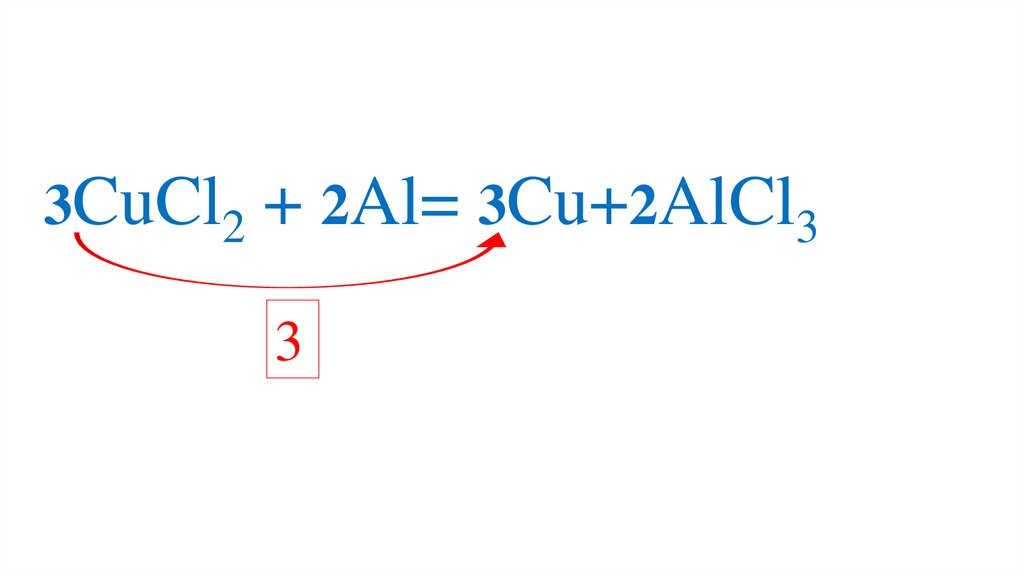

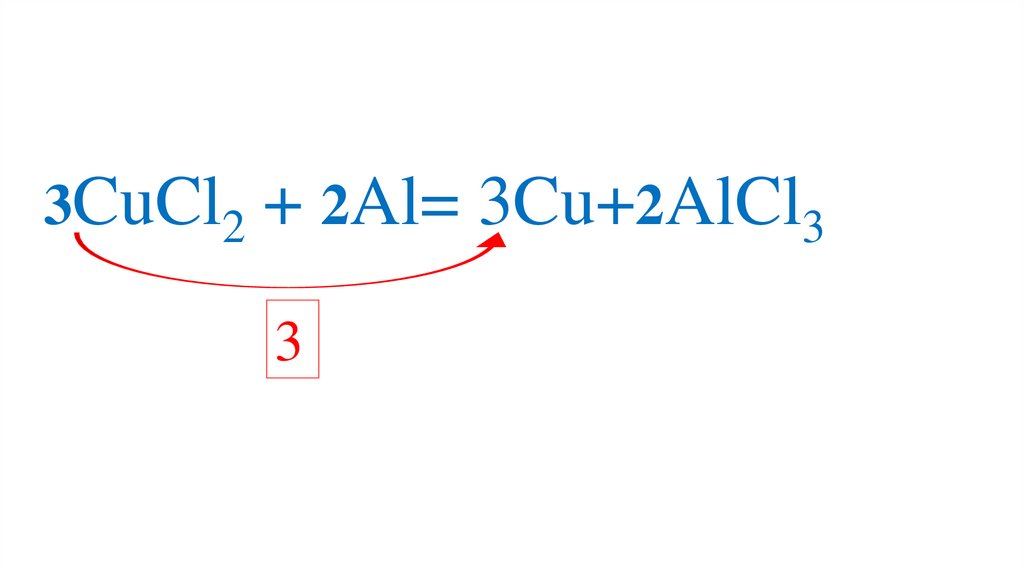
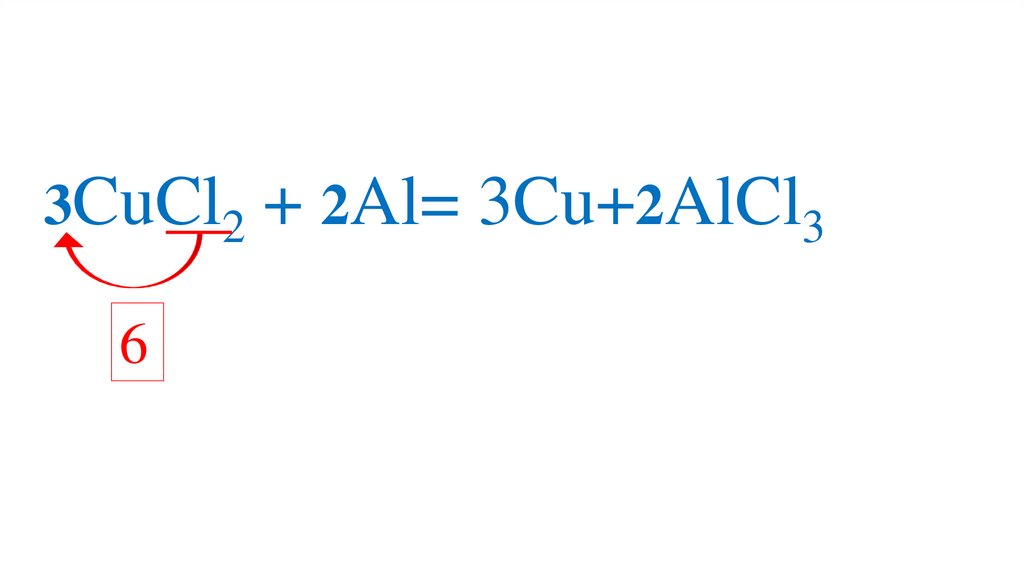
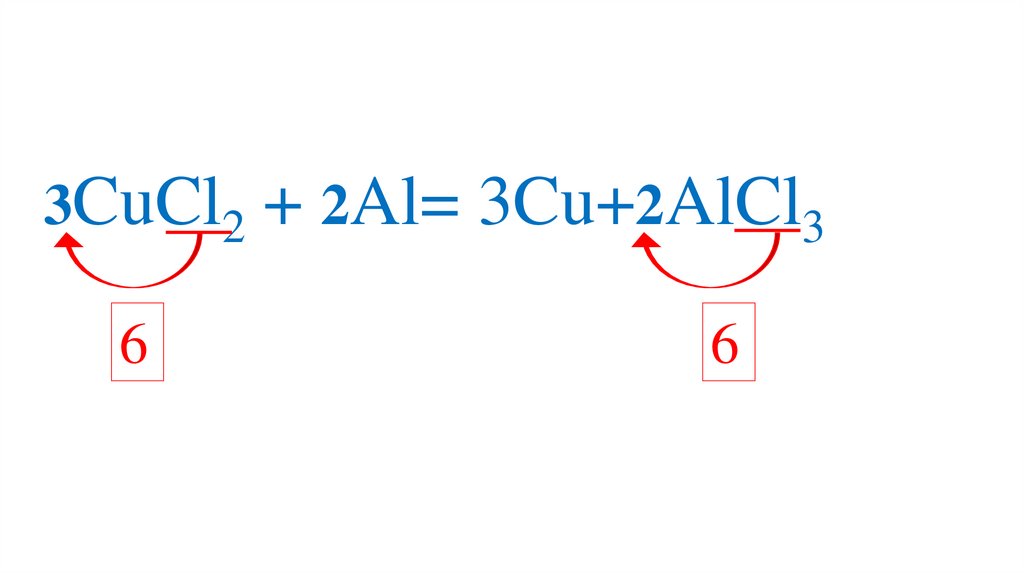
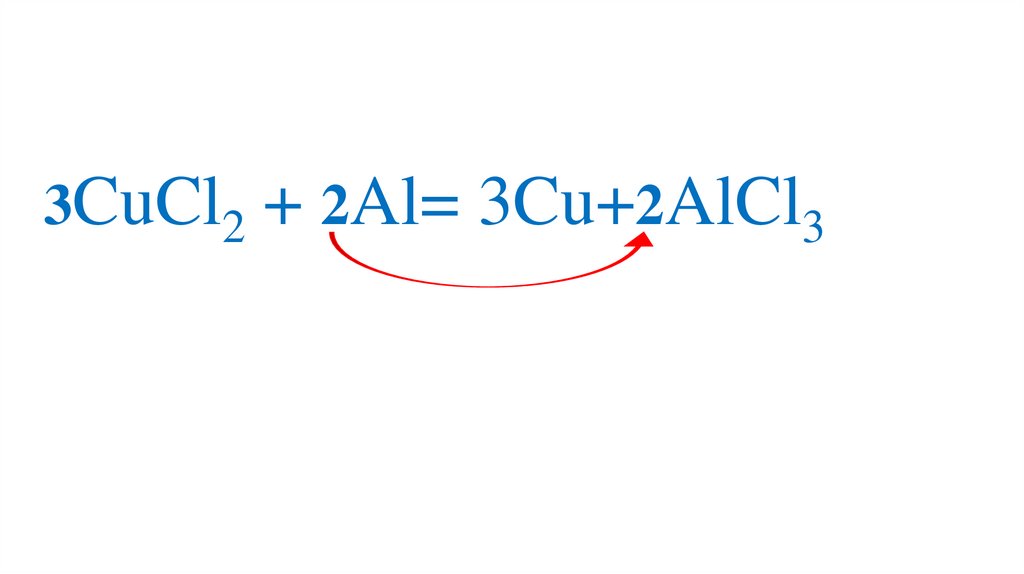
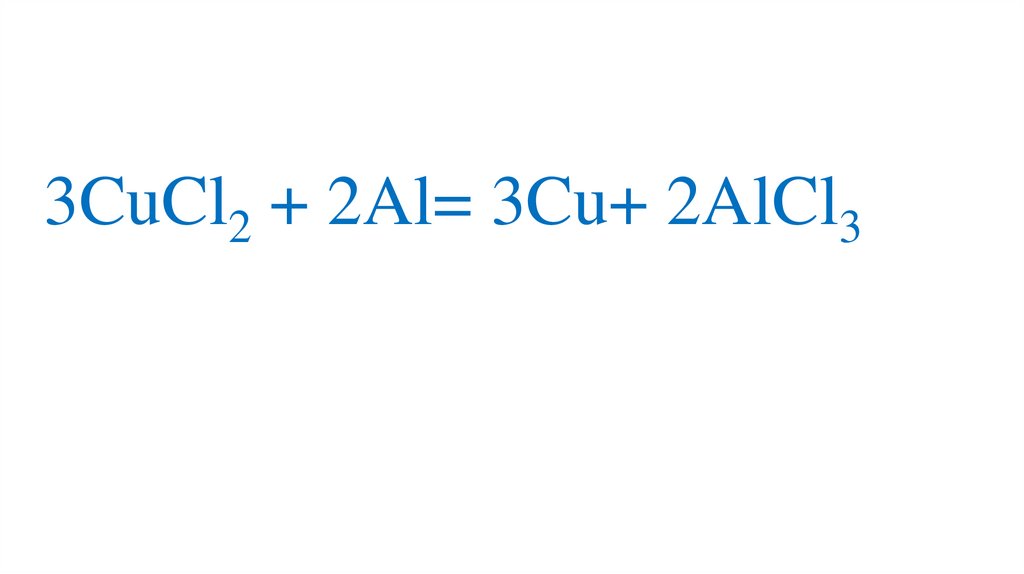













































 chemistry
chemistry








