Similar presentations:
Хімічна рівновага. Принцип Ле Шательє
1.
Хімічна рівновага. Принцип Ле Шательє.2.
• Ендотермічні реакції відбуваються з поглинанням теплоти, екзотермічні — звиділенням її в навколишнє середовище.
• Тепловий ефект хімічної реакції (ΔΗ) — це кількість теплоти, що виділяється або
поглинається під час хімічної реакції. Одиницями вимірювання теплового ефекту реакцій
є джоулі (Дж). Екзотермічні реакції мають від'ємне значення ΔΗ. Воно вказує, на скільки
джоулів зменшилася внутрішня енергія продуктів реакції порівняно з внутрішньою
енергією реагентів. Екзотермічними реакціями є всі реакції горіння. В ендотермічних
реакцій ΔΗ має додатнє значення, тому що внутрішня енергія продуктів реакції
збільшується, порівняно з внутрішньою енергією реагентів.
• Термохімічне рівняння — це хімічне рівняння, у якому зазначено тепловий ефект
реакції.
• Каталізатор — речовина, що підвищує швидкість хімічної реакції, залишаючись після
реакції в хімічно незмінному стані.
• Концентрація — кількісна характеристика вмісту певного компонента в суміші.
• Швидкість хімічної реакції — це величина, що визначається як зміна кількості
речовини реагенту чи продукту реакції, віднесена до одиниці часу (с) й одиниці об'єму (л).
3.
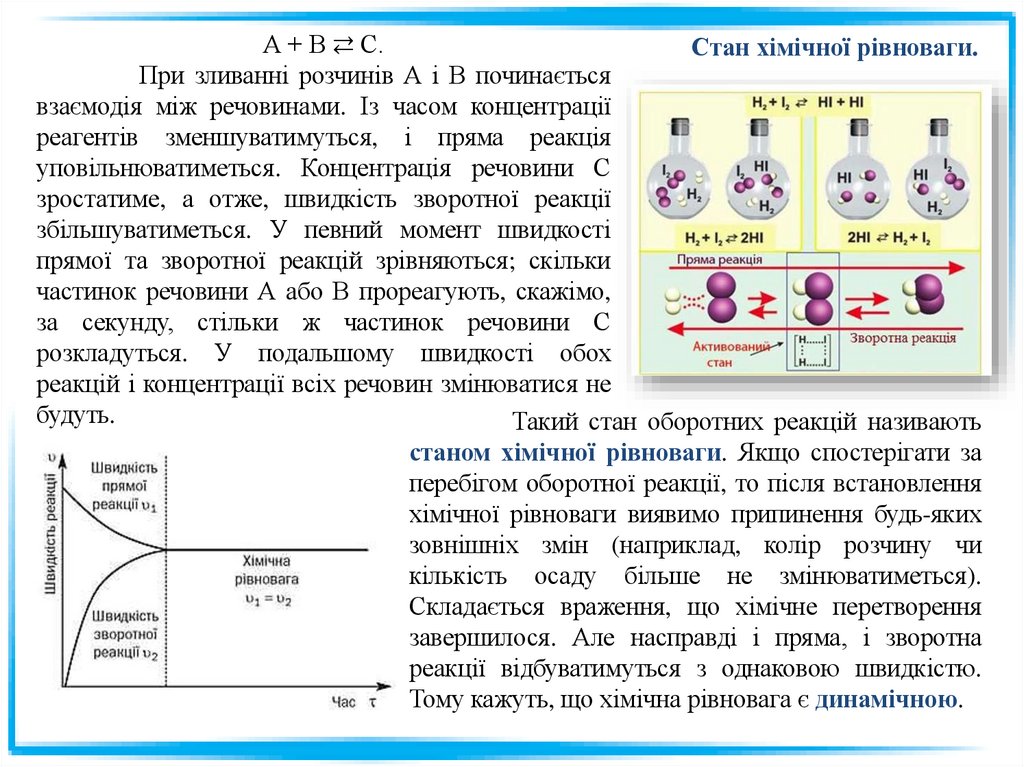
А + В ⇄ С.Стан хімічної рівноваги.
При зливанні розчинів А і В починається
взаємодія між речовинами. Із часом концентрації
реагентів зменшуватимуться, і пряма реакція
уповільнюватиметься. Концентрація речовини С
зростатиме, а отже, швидкість зворотної реакції
збільшуватиметься. У певний момент швидкості
прямої та зворотної реакцій зрівняються; скільки
частинок речовини А або В прореагують, скажімо,
за секунду, стільки ж частинок речовини С
розкладуться. У подальшому швидкості обох
реакцій і концентрації всіх речовин змінюватися не
будуть.
Такий стан оборотних реакцій називають
станом хімічної рівноваги. Якщо спостерігати за
перебігом оборотної реакції, то після встановлення
хімічної рівноваги виявимо припинення будь-яких
зовнішніх змін (наприклад, колір розчину чи
кількість осаду більше не змінюватиметься).
Складається враження, що хімічне перетворення
завершилося. Але насправді і пряма, і зворотна
реакції відбуватимуться з однаковою швидкістю.
Тому кажуть, що хімічна рівновага є динамічною.
4.
Зміщення хімічної рівновагиОборотну реакцію нескладно вивести зі стану динамічної рівноваги.
Рівновага на певний час порушується, якщо змінюються концентрація реагентів чи
продуктів реакції, температура, тиск (для реакцій, що відбуваються зі зміною об'єму
систем). Проте через певний час швидкості прямої і зворотної реакцій зрівнюються і
знову встановлюється рівновага.
У 1884 р. французький учений Ле Шательє виявив
закономірність впливу зовнішніх умов на динамічну
рівновагу оборотних хімічних реакцій. Нині вона відома в
науці як принцип Ле Шательє, що визначає вплив
конкретних чинників на зміщення динамічної рівноваги
оборотних реакцій:
якщо на систему, яка перебуває в хімічній рівновазі, вчинити
зовнішній
вплив,
що
порушує
її,
то
рівновага
зміщуватиметься в напрямку процесів, які протидіють цьому
впливу і послаблюють його.
Як уже було зазначено, зміщення триватиме доти,
доки не встановиться нова рівновага.
5. Фактори, які впливають на зсув рівноваги
Зміна концентраціїЗміна температури
Зміна тиску
6.
Вплив концентрації на зміщення хімічної рівновагиоборотних процесів.
Підвищення вмісту (концентрації) реагентів зміщує рівновагу оборотних
реакцій у напрямку прямої реакції, тобто утворення продуктів реакції. Підвищення
вмісту (концентрації) продуктів реакції зміщує рівновагу оборотних реакцій у
напрямку зворотної реакції, тобто утворення реагентів.
Зміщення стану рівноваги в разі зміни концентрації речовин:
а — початкова рівноважна суміш N2, Н2, та NH3;
б — додавання N2;
в — новий стан рівноваги, за якого вміст азоту в суміші більший (унаслідок його
додавання), амоніаку — більший (унаслідок утворення), а водню — менший
7. Вплив зміни концентрації речовин на стан хімічної рівноваги
• N2 + 3H2 ↔ 2NH3• додавання реагентів до рівноважної суміші
зміщує рівновагу в бік продуктів реакції
• додавання продукту прискорює зворотну
реакцію і зміщує хімічну рівновагу в бік
реагентів
• ↑Cвих. →
• ↑Cпрод. ←
8.
Вплив концентрації на зміщення хімічної рівноваги оборотних процесів.Зміна концентрації реагентів і продуктів реакції
а) та швидкості реакції
б) оборотних реакцій під час досягнення стану хімічної рівноваги
9.
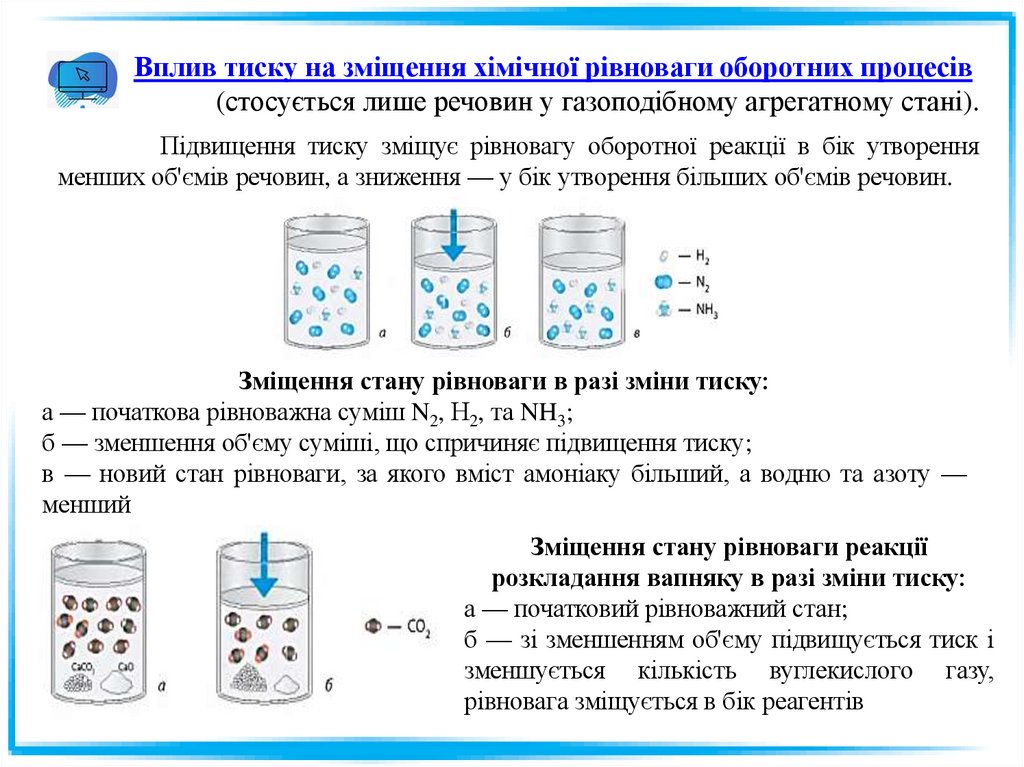
Вплив тиску на зміщення хімічної рівноваги оборотних процесів(стосується лише речовин у газоподібному агрегатному стані).
Підвищення тиску зміщує рівновагу оборотної реакції в бік утворення
менших об'ємів речовин, а зниження — у бік утворення більших об'ємів речовин.
Зміщення стану рівноваги в разі зміни тиску:
а — початкова рівноважна суміш N2, Н2, та NH3;
б — зменшення об'єму суміші, що спричиняє підвищення тиску;
в — новий стан рівноваги, за якого вміст амоніаку більший, а водню та азоту —
менший
Зміщення стану рівноваги реакції
розкладання вапняку в разі зміни тиску:
а — початковий рівноважний стан;
б — зі зменшенням об'єму підвищується тиск і
зменшується кількість вуглекислого газу,
рівновага зміщується в бік реагентів
10.
Вплив тиску на зміщення хімічної рівноваги оборотних процесів(стосується лише речовин у газоподібному агрегатному стані).
Зміщення стану рівноваги в разі зміни концентрації речовин:
а — початкова рівноважна суміш N2, H2, та NH3;
б — додавання N2;
в — новий стан рівноваги, за якого вміст азоту в суміші більший
(унаслідок його додавання), амоніаку — більший (унаслідок утворення), а
водню — менший
11. Вплив зміни тиску на стан хімічної рівноваги
• Зміна тиску впливає на стан рівноваги у тих випадках,коли реакція супроводжується зміною об'єму системи
(зміною кількості газоподібних речовин).
• У відповідності до принципу Ле Шательє збільшення тиску
зміщує хімічну рівновагу у бік утворення меншого числа
молекул газоподібних речовин. Наприклад, для реакції
димеризації нітроген (IV) оксиду:
• 2NO2 ⇄ N2O4
• З двох газоподібних молекул NO2, утворюється одна молекула
N2O4. У разі підвищення тиску рівновага зміститься у бік
утворення меншого числа молекул газу, тобто у бік утворення
N2O4. У разі зменшення тиску - у бік утворення NO2,більшого
числа молекул
12.
Вплив зміни температури середовища на стан хімічноїрівноваги
Нагрівання рівноважної суміші (2NО2 = N2О4) зміщує рівновагу в бік розкладання
димеру, про що свідчить посилення червоно-коричневого забарвлення (а), а під час
охолодження рівновага зміщується в бік утворення димеру, і суміш знебарвлюється (б)
Для визначення впливу зміни температури на стан
рівноваги необхідно враховувати зміну ентальпії реакції.
Зверніть увагу, що зміна ентальпії залежить від напрямку
реакції. Для будь-якої оборотної реакції: якщо пряма реакція є
екзотермічною, то зворотна — ендотермічною:
А → В; ΔΗ < 0
В → А; ΔΗ > 0
Нагрівання рівноважної суміші зміщує рівновагу
в бік ендотермічної реакції, а охолодження — у бік
екзотермічної.
13. Вплив зміни температури середовища на стан хімічної рівноваги
• 2NO2↔ N 2O4; ΔH = – 58 кДж/моль• Екзотермічна реакція – це реакція, яка
відбувається з виділенням теплоти. (ΔH < 0)
• Ендотермічна реакція - це реакція, яка
відбувається з поглинанням теплоти. (ΔH > 0)
↑t ←
↓t →
Відповідно до принципу Ле Шательє,
підвищення температури
(нагрівання) рівноважної суміші
зміщує рівновагу в бік ендотермічної
реакції, і навпаки.
14.
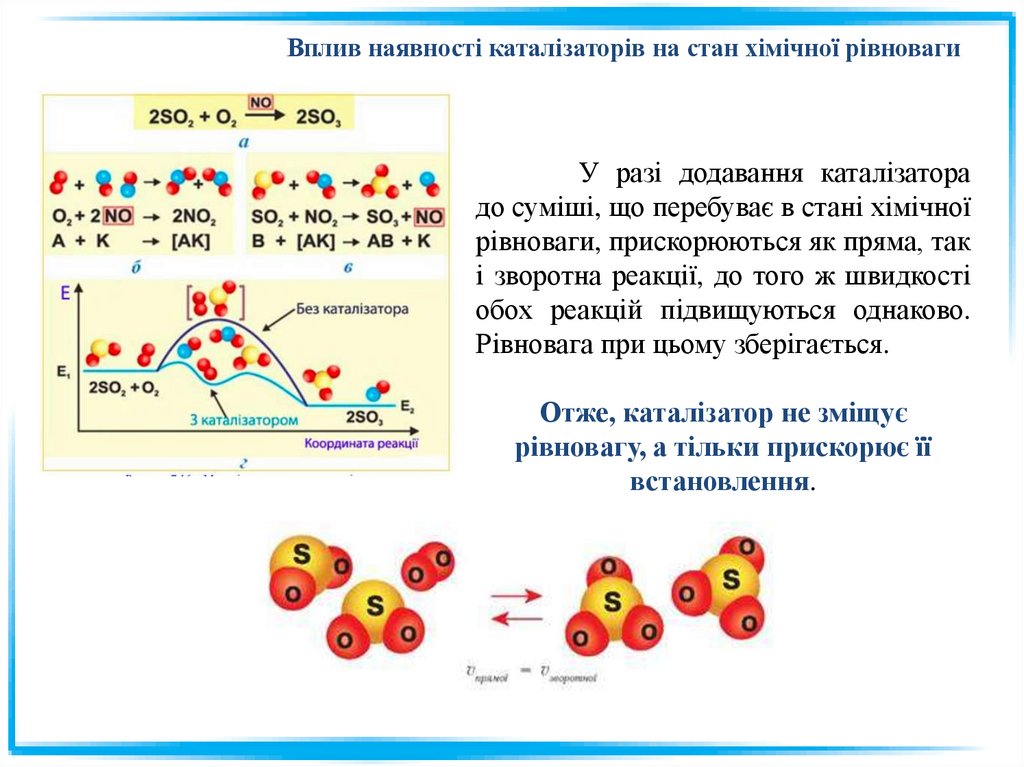
Вплив наявності каталізаторів на стан хімічної рівновагиУ разі додавання каталізатора
до суміші, що перебуває в стані хімічної
рівноваги, прискорюються як пряма, так
і зворотна реакції, до того ж швидкості
обох реакцій підвищуються однаково.
Рівновага при цьому зберігається.
Отже, каталізатор не зміщує
рівновагу, а тільки прискорює її
встановлення.
15.
Підсумовуємо вивчене• Хімічна рівновага — стан системи, коли
зрівноважується зі швидкістю зворотної реакції.
швидкість
прямої
реакції
• На стан хімічної рівноваги впливають зміни температури, тиску, концентрації.
• Підвищення температури зміщує хімічну рівновагу в бік ендотермічної
реакції, зниження температури — у бік екзотермічної.
• Для газів підвищення тиску зміщує рівновагу в бік, що спричиняє зменшення
об'єму, а зниження — у бік збільшення об'єму речовин, що реагують.
• Додавання в систему, що перебуває в стані хімічної рівноваги, одного з
реагентів зміщує рівновагу в бік утворення продуктів реакції. Ефект буде такий
самий, якщо вивести із системи один з продуктів реакції. Якщо ж збільшувати
концентрацію одного з продуктів, то реакція зміститься в бік реагентів.
16.
Завдання для засвоєння матеріалу:1) Висловте судження про значення принципу Ле Шательє для керування:
а) виробничими процесами;
б) біосферними процесами.
2) На рисунку зображено графіки швидкостей прямої та
оберненої реакцій. Визначте, який з графіків відображає
зміну швидкості прямої реакції, який - оберненої.
Поясніть, який фрагмент графіків відповідає стану
динамічної рівноваги.
3) Поясніть, як вплине:
а) підвищення тиску на зміщення рівноваги в системі
N2 + 3H2 ⇄ 2NH3, ΔΗ = -92 кДж/моль.
б) підвищення температури
СаСО3 ⇄ СаО + СО2, ΔΗ = 178 кДж/моль;
в) введення в систему додаткову кількість водню;
Н2 + І2 ⇄ 2НІ.
17. Д/З§ 11 Виконати № 151,152 (стор. 60)
• Як впливатиме зміна температури й тиску настан рівноваги і вихід продуктів у процесах?
• 2Hg + О2 ↔ 2HgO; ΔH < 0; ↑t ←
• N2 + O2 ↔ 2NO; ΔH > 0;













 chemistry
chemistry








