Similar presentations:
Галогенопроизводные предельных углеводородов. 11 класс
1. Галогенопроизводные предельных углеводородов
11 классГалогенопроизводные
предельных
углеводородов
профиль
2. Органическая химия – это химия соединений углерода
ОРГАНИЧЕСКАЯ ХИМИЯ – ЭТО ХИМИЯУГЛЕВОДОРОДОВ И ИХ ПРОИЗВОДНЫХ
3. Производные углеводородов
В состав, в состав органических веществ могут входить кислород, азот, галогены и т.д.4. Галогенпроизводные углеводородов
ПРОИЗВОДНЫЕ УГЛЕВОДОВОРОДОВ, В КОТОРЫХ ОДИНИЛИ НЕСКОЛЬКО АТОМОВ ВОДОРОДА ЗАМЕЩЕНЫ НА
АТОМЫ ГАЛОГЕНОВ
5. Этапы изучения
1.2.
3.
4.
5.
6.
7.
8.
Классификация
Строение
Номенклатура
Изомерия
Физические свойства
Химические свойства
Получение
Применение
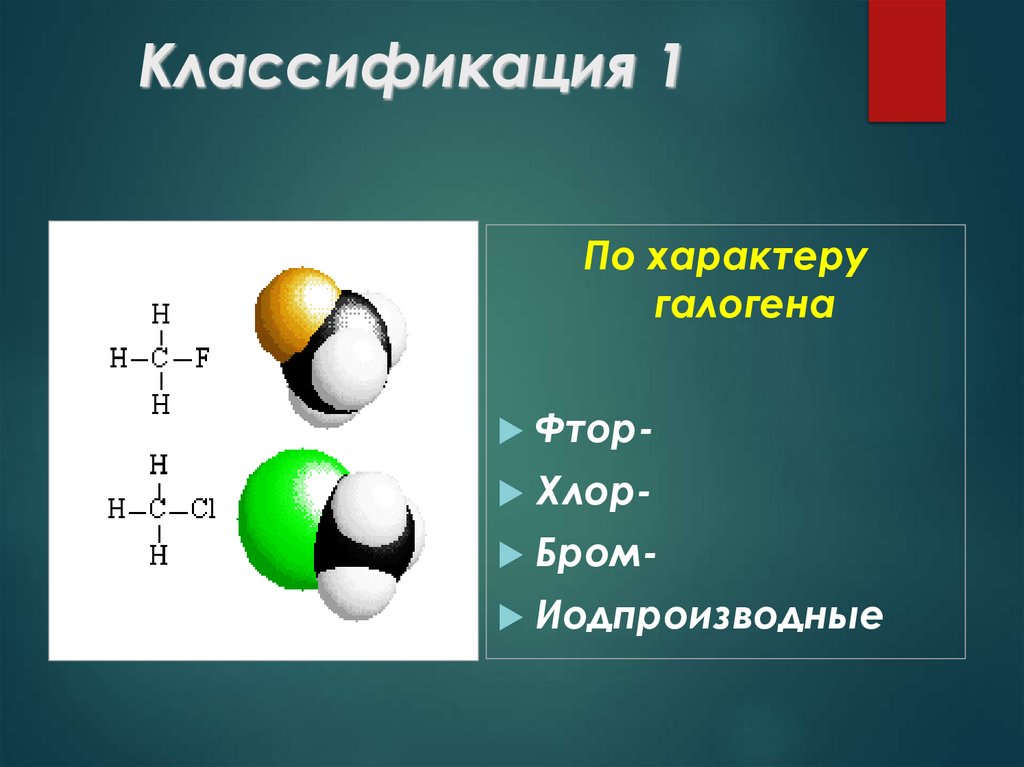
6. Классификация 1
По характеругалогена
Фтор Хлор Бром Иодпроизводные
7. Классификация 2
По числу атомовгалогенов
Моно Ди-
Тризамещенны
е
и т.д.
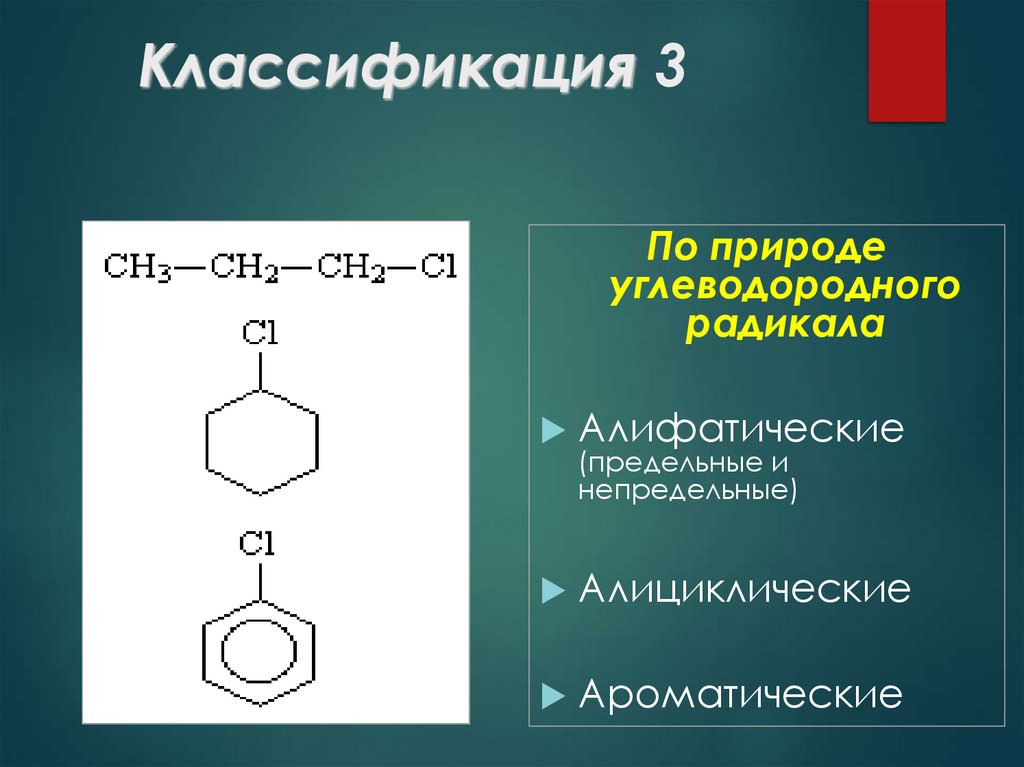
8. Классификация 3
По природеуглеводородного
радикала
Алифатические
(предельные и
непредельные)
Алициклические
Ароматические
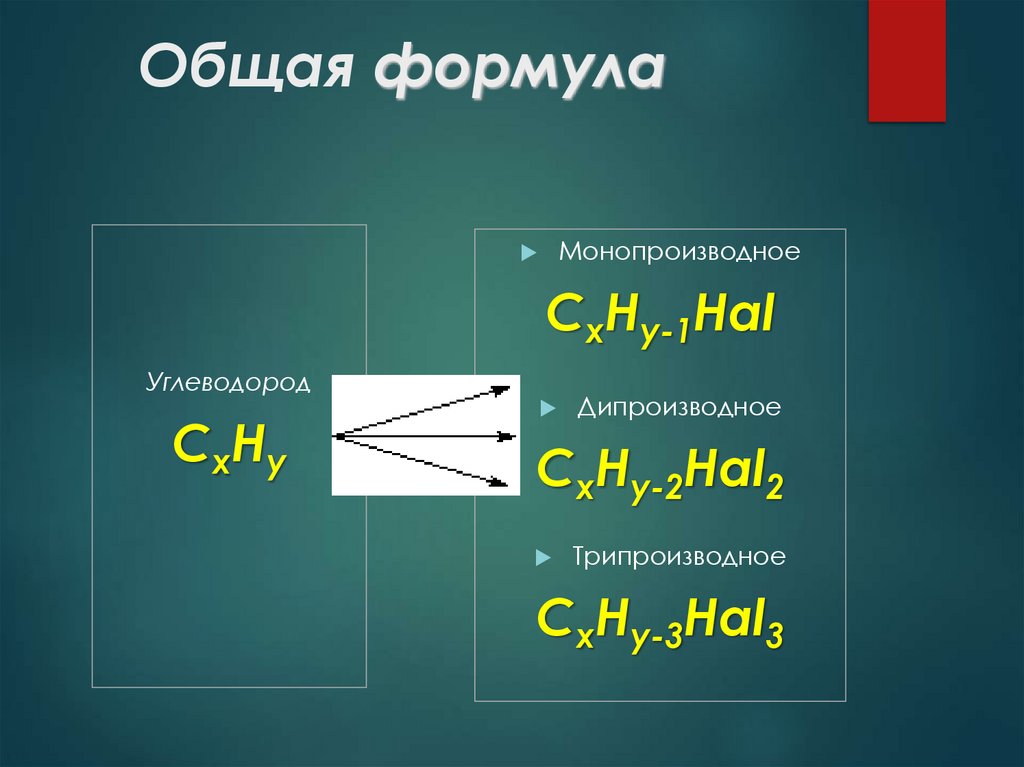
9. Общая формула
МонопроизводноеСxHy-1Hal
Углеводород
СxHy
Дипроизводное
СxHy-2Hal2
Трипроизводное
СxHy-3Hal3
10. Классификация 4 для производных алканов
По характеруатома
углерода,
связанного с
галогеном
Первичные
Вторичные
Третичные
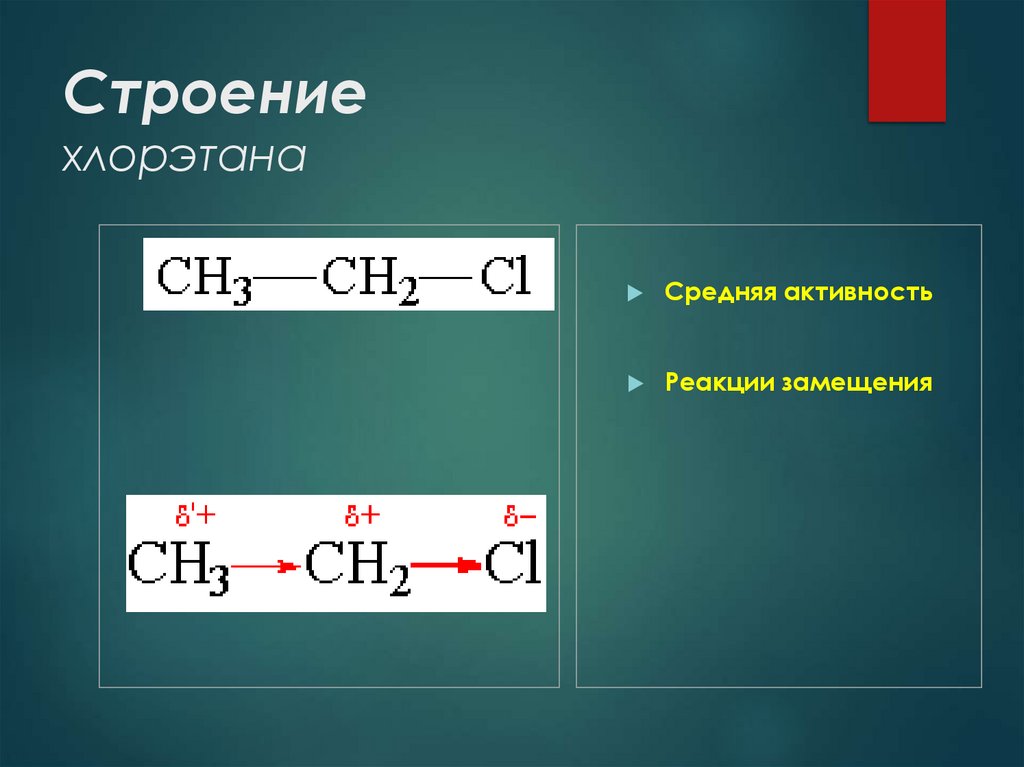
11. Строение хлорэтана
Средняя активностьРеакции замещения
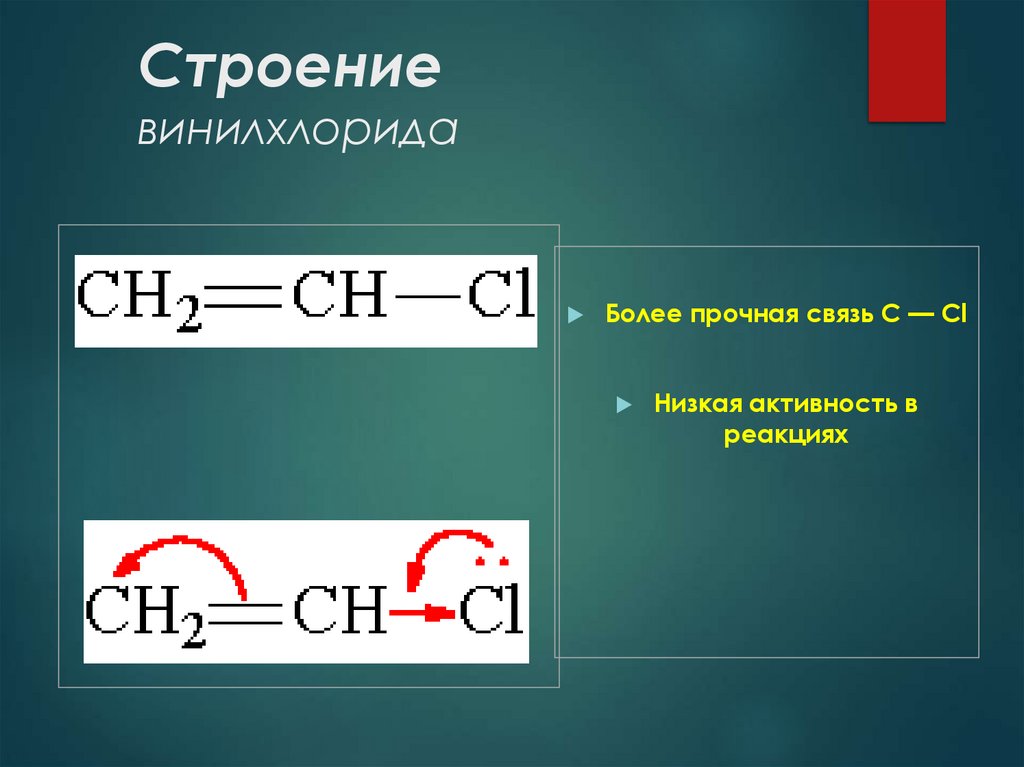
12. Строение винилхлорида
Более прочная связь С — ClНизкая активность в
реакциях
13. Номенклатура
Систематическая (заместительная)№ + галоген + углеводород
Рациональная
радикал + галогенид
Тривиальная (исторически сложившаяся)
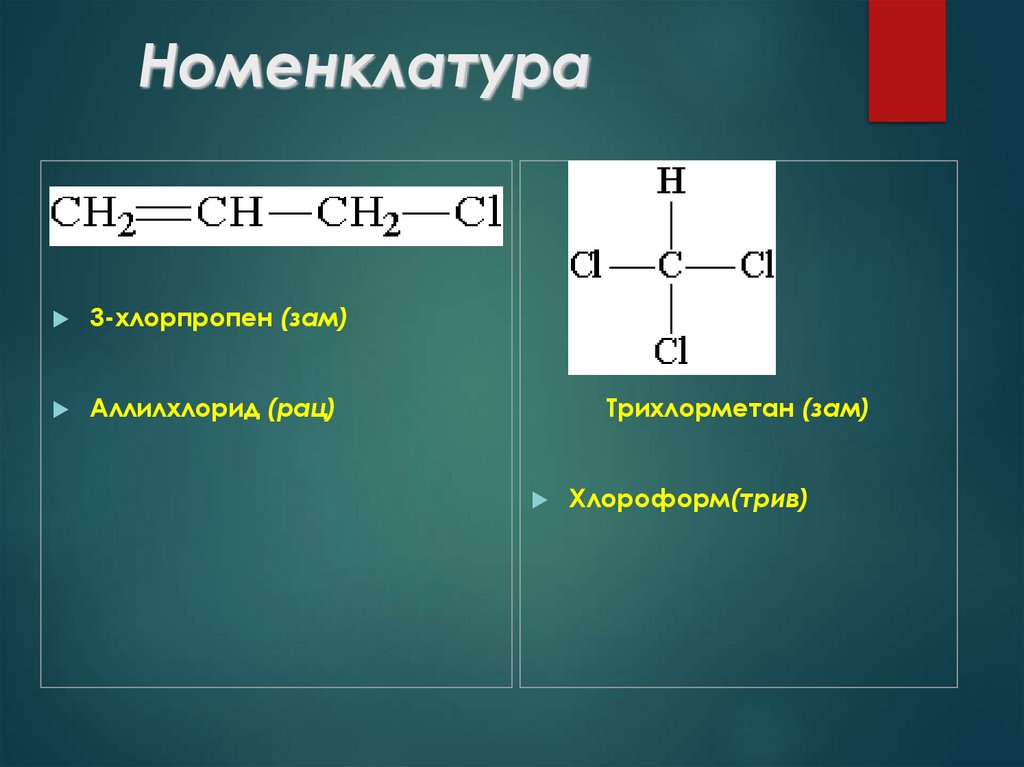
14. Номенклатура
3-хлорпропен (зам)Аллилхлорид (рац)
Трихлорметан (зам)
Хлороформ(трив)
15. Номенклатура
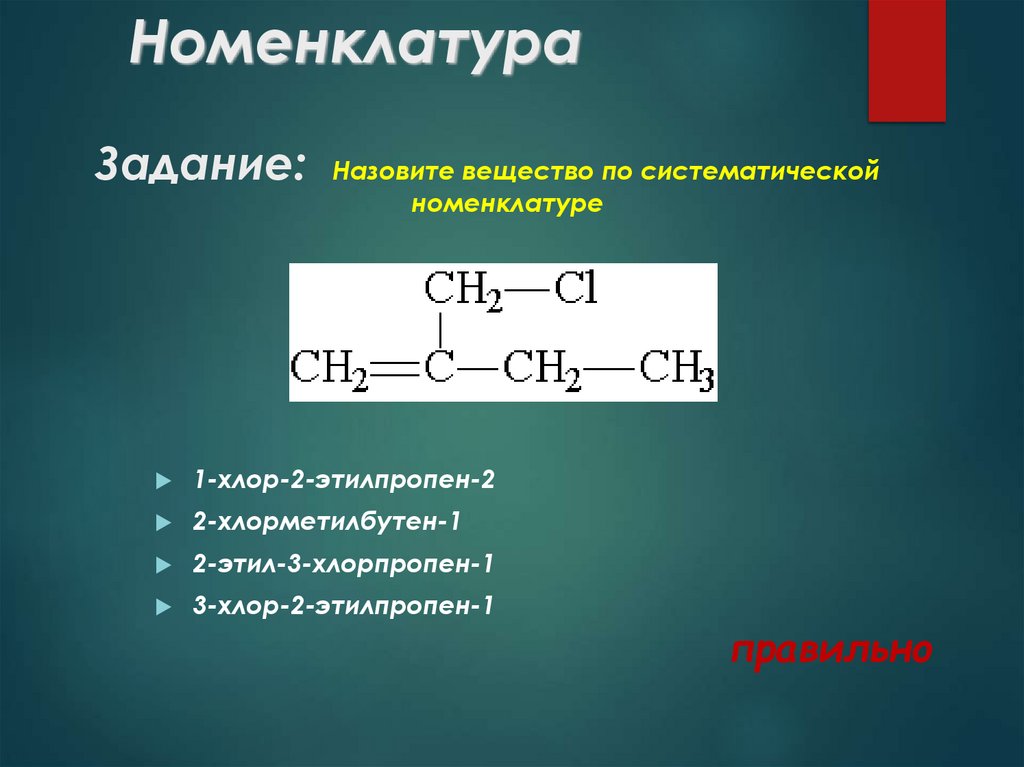
Задание: Назовите вещество по систематическойноменклатуре
1-хлор-2-этилпропен-2
2-хлорметилбутен-1
2-этил-3-хлорпропен-1
3-хлор-2-этилпропен-1
правильно
16. Изомерия
СтруктурнаяПространственная
А) характерная для
углеводородов
Если характерна для углеводородов,
от которого образовано
галогенпроизводное
+
Б) положения заместителя
17. Изомерия
ЗаданиеСоставьте формулы всех возможных изомеров состава
С4Н9Вr.
Укажите виды изомерии, характерные для этих соединений.
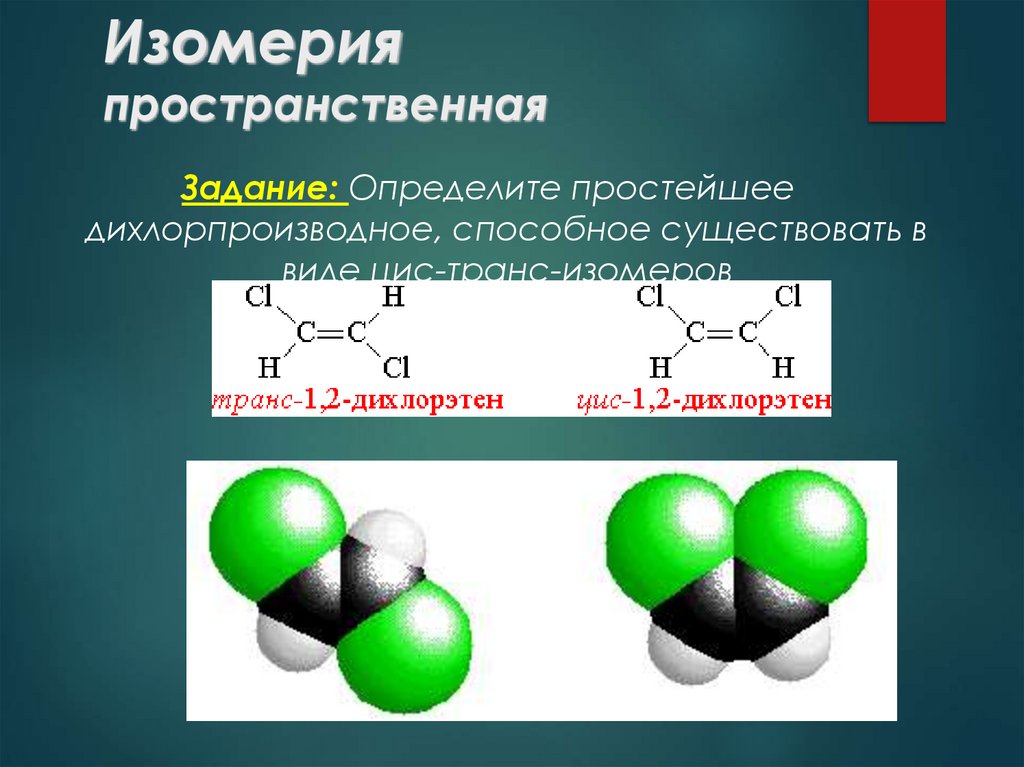
18. Изомерия пространственная
Задание: Определите простейшеедихлорпроизводное, способное существовать в
виде цис-транс-изомеров
19.
20. Физические свойства
Температуры кипения увеличиваются:А) с увеличением порядкового номера
галогена
Б) с увеличением углеводородного радикала
В) с увеличением числа атомов галогенов
Простейшие –газы, далее б/ц жидкости с
характерным запахом, нерастворимы в
воде, растворимы в орг. растворителях
Плотность увеличивается
Б) с увеличением числа атомов галогенов
А) с увеличением порядкового номера
галогена
21. Физиологическое действие
Почти все токсичны (гексахлоран, ДДТ - ядохимикаты),кроме фторпроизводных (тефлон, фреоны)
Многие обладают наркотическим воздействием
(хлороформ и др.)
Слезоточивое действие – лакриматор (бензилхлорид и
др.)
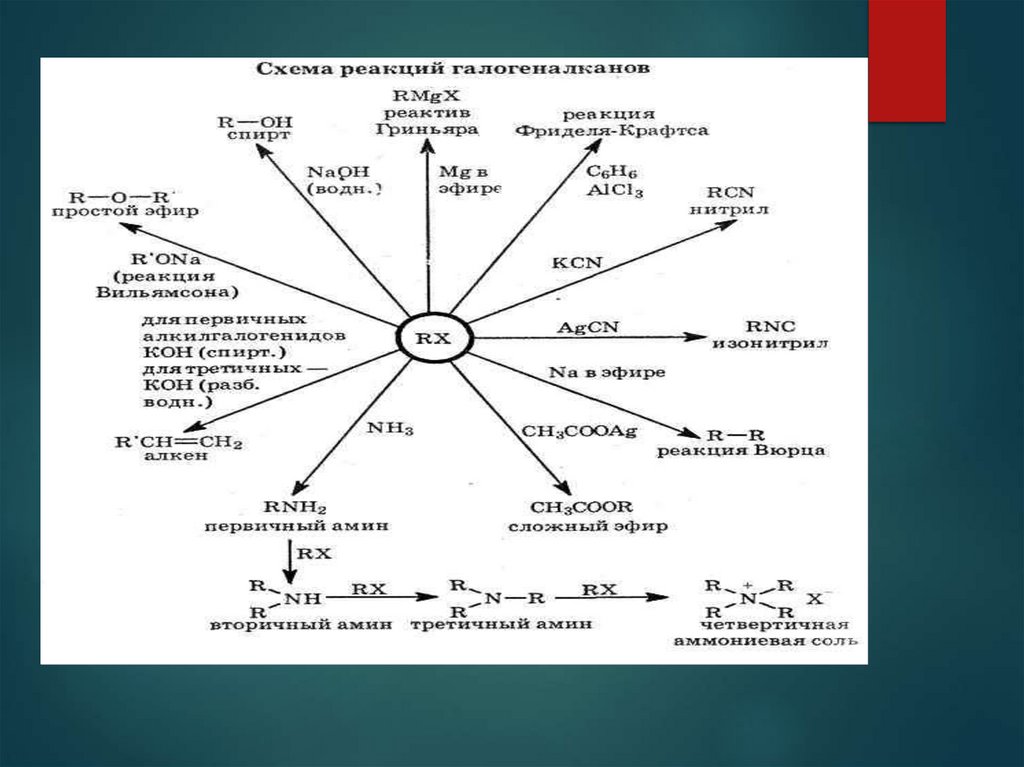
22. Химические свойства
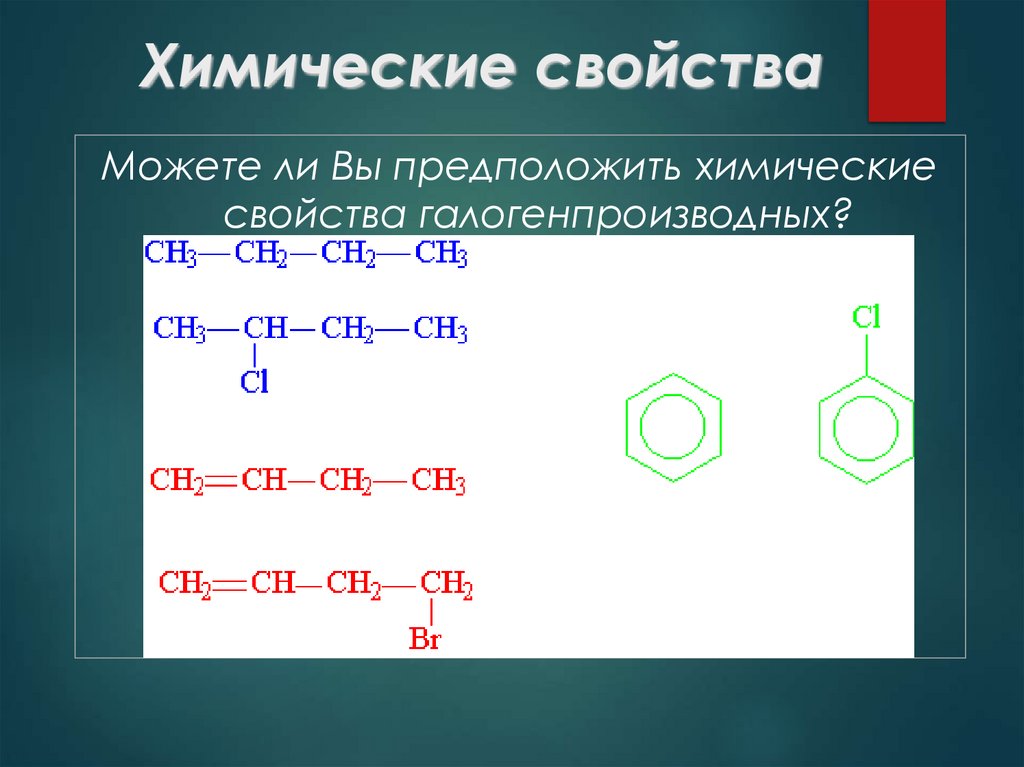
Можете ли Вы предположить химическиесвойства галогенпроизводных?
23. Химические свойства
А) реакции углеводородныхрадикалов
Те же что и у соответствующих у/в
предельные – замещение
непредельные – присоединие
ароматические – замещение
Б) реакции с участием галогенов
замещение
отщепления (элиминирования)
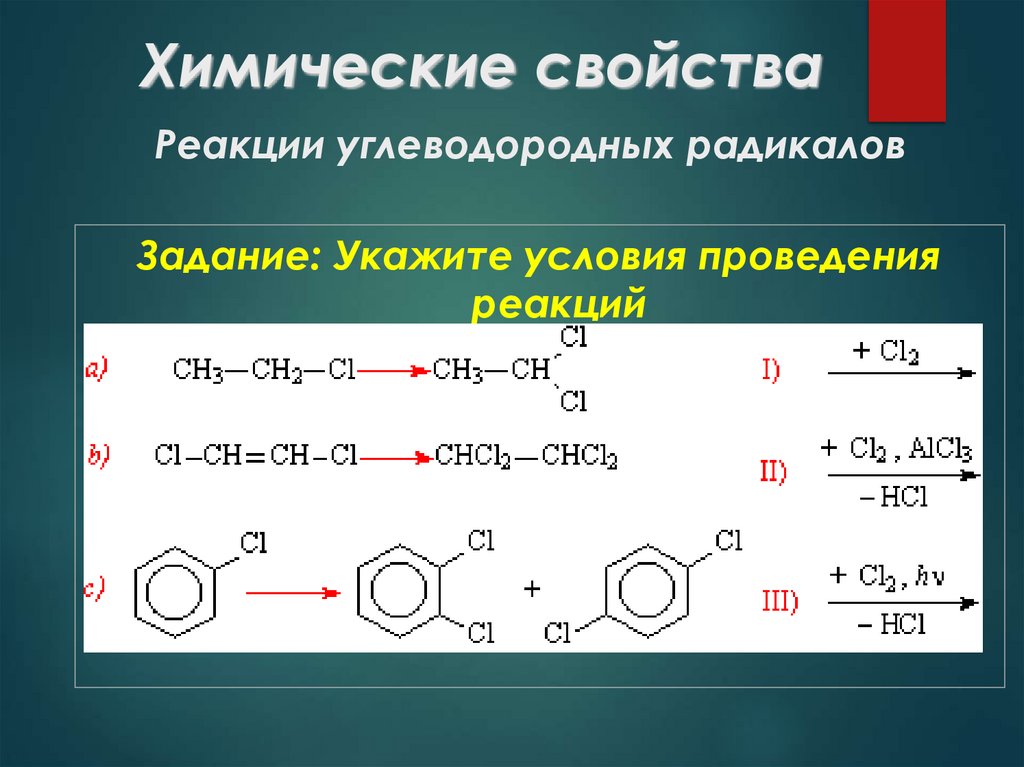
24. Химические свойства Реакции углеводородных радикалов
Задание: Укажите условия проведенияреакций
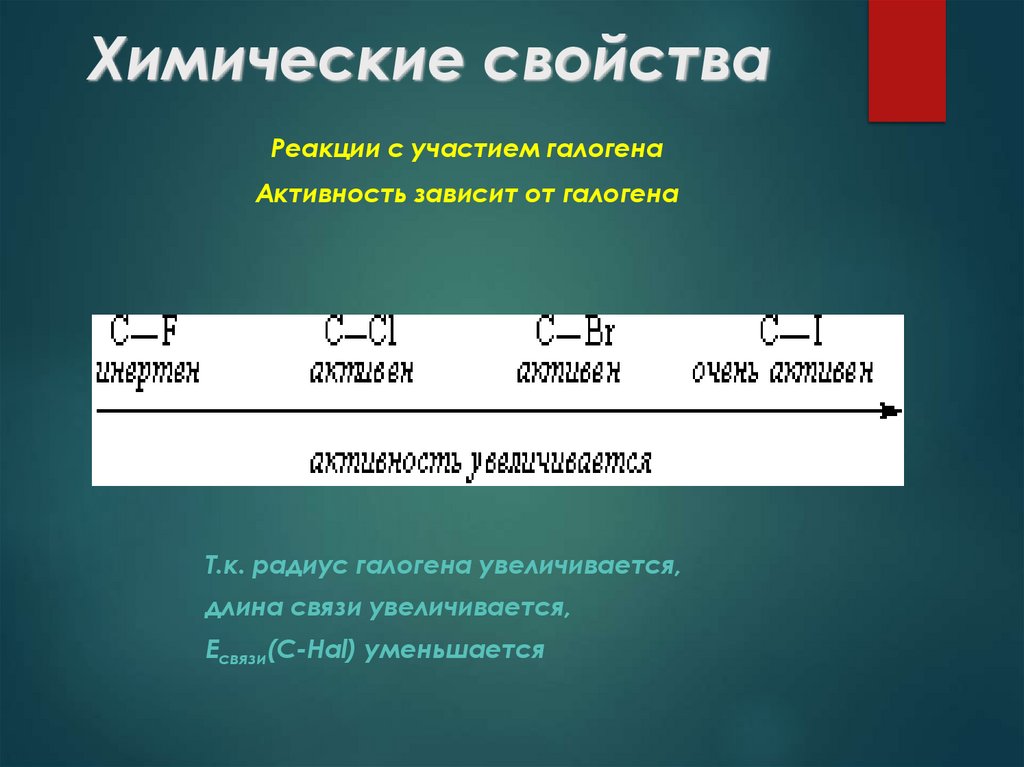
25. Химические свойства
Реакции с участием галогенаАктивность зависит от галогена
Т.к. радиус галогена увеличивается,
длина связи увеличивается,
Есвязи(С-Hal) уменьшается
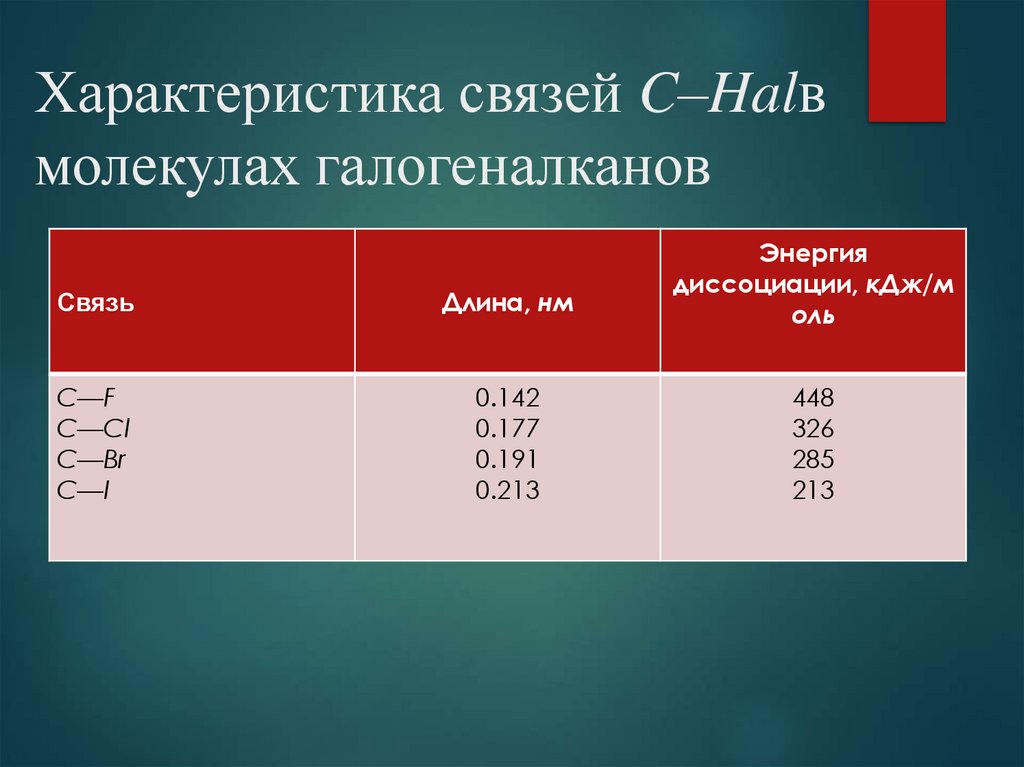
26. Характеристика связей C–Halв молекулах галогеналканов
Характеристика связей C–Halвмолекулах галогеналканов
Связь
Длина, нм
Энергия
диссоциации, кДж/м
оль
C—F
C—Cl
C—Br
C—I
0.142
0.177
0.191
0.213
448
326
285
213
27. Факторы контролирующие конкуренцию
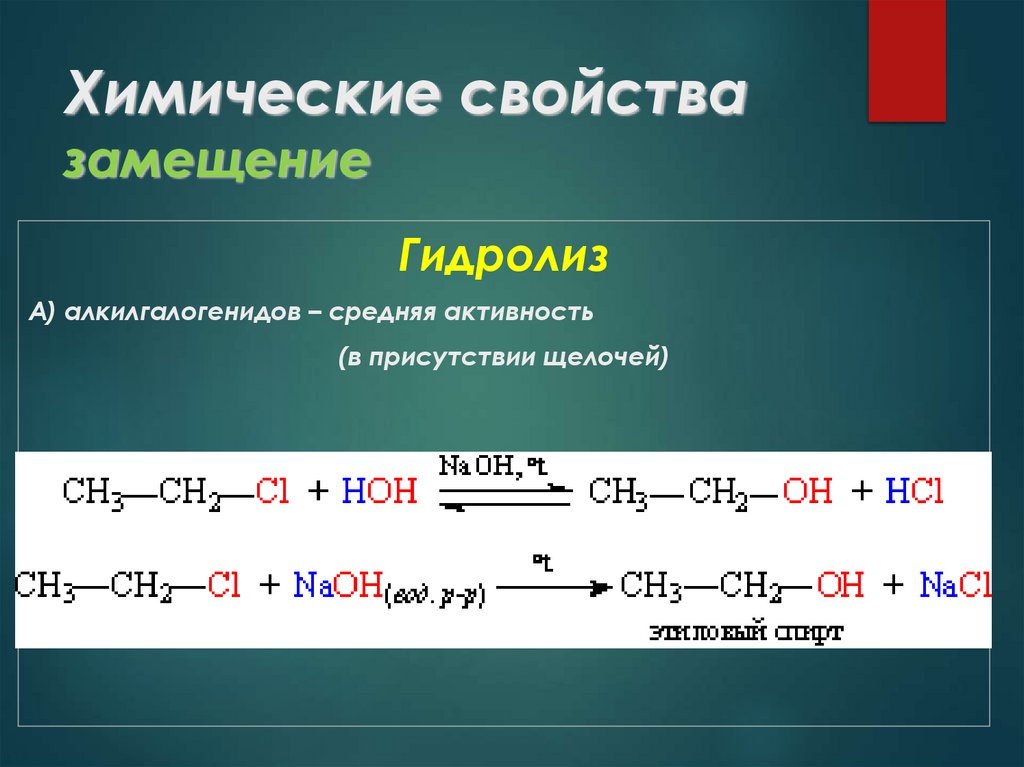
28. Химические свойства замещение
ГидролизА) алкилгалогенидов – средняя активность
(в присутствии щелочей)
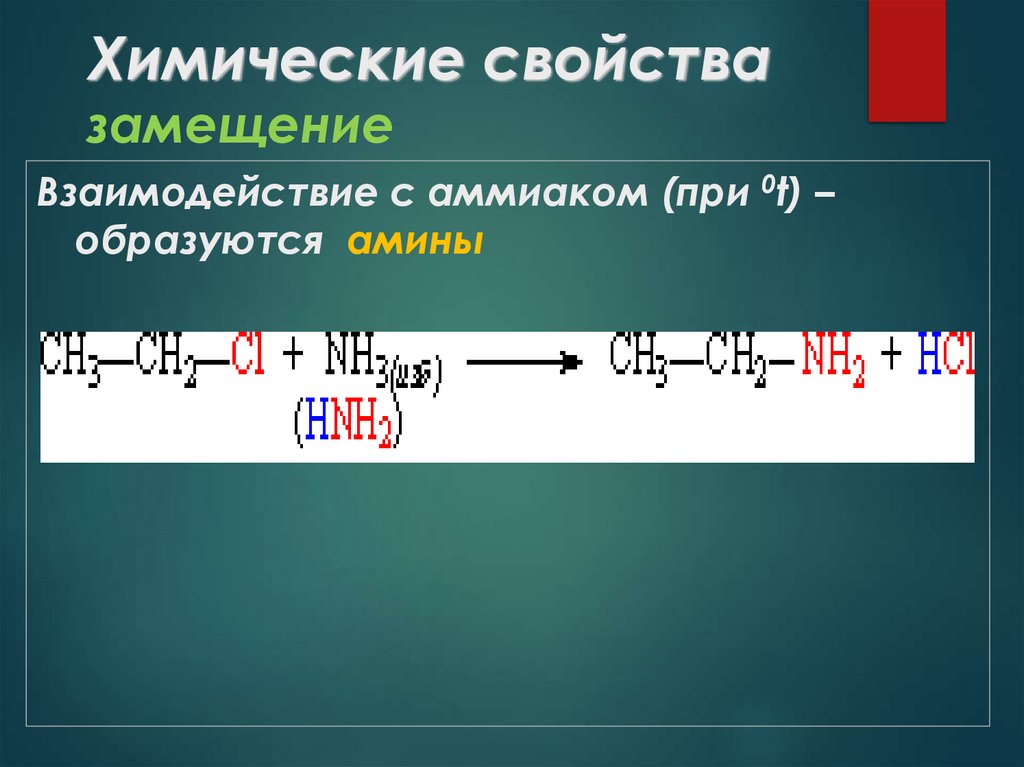
29. Химические свойства замещение
Взаимодействие с аммиаком (при 0t) –образуются амины
30. Химические свойства отщепление
Задание:Составьте уравнения реакций отщепления
хлороводорода при нагревании со спиртовым
раствором щелочи
А) 2-хлорпропана
Б) 2- хлорбутана
31. Химические свойства отщепление
Правило Зайцева:водород отщепляется отнаименее гидрированного атома углерода
Реакция отщепления – конкурирующая
реакциям замещения
32. Химические свойства окисление
Горят плохо,выделяя
ядовитые соединения (!!!) (например
хлороводород HCl),
или не горят
вовсе.
Качественная реакция на Сl, Br, I:
Окрашивание пламени в зеленый
цвет медной проволочкой,
смоченной в галогенпроизводном
33.
34. Получение
Из алканов и циклоалкановИз алкенов и алкинов
Из аренов
Из спиртов
Из альдегидов и кетонов
35.
Присоединение галогеноводородовк алкенам.
R-CH=CH2+HCl→R-CHCl-CH3
Реакции спиртов с галогеноводородами.
R-OH+H-Cl→R-Cl+H2O
Взаимодействие галогенидов фосфора или
тионилхлорида со спиртами.
3R-OH+PCl3→3R-Cl+H3PO3
36. Получение дигалогеналканов
Присоединение галогеноводородов к алкинам.R-C≡CH+2HCl→R-CCl2-CH3
Взаимодействие альдегидов и кетонов с PCl5,
PBr5 или SF4. Реакция идёт при нагревании.
R—CHO + PCl5 → R—CHCl2 + POCl3
Присоединение галогенов к алкенам
R-CH=CH2 + Cl2 → R-CHCl-CHCl
Раскрытие циклических простых эфиров
(например, ТГФ) при реакции с NaI в среде
H3PO4+P2O5.
C4H8O + HI → I-CH2CH2CH2CH2-I
При 180 °C ТГФ с хлороводородом даёт 1,4дихлорбутан
37. Применение
Анестезия С2H5Cl и наркоз CF3CHClBr (ранее СНCl3) и др.Растворители CCl4 , CH2CH2 и др. для жиров и масел;
Фреоны (хладагенты) CF2Cl2 и др.
Антисептик СНI3
Тушение пожаров CCl4 и др.
Полимеры из СН2=СН-Сl, СF2=СF2 и др.
Ядохимикаты: гексахлоран, ДДТ и др.
38. Поливинилхлорид -(CH2 – CHCl)-
ЛинолеумВиниловые обои
39. Поливинилхлорид (пластизоль) -(CH2 – CHCl)-
Окна, подставки под кружки, магниты на холодильники,шевроны (нашивки), рамки для фото.
40. Тефлон -(CF2 –CF2) -
Тефлон -(CF2 –CF2) Изделия с антипригарным покрытием41. Тефлон (политетрафторэтилен): инертный материал -(CF2 –CF2) -
Для термосвариванияполиэтиленовой пленки
Ленты и сетки с покрытием из тефлона
применяются в конвейерах для обжарки
мяса, рыбы и птицы; сушки сухарей,
орехов, семечек, изготовление
полуфабрикатов пиццы и т.п.
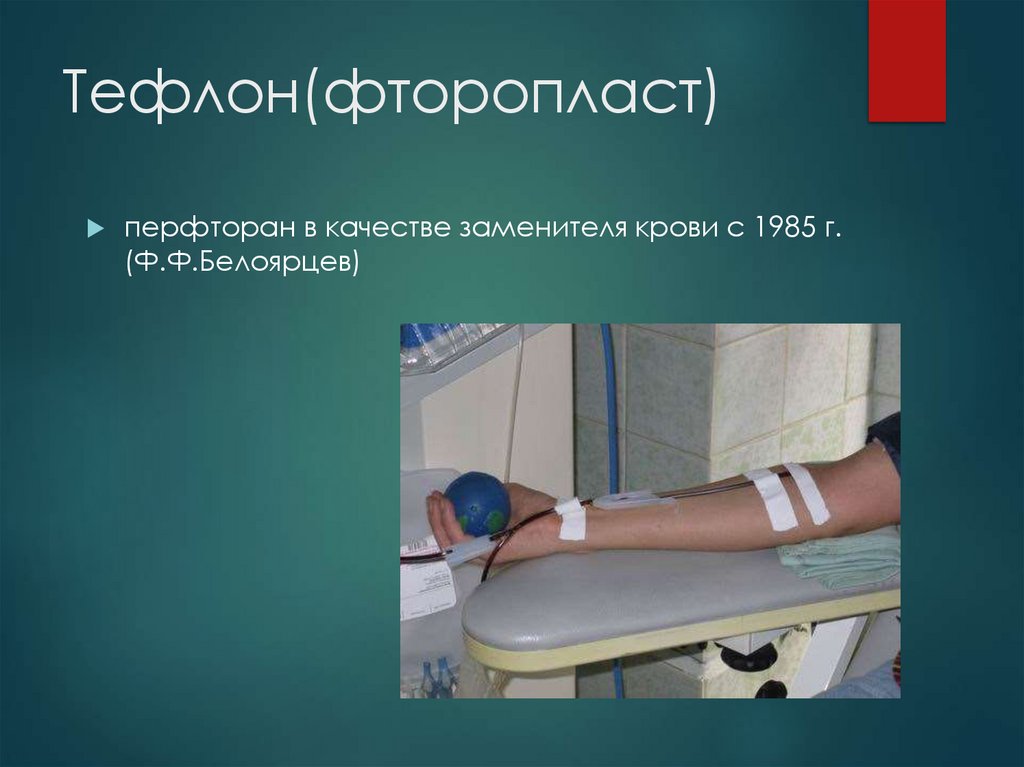
42. Тефлон(фторопласт)
перфторан в качестве заменителя крови с 1985 г.(Ф.Ф.Белоярцев)
43.
РЕФЛЕКСИЯДостигли ли вы цели урока?
В какой степени?
Какие вопросы вызвали
наибольшее затруднение?































 chemistry
chemistry








