Similar presentations:
Валентность_1 урок
1. § 8. ВАЛЕНТНОСТЬ
2.
Цель урока:Формирование понятия о валентности, умении определять
валентность в молекулах бинарных соединений.
Проблемный вопрос урока:
Как взаимодействуют между собой атомы разных элементов-неметаллов?
3.
Молекула воды имеет формулу Н2О. Почему именно такая формула у этоговещества, а не, допустим, Н3О или НО2?
Валентность — это свойство атомов одного химического
элемента соединяться со строго определённым числом
атомов другого химического элемента.
За единицу валентности принята валентность атомов водорода:
водород всегда одновалентен. Кислород двухвалентен
4.
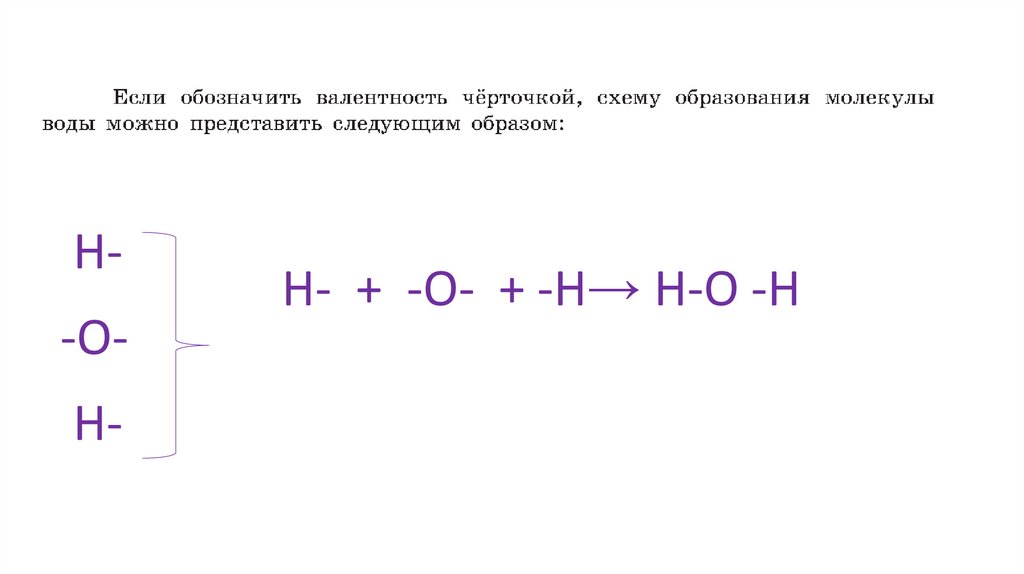
H-OH-H- + -O- + -H→ H-O -H
5.
H-OH-H- + -O- + -H→ H-O -H
Формулы, в которых валентности элементов обозначены
чёрточками, называются структурными.
6.
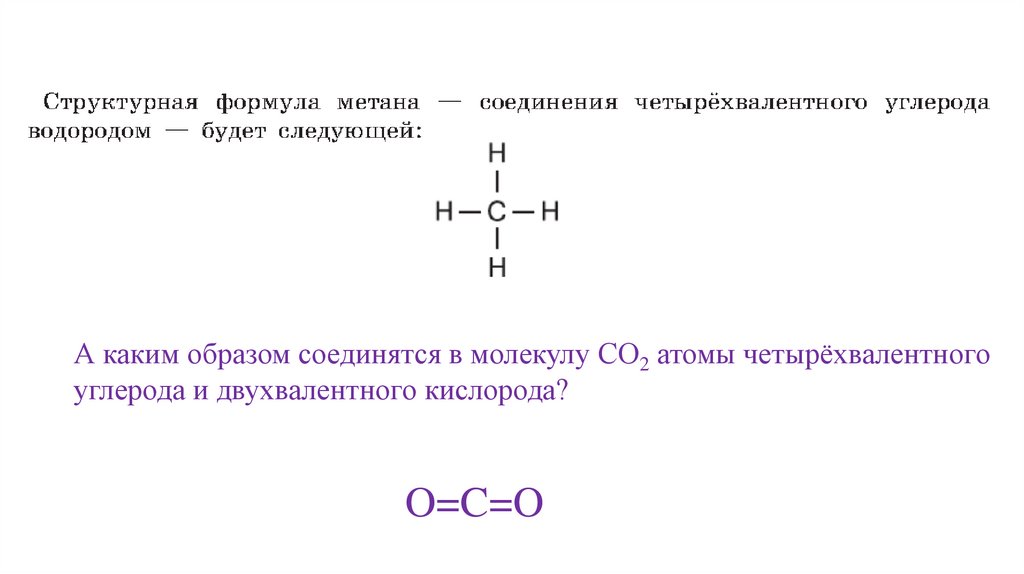
А каким образом соединятся в молекулу СО2 атомы четырёхвалентногоуглерода и двухвалентного кислорода?
O=C=O
7.
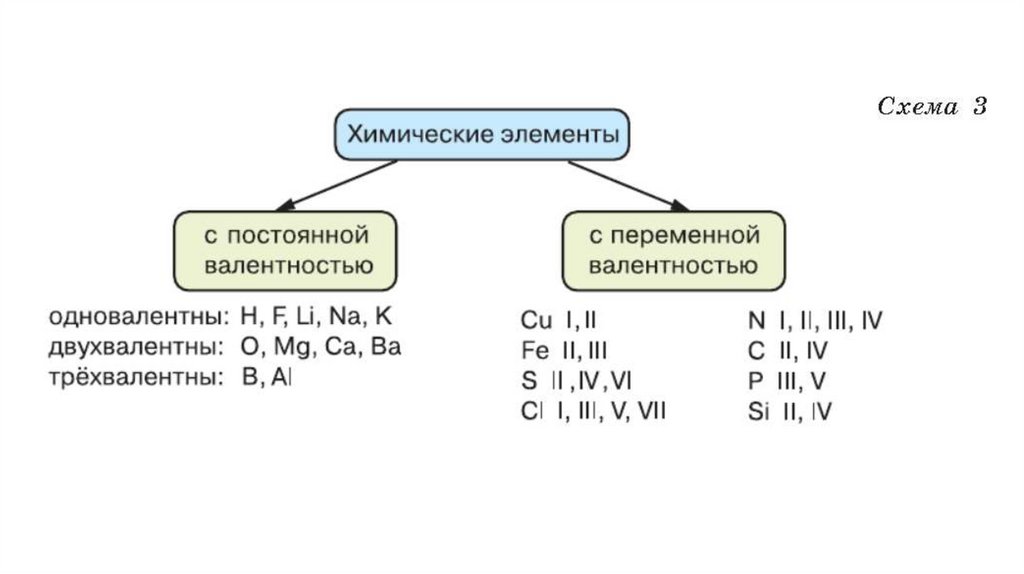
ЭЛЕМЕНТЫ С ПОСТОЯННОЙ ВАЛЕНТНОСТЬЮВалентность
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
I
H, F и элементы I группы главной подгруппы Li,
Na, K, Rb, Cs, Fr
II
O и элементы II группы Mg, Ca, Sr, Ba, Zn
III
B, Al
8.
9.
Определениевалентности по формуле
10.
Соединения, которые состоят из атомов двухэлементов, называются бинарными
соединениями и выражаются общей формулой:
x
y
Am Bn
Произведение валентности (x) на число атомов (m) одного элемента
(A) равно произведению валентности (y) на число атомов (n) другого
элемента(B)
11.
Определить валентность серы в оксиде серы (VI)x
S O3
y
Am Bn
Обозначим валентность S
через
x
12.
Обозначим валентность S через xX
S O3
x
y
Am Bn
13.
Валентность кислорода всегда равна двумX
II
S O3
x
y
Am Bn
14.
Валентность кислорода всегда равна двумX
II
S1 O3
x
y
Am Bn
Произведение валентности (x)
на число атомов (m) одного
элемента (A) равно
произведению валентности (y)
на число атомов (n) другого
элемента(B)
15.
Валентность кислорода всегда равна двумX
II
S1 O3
x
y
Am Bn
Составим уравнение:
16.
Валентность кислорода всегда равна двумX
II
S1 O3
x
y
Am Bn
Составим уравнение:
X∙1 = II∙3
X=6
17.
Получили формулу оксида серы, где валентность атома серыравна шести.
VI
II
S O3
18.
Составление формул повалентности
19.
Составить формулу оксида фосфора VPO
20.
2.Над знаками проставим римскими цифрами валентностиэлементов
V
PO
21.
2.Над знаками проставим римскими цифрами валентностиэлементов
V II
PO
22.
3.Найдем наименьшее общее кратное между валентностями:V II
PO
23.
3.Найдем наименьшее общее кратное между валентностями:10
V II
PO
24.
4.Разделим НОК на валентность каждого элемента, найдеминдексы
10
V II
PO
25.
4.Разделим НОК на валентность каждого элемента, найдеминдексы
10
V II
PO
2
26.
4.Разделим НОК на валентность каждого элемента, найдеминдексы
10
V II
PO
2 5
27.
5.Получили формулу веществаPO
2 5
28.
Составление формулсложных веществ
(вывод формулы
сульфата алюминия)
29.
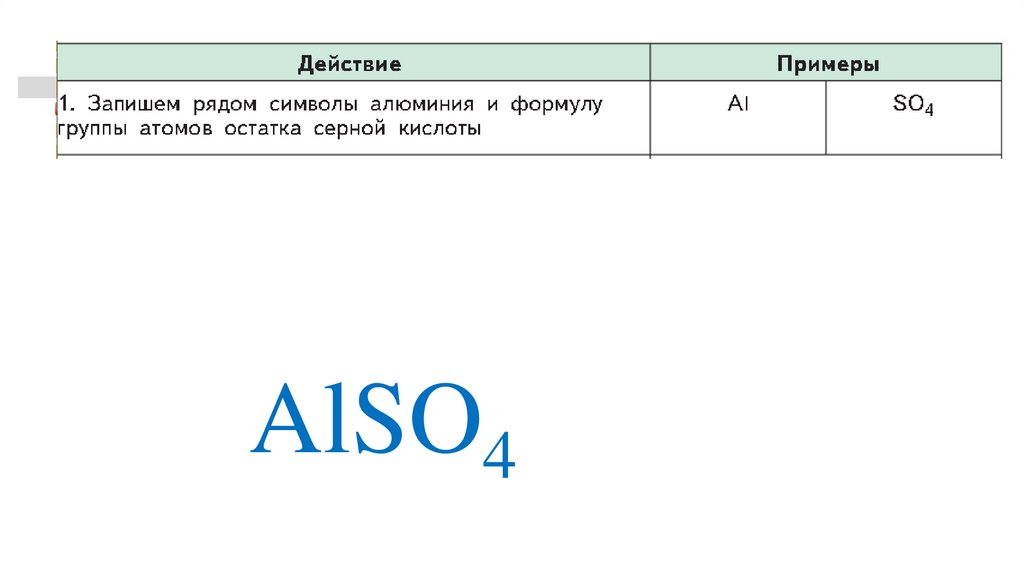
30.
AlSO431.
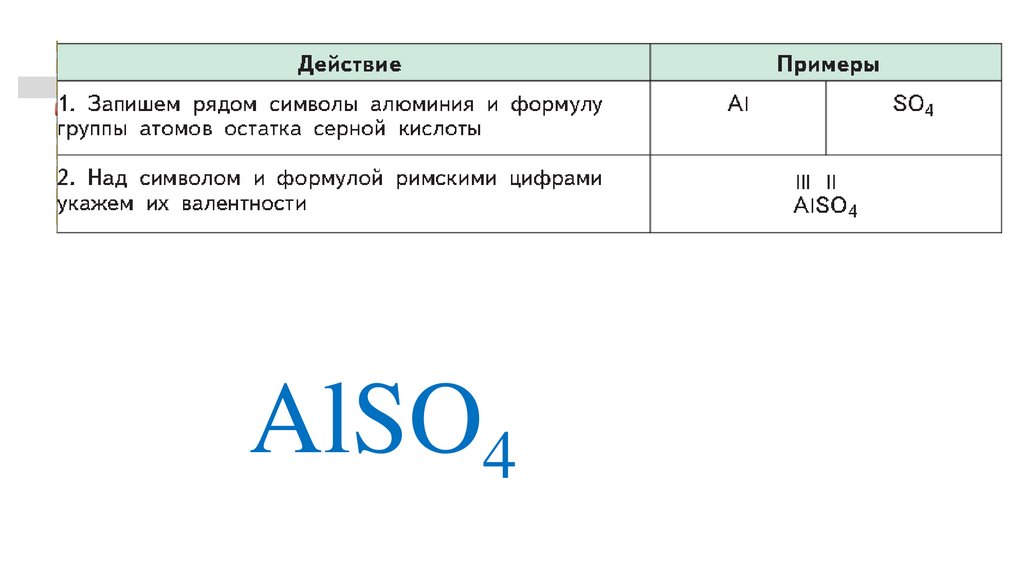
AlSO432.
IIIII
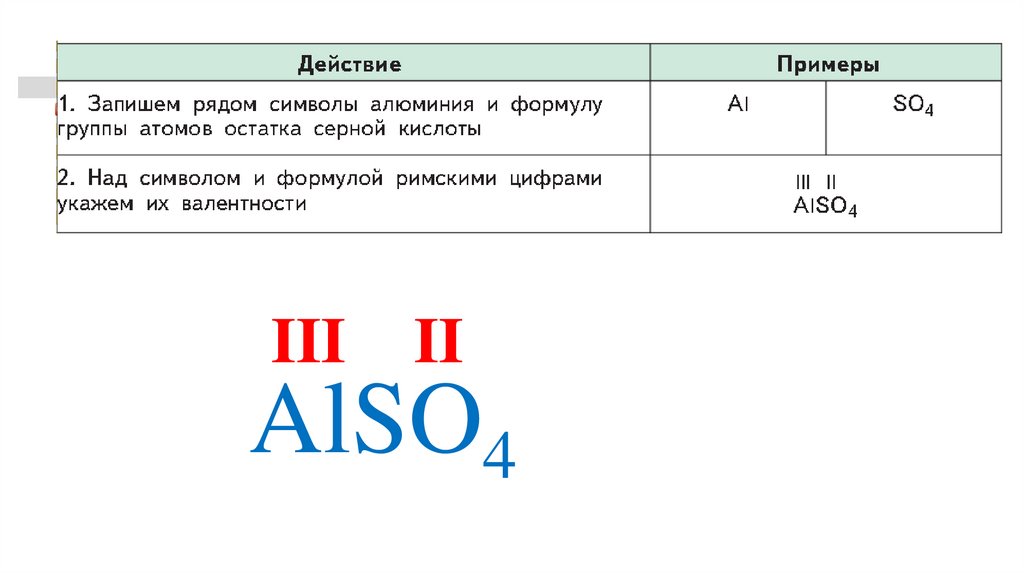
AlSO4
33.
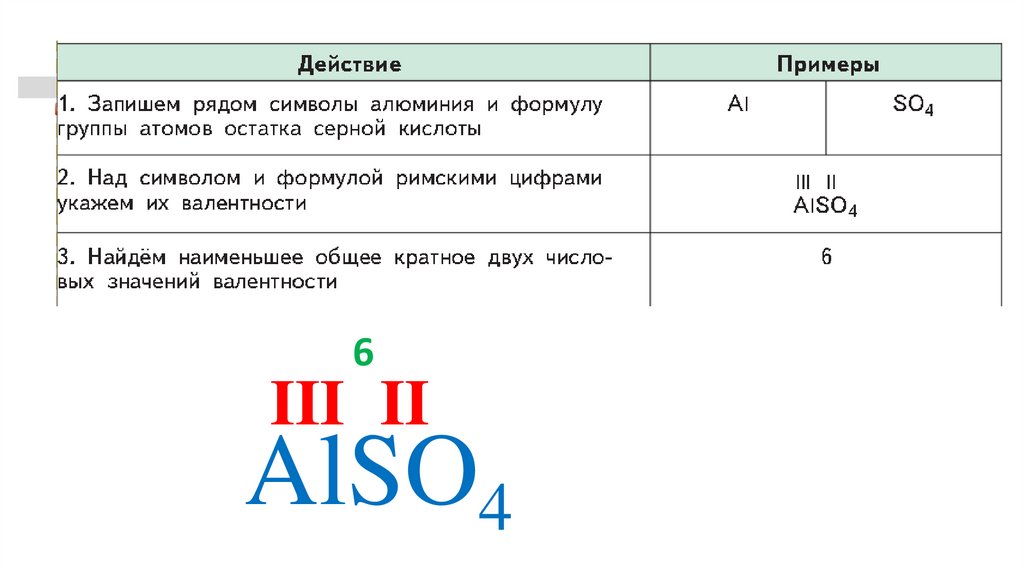
6III II
AlSO4
34.
6III
II
Al2SO4
35.
6III
II
Al2(SO4)3
36.
Al2(SO4)337.
Э -6. Упражнения.а) Составить формулу оксида азота IV
б) Определить валентность фосфора в соединении P2O3
38.
Э -5. Упражнения4
IV II
NO2
39.
Э -5. УпражненияIV II
NO2
40.
Э -5. Упражнения4
IV II
NO2
41.
Э -5. Упражнения4
IV II
NO2
42.
Э -5. Определить валентность элементовР2О3
43.
Э -5. Упражнения.II
Р2О3
44.
Э -5. Упражнения.Х
II
Р2О3
45.
Э -5. Упражнения.Х
II
Р2О3
Х∙2=2∙3
Х=3
46.
Э -5. Упражнения.III
II
Р2О3



























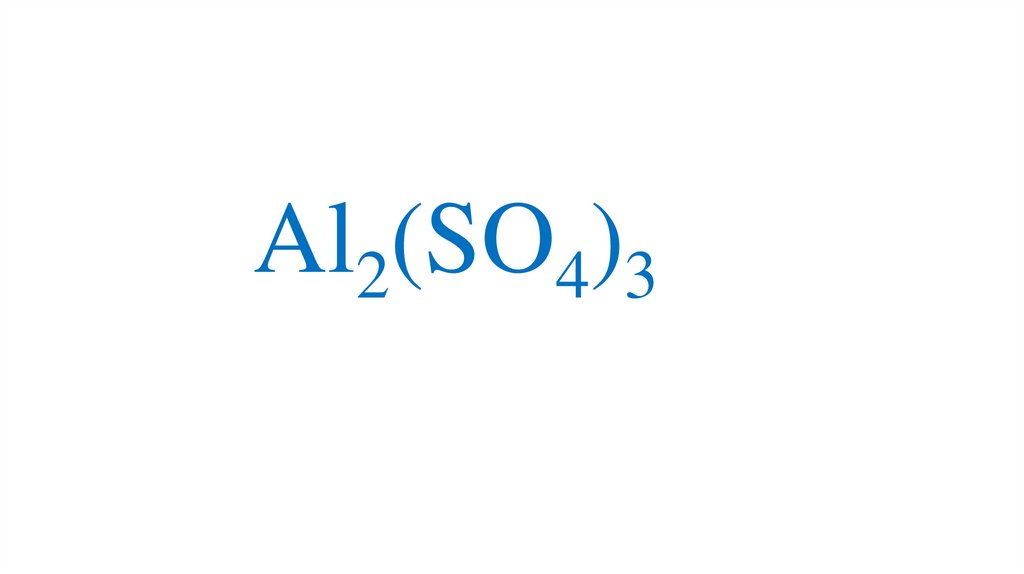




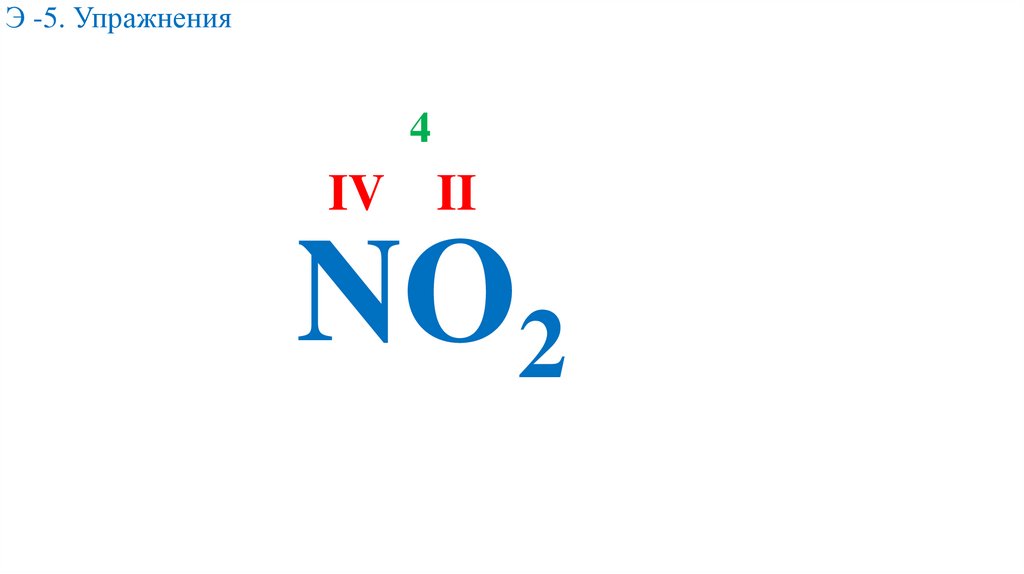


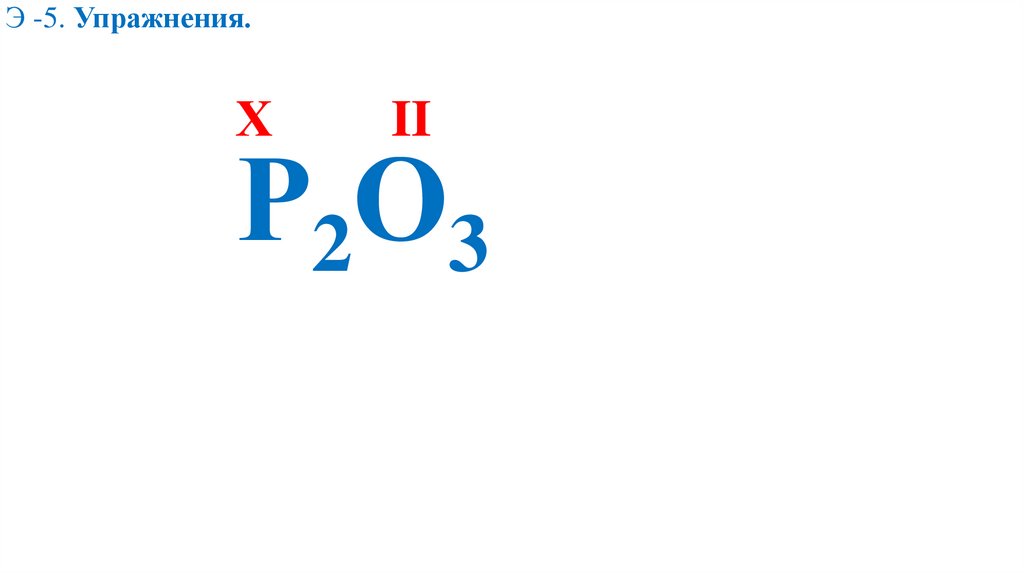
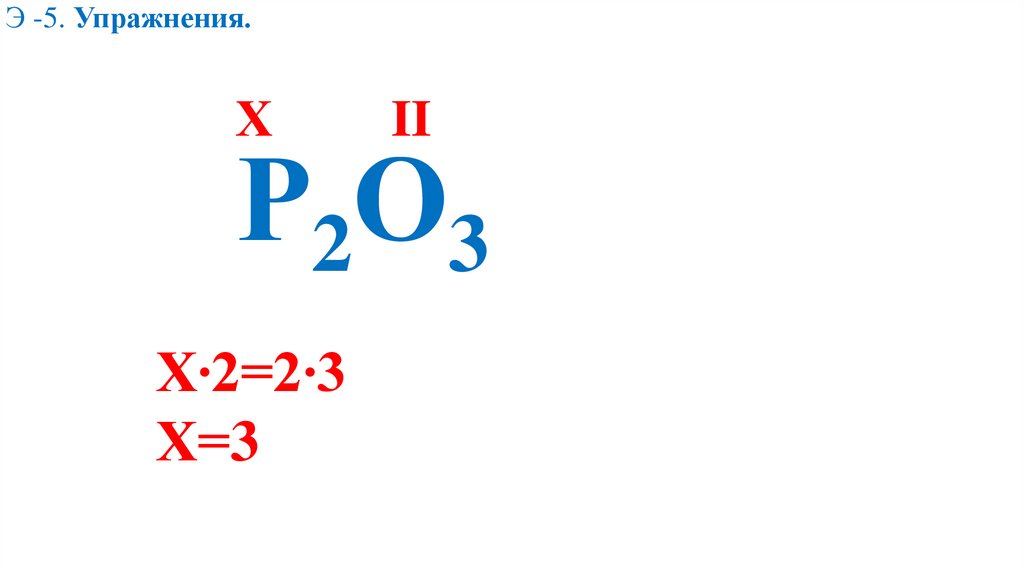
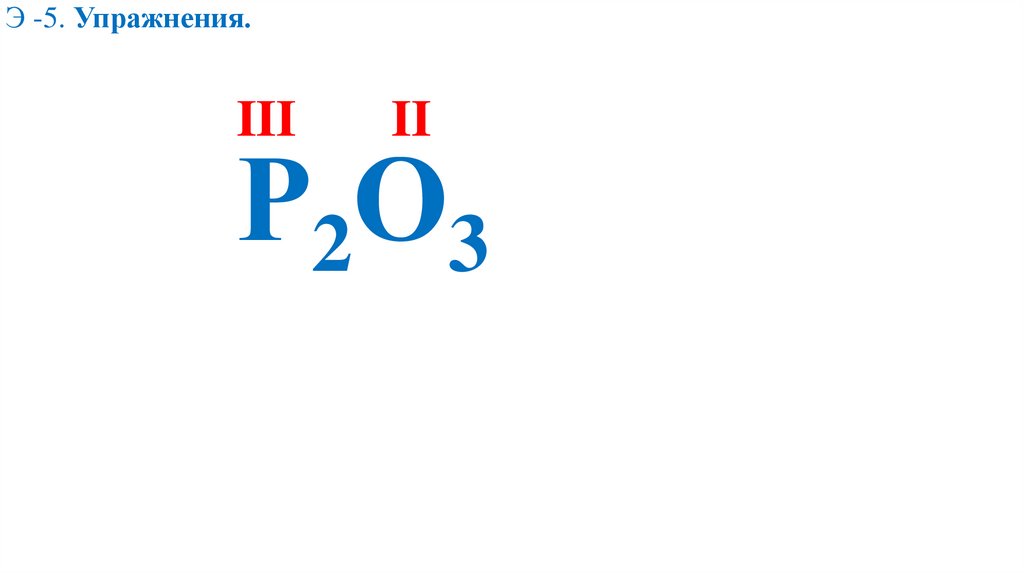
 chemistry
chemistry








