Similar presentations:
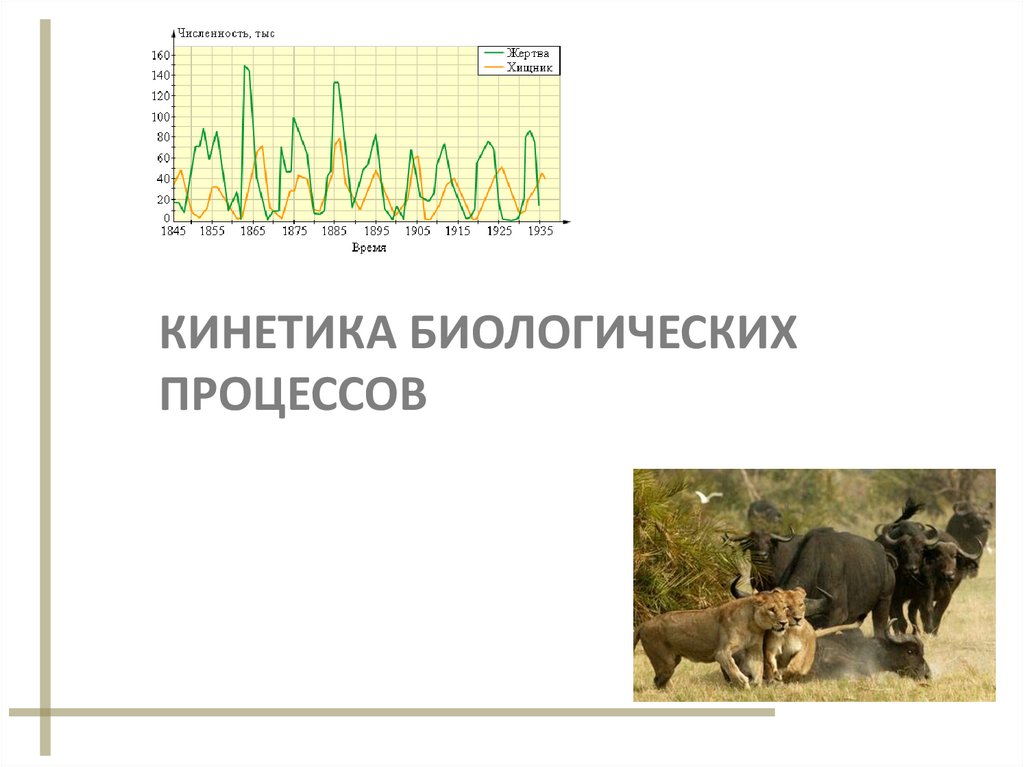
Кинетика биологических процессов
1. КИНЕТИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
2.
Основные понятия химической кинетики.Элементарные кинетические уравнения и их
решение.
Особенности кинетики биологических систем.
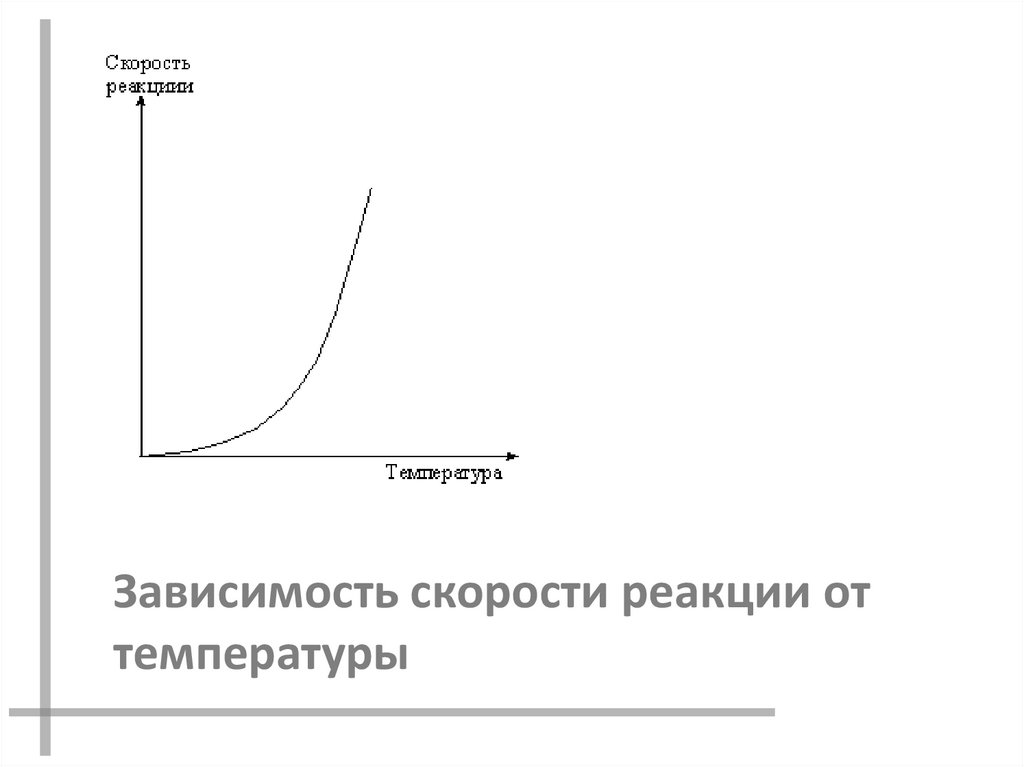
Зависимость скорости реакции от температуры.
Уравнение Аррениуса. Энергия активации.
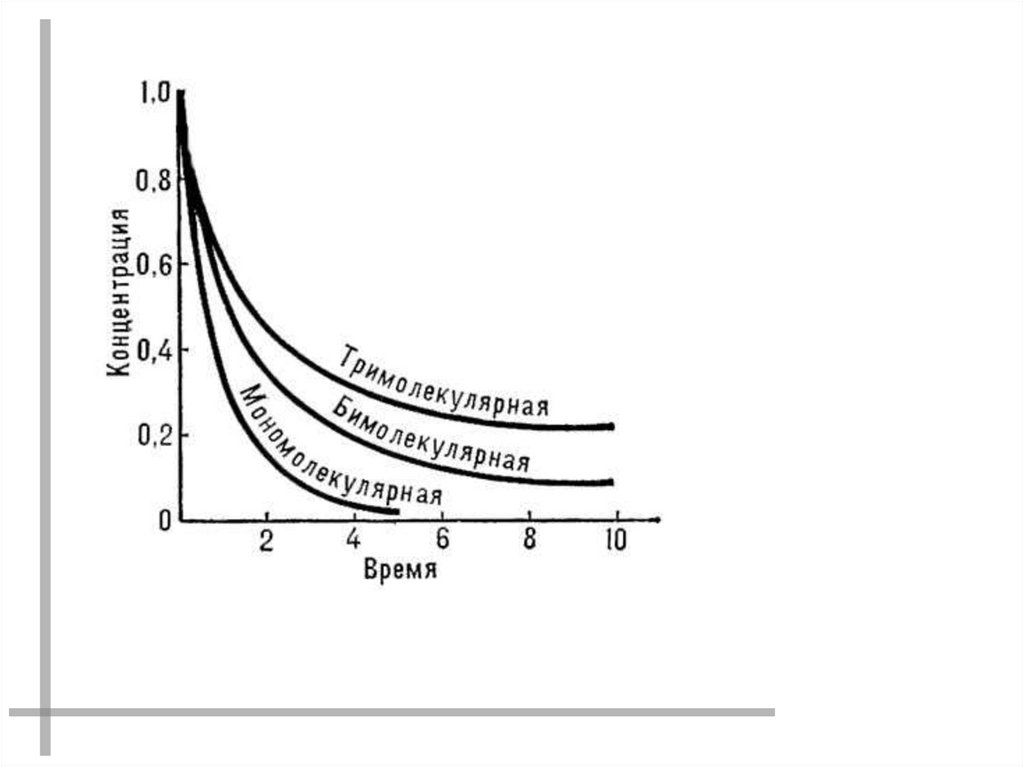
3. МОЛЕКУЛЯРНОСТЬ
Химические реакциимономолекулярные
бимолекулярные
тримолекулярные
A P
2A P
A+B+C P
A P+Q
A+B P
A+B+C P
+ Q + ...
A + B P + Q А + 2В P + Q
+ ...
4.
5.
ПОРЯДОК РЕАКЦИИПорядок реакции определяется величиной
показателя степени в кинетическом уравнении
aA+bB=cC+dD
v k A B
a
порядок прямой реакции
b
η=a+b
6.
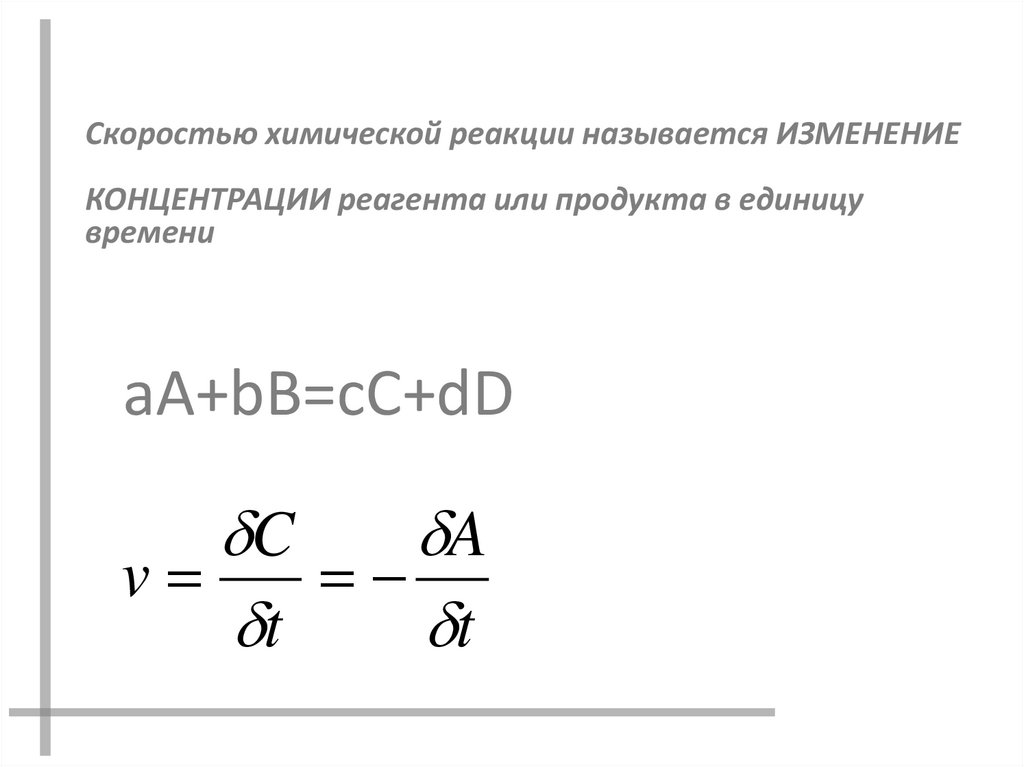
Скоростью химической реакции называется ИЗМЕНЕНИЕКОНЦЕНТРАЦИИ реагента или продукта в единицу
времени
aA+bB=cC+dD
C
A
v
t
t
7.
ЗАКОН ДЕЙСТВУЮЩИХ МАССЗакон действующих масс был
открыт в 1864–1867 годах
норвежскими учеными
К. Гульдберг
(1836–1902)
П. Вааге
(1833–1900)
aA+bB=cC+dD
Скорость химической реакции прямо пропорциональна
произведению концентраций реагирующих веществ в
степенях их стехиометрических коэффициентов.
v k A B
a
b
k- константа скорости реакции
является мерой реакционной
способности реагентов при данной
температуре
8.
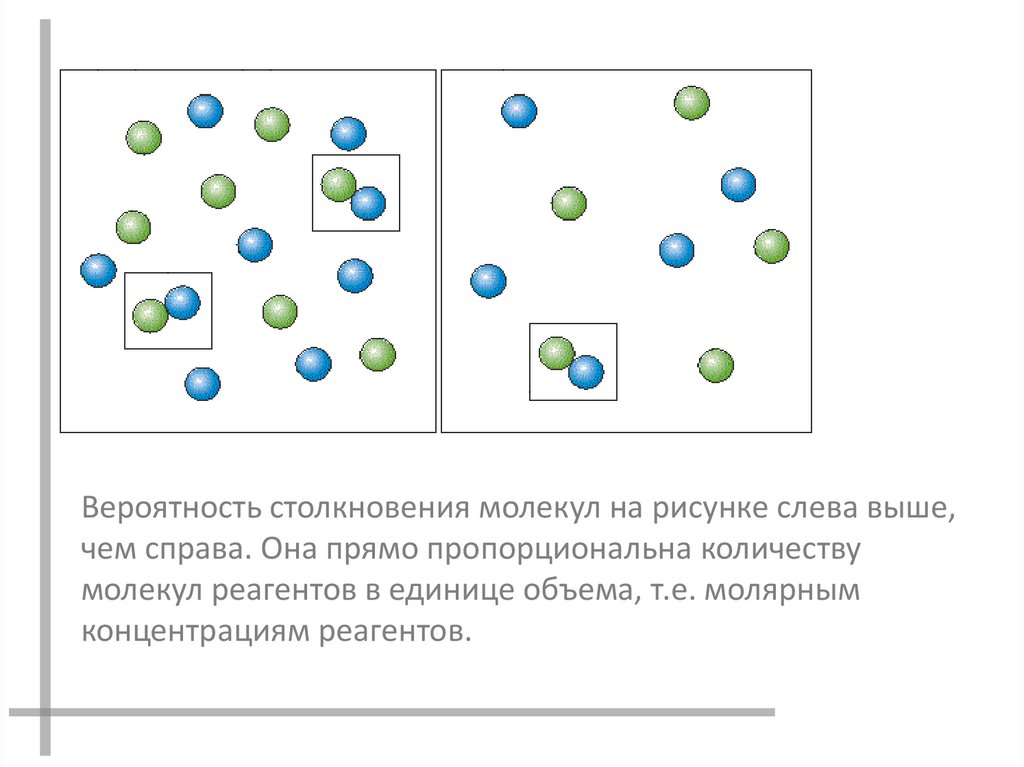
Вероятность столкновения молекул на рисунке слева выше,чем справа. Она прямо пропорциональна количеству
молекул реагентов в единице объема, т.е. молярным
концентрациям реагентов.
9.
ЭЛЕМЕНТАРНЫЕ КИНЕТИЧЕСКИЕУРАВНЕНИЯ И ИХ РЕШЕНИЕ
10.
РЕАКЦИЯ НУЛЕВОГО ПОРЯДКАko
А В
v
a
da
k0
dt
da k0dt
da
k
dt
0
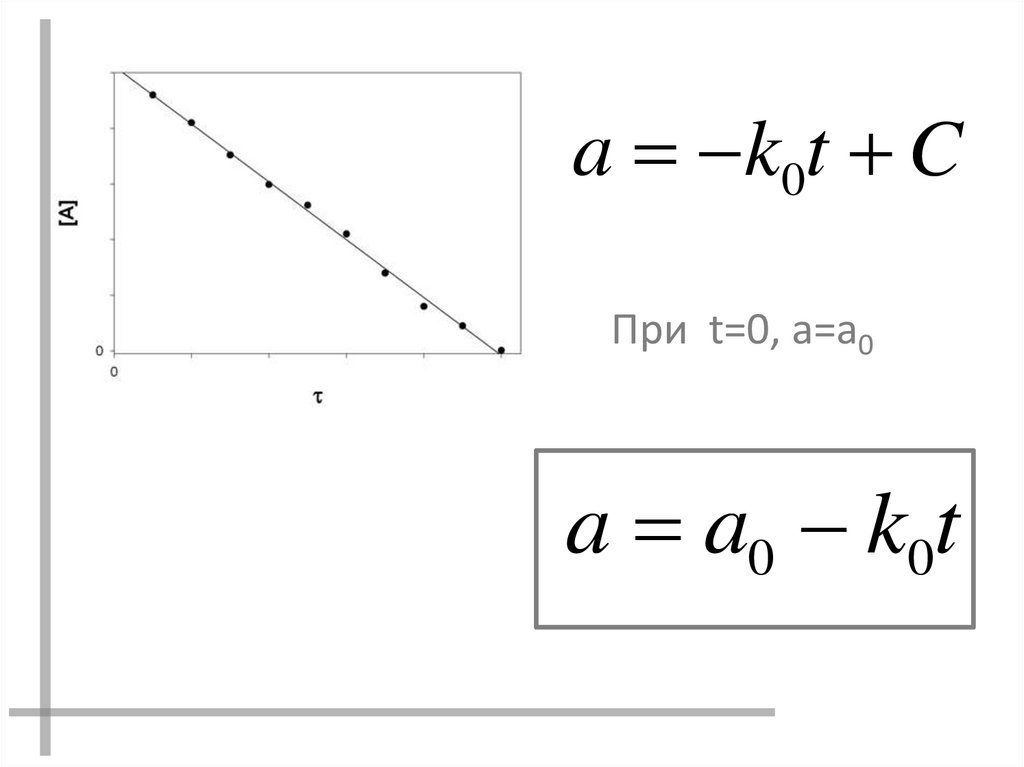
11.
a k 0t CПри t=0, a=a0
a a0 k0t
12.
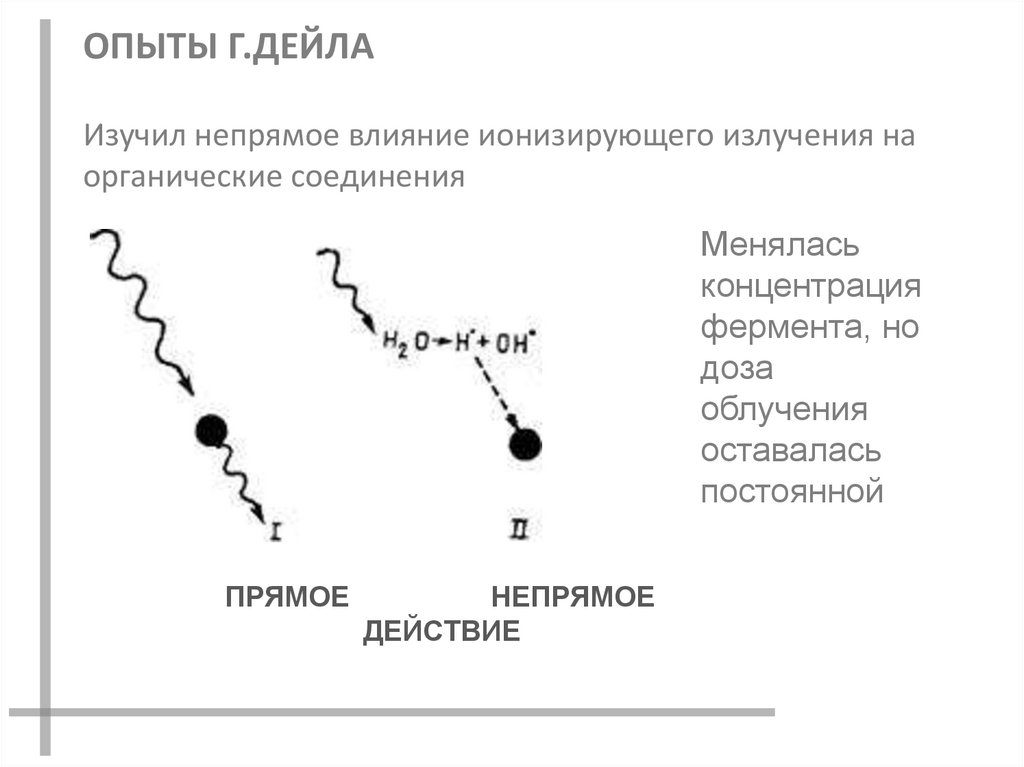
ОПЫТЫ Г.ДЕЙЛАИзучил непрямое влияние ионизирующего излучения на
органические соединения
Менялась
концентрация
фермента, но
доза
облучения
оставалась
постоянной
ПРЯМОЕ
НЕПРЯМОЕ
ДЕЙСТВИЕ
13.
ПРОДУКТЫ РАДИОЛИЗА ВОДЫ14.
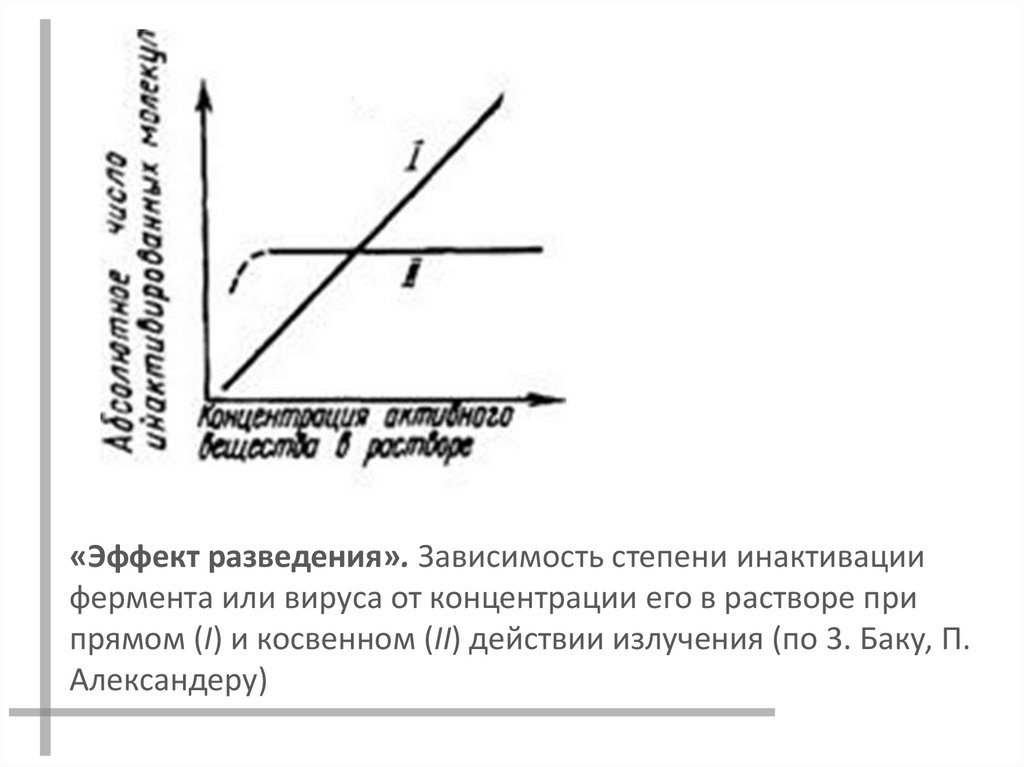
«Эффект разведения». Зависимость степени инактивациифермента или вируса от концентрации его в растворе при
прямом (I) и косвенном (II) действии излучения (по 3. Баку, П.
Александеру)
15.
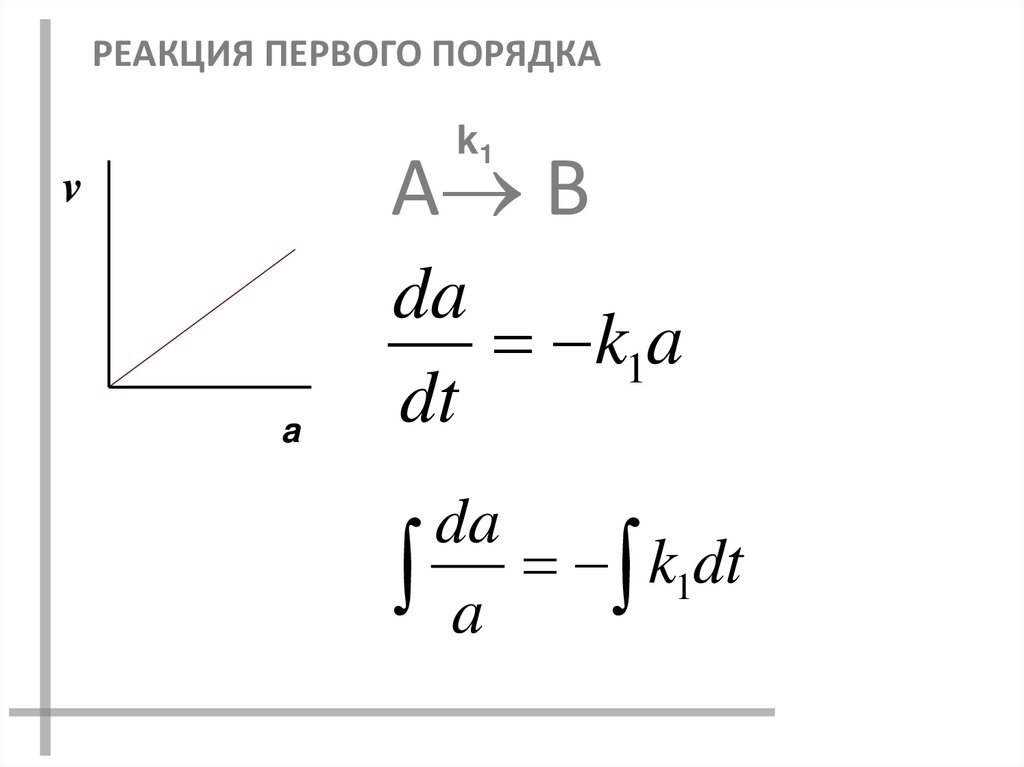
РЕАКЦИЯ ПЕРВОГО ПОРЯДКАk1
А В
v
a
da
k1a
dt
da
k
dt
1
a
16.
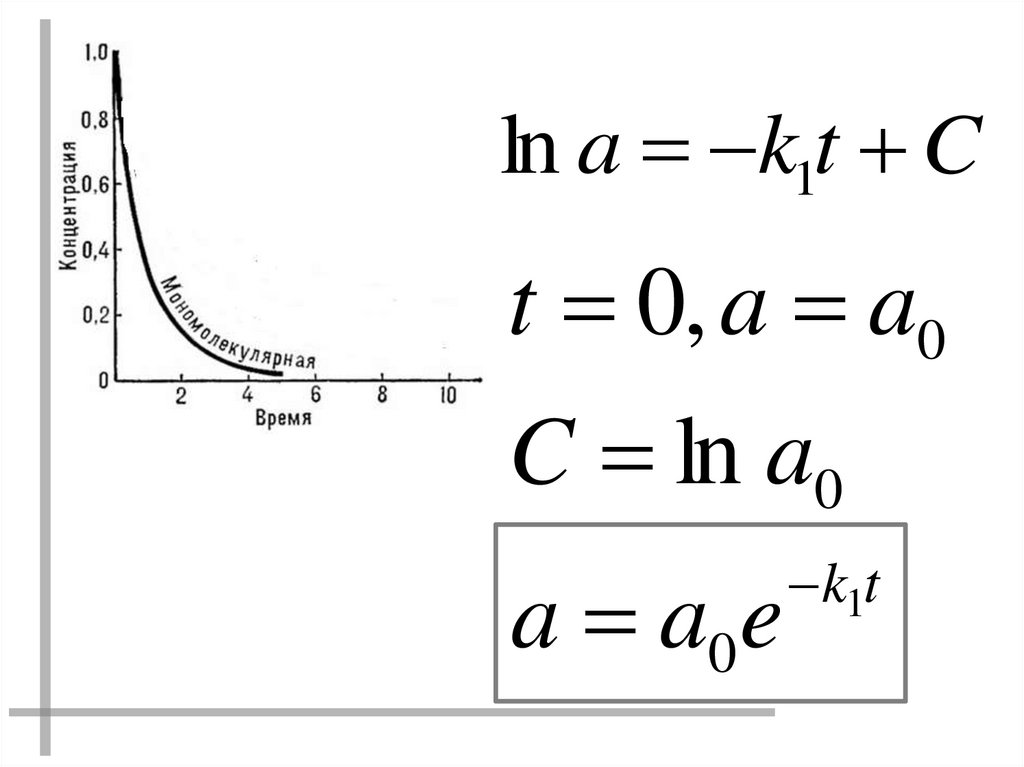
ln a k1t Ct 0, a a0
C ln a0
a a0e
k1t
17.
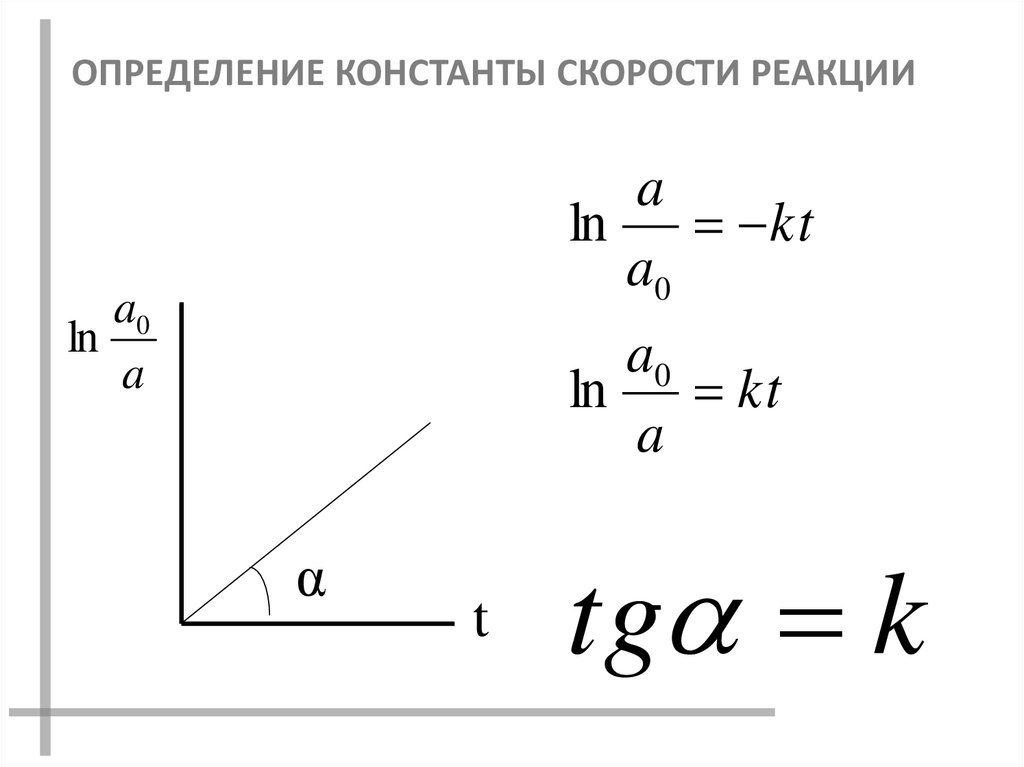
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИa
ln
kt
a0
a0
ln
a
a0
ln
kt
a
α
t
tg k
18.
Выражение для b найдем из условия закрытости системыa b a0
b a0 a
b a0 a0e
b a0 1 e
kt
kt
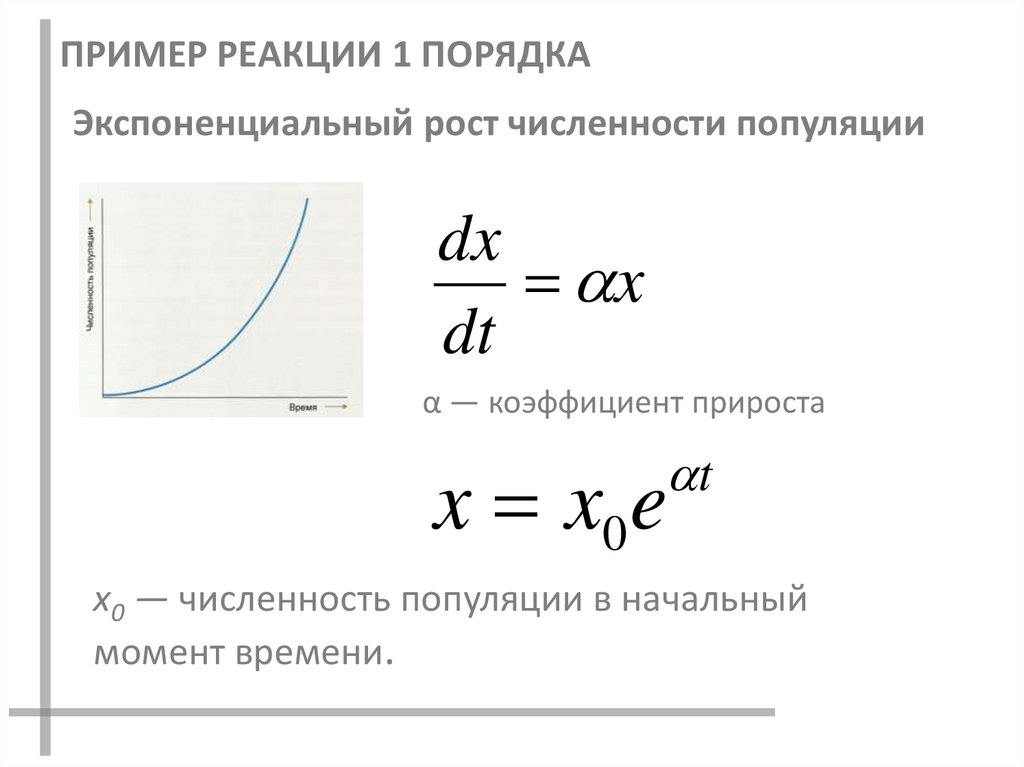
19. Пример реакции 1 порядка
ПРИМЕР РЕАКЦИИ 1 ПОРЯДКАЭкспоненциальный рост численности популяции
dx
x
dt
α — коэффициент прироста
t
x x0e
x0 — численность популяции в начальный
момент времени.
20.
Модель Мальтуса. Экспоненциальный ростнародонаселения
dx
x
dt
Т.Мальтус
(1766–1834)
8,01 миллиарда человек
α — коэффициент прироста
t
x x0e
x0 — численность популяции в
начальный момент времени.
https://im.kommersant.ru/ISSUES.PHOTO/CORP/2022/11/10/popul01%20(2)2222.png
21.
ОСОБЕННОСТИ КИНЕТИКИ БИОЛОГИЧЕСКИХ СИСТЕМ(БС)
1. В БС в качестве переменных выступают не только
концентрации, но и любые другие величины.
2. Переменные изменяются не только во времени, но и в
пространстве. Скорость определяется не только
константами реакции, но и диффузионными процессами.
3. БС пространственно неоднородны. Условия в разных
частях системы могут отличаться.
4. БС мультистационарны. Может быть несколько
устойчивых режимов функционирования.
5. Процессы в БС нелинейны.
6. Кинетические модели БС крайне сложные.
Моделирование требует большого числа упрощений.
22. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ ЭНЕРГИЯ АКТИВАЦИИ
23.
Я. Х. Вант-Гофф(1852–1911)
24.
Зависимость скорости реакции оттемпературы
25.
С. А.Аррениусk Ae
A pz
Ea
RT
(1859–1927)
k pze
Ea - энергия активации
Ea
RT
26.
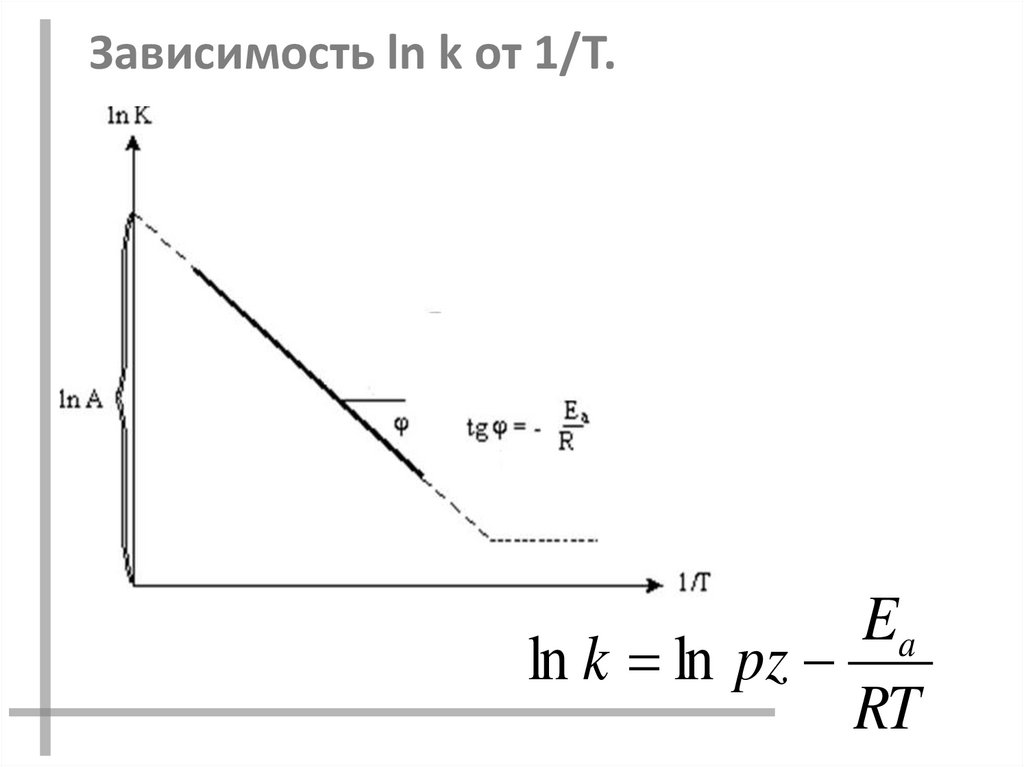
Зависимость ln k от 1/T.Ea
ln k ln pz
RT
27.
28.
29.
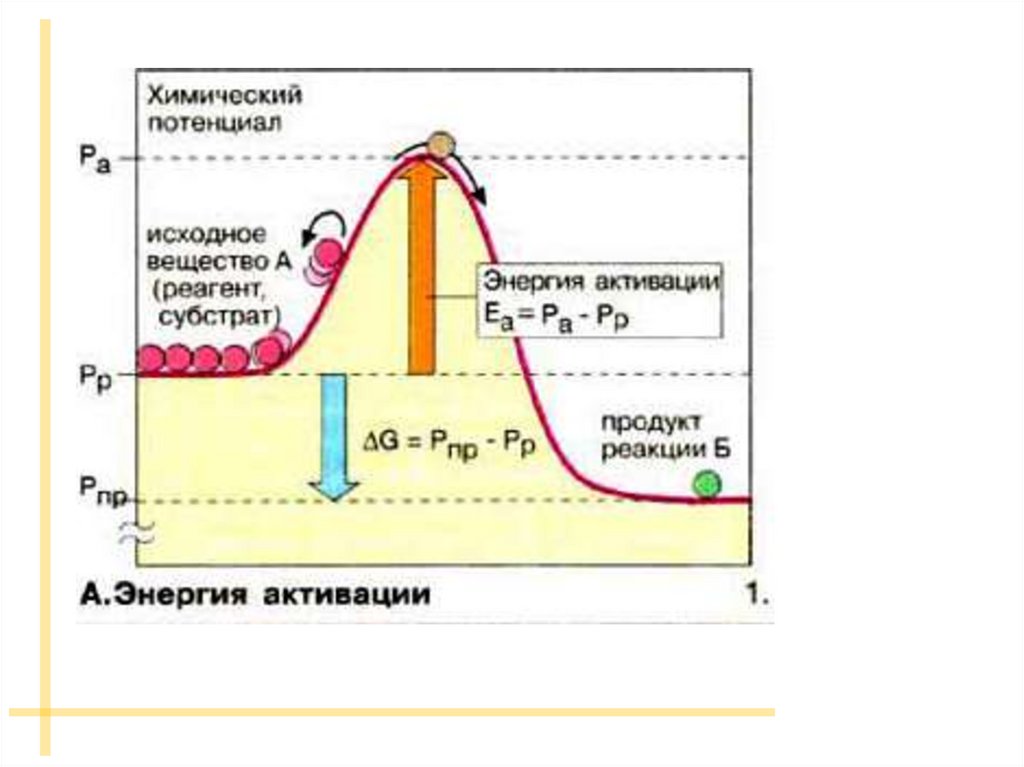
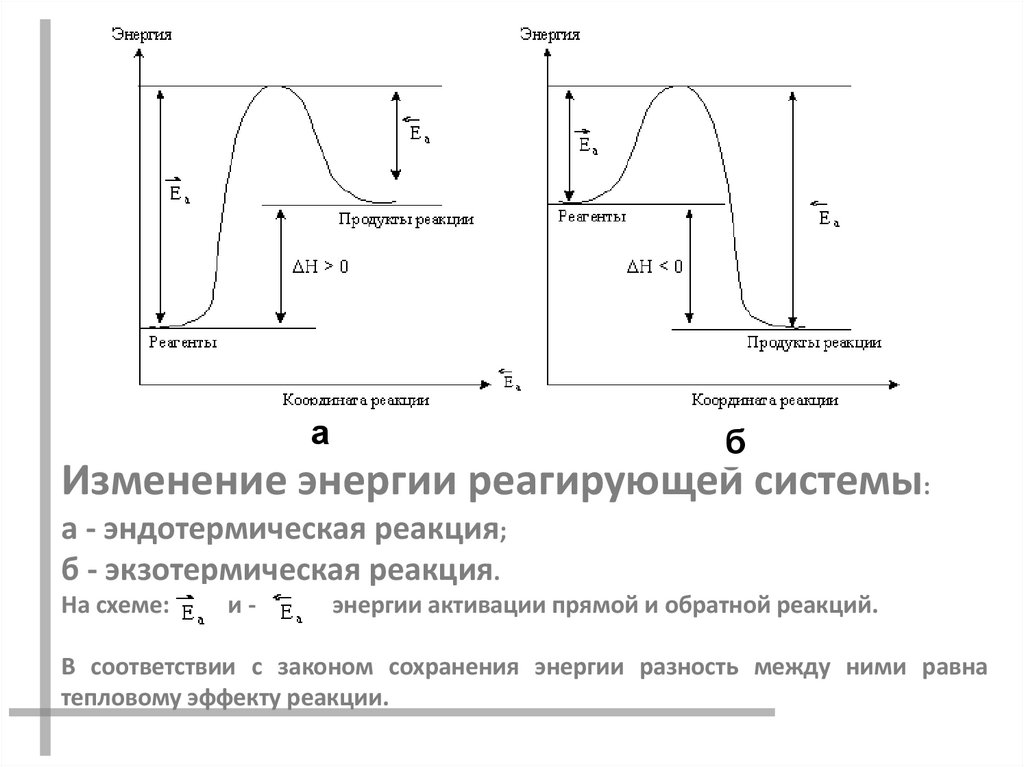
аб
Изменение энергии реагирующей системы:
а - эндотермическая реакция;
б - экзотермическая реакция.
На схеме:
и-
энергии активации прямой и обратной реакций.
В соответствии с законом сохранения энергии разность между ними равна
тепловому эффекту реакции.
30.
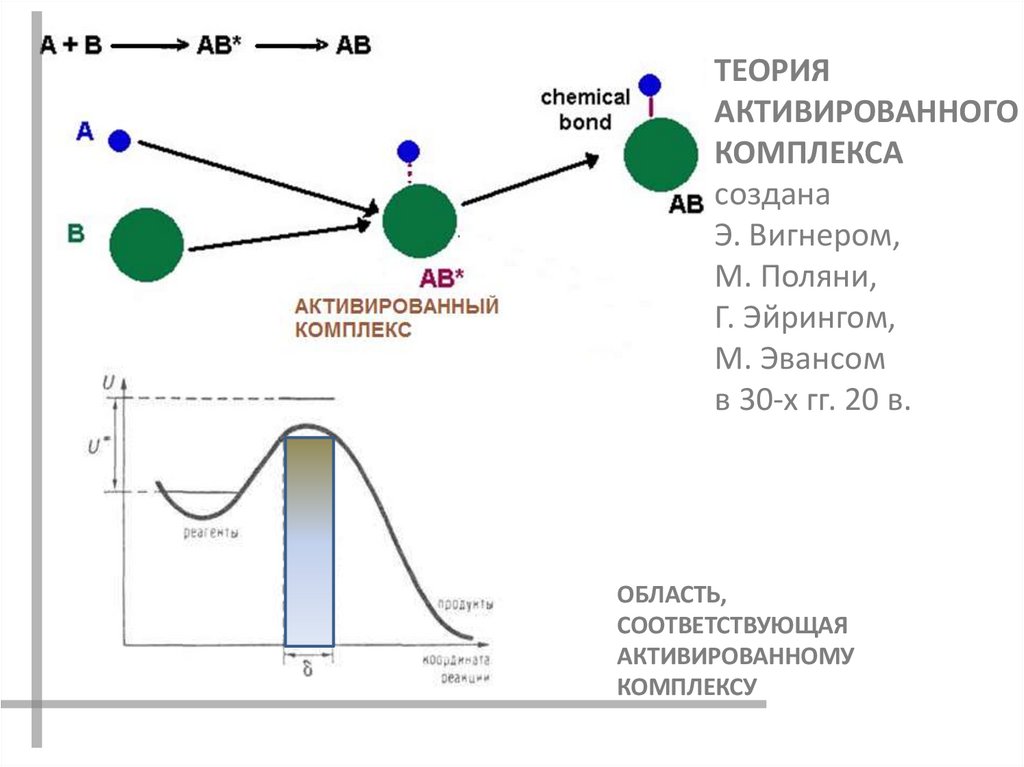
ТЕОРИЯАКТИВИРОВАННОГО
КОМПЛЕКСА
создана
Э. Вигнером,
М. Поляни,
Г. Эйрингом,
М. Эвансом
в 30-х гг. 20 в.
ОБЛАСТЬ,
СООТВЕТСТВУЮЩАЯ
АКТИВИРОВАННОМУ
КОМПЛЕКСУ
31.
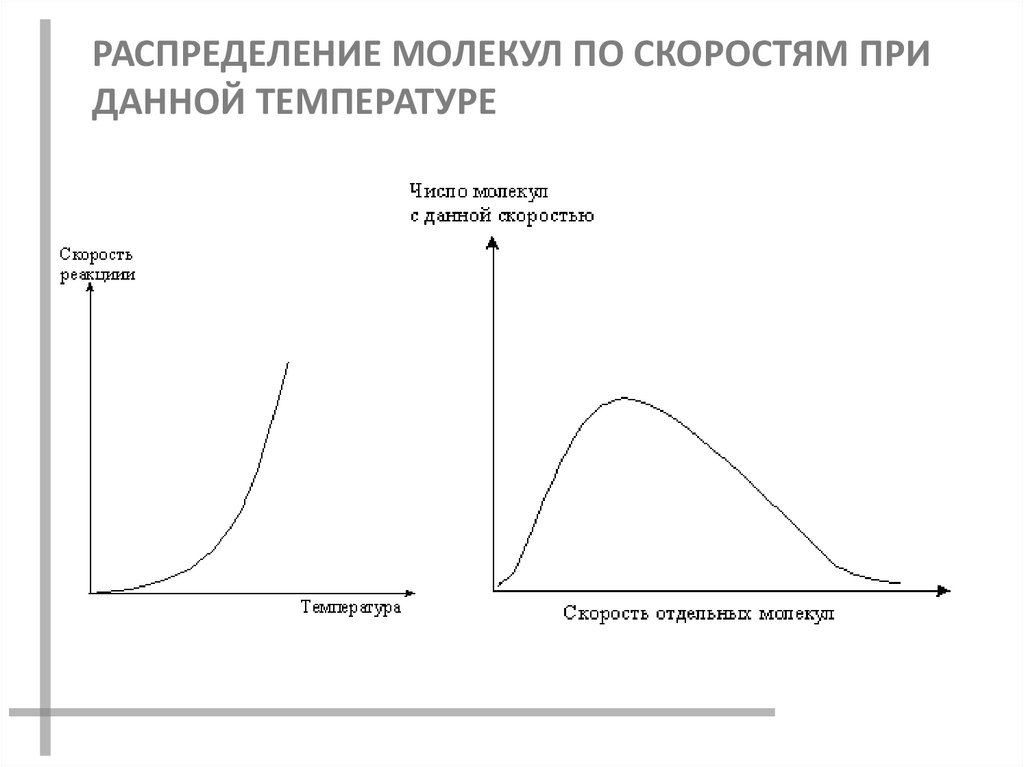
РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ ПРИДАННОЙ ТЕМПЕРАТУРЕ











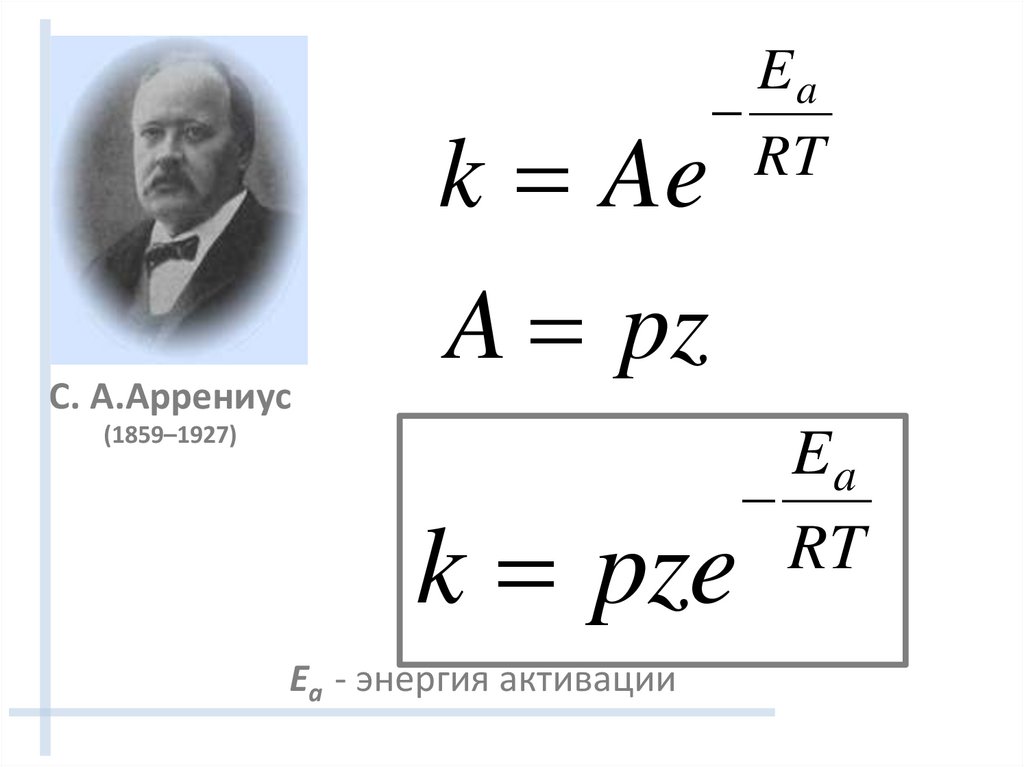

 chemistry
chemistry








