Similar presentations:
Коррозия изделий, произведенных из сплавов железа
1.
2. ?
Which metal do you use most often in everyday life?https://www.menti.com/alt6s43khvmk
3. Цели:
• 8.2.4.1 знать, что некоторые металлы подвергаются окислениюбыстрее других;
• 8.2.4.2 -описывать реакции взаимодействия активных металлов с
водой
• 8.2.4.3 -исследовать факторы, влияющие на возникновение коррозии
металлов
• 8.2.2.5 составлять уравнения реакций металлов с кислотами
• 8.2.4.8 -прогнозировать возможность протекания незнакомых
реакций замещения металлов, используя ряд активности металлов
4.
Коррозия изделий, произведенных из сплавов железаКрасно-коричневый налет состоит из оксида и
гидроксида железа (III)
Коррозия - это самопроизвольное разрушение металлов и сплавов в
результате химического, электрохимического или физико-химического
взаимодействия с окружающей средой.
5.
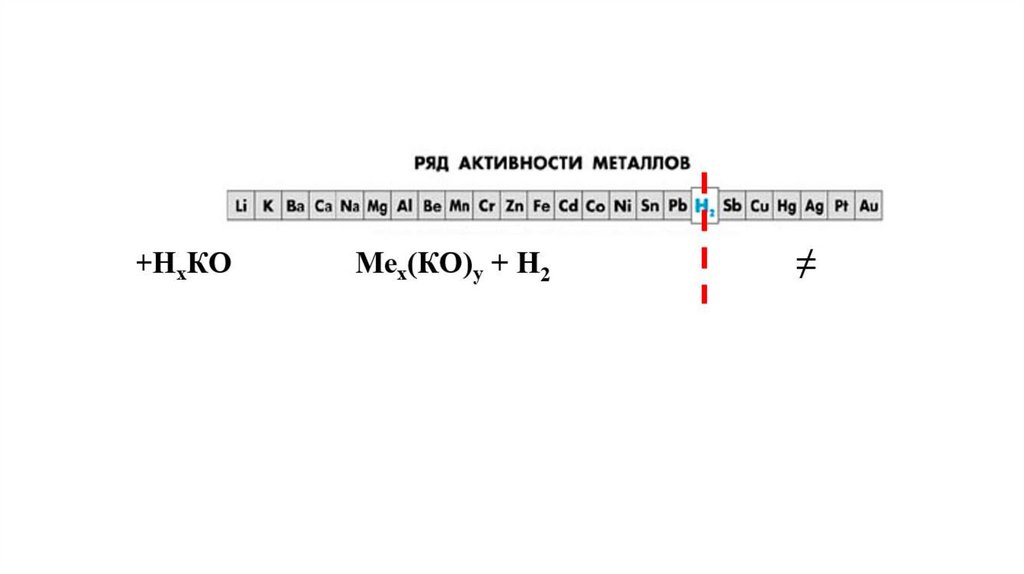
Ряд активности металловLi K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
Корродируют Корродируют
быстро
Не
корродируют
6.
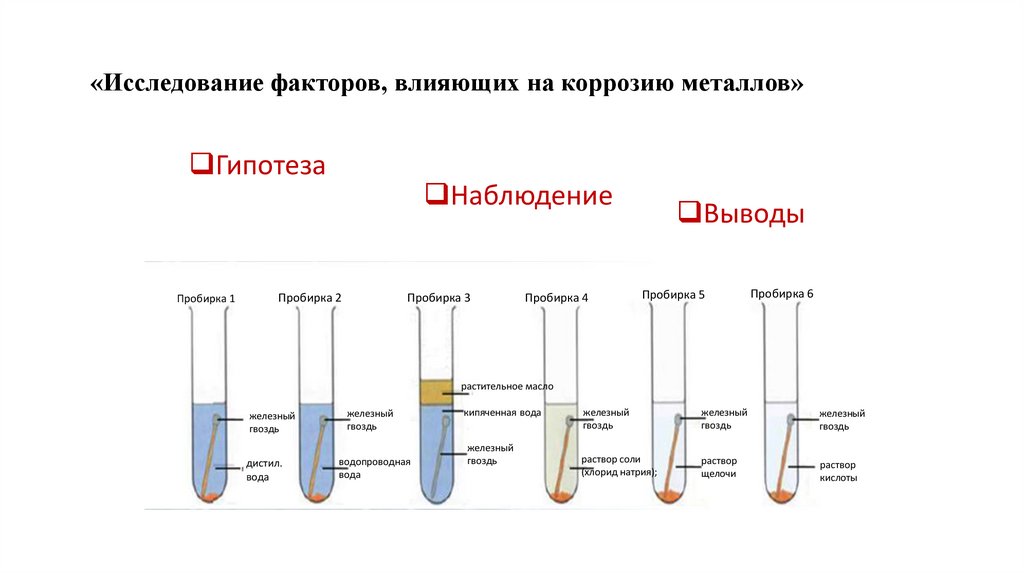
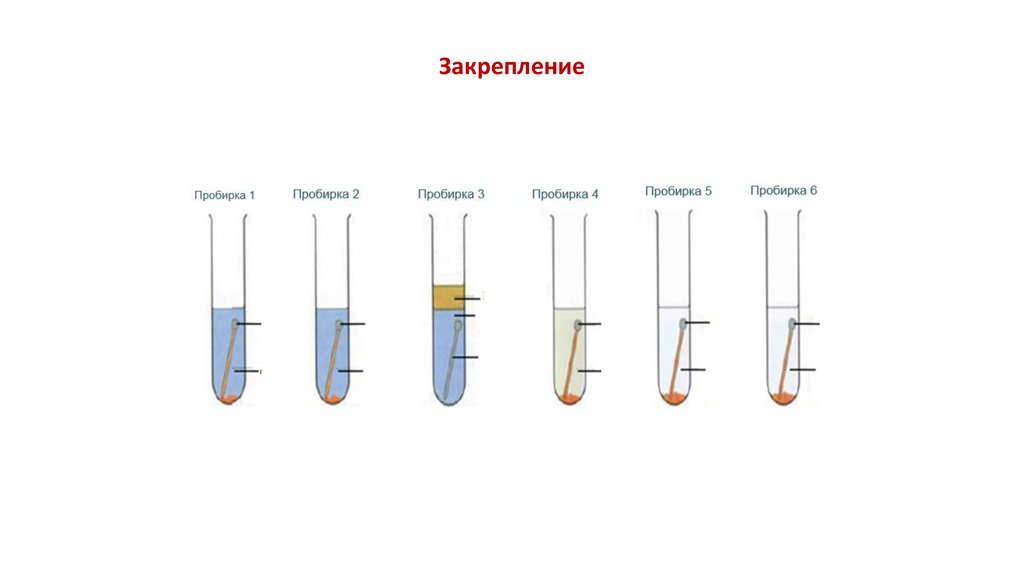
«Исследование факторов, влияющих на коррозию металлов»Гипотеза
Пробирка 1
Наблюдение
Пробирка 2
Пробирка 3
Пробирка 4
Выводы
Пробирка 5
Пробирка 6
растительное масло
железный
гвоздь
дистил.
вода
железный
гвоздь
водопроводная
вода
кипяченная вода
железный
гвоздь
железный
гвоздь
железный
гвоздь
железный
гвоздь
раствор соли
(хлорид натрия);
раствор
щелочи
раствор
кислоты
7.
Выводы по результатам наблюдений:Пробирка №1:
Поскольку средой коррозии является
вода, гвоздь соприкосаясь с водой
подвергся слабой коррозии.
Дистилированная вода – чистая вода
без примесей, но в ней присутствует
растворенный кислород (пробирка не
закрыта). Поэтому, в пробирке №1
происходит медленная коррозия
металла.
8.
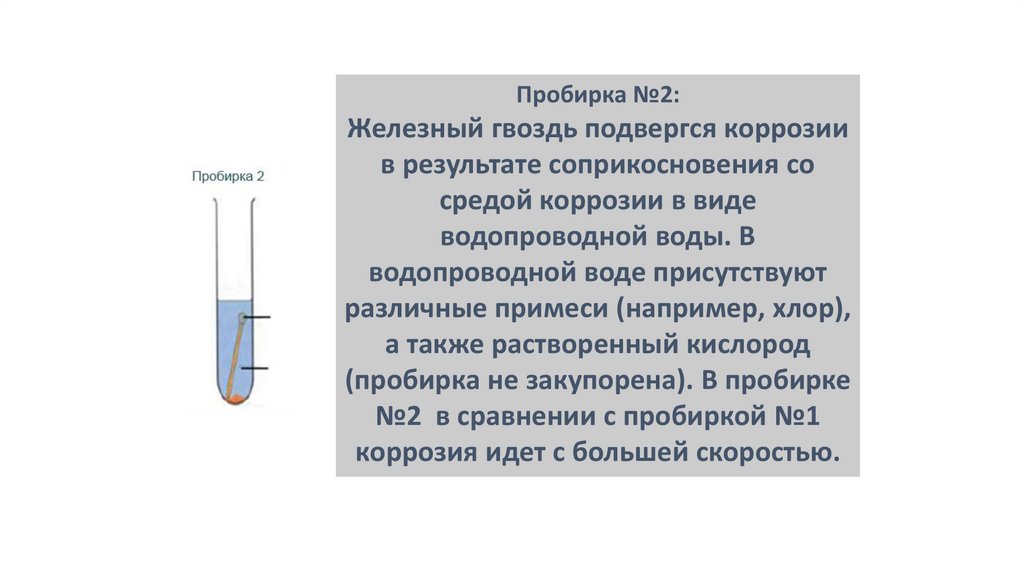
Пробирка №2:Железный гвоздь подвергся коррозии
в результате соприкосновения со
средой коррозии в виде
водопроводной воды. В
водопроводной воде присутствуют
различные примеси (например, хлор),
а также растворенный кислород
(пробирка не закупорена). В пробирке
№2 в сравнении с пробиркой №1
коррозия идет с большей скоростью.
9.
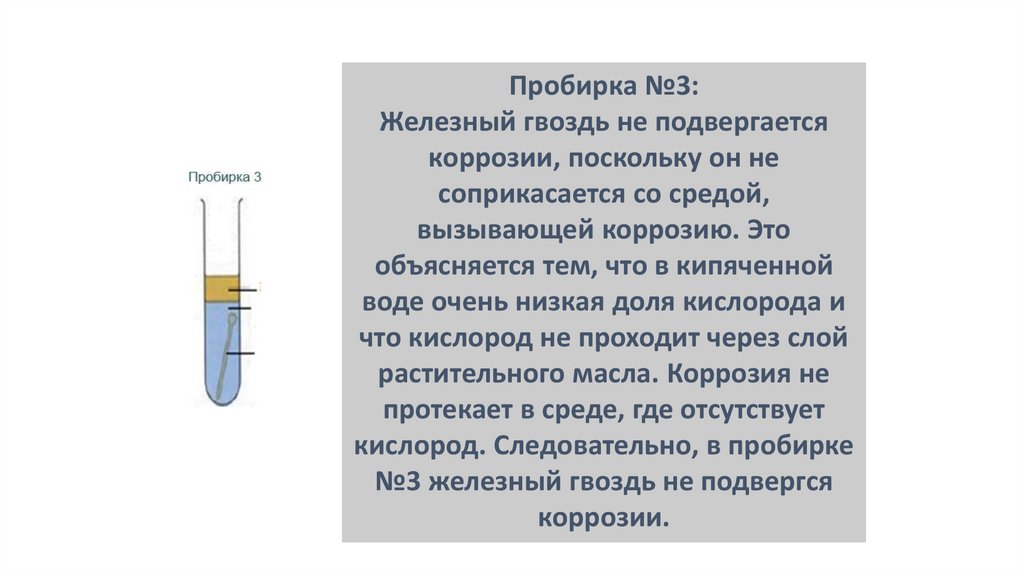
Пробирка №3:Железный гвоздь не подвергается
коррозии, поскольку он не
соприкасается со средой,
вызывающей коррозию. Это
объясняется тем, что в кипяченной
воде очень низкая доля кислорода и
что кислород не проходит через слой
растительного масла. Коррозия не
протекает в среде, где отсутствует
кислород. Следовательно, в пробирке
№3 железный гвоздь не подвергся
коррозии.
10.
Пробирка №4:Железный гвоздь подвергся
сильной коррозии, поскольку
был опущен в активную
среду - раствор соли. Он
разрушает железо с большой
скоростью.
11.
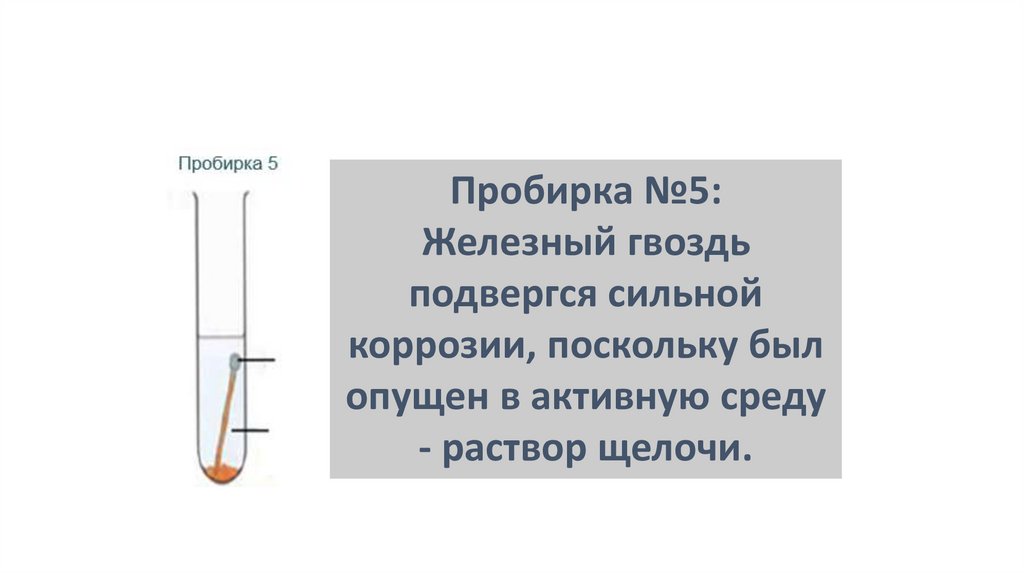
Пробирка №5:Железный гвоздь
подвергся сильной
коррозии, поскольку был
опущен в активную среду
- раствор щелочи.
12.
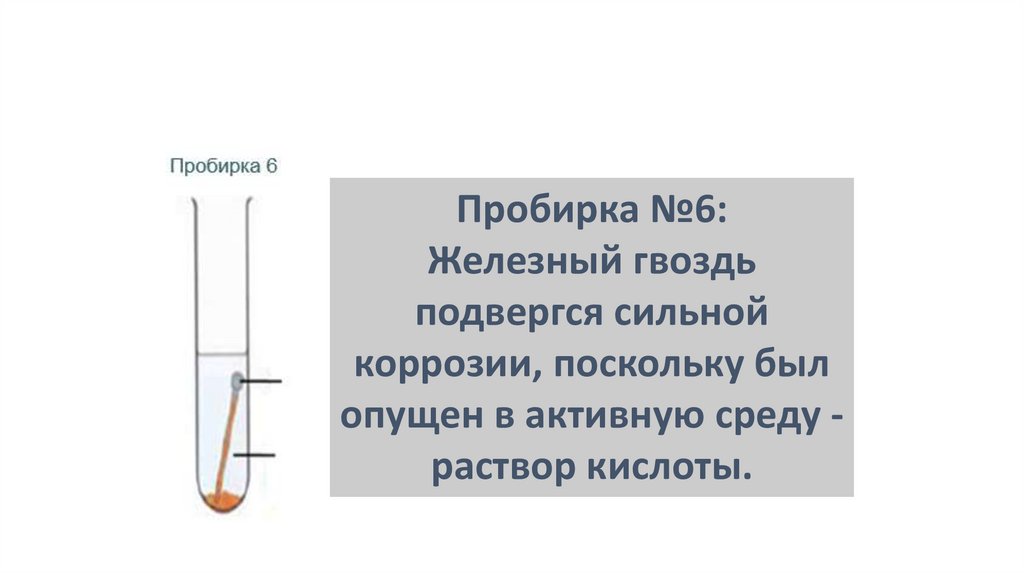
Пробирка №6:Железный гвоздь
подвергся сильной
коррозии, поскольку был
опущен в активную среду раствор кислоты.
13.
Закрепление14. Взаимодействие металлов с кислородом и водородом
15.
У большинства металлов на внешнем слое присутствуетнебольшое количество электронов (1-3), в связи с чем,
во многих реакциях они выступают в роли
восстановителя и отдают свои электроны.
Многие металлы являются обладают высокой
активностью и легко вступают в реакции присоединения
с неметаллами, с реакциями замещения с водой,
кислотами и солями.
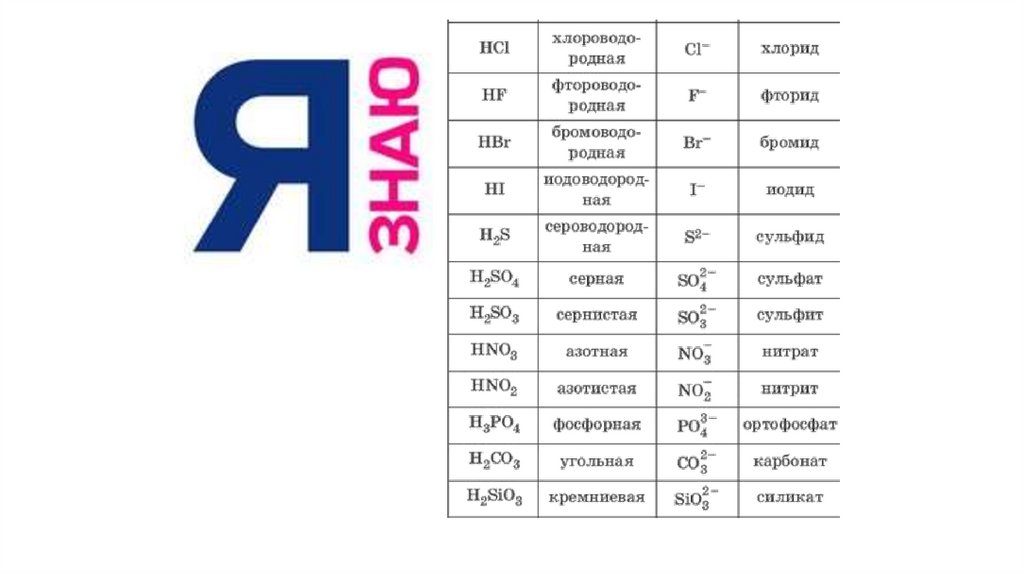
16. А знаешь ли ты формулы кислот?
Кислоты…?17.
18.
Что такое кислота?Кислоты – соединения,
состоящие из атомов водорода
и кислотных остатков.
19.
Что такое соль?Соли – соединения, состоящие
из атомов металла и
кислотных остатков.
20.
Что такое реакция замещения?Реакция замещения – реакция,
протекающая между
элементами и соединениями,
при которой атомы элемента
замещают атомы одного из
элементов в соединении.
21.
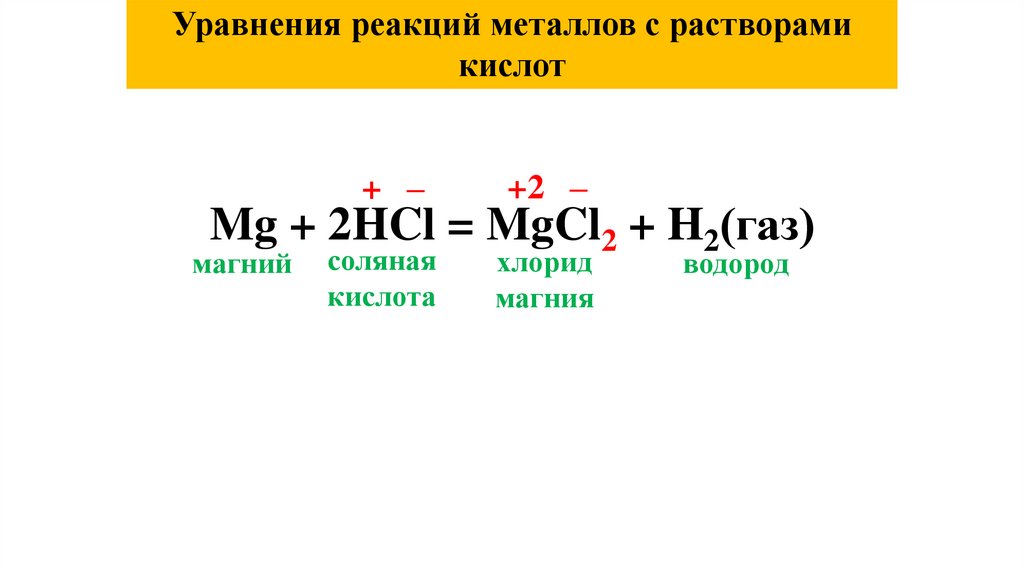
Уравнения реакций металлов с растворамикислот
+ –
+2 –
соляная
кислота
хлорид
магния
Mg + 2HCl = MgCl2 + H2(газ)
магний
водород
22. Как реагируют металлы с водой?
Активные металлы энергично взаимодействуют с водойпри обычных условиях по схеме:
2Me + 2nH2O → 2Me(OH)n + nH2
Металлы средней активности взаимодействуют с
водой при нагревании по схеме: 2Me + nH2O
Me2On + nH2
Металлы, стоящие после водорода не
реагируют с водой.
23.
24. Group work
25. Group 1
Медные предметы после погружения враствор хлорида ртути (II) становятся как
бы «серебряными». Объясните это явление.
Запишите уравнение реакции в тетрадь.
26. Group 2
Один из способов очистки ртути от примесейцинка и олова заключается в том, что ее
взбалтывают с раствором сульфата ртути
HgSO4.
В чем сущность этого способа очистки ртути.
Дайте обоснованный ответ.
27. Group 3
Найдите в ряду активности металл соследующими признаками
А) он не вытесняет водород из раствора
кислот
В) он вытесняет ртуть из раствора ее солей
28. Group 4
Приведите 2 примера реакции, где металлсможет вытеснить свинец из его раствора
Приведите 2 примера, где металл вытесняет
водород из раствора кислоты.
29.
Как ряд активности помогает предсказывать реакции?30.
Домашнее заданиеСоздать мини-постер / презентацию «Как защитить металл от
коррозии?»




















 chemistry
chemistry








