Similar presentations:
Биохимия межклеточного матрикса, коллагеновые белки, синтез, роль аскорбиновой кислоты. Неколлагеновые белки
1. Лекция 18: Биохимия межклеточного матрикса, коллагеновые белки, синтез, роль аскорбиновой кислоты. Неколлагеновые белки.
Металлопротеиназы.Дисциплина: Биохимия
для специальности 31.05.01 Лечебное дело
ИФОИТМ ТГМУ
доц. О. А. Артюкова
2. Основные вопросы лекции:
Биохимия соединительной ткани и межклеточного матрикса.Организация межклеточного матрикса.
Общие сведения о структуре коллагеновых белков.
Синтез коллагена. Этапы внутриклеточного синтеза: транскрипция, трансляция,
посттрансляционная модификация, роль аскорбиновой кислоты, формирование
коллагеновых фибрилл вне клетки.
Нарушения синтеза коллагеновых белков у человека.
Катаболизм белков межклеточного матрикса.
Регуляция активности матриксных металлопротеиназ.
Неколлагеновые белки межклеточного матрикса. Эластин. Синтез и распад эластина.
Изменения в структуре эластина при патологических процессах.
Протеогликаны и гликозаминогликаны. Протеогликаны базальных мембран.
Распад гликозаминогликанов. Мукополисахаридозы.
Неколлагеновые белки со специальными свойствами. Адгезивные белки.
Изменение соединительной ткани в онтогенезе и при заболеваниях.
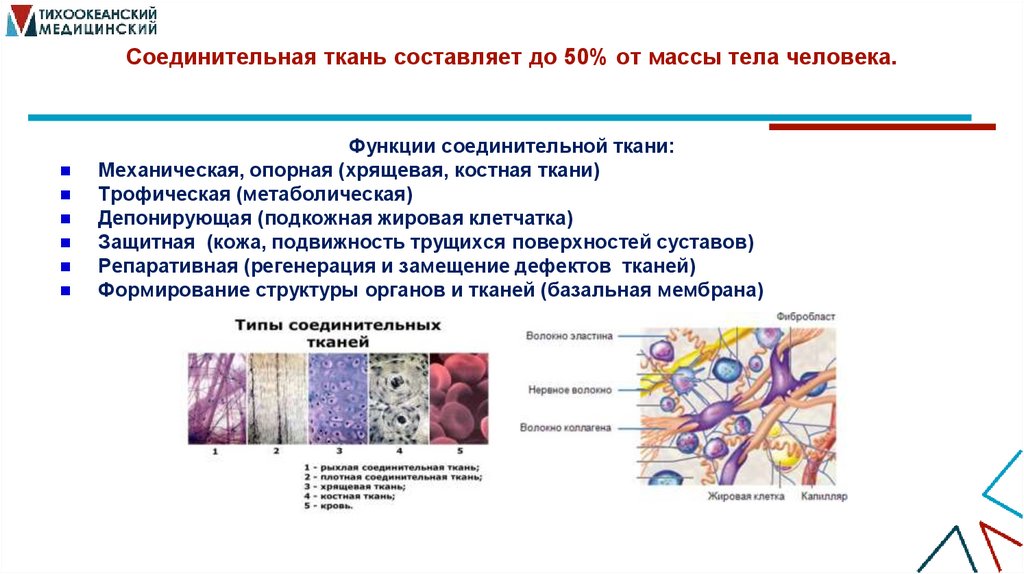
3. Соединительная ткань составляет до 50% от массы тела человека.
Функции соединительной ткани:Механическая, опорная (хрящевая, костная ткани)
Трофическая (метаболическая)
Депонирующая (подкожная жировая клетчатка)
Защитная (кожа, подвижность трущихся поверхностей суставов)
Репаративная (регенерация и замещение дефектов тканей)
Формирование структуры органов и тканей (базальная мембрана)
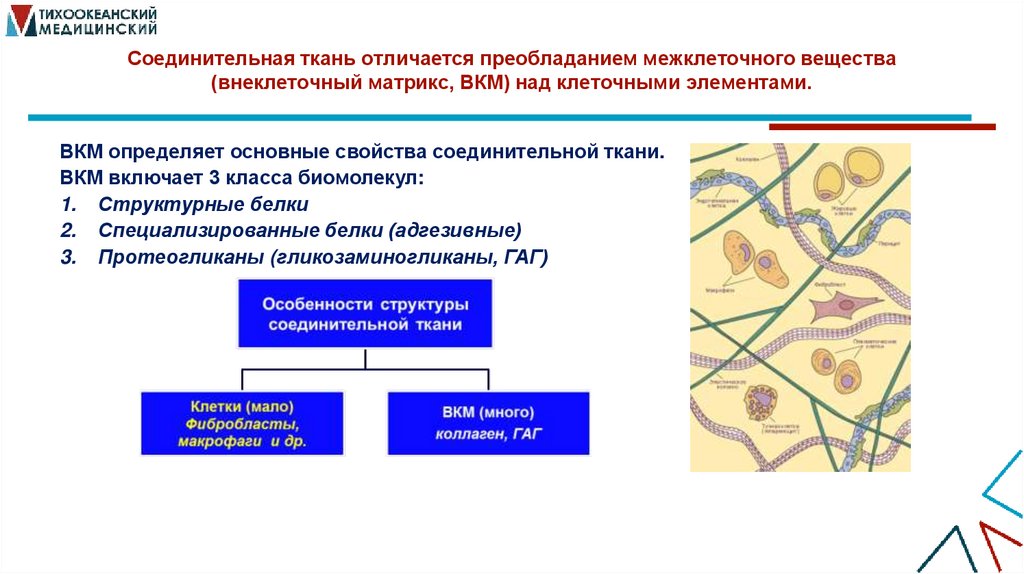
4. Соединительная ткань отличается преобладанием межклеточного вещества (внеклеточный матрикс, ВКМ) над клеточными элементами.
ВКМ определяет основные свойства соединительной ткани.ВКМ включает 3 класса биомолекул:
1. Структурные белки
2. Специализированные белки (адгезивные)
3. Протеогликаны (гликозаминогликаны, ГАГ)
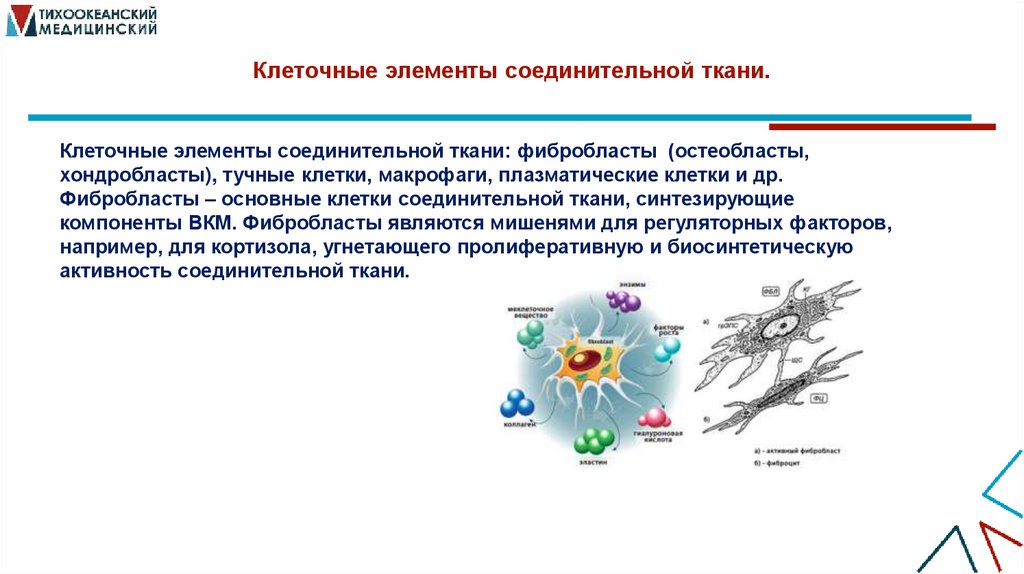
5. Клеточные элементы соединительной ткани.
Клеточные элементы соединительной ткани: фибробласты (остеобласты,хондробласты), тучные клетки, макрофаги, плазматические клетки и др.
Фибробласты – основные клетки соединительной ткани, синтезирующие
компоненты ВКМ. Фибробласты являются мишенями для регуляторных факторов,
например, для кортизола, угнетающего пролиферативную и биосинтетическую
активность соединительной ткани.
6. Клеточные элементы соединительной ткани и обмен компонентов ВКМ.
Фибробласты, остеобласты и др.Макрофаги, тучные клетки и др.
синтез органических и неорганических
компонентов ВКМ.
синтез ферментов, разрушающих
компоненты ВКМ.
ВКМ содержит молекулы, способные путём самосборки образовывать
высокоупорядоченную трёхмерную структуру, определяющую её
функциональные свойства. Обмен компонентов ВКМ происходит
внеклеточно и обеспечивает метаболизм соединительной ткани.
Соединительная ткань претерпевает возрастные изменения (старение).
С изменением метаболизма в соединительной ткани связано развитие важнейших
патологических процессов в организме (воспаление, метастазирование,
коллагенозы, мукополисахаридозы).
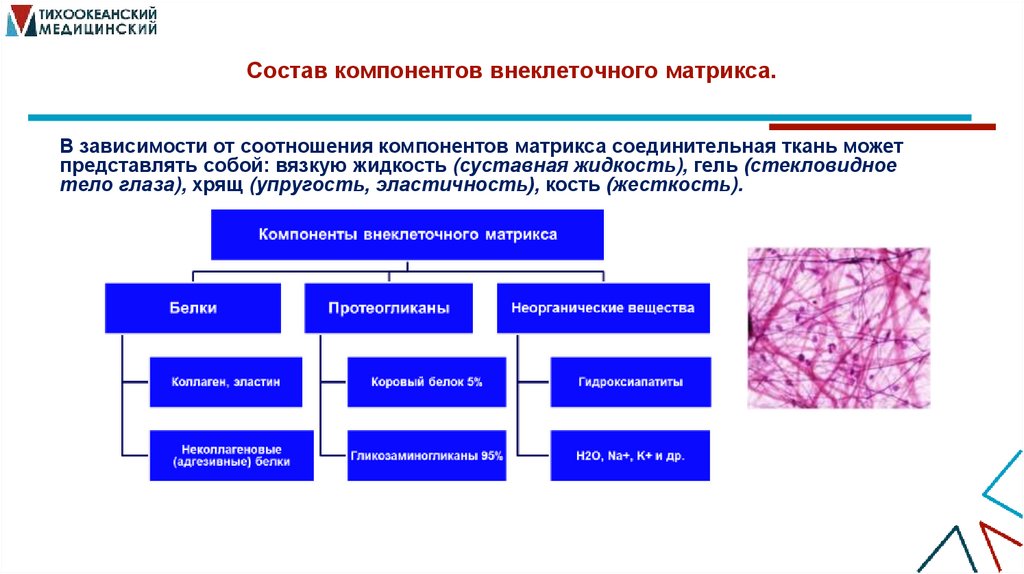
7. Состав компонентов внеклеточного матрикса.
В зависимости от соотношения компонентов матрикса соединительная ткань можетпредставлять собой: вязкую жидкость (суставная жидкость), гель (стекловидное
тело глаза), хрящ (упругость, эластичность), кость (жесткость).
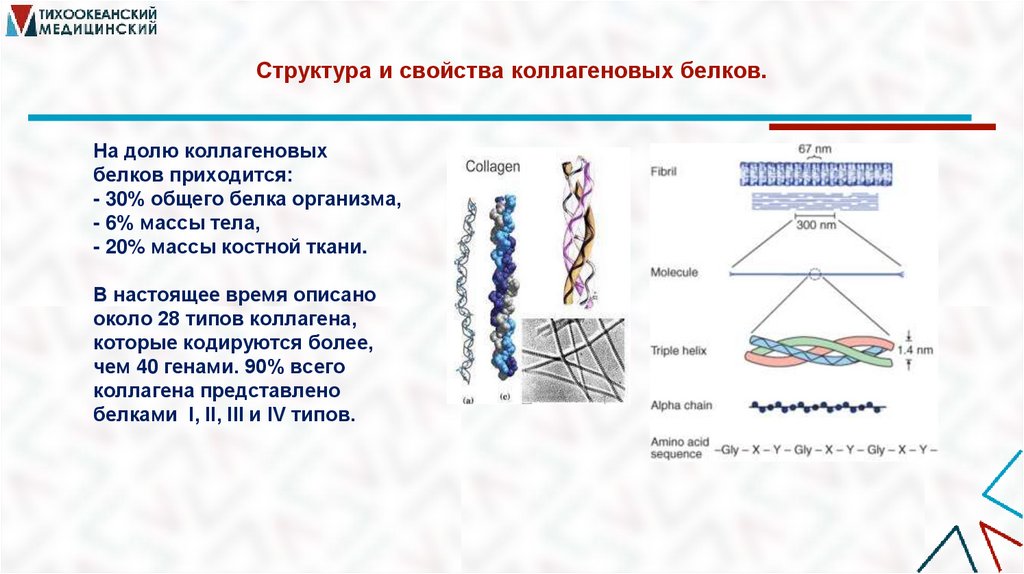
8. Структура и свойства коллагеновых белков.
На долю коллагеновыхбелков приходится:
- 30% общего белка организма,
- 6% массы тела,
- 20% массы костной ткани.
В настоящее время описано
около 28 типов коллагена,
которые кодируются более,
чем 40 генами. 90% всего
коллагена представлено
белками I, II, III и IV типов.
9. Типы коллагенов:
Фибриллообразующие коллагены (I, II, III, V, XI тип) имеют форму фибрилл и построеныиз структурных единиц, называемых тропоколлагенами. Молекулы тропоколлагена
(ММ 300 кДа) - толщина 1,5 нм, длина 300 нм.
Коллагены, ассоциированные с фибриллами ( IX, XII, XIV тип) не способны формировать
фибриллы, но, связываясь с фибриллярными коллагенами, ограничивают длину,
толщину и ориентацию фибрилл коллагенов I и II типов. Особенность- наличие в их
структуре как глобулярных, так и фибриллярных доменов.
Нефибриллярные (сетевидные) типы коллагена ( IV, VIII и X тип) формируют сетевидные
структуры. Наиболее распространен коллаген IV типа - основной структурный белок
базальных мембран.
Коллагены, образующие микрофибриллы ( VI тип) - короткоцепочечные белки,
располагаются между фибриллами интерстициальных коллагенов, содержат
последовательности арг-гли-асп (RGD), которые обеспечивают клеточную адгезию.
10. Коллаген – сложный внеклеточный белок, синтезируется фибробластами, хондробластами, остеобластами, одонтобластами,
цементобластами, кератобластами.Синтез коллагена проходит в 8 этапов (5 внутриклеточных, 3 внеклеточных).
Синтез коллагена включает основные стадии:
- трансляция полипептидной цепи на рибосомах;
- внутри – и внеклеточная модификация;
- образование коллагеновых волокон.
Известно более 400 мутаций коллагена,
связанных с развитием патологии
соединительной ткани
(дисплазия соединительной ткани,
несовершенный остеогенез и др.).
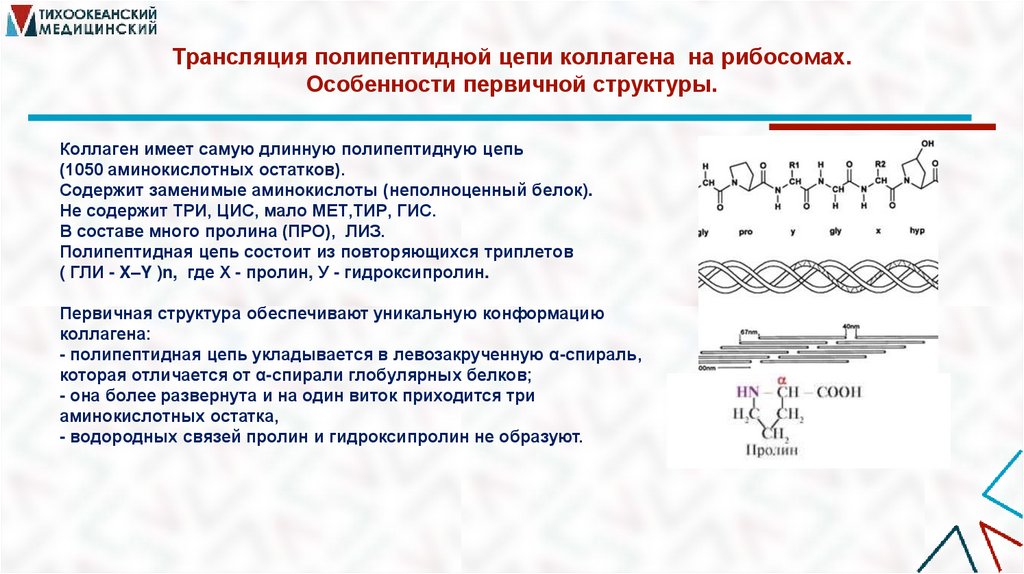
11. Трансляция полипептидной цепи коллагена на рибосомах. Особенности первичной структуры.
Коллаген имеет самую длинную полипептидную цепь(1050 аминокислотных остатков).
Содержит заменимые аминокислоты (неполноценный белок).
Не содержит ТРИ, ЦИС, мало МЕТ,ТИР, ГИС.
В составе много пролина (ПРО), ЛИЗ.
Полипептидная цепь состоит из повторяющихся триплетов
( ГЛИ - X–Y )n, где Х - пролин, У - гидроксипролин.
Первичная структура обеспечивают уникальную конформацию
коллагена:
- полипептидная цепь укладывается в левозакрученную α-спираль,
которая отличается от α-спирали глобулярных белков;
- она более развернута и на один виток приходится три
аминокислотных остатка,
- водородных связей пролин и гидроксипролин не образуют.
12. Посттрансляционная внутриклеточная модификация коллагена.
Посттрансляционная внутриклеточная модификацияколлагена включает следующие процессы:
1. гидроксилирование пролина, лизина;
2. гликозилирование коллагена;
3. дезаминирование лизина;
4. формирование вторичной и третичной структуры
(«спирали коллагена»)
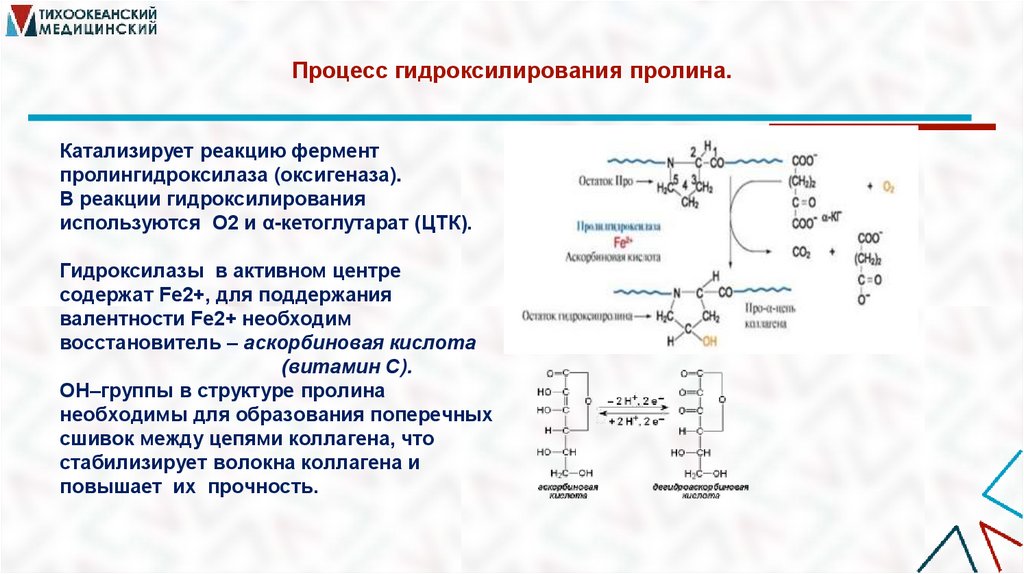
13. Процесс гидроксилирования пролина.
Катализирует реакцию ферментпролингидроксилаза (оксигеназа).
В реакции гидроксилирования
используются О2 и α-кетоглутарат (ЦТК).
Гидроксилазы в активном центре
содержат Fе2+, для поддержания
валентности Fe2+ необходим
восстановитель – аскорбиновая кислота
(витамин С).
ОН–группы в структуре пролина
необходимы для образования поперечных
сшивок между цепями коллагена, что
стабилизирует волокна коллагена и
повышает их прочность.
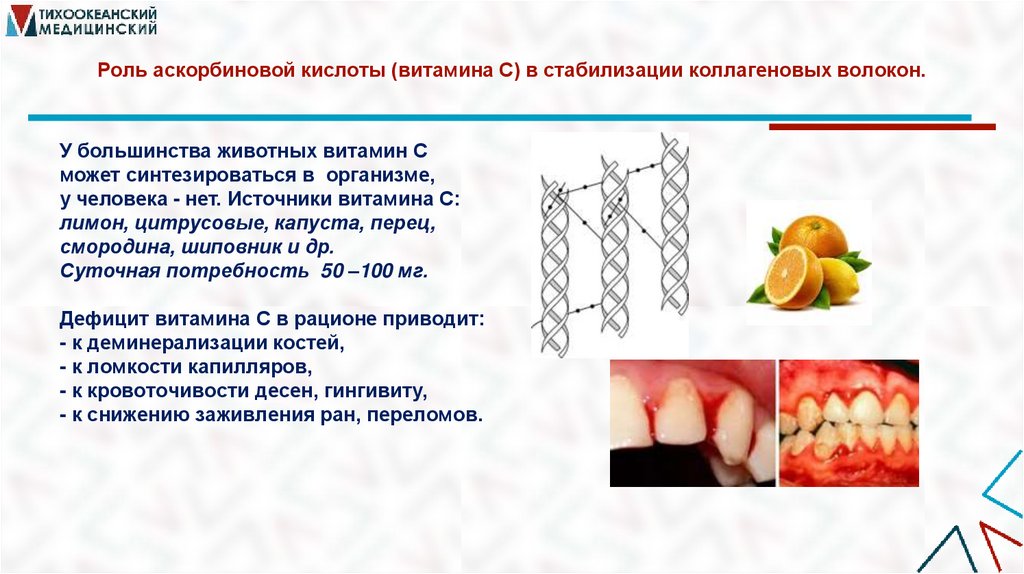
14. Роль аскорбиновой кислоты (витамина С) в стабилизации коллагеновых волокон.
У большинства животных витамин Сможет синтезироваться в организме,
у человека - нет. Источники витамина С:
лимон, цитрусовые, капуста, перец,
смородина, шиповник и др.
Суточная потребность 50 –100 мг.
Дефицит витамина С в рационе приводит:
- к деминерализации костей,
- к ломкости капилляров,
- к кровоточивости десен, гингивиту,
- к снижению заживления ран, переломов.
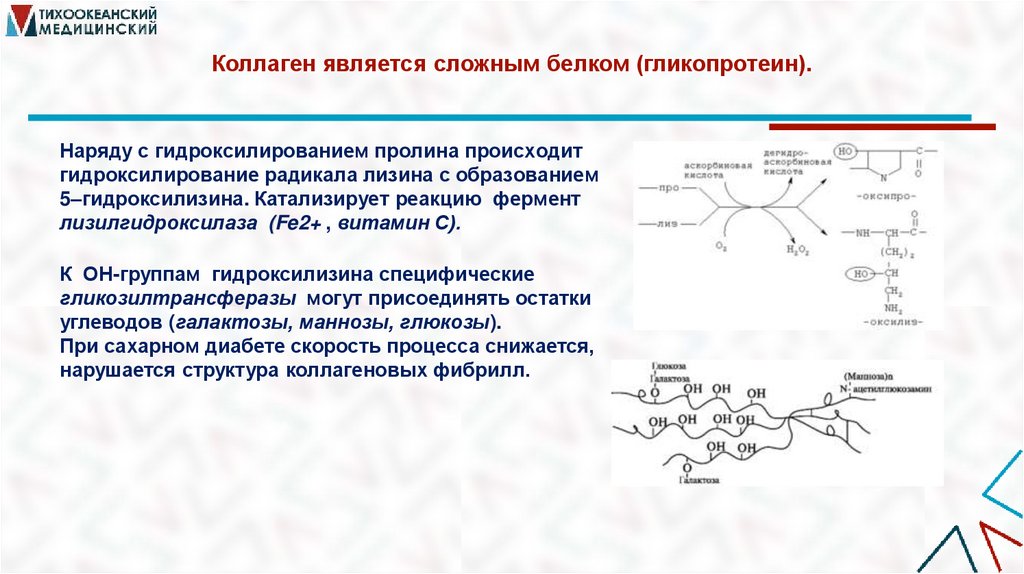
15. Коллаген является сложным белком (гликопротеин).
Наряду с гидроксилированием пролина происходитгидроксилирование радикала лизина с образованием
5–гидроксилизина. Катализирует реакцию фермент
лизилгидроксилаза (Fe2+ , витамин С).
К ОН-группам гидроксилизина специфические
гликозилтрансферазы могут присоединять остатки
углеводов (галактозы, маннозы, глюкозы).
При сахарном диабете скорость процесса снижается,
нарушается структура коллагеновых фибрилл.
16. Образование спирали коллагена.
Гидроксиаминокислоты необходимы для стабилизациитройной спирали коллагена, поскольку ОН-группы
участвуют в образовании водородных связей между
α-цепями. Жесткая циклическая структура пролина не
позволяет образовать правозакрученную α-спираль,
но образует т.н. "пролиновый излом«, благодаря
чему формируется левозакрученная спираль, где
на 1 виток приходится 3 аминокислотных остатка.
Молекула коллагена построена из 3 полипептидных
цепей, сплетенных в плотный жгут–
тропоколлаген (длина 300 нм, диаметр 1,6 нм).
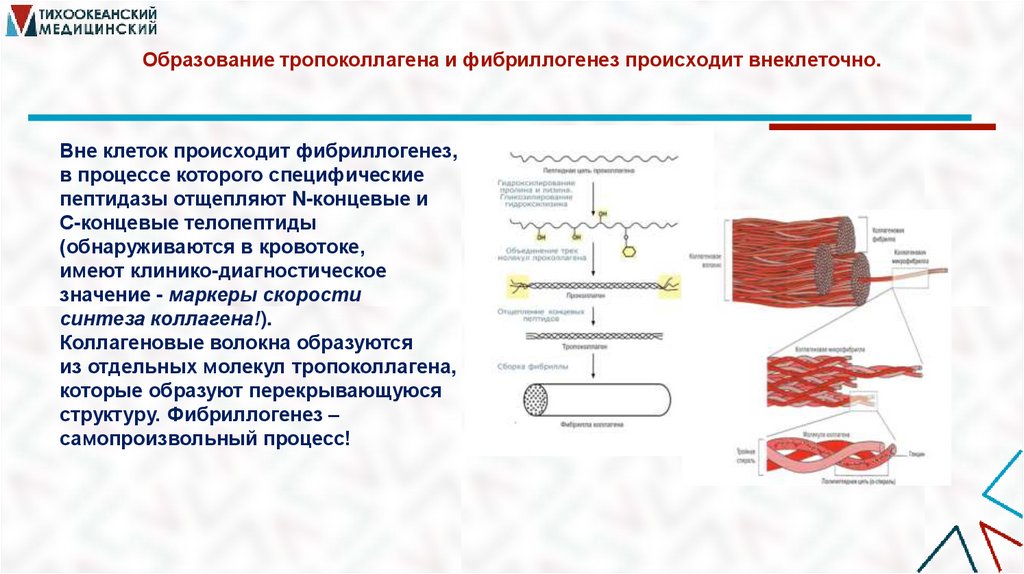
17. Образование тропоколлагена и фибриллогенез происходит внеклеточно.
Вне клеток происходит фибриллогенез,в процессе которого специфические
пептидазы отщепляют N-концевые и
С-концевые телопептиды
(обнаруживаются в кровотоке,
имеют клинико-диагностическое
значение - маркеры скорости
синтеза коллагена!).
Коллагеновые волокна образуются
из отдельных молекул тропоколлагена,
которые образуют перекрывающуюся
структуру. Фибриллогенез –
самопроизвольный процесс!
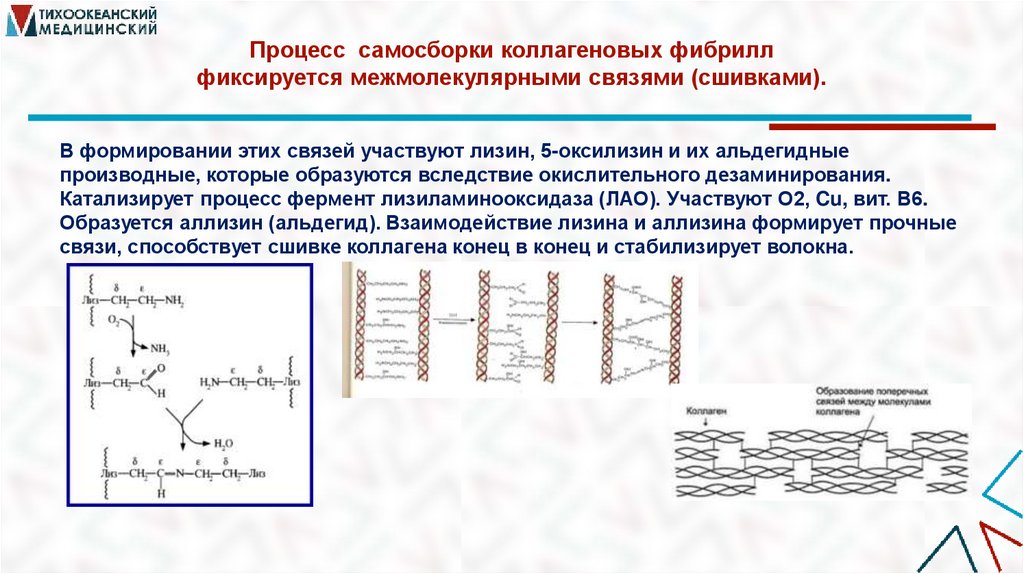
18. Процесс самосборки коллагеновых фибрилл фиксируется межмолекулярными связями (сшивками).
В формировании этих связей участвуют лизин, 5-оксилизин и их альдегидныепроизводные, которые образуются вследствие окислительного дезаминирования.
Катализирует процесс фермент лизиламинооксидаза (ЛАО). Участвуют О2, Cu, вит. В6.
Образуется аллизин (альдегид). Взаимодействие лизина и аллизина формирует прочные
связи, способствует сшивке коллагена конец в конец и стабилизирует волокна.
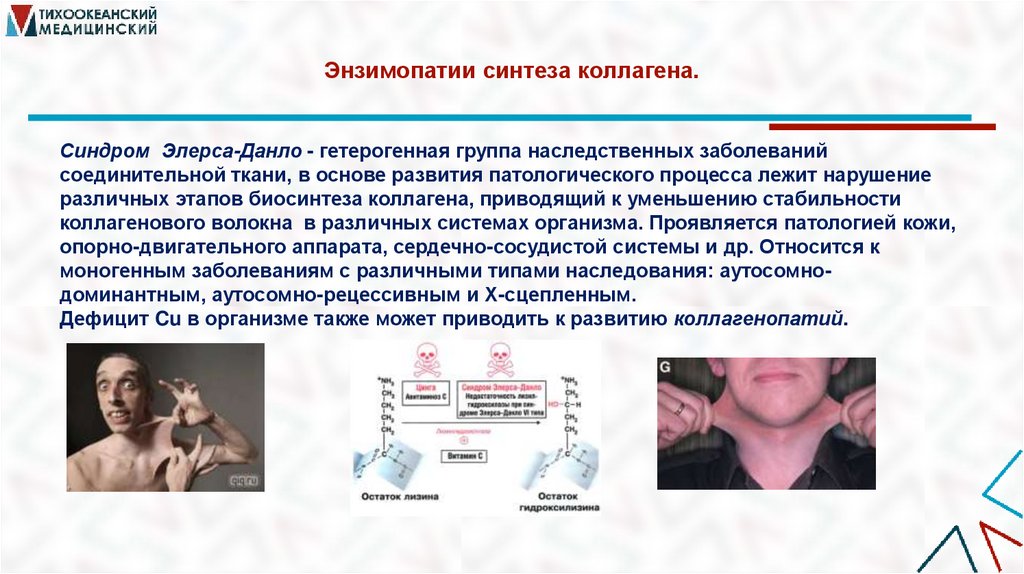
19. Энзимопатии синтеза коллагена.
Синдром Элерса-Данло - гетерогенная группа наследственных заболеванийсоединительной ткани, в основе развития патологического процесса лежит нарушение
различных этапов биосинтеза коллагена, приводящий к уменьшению стабильности
коллагенового волокна в различных системах организма. Проявляется патологией кожи,
опорно-двигательного аппарата, сердечно-сосудистой системы и др. Относится к
моногенным заболеваниям с различными типами наследования: аутосомнодоминантным, аутосомно-рецессивным и Х-сцепленным.
Дефицит Cu в организме также может приводить к развитию коллагенопатий.
20. Необычные механические свойства коллагена связаны с первичной и пространственной структурами.
Коллагеновая фибрилла — этополукристаллическая структура.
Коллагеновые волокна — это пучки фибрилл.
Физико-химические свойства коллагена:
- нерастворим в воде, солевых растворах,
слабых растворах кислот и щелочей!
- возможна частичная соллюбилизация
при кипячении (образуется желатина!)
- коллаген - очень прочный белок!
Коллагеновые фибриллы в физиологических
условиях устойчивы к действию трипсина,
пепсина, лизосомальных и нелизосомальных
пептидаз, способных расщеплять только
денатурированный коллаген.
21. Ускоренный синтез коллагена происходит в заживающей ране.
В область повреждения мигрируют фибробласты и синтезируют компоненты матрикса(коллаген). На месте раны формируется разновидность соединительной ткани - рубец.
Синтез коллагена в заживающих ранах нарушается:
1) при энзимопатиях,
2) при авитаминозах С, В6,
3) при недостатке Fe, Cu,
4) при нарушении оксигенации ткани (гипоксия),
5) у больных сахарным диабетом.
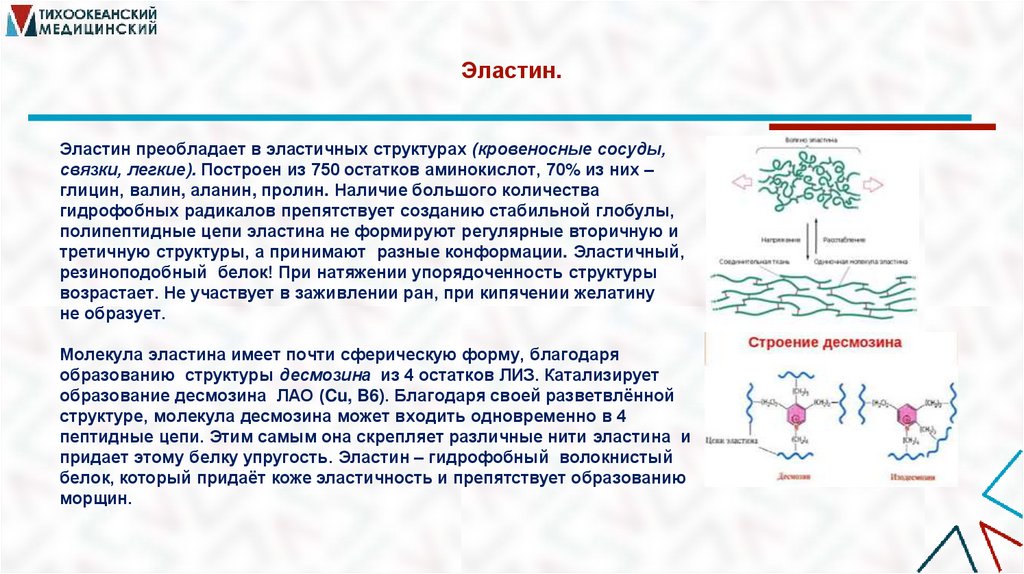
22. Эластин.
Эластин преобладает в эластичных структурах (кровеносные сосуды,связки, легкие). Построен из 750 остатков аминокислот, 70% из них –
глицин, валин, аланин, пролин. Наличие большого количества
гидрофобных радикалов препятствует созданию стабильной глобулы,
полипептидные цепи эластина не формируют регулярные вторичную и
третичную структуры, а принимают разные конформации. Эластичный,
резиноподобный белок! При натяжении упорядоченность структуры
возрастает. Не участвует в заживлении ран, при кипячении желатину
не образует.
Молекула эластина имеет почти сферическую форму, благодаря
образованию структуры десмозина из 4 остатков ЛИЗ. Катализирует
образование десмозина ЛАО (Cu, B6). Благодаря своей разветвлённой
структуре, молекула десмозина может входить одновременно в 4
пептидные цепи. Этим самым она скрепляет различные нити эластина и
придает этому белку упругость. Эластин – гидрофобный волокнистый
белок, который придаёт коже эластичность и препятствует образованию
морщин.
23. Особенности катаболизма эластина.
При снижении образования десмозинов поперечные сшивки образуются в недостаточном количествеили не образуются и как следствие у эластических тканей снижается прочность на разрыв и
растяжимость (утрачиваются резиноподобные свойства). Клинически проявляется
кардиоваскулярными изменениями (аневризма аорты, дефекты клапанов сердца, пневмония,
эмфизема лёгких).
Причины нарушений структуры эластина: снижение активности ЛАО (энзимопатия), дефицит Cu, вит. В6.
Время полураспада эластина – 75 лет (медленно обменивается). Катаболизм происходит при
участии эластазы нейтрофилов. В норме эластазу ингибирует α1-антитрипсин (БОФ).
Активация эластазы в легких разрушает эластин в альвеолярных стенках,
что ведёт к потере эластичных свойств, разрушению альвеол и развитию
эмфиземы лёгких.
24. Катаболизм белков матрикса.
Матриксные металлопротеиназы (MMП) — это семейство внеклеточныхцинк-зависимых эндопептидаз, способных разрушать все типы
белков внеклеточного матрикса.
Установлено более 20 ММП (специфичны!), наиболее известны коллагеназа
(ММП-1), желатиназа, эластаза.
ММП играют роль в ремоделировании тканей, ангиогенезе, пролиферации,
участвуют в метастазировании опухолей. Активность ММП повышается
при деструкции межклеточного матрикса, которая наблюдается при
целом ряде заболеваний. ММП синтезируются в виде препроферментов.
Активность ММП зависит от уровня экспрессии их генов. Синтез на
уровне транскрипции контролируется цитокинами и гормонами.
Активность ММП находится под контролем специфических белков - тканевых
ингибиторов металлопротеиназ (ТИМП). В настоящее время хорошо изучены
4 вида ТИМП (специфическое действию). ТИМП инактивируются путём
гидролиза с участием различных протеиназ. Снижение активности ТИМП
приводит к нарушению процессов обновления и деградации коллагена.
25. Катаболизм коллагена.
Коллаген - медленно обменивающий белок (время жизни- недели,месяцы). Катаболизм коллагена обеспечивают коллагеназы
(ММП-1, ММП-13). Источниками фермента являются остеокласты,
фибробласты, макрофаги, патогенные бактерии. Активность
коллагеназы возрастает при ревматоидном артрите, при ряде кожных
заболеваний, язвенных кератитах, воспалении, опухолевом росте и др.
Коллагеназы рассекают все 3 пептидные α- цепи молекулы
нативного коллагена, примерно на 1/4 расстояния от С-конца.
Образующиеся фрагменты коллагена становятся растворимыми
в воде и денатурируют, после чего их пептидные связи
становятся доступными для гидролиза другими пептидазами.
Активация фермента происходит из проферментов
путем частичного протеолиза.
Плазмин
проколлагеназа
- 81 АК
коллагеназа
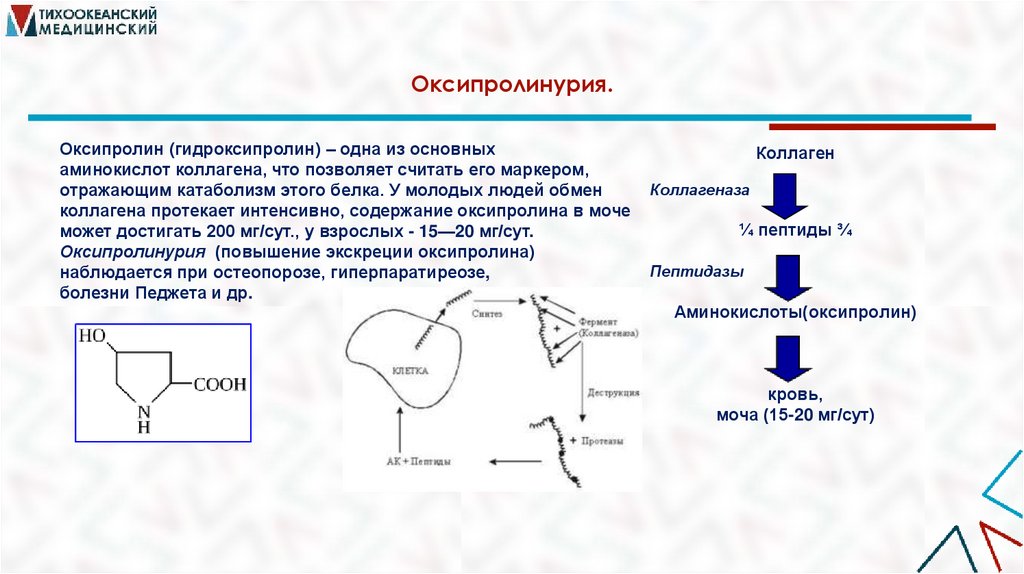
26. Оксипролинурия.
Оксипролин (гидроксипролин) – одна из основныхаминокислот коллагена, что позволяет считать его маркером,
отражающим катаболизм этого белка. У молодых людей обмен
коллагена протекает интенсивно, содержание оксипролина в моче
может достигать 200 мг/сут., у взрослых - 15—20 мг/сут.
Оксипролинурия (повышение экскреции оксипролина)
наблюдается при остеопорозе, гиперпаратиреозе,
болезни Педжета и др.
Коллаген
Коллагеназа
¼ пептиды ¾
Пептидазы
Аминокислоты(оксипролин)
кровь,
моча (15-20 мг/сут)
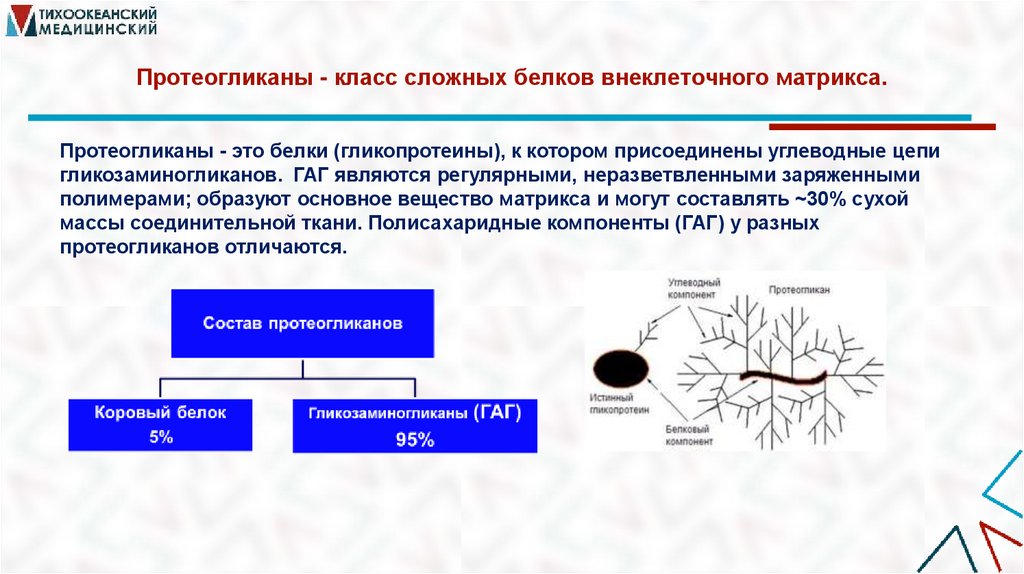
27. Протеогликаны - класс сложных белков внеклеточного матрикса.
Протеогликаны - класс сложных белков внеклеточного матрикса.Протеогликаны - это белки (гликопротеины), к котором присоединены углеводные цепи
гликозаминогликанов. ГАГ являются регулярными, неразветвленными заряженными
полимерами; образуют основное вещество матрикса и могут составлять ~30% сухой
массы соединительной ткани. Полисахаридные компоненты (ГАГ) у разных
протеогликанов отличаются.
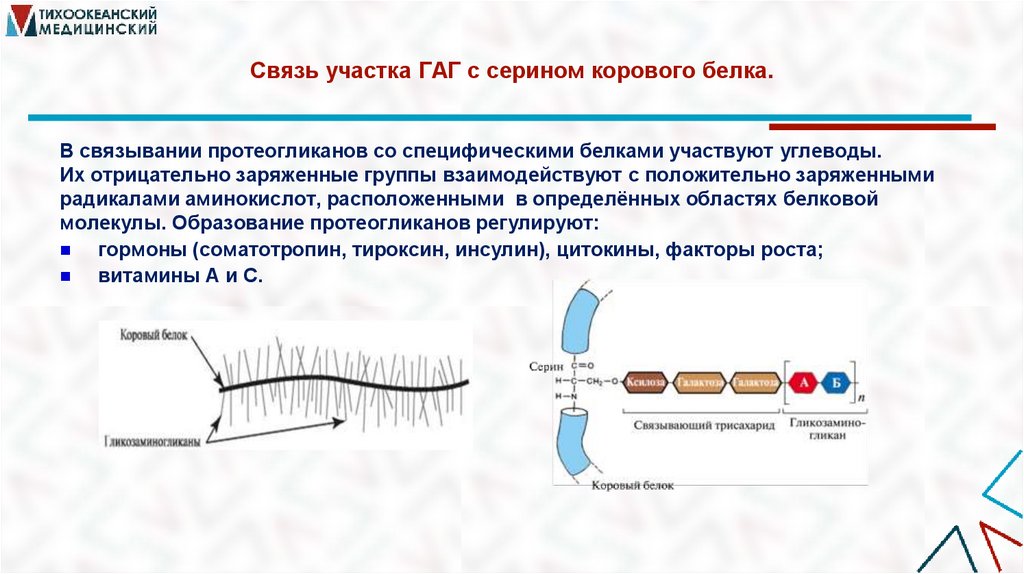
28. Связь участка ГАГ с серином корового белка.
В связывании протеогликанов со специфическими белками участвуют углеводы.Их отрицательно заряженные группы взаимодействуют с положительно заряженными
радикалами аминокислот, расположенными в определённых областях белковой
молекулы. Образование протеогликанов регулируют:
гормоны (соматотропин, тироксин, инсулин), цитокины, факторы роста;
витамины А и С.
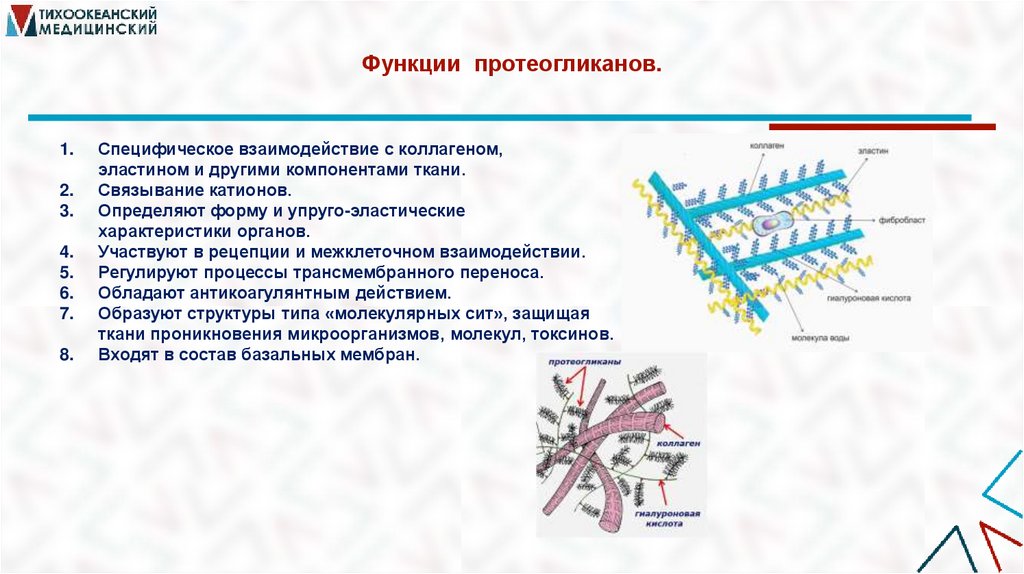
29. Функции протеогликанов.
1.2.
3.
4.
5.
6.
7.
8.
Специфическое взаимодействие с коллагеном,
эластином и другими компонентами ткани.
Связывание катионов.
Определяют форму и упруго-эластические
характеристики органов.
Участвуют в рецепции и межклеточном взаимодействии.
Регулируют процессы трансмембранного переноса.
Обладают антикоагулянтным действием.
Образуют структуры типа «молекулярных сит», защищая
ткани проникновения микроорганизмов, молекул, токсинов.
Входят в состав базальных мембран.
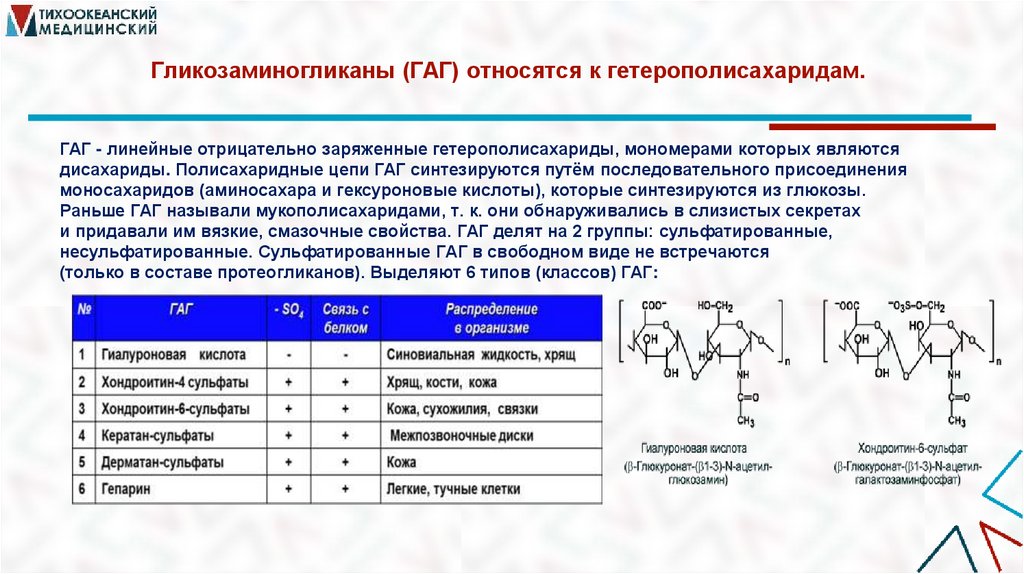
30. Гликозаминогликаны (ГАГ) относятся к гетерополисахаридам.
Гликозаминогликаны (ГАГ) относятся к гетерополисахаридам.ГАГ - линейные отрицательно заряженные гетерополисахариды, мономерами которых являются
дисахариды. Полисахаридные цепи ГАГ синтезируются путём последовательного присоединения
моносахаридов (аминосахара и гексуроновые кислоты), которые синтезируются из глюкозы.
Раньше ГАГ называли мукополисахаридами, т. к. они обнаруживались в слизистых секретах
и придавали им вязкие, смазочные свойства. ГАГ делят на 2 группы: сульфатированные,
несульфатированные. Сульфатированные ГАГ в свободном виде не встречаются
(только в составе протеогликанов). Выделяют 6 типов (классов) ГАГ:
31. Физико-химические и функциональные свойства гиалуроновой кислоты:
1. Большая молекулярная масса (несколько млн. Да).2. Активно связывает ионы Na+, K+, Ca+ и 200-500 молекул Н2О, обладает вязкостью.
3. Защищает от проникновения микроорганизмов («молекулярное сито»).
4. Выполняет структурно-образовательную функцию.
5. Регулирует клеточную дифференцировку.
6. Выполняет репаративную функцию.
ГК не связана с белками, несет большой отрицательный заряд, высоко гидрофильна, обладает
вытянутой конформацией, образует гели при низких концентрациях, вызывает набухающее давление
(тургор), что придает матриксу способность противостоять сжатию. ГК является обязательным
компонентом синовиальной жидкости, стекловидного тела глаза, кожи и др.
32. Применение ГАГ в терапии и эстетической медицине.
Гиалуроновая кислота и другие ГАГ широко используютсяв медицинской практике и эстетической медицине. ГАГ
оказывают противовоспалительное, ранозаживляющее
действие; способствуют регенерации эпителия;
предотвращают образование спаек и др. Препараты,
содержащие хондроитинсульфаты и глюкозамин,
способствуют синтезу хрящевой ткани.
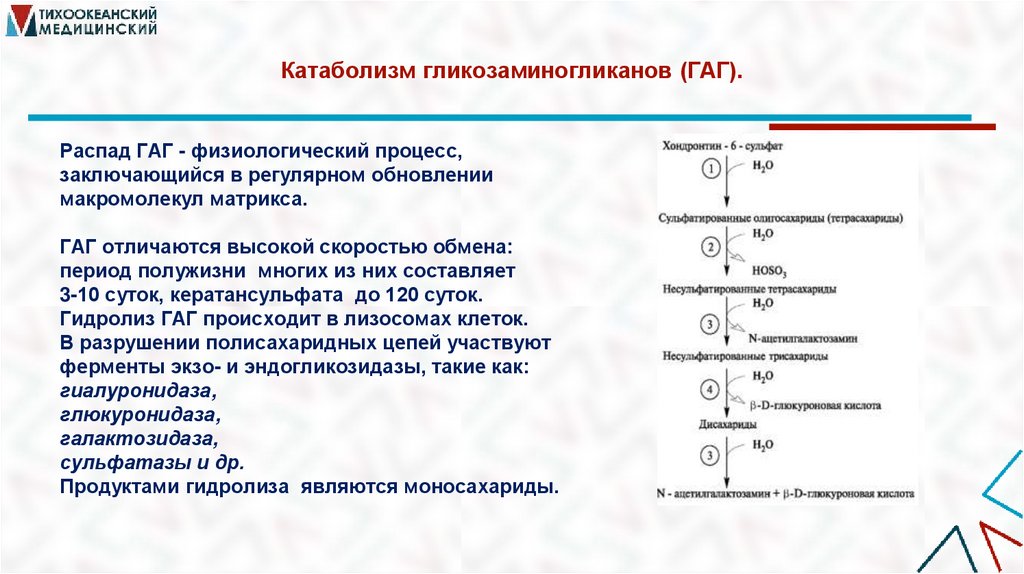
33. Катаболизм гликозаминогликанов (ГАГ).
Распад ГАГ - физиологический процесс,заключающийся в регулярном обновлении
макромолекул матрикса.
ГАГ отличаются высокой скоростью обмена:
период полужизни многих из них составляет
3-10 суток, кератансульфата до 120 суток.
Гидролиз ГАГ происходит в лизосомах клеток.
В разрушении полисахаридных цепей участвуют
ферменты экзо- и эндогликозидазы, такие как:
гиалуронидаза,
глюкуронидаза,
галактозидаза,
сульфатазы и др.
Продуктами гидролиза являются моносахариды.
34. «Болезни накопления» или мукополисахаридозы. .
Нарушение катаболизма (энзимопатии) приводит к накоплению ГАГ в лизосомах и развитиюмукополисахаридозов. Продукты неполного расщепления ГАГ откладываются в лизосомах клеток,
а также выделяются с мочой. Существует несколько типов мукополисахаридозов в зависимости
от того, какой фермент является дефектным.
Мукополисахаридозы проявляются
системными поражениями скелета,
задержкой физического развития,
грубыми функциональными
нарушениями ЦНС (слабоумие),
изменениями органов, сердечнососудистой недостаточностью и др.
Прогноз неблагоприятный,
влияет на продолжительность
жизни (до 10 лет).
35. Катаболизм гиалуроновой кислоты
В теле человека (70 кг) содержится около 15 г гиалуроновой кислоты (50% в коже).Ежедневно около 5 г гиалуроновой кислоты разрушается и вновь синтезируется,
то есть время жизни молекулы ограничивается несколькими днями.
Гиалуроновая кислота - самый быстро обновляемый компонент матрикса! Разрыв гликозидных связей
происходит под действием фермента гиалуронидазы. Большинство функций фермента связаны со
способностью увеличивать проницаемость тканей за счёт снижения вязкости мукополисахаридов, что
приводит к деполимеризации и деструкции соединительной ткани. В результате действия фермента
нарушается фильтрующая система, скапливается вода (развиваются отеки!).
Высокая активность гиалуронидазы фиксируется
- в лизосомах (способствует обновлению тканей);
- у стрептококков, стафилококков (повышает патогенность бактерий);
- в опухолевых клетках (облегчает метастазирование опухолей);
- в яде пчел, змей (повышает токсичность яда).
36. Применение гиалуронидазы в терапии.
Терапевтическая эффективность гиалуронидазы заключается вулучшении подвижности суставов, размягчении рубцов, устранении или
уменьшении контрактур, рассасывании гематом. Действие фермента
наиболее выражено в начальной стадии патологических процессов.
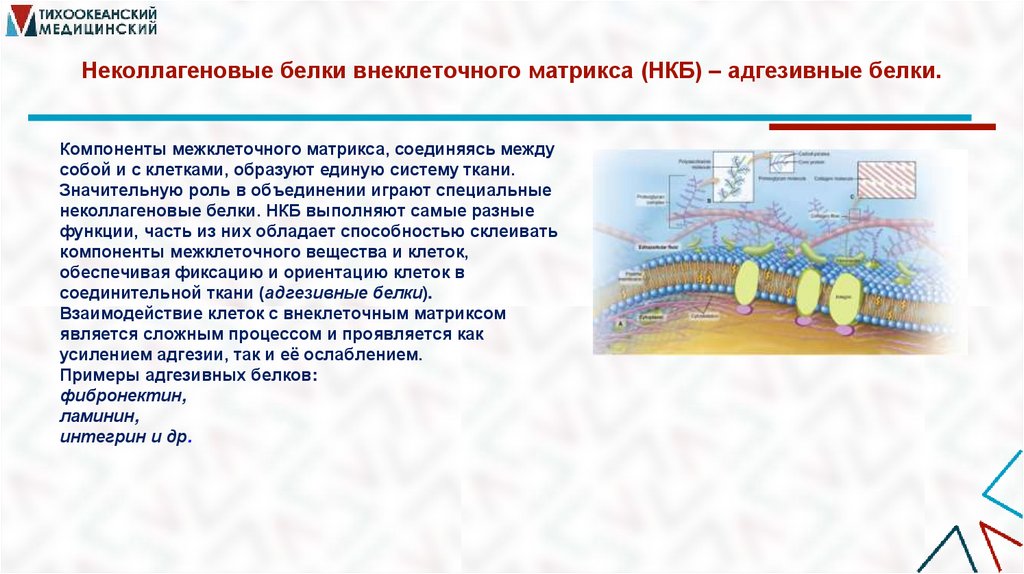
37. Неколлагеновые белки внеклеточного матрикса (НКБ) – адгезивные белки.
Компоненты межклеточного матрикса, соединяясь междусобой и с клетками, образуют единую систему ткани.
Значительную роль в объединении играют специальные
неколлагеновые белки. НКБ выполняют самые разные
функции, часть из них обладает способностью склеивать
компоненты межклеточного вещества и клеток,
обеспечивая фиксацию и ориентацию клеток в
соединительной ткани (адгезивные белки).
Взаимодействие клеток с внеклеточным матриксом
является сложным процессом и проявляется как
усилением адгезии, так и её ослаблением.
Примеры адгезивных белков:
фибронектин,
ламинин,
интегрин и др.
38. Фибронектин – высокомолекулярный гликопротеин, ключевой белок матрикса, синтезируемый фибробластами.
Фибронектин – высокомолекулярный гликопротеин,ключевой белок матрикса, синтезируемый фибробластами.
Фибронектин - обязательный компонент ткани,
определяющий структурные и функциональные
взаимодействия клеток и межклеточного матрикса.
Синтезируется и секретируется в межклеточное
пространство многими клетками, содержит 4-5%
углеводов (гликопротеин).
Фибронектин построен из 2 пептидных цепей,
соединенных 2 дисульфидными связями. Каждая
цепь содержит 7- 8 доменов, которые предназначены
для связывания с белками, ГАГ, клетками.
На молекуле фибронектина есть центр связывания
трансглутаминазы – фермента, катализирующего
реакцию между остатками глутамина одной молекулы
фибронектина и лизина другой, сшивая их друг с другом.
В основе метастазирования опухолей лежит снижение
адгезии между клетками (количество фибронектина
в опухолевой ткани резко снижается).
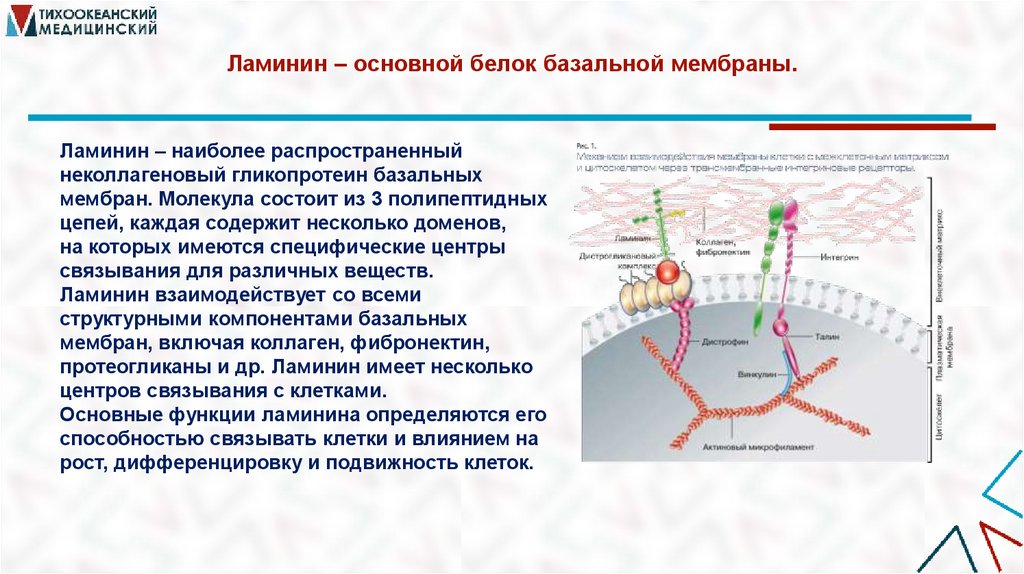
39. Ламинин – основной белок базальной мембраны.
Ламинин – наиболее распространенныйнеколлагеновый гликопротеин базальных
мембран. Молекула состоит из 3 полипептидных
цепей, каждая содержит несколько доменов,
на которых имеются специфические центры
связывания для различных веществ.
Ламинин взаимодействует со всеми
структурными компонентами базальных
мембран, включая коллаген, фибронектин,
протеогликаны и др. Ламинин имеет несколько
центров связывания с клетками.
Основные функции ламинина определяются его
способностью связывать клетки и влиянием на
рост, дифференцировку и подвижность клеток.
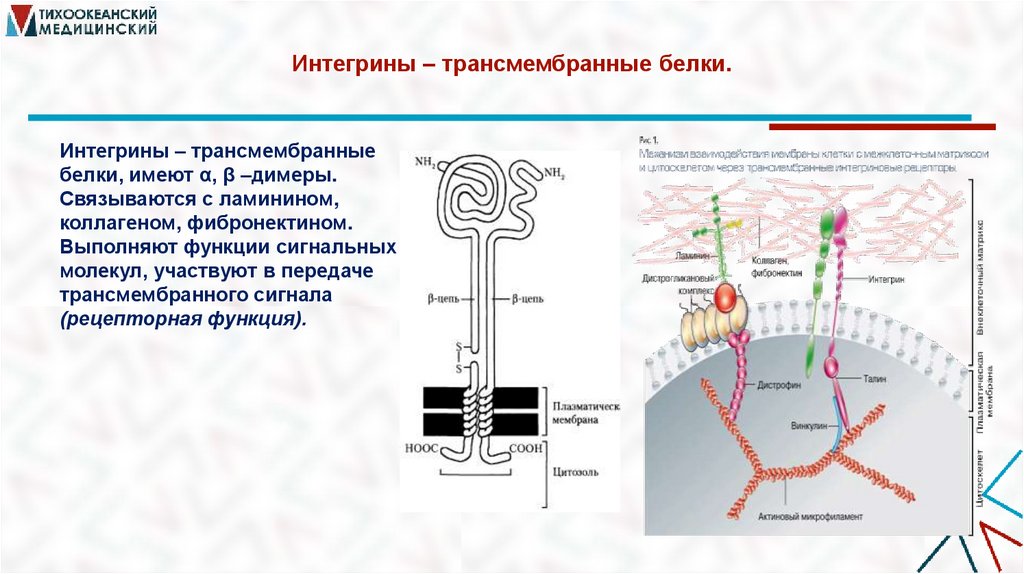
40. Интегрины – трансмембранные белки.
Интегрины – трансмембранныебелки, имеют α, β –димеры.
Связываются с ламинином,
коллагеном, фибронектином.
Выполняют функции сигнальных
молекул, участвуют в передаче
трансмембранного сигнала
(рецепторная функция).
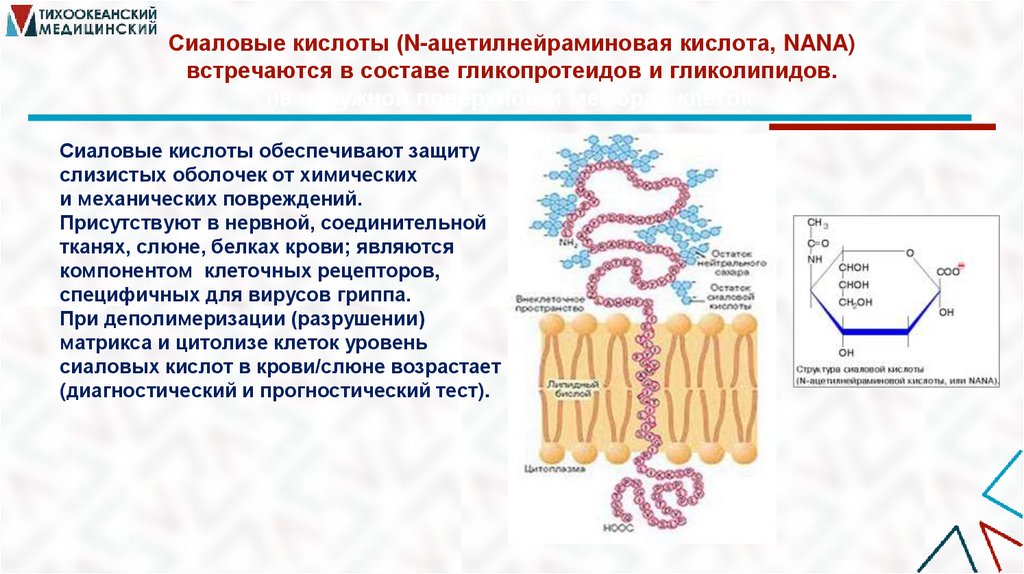
41. Сиаловые кислоты (N-ацетилнейраминовая кислота, NANA) встречаются в составе гликопротеидов и гликолипидов. на наружной
поверхности мембран клеток.Сиаловые кислоты обеспечивают защиту
слизистых оболочек от химических
и механических повреждений.
Присутствуют в нервной, соединительной
тканях, слюне, белках крови; являются
компонентом клеточных рецепторов,
специфичных для вирусов гриппа.
При деполимеризации (разрушении)
матрикса и цитолизе клеток уровень
сиаловых кислот в крови/слюне возрастает
(диагностический и прогностический тест).
42. Коллагенозы (коллагеновые болезни).
Коллагенозы (коллагеновые болезни) - группа заболеваний, объединенныхфункционально-морфологическими изменениями со стороны
соединительной ткани и коллагеновых волокон. Характерным
проявлением коллагенозов является прогрессирующее течение,
вовлечение в патологический процесс различных внутренних органов,
сосудов, кожи, опорно-двигательной систем. К числу коллагенозов относят:
ревматоидный артрит, ревматизм, системную красную волчанку,
системную склеродермию и др.
Эти заболевания объединены на основании общего
патоморфологического признака и патогенетического механизма
(нарушения иммунного гомеостаза).
Термин «коллагенозы» не в полной мере отражает происходящие
патологические изменения, поэтому в настоящее время данную группу
принято называть «диффузными заболеваниями соединительной ткани»
Диагностические и прогностические биохимические тесты отражают
степень деполимеризации соединительной ткани и коллагена.
43. Регуляция метаболизма соединительной ткани.
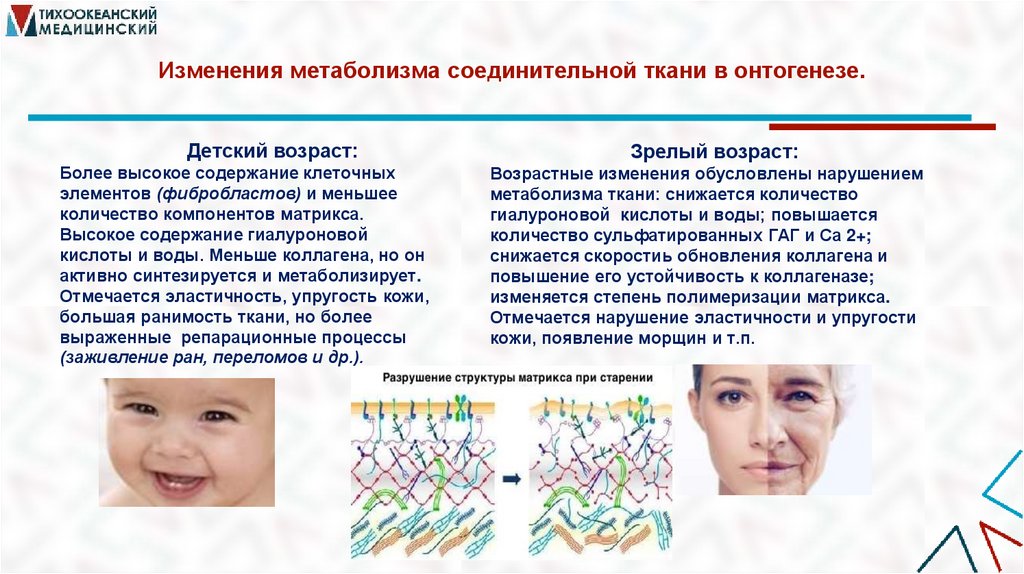
44. Изменения метаболизма соединительной ткани в онтогенезе.
Детский возраст:Более высокое содержание клеточных
элементов (фибробластов) и меньшее
количество компонентов матрикса.
Высокое содержание гиалуроновой
кислоты и воды. Меньше коллагена, но он
активно синтезируется и метаболизирует.
Отмечается эластичность, упругость кожи,
большая ранимость ткани, но более
выраженные репарационные процессы
(заживление ран, переломов и др.).
Зрелый возраст:
Возрастные изменения обусловлены нарушением
метаболизма ткани: снижается количество
гиалуроновой кислоты и воды; повышается
количество сульфатированных ГАГ и Са 2+;
снижается скоростиь обновления коллагена и
повышение его устойчивость к коллагеназе;
изменяется степень полимеризации матрикса.
Отмечается нарушение эластичности и упругости
кожи, появление морщин и т.п.



















 biology
biology








