Similar presentations:
Соединительная ткань (расширенный материал по лекции для самостоятельной подготовки студентов)
1. СОЕДИНИТЕЛЬНАЯ ТКАНЬ (расширенный материал по лекции для самостоятельной подготовки студентов)
Жаворонок Т.В.Доктор мед. наук,
профессор кафедры
биохимии и
молекулярной биологии
СибГМУ
2.
• Классификациясоединительной
ткани
(тип и
локализация)
3.
Тип соединительнойткани
Локализация
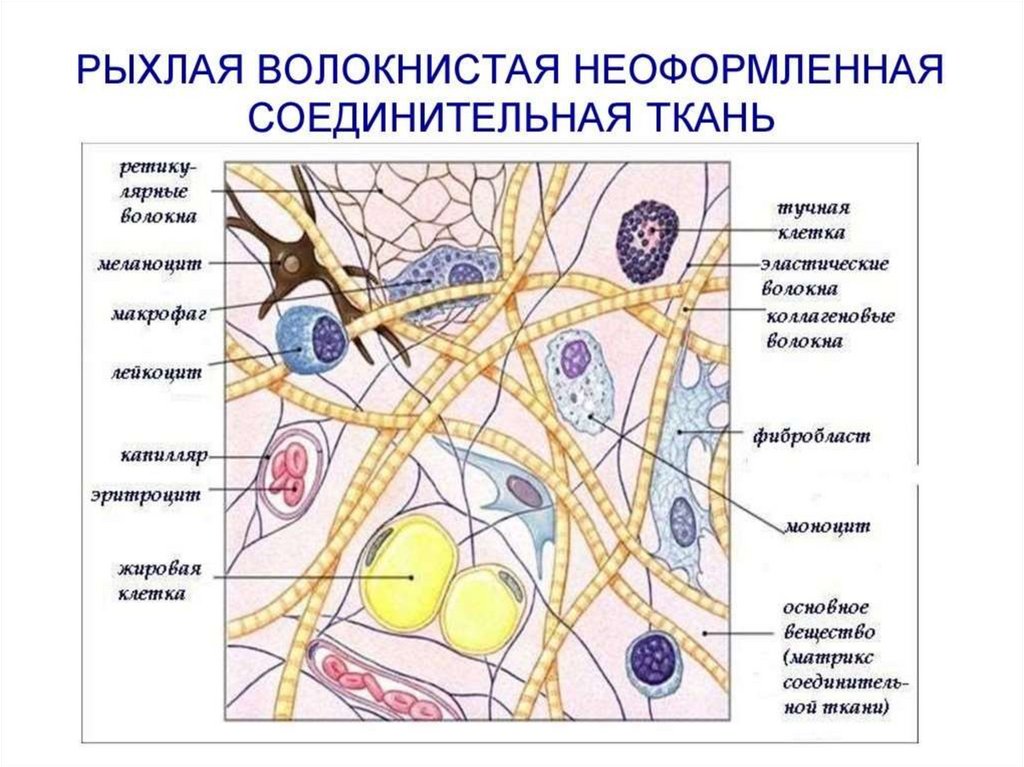
I. Собственно соединительная ткань:
а) Рыхлая
волокнистая
неоформленная
присутствует во всех органах, сосочковом
слое дермы, сопровождает кровеносные
и лимфатические сосуды
б) Плотная волокнистая
неоформленная
сетчатый слой дермы
оформленная
сухожилия, связки, фиброзные мембраны
(фасции, апоневрозы, сухожильные центры
диафрагмы, капсулы некоторых органов)
4.
II. Соединительная ткань со специальными свойствами:а) Ретикулярная
строма кроветворных органов
б) Жировая
белая
подкожная жировая клетчатка брюшной
полости, сальник, брыжейка, надхрящница
бурая
у новорожденных детей, у некоторых
животных в области шеи, лопаток, за
грудиной, вдоль позвоночника, под кожей,
между мышцами
в) Слизистая
пупочный канатик плода
г) Пигментная
участки кожи в области сосков, мошонки,
анального отверстия, сосудистая и радужная
оболочки глаза, родимые пятна
5.
III. Скелетные ткани:а) Хрящевая ткань
гиалиновая
хрящевые части ребер, трахеи, бронхи,
суставные поверхности в местах соединения
эпифиза и диафиза трубчатых костей
эластическая
ушные раковины, надгортанник, рожковидные
и клиновидные хрящи гортани, наружные
слуховые проходы, слуховые трубы
волокнистая
межпозвоночные
сочленения
диски,
полуподвижные
б) Костная ткань
грубоволокнистая
у зародышей, у взрослых в местах заросших
черепных швов, прикрепления сухожилий к
костям
Пластинчатая
компактное
и
губчатое
вещество
в большинстве плоских и трубчатых костях
скелета
6.
7. Какие ещё существуют типы соединительной ткани? Относятся ли ткани зуба и пародонта к соединительным?
8.
9.
10.
11.
12. КЛЕТКИ функционируют в тесном взаимо-действии. У каждого вида клеток свои задачи.
ПОЭТОМУ КЛЕТКИ условно ДЕЛЯТ:1. "производственные" или резиденты
(клетки ФИБРОБЛАСТИЧЕСКОГО РЯДА)
синтезируют и выделяют вещества
внеклеточного матрикса;
2. регуляторные (тучные клетки,
нейтрофилы, макрофаги, лимфоциты).
Работу регуляторных клеток схематично
можно представить так:
• Тучные клетки выделяют биологически
активные соединения (гистамин,
серотонин, другие медиаторы), которые
влияют на микроциркуляцию.
При этом изменяется в ту или другую
сторону просвет мелких сосудов (артериол
и капилляров), а также проницаемость их
стенок для других
клеток – лимфоцитов,
макрофагов,нейтрофилов.
Тучные клетки активируют Т-лимфоциты и
13.
14. БЕЛКИ МАТРИКСА соединительной ткани
• Фибриллярные (коллаген,эластин)
• Гликопротеины:
-- структурноадгезивные
(фибронектин, ламинин,
нидоген),
-- антиадгезивные
(остеонектин),
-- со смешанными
свойствами
(тромбоспондин)
• Протеогликаны (агрекан,
15.
16.
Типколлаг
ена
Характеристика
I
волокнистый коллаген
с
толстыми, прочными
фибриллами
кости, сухожилия, кожа,
соединительнотканная оболочка
органов, грануляционная ткань
при заживлении, продуцируется
фибробластами
II
волокнистый коллаген
с тонкими фибриллами
хрящ, стекловидное тело,
продуцируется хондроцитами
тонковолокнистый
высокорастяжимый
коллаген
кожа, матка, легкие, кишечник,
кровеносные сосуды,
грануляционная ткань,
продуцируется фибробластами и
гладкомышечными клетками
III
Локализация
17.
IVV
VI, VII,
VIII
нефибриллярный,
аморфный коллаген
базальные мембраны,
вырабатывается
эндотелиоцитами
тонковолокнистый
сосудистая стенка,
вырабатывается
эндотелиоцитами
аморфный коллаген
заякоривающие филаменты,
соединяет эпидермис с дермой,
эндотелий с десцеметовой
мембраной роговицы
18.
Распределение коллагенов• коллаген I - кожа сухожилия, кости, роговица,
плацента, артерии, печень, дентин
• коллаген II - хрящи межпозвоночные диски
стекловидное тело, роговица
• коллаген III - артерии, матка, кожа плода, строма
паренхиматозных органов
• коллаген IV - базальные мембраны
• коллаген V - при коллагене 1 и 2
• коллаген VI - хрящи, кровеносные сосуды, связки,
кожа матка, легкие почки
• коллаген VII - амнион, кожа пищевод, роговица
• коллаген VIII - роговица кровеносные сосуды,
культуральная среда эндотелия
19.
коллаген IX - при коллагене 2
коллаген X - хрящи гипертрофированные
коллаген XI - при коллагене 2
коллаген XII - при коллагене 1
коллаген XIII - многие ткани
коллаген XIV - при коллагене 1
коллаген XV - многие ткани
коллаген XVI - многие ткани
коллаген XVII - гемидесмосомы кожи
коллаген XVIII - многие ткани, печень, почки
коллаген XIX - клетки рабдомиосаркомы
20. В зависимости от особенностей строения и общности функций коллагены делят на 3 основные группы:
В зависимости от особенностейстроения и общности функций
коллагены делят на 3
основные группы:
фибриллоформирующие
или
фибриллярные -изоколлагены
типов I, II, III, V, XI .
фибриллоассоциируемые изоколлагены типов IX, XII, XV, XVI и XVIII. Они
связаны с волокнами
фибриллоформирующих коллагенов.
Фибриллоассоциированные
коллагены не теряют
дополнительные пептиды после
секреции из клетий в матрикс,
обеспечивают соединение
фибриллоформирующих коллагенов с
другими молекулами матрикса.
сетьформирующие изоколлагены типов IV, VI, VII, VIII и X.
Они образуют сетевидные
21. Коллаген
• Коллагеновые волокна образованы молекуламитропоколлагена. Он состоит из 3-х субъединиц, каждая
≈ 1000 остатков АК, закрученных в плотную левую спираль,
на 1 виток спирали 3 остатка АК.
• Три спирали образуют структуру, подобную кабелю и
закрученную в правую спираль – тропоколлаген.
• Уникальность строения тропоколлагена обусловлена
наличием ГЛИ (1/3), иминокислот – ПРО и оксиПРО (до 1/4),
присутствием 5-оксилизина (1%).
Формула коллагена (G-Х-У)n
22.
Синтезпро- -цепи
Гидроксилирование
определенных остатков
пролина и лизина
Гликозилирование
определенных остатков
гидроксилизина
ОН
Рибосома
гранулярного ЭР
Процессы, происходящие
во внутриклеточных мембранных структурах (ЭПР,
аппарат Гольджи, секреторные пузырьки)
ОН
ОН
ОН
COOH
NH2
ОН
Объединение трех
про- -цепей
Образование
тройной спирали
Плазматическая мембрана
Секреция
М олекула
проколлагена
Отщепление
концевых пептидов
М олекула
коллагена
Сборка фибриллы
Коллагеновая
фибрилла
50 нм
Агрегация фибрилл
в коллагеновые волокна
Коллагеновое
волокно
23.
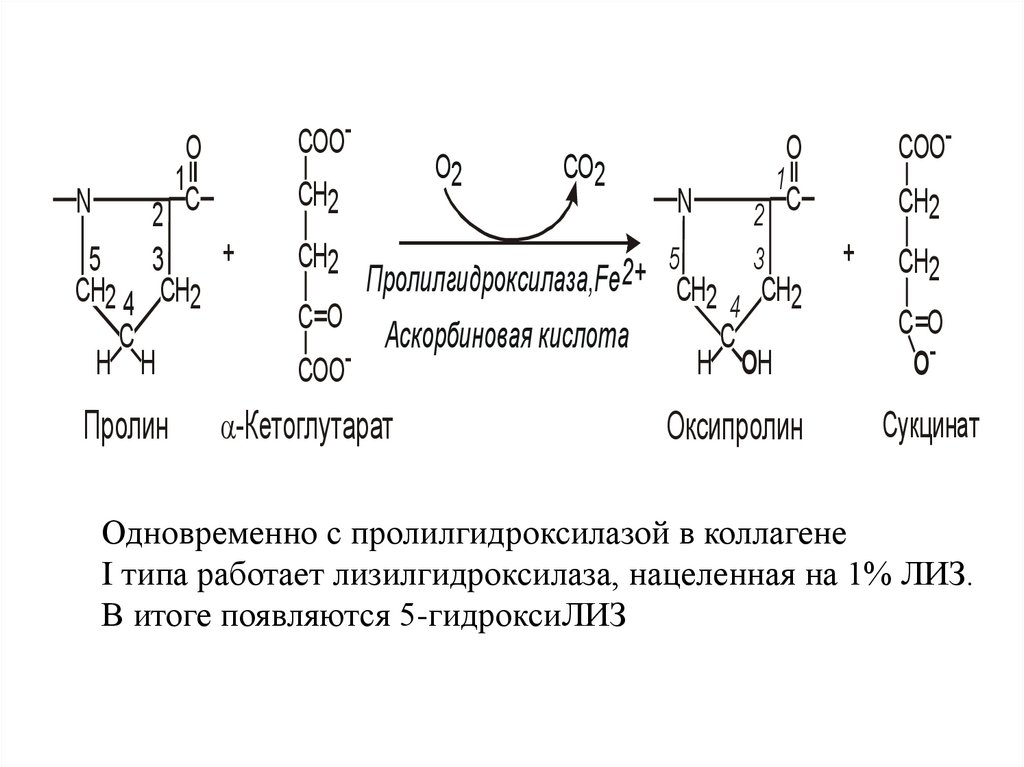
O1
N
2 C
+
5
3
CH2 4 CH2
C
H H
Пролин
COOCH2
CH2
O2
CO2
N
5
1
2 C
3
Пролилгидроксилаза,Fe2+ CH2 CH2
4
C O
Аскорбиновая кислота
C
COO-
-Кетоглутарат
COO-
O
CH2
+
CH2
H ОH
C O
O-
Оксипролин
Сукцинат
Одновременно с пролилгидроксилазой в коллагене
I типа работает лизилгидроксилаза, нацеленная на 1% ЛИЗ.
В итоге появляются 5-гидроксиЛИЗ
24. Далее идёт гликозилирование по приобретённым ОН-группам ЛИЗ
• присоединение углеводных единиц:сначала галактозилтрансфераза переносит на
гидроксиЛИЗ галактозу из УДФ-галактозы, затем
глюкозилтрансфераза использует УДФ-глюкозу и
достраивает часть галактоз до дисахарида «галактозаглюкоза». Часть галактоз не дополняется глюкозой.
• Гидроксилирование и трансферазные реакции идут в
просвете эндоплазматической сети во вновь
синтезированном коллагене, ещё не претерпевшем
спирализации в про- -цепь.
• Затем три про- -цепи с помощью водородных связей
объединяются в молекулу проколлагена, которая далее
секретируется в межклеточный матрикс, где от неё
удаляются концевые С- и N-пропептиды.
25. Секреция проколлагена во внеклеточный матрикс
• После завершениявнутриклеточного
процессинга молекулы
гликозилированного
проколлагена через комплекс
Гольджи смещаются к
26.
27.
После формирования во внеклеточном матриксе фибриллколлагена их прочность растёт за счёт образования между
остатками лизина дополнительных би-, трифункциональных
ковалентных сшивок (лизиннорлейцин, пиридинолин и др.)
В коллагене
ЛИЗ-NH2 + NH 2-ЛИЗ
Окисление
ЛИЗ-С=О+ О=С-ЛИЗ
Н
Н
Альдольная сшивка
ЛИЗ-СН=С-ЛИЗ
О=С
Н
присоединяется
гистидин
28.
29.
30.
Биохимические маркёрысинтеза костного коллагена-I
• N- и С-пропептиды коллагена
• Пролил- и лизилгидроксилазы
• Щелочная фосфатаза (костный изофермент ВАР)
• Фибронектин
распада костного коллагена-I
• N- и С-телопептиды коллагена (С-телопептид β-8АА)
• Пиридинолин
• Гидроксипролин
• Гликозиды гидроксилизина:
ГГЛ (галактозил-гидроксилизин)
ГГГЛ (глюкозил-галактозил-гидроксилизин)
• Коллагеназа, эластаза
• Кислая фосфатаза (тартрат-резистентная TRACP 5B)
31. Заболевания, связанные с нарушением обмена коллагена: 1) болезни синтеза 2) болезни распада
связанныес нарушением
обмена
коллагена
:
1) болезни
синтеза
2) болезни
распада
32.
Заболевания, связанные с нарушениемсинтеза коллагена
Несовершенный остеогенез (НО) – мутации
(более 160) в гене, кодирующем синтез коллагена I.
Самая неблагоприятная замена – глицин на другую
аминокислоту → нет нормальной тройной спирали.
Признаки: ломкость костей, аномалия зубов, гиперподвижность суставов, треугольная форма лица,
голубые склеры.
Синдром Морфана (СМ) – повышенная
растворимость коллагеновых волокон, они
подвержены катаболизму. В моче повышена
концентрация гидроксипролинов.
33.
.Сайты мутаций в молекуле проколлагена типа I.
СЭД — синдром Элерса-Данлоса
НО — несовершенный остеогенез
СМ — синдром Марфана
34.
Синдром Элерса–Данлоса (СЭД) –дефект коллагена III
– врожденный дефицит проколлагеновой пептидазы:
не отщепляются концевые пропептиды, нарушено
образование фибрилл, коллаген в виде сети с высокой
растворимостью→ дефекты формирования скелета,
зубного ряда
– хрупкая кожа, чрезмерно подвижны суставы, спонтанно разрывы крупных сосудов или пневмоторакс,
перфорация кишечника, разрывы беременной матки.
35.
Дефект коллагена IIСиндром Вагнера:
в стекловидном теле синтез ½ молекулы коллагена
→ прогрессирующая миопия, отслойка сетчатки,
патология суставов.
Болезнь Книста:
укорочение цепей коллагена → укорочение и
деформация конечностей, тугоподвижность суставов,
кифосколиоз, миопия высокой степени.
36.
Синдром Альпорта – дефект коллагена IV нарушение образования базальных мембран.Поражения почек, гематурия с протеинурией.
Синдром Гудпасчера – дефект коллагена IV образование антител к коллагену.
Гломерулонефрит, легочный гемосидероз.
37.
Буллезный эпидермолиз – дефект коллагена VII снижение количества заякоренных фибрилл.Эпидермис слабо связан с дермой, легко
слущивается и образует пузыри (буллы),
которые легко травмируются, эрозируются.
Синдром чрезмерных кожных складок
38. Болезни, связанные с нарушением деградации коллагена
• Увеличенная активность коллагеназыобнаружена в суставах при ревматоидном
артрите, в тканях ротовой полости при
периодонтите, при ряде кожных заболеваний,
язвенных кератитах. Коллагенолитическая
активность увеличивается при воспалении,
в заживающих ранах, в опухолях.
• Недостаточность активности коллагеназы
отмечается при циррозе печени, склеродермии,
легочном фиброзе и др.
39.
• Свободная
глюкоза
крови,
попадая
в ткани,
образуе
т
попереч
ные
сшивки
с
коллаге
ном
в
процесс
40. Фибриллярные белки пульпы
• В пульпе коллагеновые волокна образованыколлагеном-I, ретикулиновые – коллагеном-III.
• В отличие от обычной рыхлой соединительной
ткани в пульпе меньше выражено преобладание
коллагена-I.
• Возрастное накопление волокон в пульпе
сопровождается снижением растворимости и
возрастанием жёсткости коллагена вследствие
увеличения количества межфибриллярных
трифункциональных сшивок.
• В пульпе отсутствует полноценный эластин (нет
функциональной потребности), лишь в малом
количестве белки по типу его предшественников
41. Отличия коллагена и эластина
КоллагенНесколько
генетических
типов
Тройная
спираль
Эластин
Один
генетический
тип
Не образует
тройной
спирали
Нет повторов
(Гли-X-Y)
(Гли-X-Y)n
структуры
повторы
Имеется
Нет
гидроксипроли гидроксипролин
н
а
Гликозилирова Нет
42. эластин
• Главный белок эластическихволокон (периодонт, сосуды,
лёгкие, кожа, подслизистый слой
губ, щёк). Волокна из почти
сферических молекул. Как и в
коллагене-I, много гид-рофобных
АК, важен лизин, участвующий в
синтезе сшивок
1) «лизин-
норлейцин» бифункциональные сшивки
эластина,
43.
• При образовании сшивкидесмозина сначала 3 остатка
ЛИЗ окисляются лизилоксидазой
до ε-альдегидов (аллизин), а
затем соединяются с четвертым
остатком ЛИЗ
• Остатки лизина находятся на 2-х
соседних цепях и могут
44. эластин
45.
Матриксные металлопротеиназы –ферменты распада белков
(имеют и эмпирические названия)
1. Интерстициальные коллагеназы
(ММП-1,8,13)
2. Желатиназа (ММП- 2,9)
3. Стромелизин (ММП- 3,7,10,11)
4. Мембранные (ММП – 14,15,16,17,24,25)
5. Металлоэластаза (ММП-12)
46. Специфичность ММП
ММП обладают разнойспецифичностью. Например:
• Эластин расщепляется
эластазой нейтрофилов и
макрофагов, которая не
отличается особой
специфичностью и способна
гидролизовать также
протеогликаны и
гликопротеины.
• Коллагеназа действует
специфично: перерезает все
три пептидные цепи
коллагена в одном месте (≈ на
1/4 расстояния от С-конца
47.
48. Гликопротеины матрикса
49.
АДГЕЗИВНЫЕ БЕЛКИМ еста связывания:
NH2
для коллагена
для клеток
NH2
для гепарина
НООС
S S
S S
СООН
фибронектин
Единственной тканью
организма, в которой не
обнаружены фибронектины
является
интертубулярный дентин
50.
Фибронектинсвязывающий участокNH2
NH2
-цепь
Рецептор фибронектина
Плазматическая
мембрана
НООС
СООН
Цитозоль
51. Реализация адгезивных функций фибронектина
52.
Ламинин-- Гликопротеин базальных мембран,
адгезивный белок для эпителиальных и
мезенхимальных клеток. -- Молекула имеет
крестообразную форму с тремя одноцепочечными
и одной трехцепочечной ветвью.
-- Взаимодействует с коллагеном IV, нидогеном,
фибронектином, клетками.
-- Главная функция – способность связывать
клетки и модулировать клеточное поведение:
рост, дифференцировку и подвижность клеток.
53.
Схема строения ламинина1
2
3
4
–
–
–
–
места
места
место
место
соединения
соединения
связывания
связывания
с
с
с
с
клеткам
коллаге
гепаран
гепарин
54.
Нидоген– Сульфатированный гликопротеин базальных
мембран, белковая цепь скручена в 3 домена
– связывается с ламинином и коллагеном-IV
– содержит последовательность RGD → может
соединяться с клеточной поверхностью
55. Базальные мембраны: связи коллагена-IV, ламинина, нидогена и протеогликана агрина
56.
Антиадгезивные белки –играют роль в эмбриогенезе,
морфогенезе, развитии ответа на
повреждение
1. Остеонектин (синоним
SPARC -
Secreted
Protein Acidic and Rich in Cysteine) – кислый
секреторный белок, богатый цистеином.
-- Состоит из 4 доменов, 2 из них могут
присоединять
Са → участие в минерализации: связь
коллагена с
кристаллами гидроксиапатита
57.
2. Тромбоспондинмультифункционален.
Тример из одинаковых субъединиц, связывается с
Са, иными катионами, коллагеном,
фибронектином, ламинином, ГАГ, клетками (сайт
RGD)
-- В фибробластах, клетках эндотелия работает
как антиадгезивный белок, но в кости
способствует адгезии остеобластов к
поднадкостничному остеоиду.
-- В клетках роговицы глаза, тромбоцитах
58. Взаимодействие рецепторов к фибриногену и тромбоспондину с соответствующими лигандами
59. Гликопротеины и протеогликаны матрикса
Гликопротеины
и
протеогликаны
Белки
матрикса связаны с
матрикса
углеводами, разли-чия в
углеводном компоненте
существенны и
определяют
полифункциональность
молекул.
• Состояние матрикса
зависит от количества и
соотношения коллагена и
протеогликанов,
наличия и распределения
адгезивных и
антиадгезивных белков
гликопротеиновой
60.
61.
62.
63.
64.
65.
• классификация ГАГ (построению):
1. глюкуронат
2. хондроитинсульфаты 4 и 6 (ХсА
и ХсС),
дерматансульфат (ХсВ)
3. гепарансульфаты и гепарин
4. кератансульфаты
66. гликозаминогликаны
гликозаминогликаны
67.
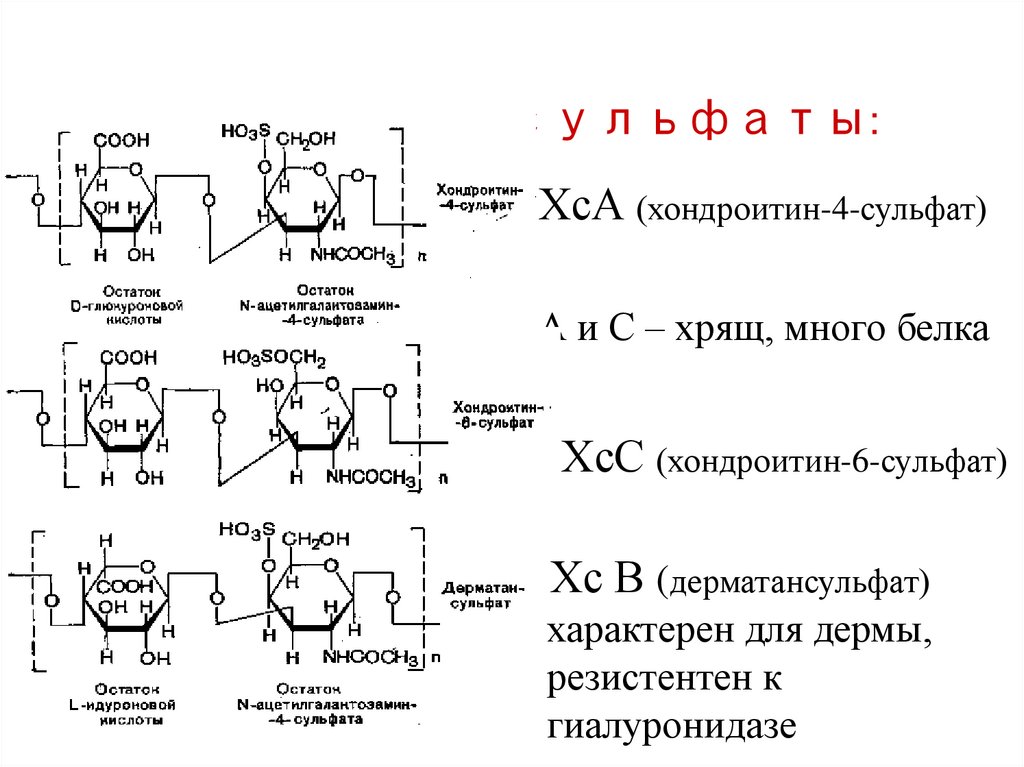
Хондроитинсульфаты:ХсА (хондроитин-4-сульфат)
А и С – хрящ, много белка
ХсС (хондроитин-6-сульфат)
Хс В (дерматансульфат)
характерен для дермы,
резистентен к
гиалуронидазе
68.
Кератансульфаты: Кс I –роговица глаза
Кс II – хрящевая ткань
Гепарин – антикоагулянт;
гепарансульфаты
69.
70.
71.
Белок подвергаетсяпосттрансляционной
модификации:
ксилозилированию и
фосфорилированию. Ключевой
фермент биосинтеза УДФксилозилтрансфераза,
переносящий остатки ксилозы
на коровый белок.
72.
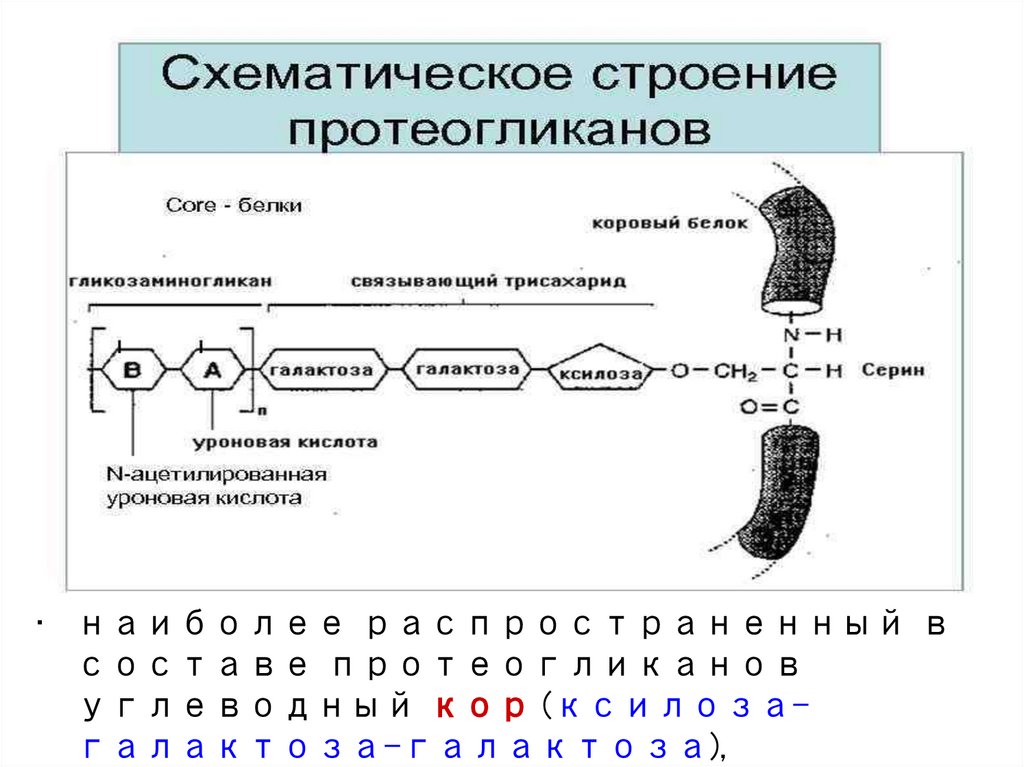
• наиболее распространенный всоставе протеогликанов
углеводный кор (ксилозагалактоза-галактоза),
73.
Связи компонентов ПРОТЕОГЛИКАНОВДля присоединения к коровому белку КОРа
(сердцевинного
олигосахаридного фрагмента, состоящего из простых сахаров)
в разных классах протеогликанов используются разные:
1. О-гликозидная между серином и ксилозой
2. О-гликозидная между серином/треонином
и N-ацетилглюкозамином
3. N-гликозиламидная между азотом аспарагина
и N-ацетилглюкозамином
Синтез кора N-связанных белковоуглеводных комплексов
идёт отдельно от белка. Ведущую роль в синтезе таких
олигосахаридов играет долихол (гидрофобный «якорь») –
полиизопреновое соединение, состоящее из 17-21 изопреновых
единиц (ответвление пути синтеза холестерола)
Затем присоединяются полимеры
74.
долихол
и его роль
в синтезе
олигосах
аров
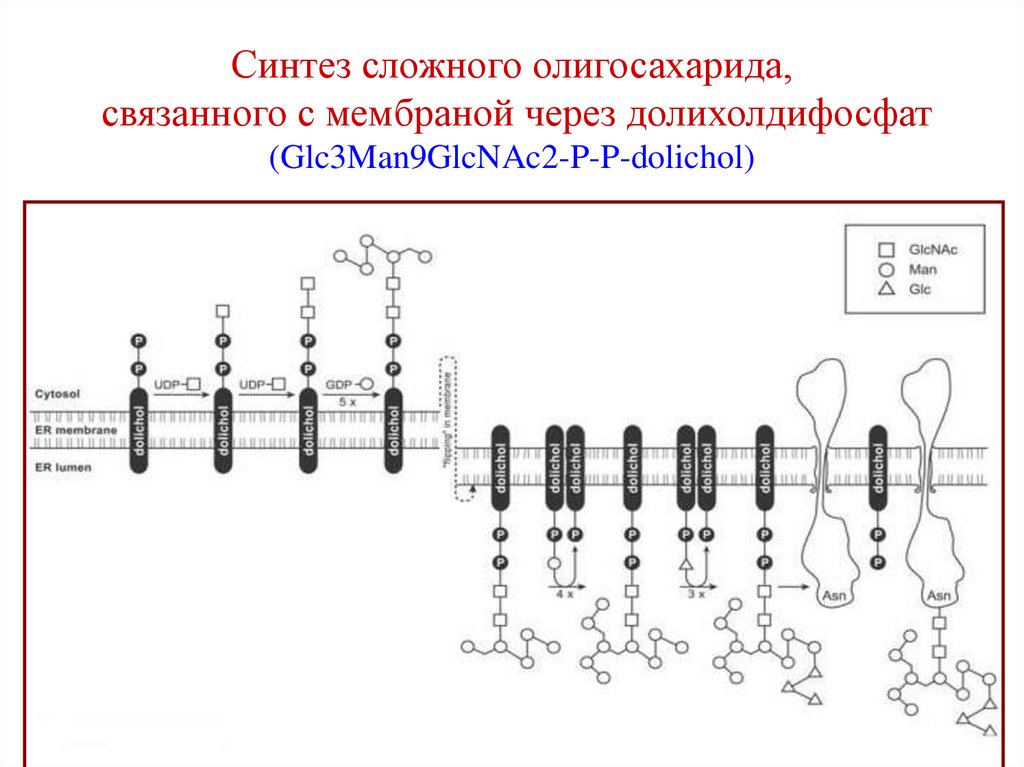
75. Синтез сложного олигосахарида, связанного с мембраной через долихолдифосфат (Glc3Man9GlcNAc2-P-P-dolichol)
76. Схема распознавания сайта гликозилирования и перенос углеводной цепи с липида (долихола) на растущий полипептид
77. Процессинг углеводной цепи в ЭПС и аппарате Гольджи (отщепление концевых моносахаров; формирование ядра – Man3GlcNAc2;
включение новых моносахаров) в итоге у разныхбелков разное конечное строение олигосахарида (ГП; кор ПГ)
78. Путь синтеза уроновых кислот в печени и соединительной ткани
79.
• Схемасинтеза
аминосахаров
из
глюкозы
80. Классификация протеогликанов основного вещества матрикса
• Большие ПГ(гиалектаны)
• Малые ПГ, богатые
лейцином
• ПГ базальных
мембран
• ПГ клеточных
мембран
81.
82.
Большие протеогликаны (гиалектаны) –агрекан и версикан - в хрящевой и костных тканях
ММ около 200 106 Да
1 мкм
Протеогликановый агрегат
Сердцевинный
белок
Связующие белки
Кератансульфат
Хондроитинсульфат
Сердцевина из
гиалуроновой кислоты
83.
84.
Малые протеогликаны богатыеЛЕЙ
имеют небольшой коровый белок, к которому
присоединены
одна или две цепи гликозаминогликанов.
Бигликан - ММ 36 000, серин в положении 5 и 11,
две ГАГ-цепи.
Декорин - ММ 38 000 Да, серин в 4 положении, одна
ГАГ-цепь из дерматансульфата с ММ 30 000 Да.
Имеет участок богатый лейцином, на N-конце серин.
Фибромодулин - ММ 40 000 Да, не содержит серина,
кератансульфат присоединен через NH-группу
аспарагина,
85.
Протеогликаныбазальных мембран
(перлекан, агрин, бамакан)
отличаются
гетерогенностью,
содержат
преимущественно
гепарансульфатные цепи
высокой и низкой
плотности
Протеогликаны
86.
Коллагены, ГП и ПГ вБАЗАЛЬНОЙ МЕМБРАНЕ
87.
1) трансмембранный коровый белок2) заякоренный коровый белок
88. В составе тканей зуба
• Протеогликаны и гликозаминогликанынаходятся, главным образом, в пульпе.
Среди гликозаминогликанов пульпы наиболее
часто встречаются гиалуроновая кислота,
хондроитин-6-сульфат, дерматан-4-сульфат и
кератан-4-фосфо-6-сульфат
• В дентине (дентиновых канальцах) и цементе
содержатся преимущественно гиалуроновая
кислота, хондроитинсульфаты, кератансульфат
89. Протеогликановые агрегаты пульпы 1 – гиалуроновая кислота, 2 – субъединицы кóровых белков протеогликанов, 3 – цепи
пульпы1 – гиалуроновая
кислота,
2 – субъединицы
кóровых
белков
протеогликанов,
3 – цепи
хондроитинсульф
атов,
4 – цепи
кератансульфато
в,
5 – цепи
дерматансульфат
Гиалуроновая кислота в пульпе может
связывать
ов,
несколько десятков коровых белков
протеогликанов,
6 – фрагменты
олигосахаридов.
образуя комплексы подобные надмолекулярным
агрегатам хряща.
• В агрегации комплексов участвуют ионы Са.
• Комплексы гиалектанов с гиалуроновой кислотой
определяют повышенную гидратированность пульпы.
90. В пульпе
• Гликозаминогликаны основного веществадинамичны и постоянно находятся в состоянии
«полимеризация↔деполимеризация». В
деполимеризации участвует гиалуронидаза.
• Интенсивность реакций зависит: в норме от
возраста, функциональной активности пульпы,
при заболеваниях – от течения патол. процесса.
• При воспалении под влиянием гиалуронидазы и
протеиназ активируется деполимеризация всех
компонентов белково-углеводных агрегатов
пульпы. В итоге образуется много дисахаридов,
они связывают бóльшее количество воды, и
пульпа набухает.
91. Здоровая пульпа является биобарьером, препятствующим проникновению патогенных микроорганизмов в периодонт
• Гликопротеины и протеогликаны основного веществапульпы богаты сиаловыми кислотами (N- или О-ацилированные производные нейраминовой кислоты).
• Сиаловые кислоты в гликопротеинах (сиалопротеины)
являются концевыми остатками олигосахаридов. Кроме
того, могут быть структурными компонентами протеогликанов (в кератансульфатах и др.), гликолипидов.
• Высокое содержание N-ацетилнейраминовой кислоты
обеспечивает защиту пульпы от инфекций и токсинов,
сосудов от атеросклероза.
92. Синтез сиаловых кислот (на примере N-ацетилнейраминовой)
93. Распад протеогликанов
• Распад происходит вмежклеточном матриксе
под действием гликозидаз
и протеаз.
• В гидролизе
гликозаминогликановых
компонен-тов участвует
множество ферментов:
β-гиалуронидаза, β-глюкуронидаза, β-галактозидаза,
α-L-идуронидаза, α-нейраминидаза,
α-глюкозаминидаза, N-ацетил-α-Dглюкозаминидаза, гепарансульфатаза,
α- и β-маннозидазы и другие.
94.
95.
• Название произошло отстарого наименования
гликозаминогликанов –
«мукополисахариды»
• В основе
мукополисахаридо
зов (МПС)
лежат наследственные
дефекты ферментов
деградации ГАГкомпонентов
протеогликанов в
матриксе соединительной
96. МПС относят к лизосомным болезням накопления
• Фрагменты ГАГ накапливаются в тканях.• МПС проявляются системными
дефектами костной, хрящевой,
соединительных тканей (с деформацией
скелета, поражением сосудов,
помутнением роговицы), задержкой
физического и умственного развития,
снижением продолжительности жизни.
97. МПС 1
98. МПС 1
99. МПС 2
100. МПС 2 – синдром Хантера
101. МПС 3
102. полость рта при МПС
• Для зубочелюстнойсистемы важны:
гигиена полости рта,
удаление зубов
• Для слюнных желёз:
хирургическая
реканализация
саливаторных
протоков

































































































 biology
biology








