Similar presentations:
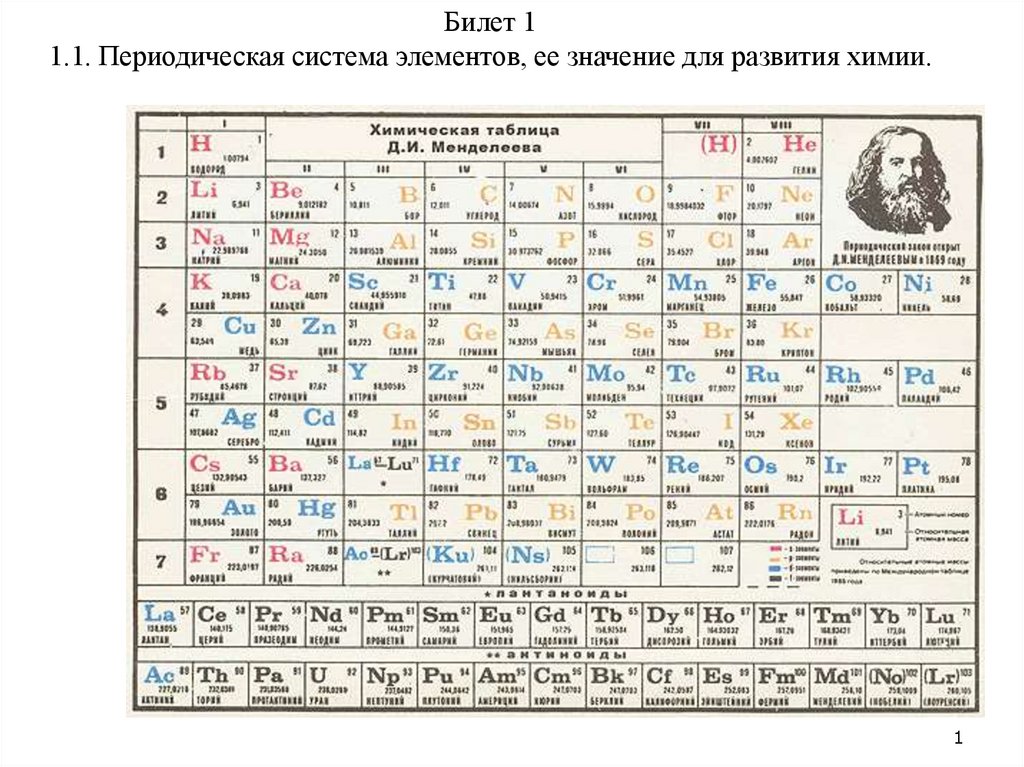
Периодическая система элементов, ее значение для развития химии
1.
Билет 11.1. Периодическая система элементов, ее значение для развития химии.
1
2.
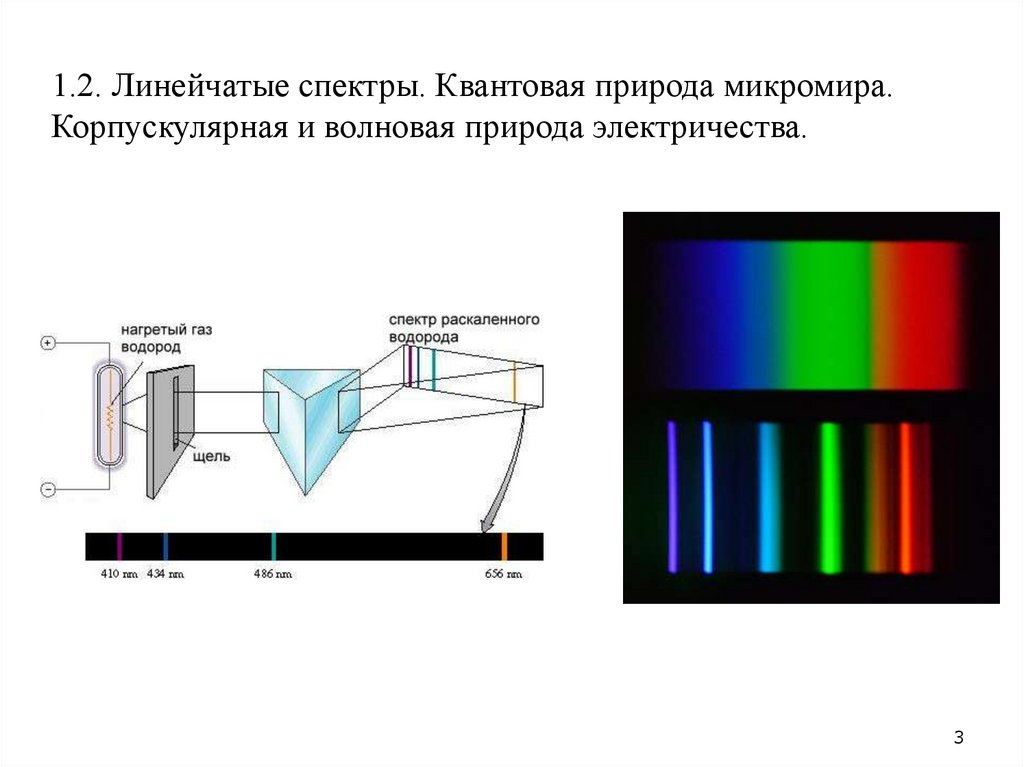
•1.2. Линейчатые спектры. Квантовая природа микромира.• Корпускулярная и волновая природа электронов. Описание атома водорода.
3.
1.2. Линейчатые спектры. Квантовая природа микромира.Корпускулярная и волновая природа электричества.
3
4.
Билет 22.1. Сложные вещества, атом, молекула, кристалл. Волновая функция,
понятие орбитали.
Сложные вещества образованы разными элементами и могут иметь состав
постоянный (стехиометрические соединения) или меняющийся в некоторых
пределах (нестехиометрические соединения).
4
5.
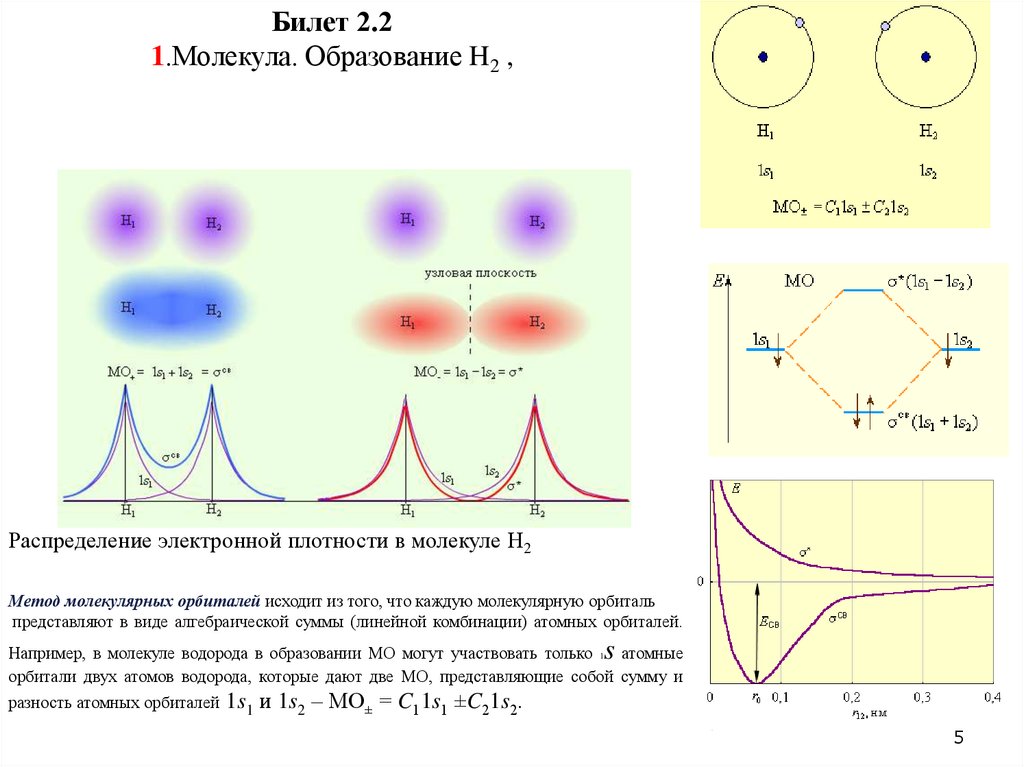
Билет 2.21.Молекула. Образование H2 ,
Распределение электронной плотности в молекуле H2
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь
представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей.
s
Например, в молекуле водорода в образовании МО могут участвовать только 1 атомные
орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и
разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
5
6.
Билет 3•Квантовая природа микромира. Корпускулярно волновая природа материи,
•соотношение де Бройля. Электроны и электромагнитные волны,
•спин электрона, ионы.
3.1. Основные парадигмы строения вещества:
1. Атомно-молекулярное строение вещества, "кирпичное"
(из элементарных частиц) в своей основе.
2. Квантовая природа микромира.
3. Корпускулярно-волновая природа электричества
(электроны и электромагнитные волны, электрическое
поле).
4. Закон сохранения материи-энергии.
5. Электрическая (электронная) природа химической связи.
6. Однозначная связь строения вещества и его химических
свойств (Периодический закон).
6
7.
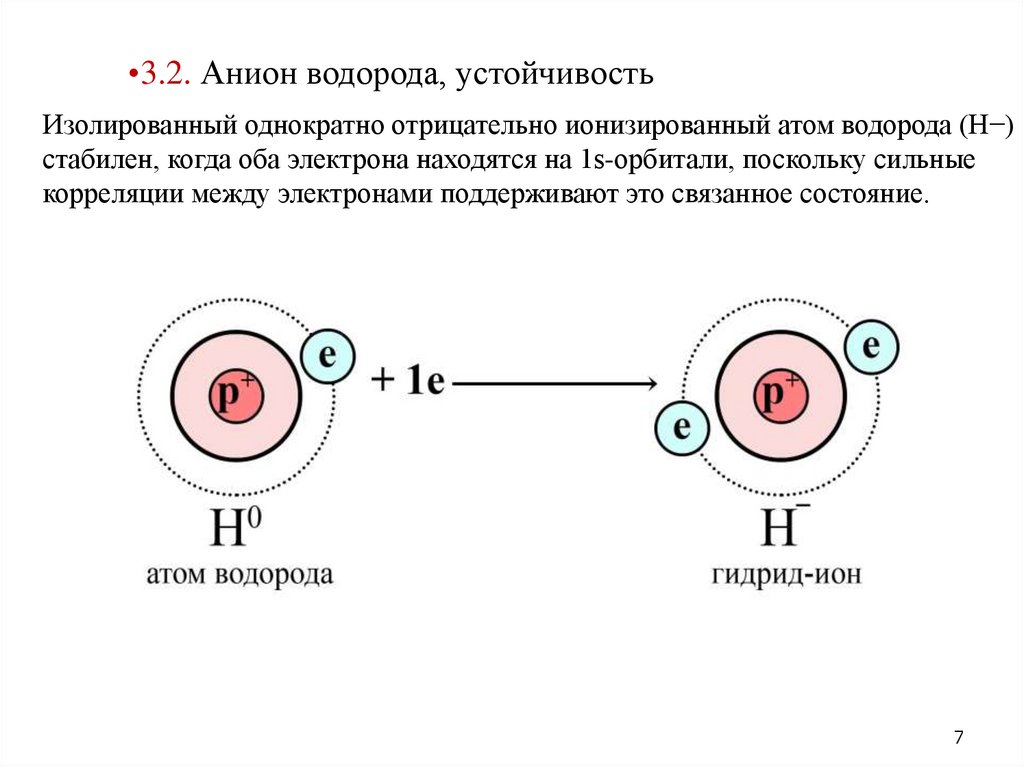
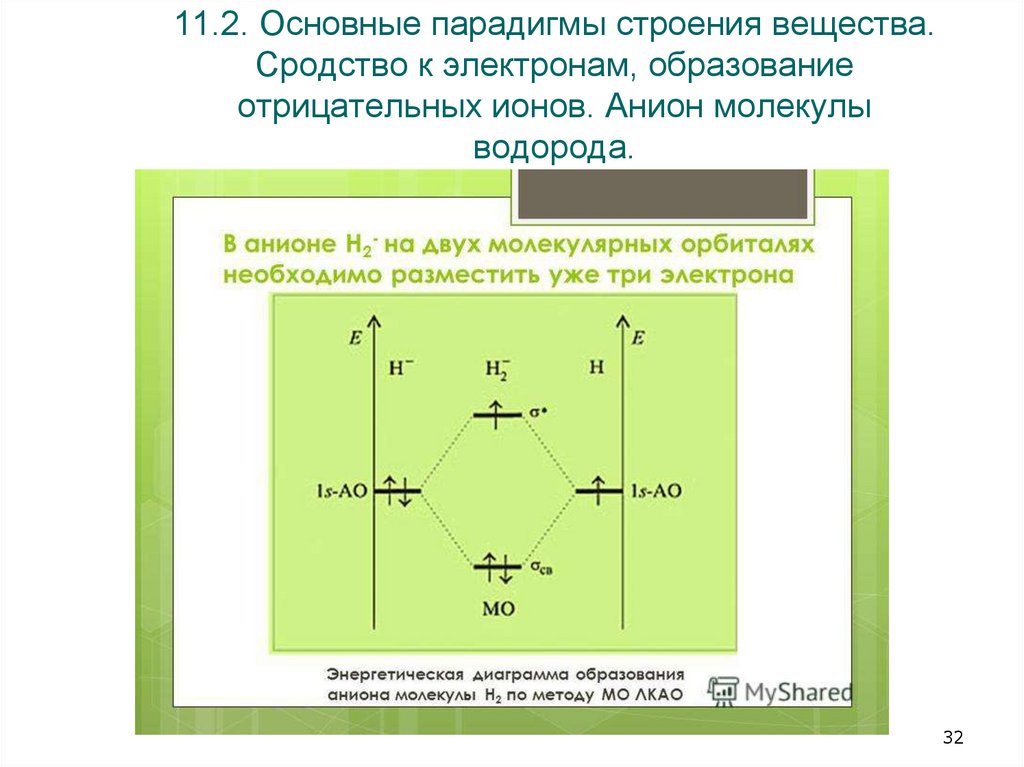
•3.2. Анион водорода, устойчивостьИзолированный однократно отрицательно ионизированный атом водорода (H−)
стабилен, когда оба электрона находятся на 1s-орбитали, поскольку сильные
корреляции между электронами поддерживают это связанное состояние.
7
8.
4.1. Некоторые вещества встречаются самородномсостоянии, в месторождениях и для их применения
не надо осуществлять химические превращения
S
Pt
Ag
Cu
Au
8
9.
4.1. Аллотро́пия - существование двух и более простыхвеществ одного и того же химического элемента ,
различных по строению и свойствам - так называемых
аллотропных модификаций или форм.
Элемент
Аллотропные модификации
Множество модификаций: алмаз, графит,
УГЛЕРОД: фуллерен, карбин, графен, углеродные
нанотрубки
Две аллотропные модификации: О2 — КИСЛОРОД
и О3 — ОЗОН. Кислород бесцветен, не имеет
КИСЛОРОД:
запаха; озон имеет выраженный запах, имеет
бледно-фиолетовый цвет, он более бактерициден.
Большое число аллотропных модификаций,
второе место после углерода. Основные
СЕРА:
модификации: ромбическая, моноклинная и
пластическая сера.
9
10.
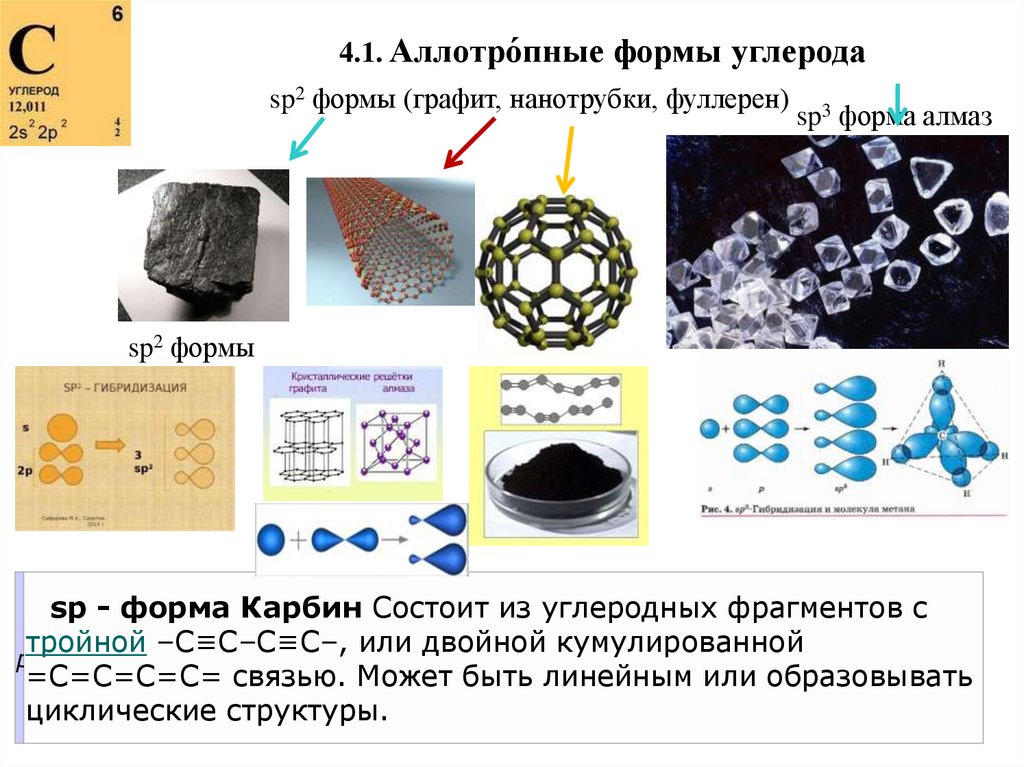
4.1. Аллотро́пные формы углеродаsp2 формы (графит, нанотрубки, фуллерен)
sp3 форма алмаз
sp2 формы
sp - форма Карбин Состоит из углеродных фрагментов с
тройной –С≡С–С≡С–, или двойной кумулированной
p
=С=С=С=С= связью. Может быть линейным или образовывать
циклические структуры.
10
11.
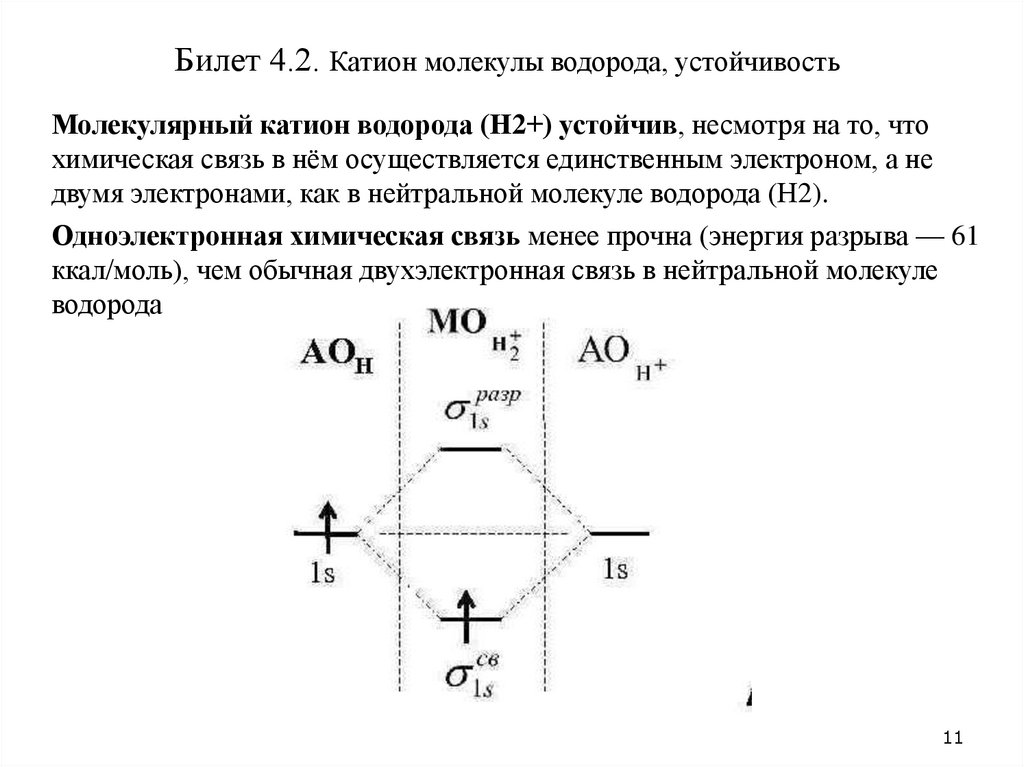
Билет 4.2. Катион молекулы водорода, устойчивостьМолекулярный катион водорода (H2+) устойчив, несмотря на то, что
химическая связь в нём осуществляется единственным электроном, а не
двумя электронами, как в нейтральной молекуле водорода (H2).
Одноэлектронная химическая связь менее прочна (энергия разрыва — 61
ккал/моль), чем обычная двухэлектронная связь в нейтральной молекуле
водорода
11
12.
Билет 5.21. Квантовые постулаты Бора.
Первый постулат Бора (постулат стационарных состояний): в
атоме существуют стационарные (не изменяющиеся со временем)
состояния, в которых он не излучает энергии. Стационарным
состояниям атома соответствуют стационарные орбиты, по которым
движутся электроны. Движение электронов по стационарным орбитам
не сопровождается излучением электромагнитных волн.
Втором постулат Бора (правило частот): при переходе электрона с одной
стационарной орбиты на другую излучается (поглощается) один фотон с
энергией: ħω= En – Em
Третий постулат: в стационарном состоянии атома электрон, двигаясь по
круговой орбите, должен иметь дискретные квантованные значения момента
импульса, удовлетворяющие условию: mvrn = n ħ
12
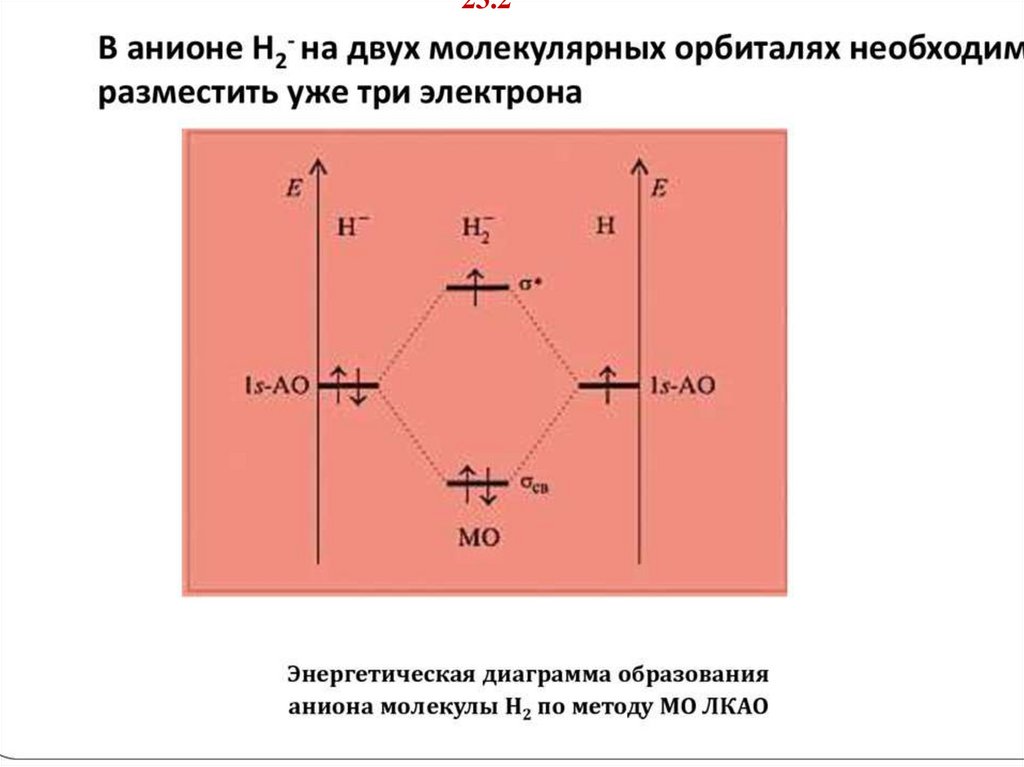
13.
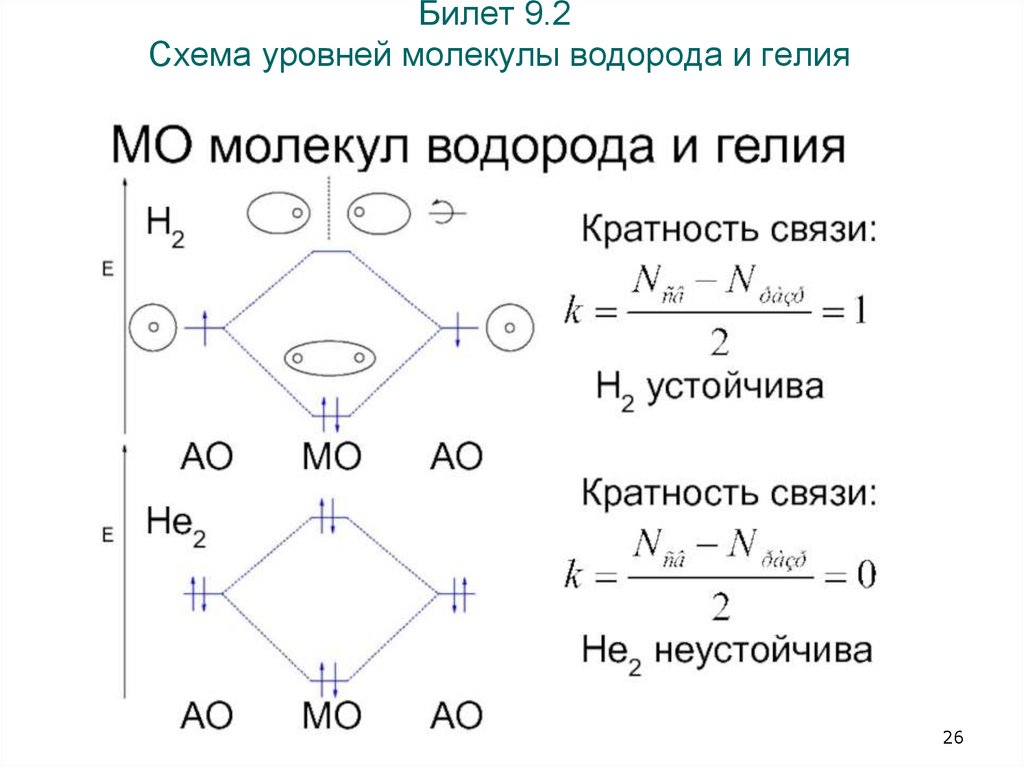
5.2. Ионы молекулы водорода – отрицательный и положительныйТаблица Энергия, длина и порядок связи в молекулах элементов 1 периода
Молекулярны
е параметры
Молекулы и молекулярные ионы
МО
H2+
H2
He2+
He2
σ*
-
-
-
-+
σсв
-
-+
-+
-+
Eсв,
кДж∙моль–1
256
435
230
0
Длина
связи, r 0, нм
0,106
0,075
0,108
–
Порядок
связи
0,5
1
0,5
0
13
14.
Билет 66.1. Предмет и задачи химии. Атом и молекула. Место химии в системе
естественных наук.
Веществ очень много. В настоящее время ученые знают около 4 млн.
органических и около 100 тыс. неорганических (минеральных) веществ.
Их классифицируют по различным признакам. Так, все известные
вещества можно разделить на три группы: простые, сложные и смеси.
Важнейшие задачи химии –
1. получение веществ с заранее заданными свойствами,
2. интенсификация промышленных производств
3. создание безотходных технологий химических превращений.
14
15.
6.1. Атом (от греч. atomos – неделимый), наименьшая частицахимического элемента, носитель его свойств. Каждому
химическому элементу соответствует совокупность
определенных атомов.
Молекула (новолат. molecula, уменьшит. от лат. moles – масса),
микрочастица, образованная из двух или большего числа
атомов и способная к самостоятельному существованию.
Имеет постоянный состав (качественный и количественный)
входящих в нее атомных ядер и фиксированное число
электронов и обладает совокупностью свойств, позволяющих
отличать одну молекулу от других, в т. ч. от молекул того же
состава.
15
16.
6.216
17. Билет 7.1 Молекулярно-кинетическая теория.
1718.
Билет 7.2. Решение уравнения Шредингера в сферических координатах,оператор Лапласа в декартовых координатах, смысл волновой функции.
Рассмотрим сейчас решение уравнения Шрёдингера для атома водорода.
Так как потенциальная функция электрона в атоме водорода имеет вид e2/r
где e — заряд электрона (и протона), r — радиус-вектор, то уравнение
Шрёдингера запишется следующим образом:
В декартовых координатах оператор Лапласа имеет вид:
В сферических координатах оператор Лапласа имеет вид:
18
19.
7.2. Решение уравнения Шредингера в сферическихкоординатах для атома водорода имеет вид:
где:
— Боровский радиус.
— обобщённые полиномы Лагерра степени от функции
— нормированные на единицу сферические функции.
Выражение для энергии электрона
n – главное квантовое число
l – орбитальное квантовое число
m – магнитное квантовое число
постоянная Ридберга
19
20.
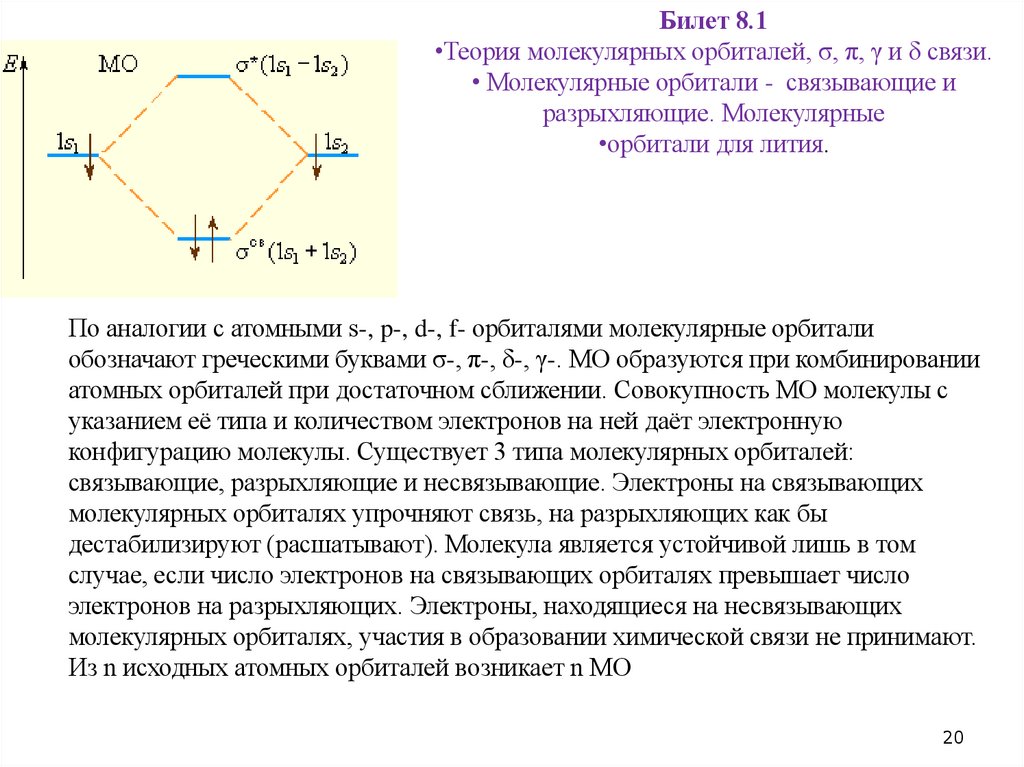
Билет 8.1•Теория молекулярных орбиталей, σ, π, γ и δ связи.
• Молекулярные орбитали - связывающие и
разрыхляющие. Молекулярные
•орбитали для лития.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали
обозначают греческими буквами σ-, π-, δ-, γ-. МО образуются при комбинировании
атомных орбиталей при достаточном сближении. Совокупность МО молекулы с
указанием её типа и количеством электронов на ней даёт электронную
конфигурацию молекулы. Существует 3 типа молекулярных орбиталей:
связывающие, разрыхляющие и несвязывающие. Электроны на связывающих
молекулярных орбиталях упрочняют связь, на разрыхляющих как бы
дестабилизируют (расшатывают). Молекула является устойчивой лишь в том
случае, если число электронов на связывающих орбиталях превышает число
электронов на разрыхляющих. Электроны, находящиеся на несвязывающих
молекулярных орбиталях, участия в образовании химической связи не принимают.
Из n исходных атомных орбиталей возникает n МО
20
21.
Билет 8.2Вещество, простые и сложные вещества. Разделы химии.
Минералы, их образование, Молекула He2.
Химия тесно связана с физикой. Это физическая химия.
Химия соприкасается также с другими естественными науками и
особенно с геологией (геохимия) и биологией (биохимия) .
Космохимия изучает состав космических тел и миграцию элементов во
Вселенной.
Химию можно разделить на три большие части: общую, неорганическую и
органическую.
Общая химия рассматривает закономерности, относящиеся ко всем
химическим превращениям. Неорганическая химия изучает свойства и
превращения неорганических (минеральных) веществ.
Органическая химия изучает свойства и превращения органических
веществ.
21
22.
8.2. Пять наиболее используемых продуктов добыто вРФ в 2018 году:
1. Нефть - более 500 млн. т.
2. Газ - 733 млрд куб. м.
3. Уголь - более 439 млн. т угля
4. Известняк –62 млн. тонн 2018 году в России
5. Сера –7 млн. тонн.
22
23. 8.2. Связь химии с другими разделами естествознания
Химия тесно связана с физикой.Это физическая химия.
Химия соприкасается также с
другими естественными науками и
особенно с геологией (геохимия)
и биологией (биохимия) .
Космохимия изучает состав
космических тел и миграцию
элементов во Вселенной.
23
24.
•8.2. Молекула He2.Некоторые особенности этой молекулы:
Слабая связь между атомами. Молекула разорвётся, если будет слишком
сильно вращаться или вибрировать.
Большая длина связи. Расстояние между атомами в димере гелия
составляет около 5200 пикометров (52 Å).
Маленькая энергия связи. Димер гелия обладает энергией связи около
десятой доли микроэлектронвольта.
Можно сказать что молекула не устойчива
24
25.
Билет 9.18.1. Основные положения метода валентных связей. Атомные
орбитали. Радиальная и угловая части волновой функции
1. Ковалентную химическую связь образуют два электрона с
противоположными спинами, принадлежащие двум атомам. Например, при
сближении двух атомов водорода происходит частичное перекрывание их
электронных орбиталей и образуется общая пара электронов
2. При образовании ковалентной химической связи происходит
перекрывание волновых функций электронов (электронных орбиталей),
при этом связь будет тем прочнее, чем больше это перекрывание.
3. Ковалентная химическая связь располагается в том направлении, в
котором возможность перекрывания волновых функций электронов,
образующих связь будет наибольшей.
4. Валентность атома в нормальном (невозбужденном) состоянии
определяется:
числом неспаренных электронов, участвующих в образовании общих
электронных пар с электронами других атомов;
25
26. Билет 9.2 Схема уровней молекулы водорода и гелия
2627.
Билет 10•10. 1.Элементная сера, ее полиморфизм.
• Роль серы в современной промышленности
•и проблемы, связанные с ее переработкой.
27
28.
10.1.СЕРА один из немногих элементов способныхобразовывать цепочечные структуры
Преобладающий желтовато-зеленый цвет обусловлен присутствием
наиболее распространенного аллотропа серы с молекулой из восьми
атомов – S8. В определенных условиях эти молекулы разделяются на
более короткие цепочки S3 и S4, там сера приобретает более
красноватый оттенок.
Полисульфид кальция CaSx,
где х=4 или 5
28
29.
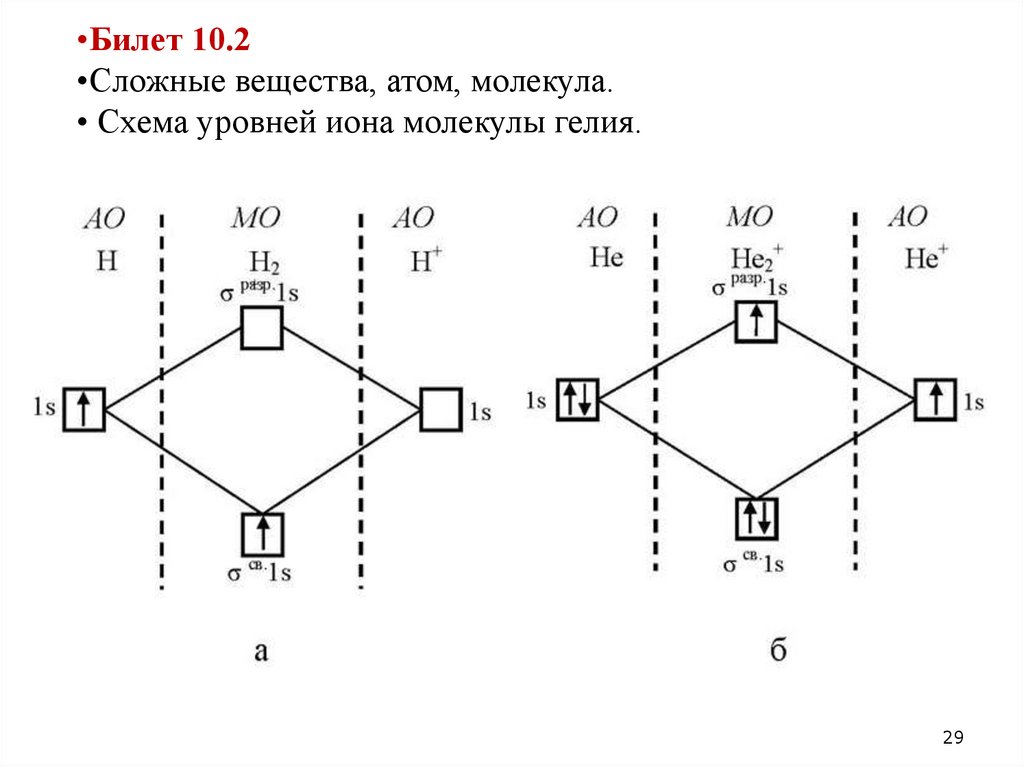
•Билет 10.2•Сложные вещества, атом, молекула.
• Схема уровней иона молекулы гелия.
29
30. Билет 11 1.1. Формулы Льюиса, изображения неполярных молекул водорода, кислорода, хлора, азота. Химическая ковалентная связь
Американский химик Дж. Льюис в 1916 году предложилобозначать электроны точками рядом с символами элементов.
Одна точка обозначает один электрон. В этом случае
образование молекулы водорода из атомов записывается так:
Оказалось, что формулы Льюиса имеют глубокий химический
смысл. Мы видим, что связь между атомами водорода
обозначается парой электронов. Как предположил Льюис,
именно пара электронов позволяет образовать ковалентную
связь.
30
31. 11.1. Только о небольшой части всех химических связей можно сказать, что они являются чисто ковалентными. В таких соединениях
поделеннаяпара электронов всегда находится на одинаковом расстоянии от ядер
обоих атомов. Это возможно тогда, когда между собой связаны
одинаковые атомы. Например, из рассмотренных нами в этой главе
молекул чисто ковалентными окажутся двухатомные молекулы
водорода, кислорода, хлора, азота:
Когда между собой связываются разные
атомы, поделенная пара химической
связи всегда смещена к одному из
атомов. К какому? Разумеется, к тому
атому, который проявляет более сильные
акцепторные свойства.
31
32. 11.2. Основные парадигмы строения вещества. Сродство к электронам, образование отрицательных ионов. Анион молекулы водорода.
3233.
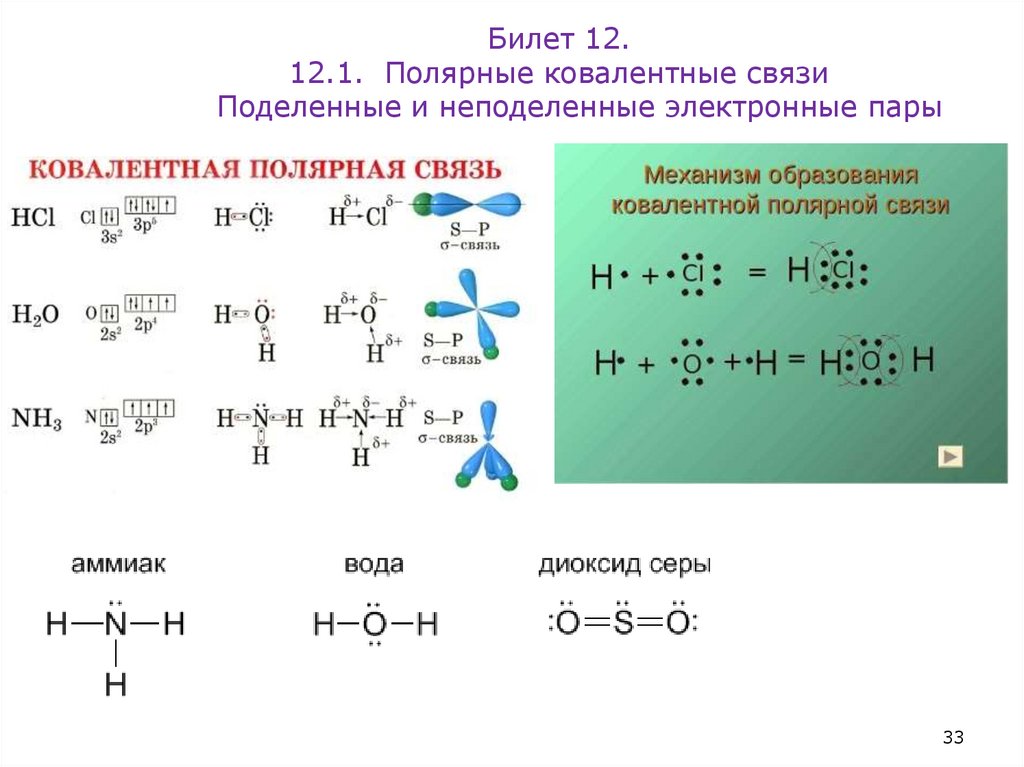
Билет 12.12.1. Полярные ковалентные связи
Поделенные и неподеленные электронные пары
33
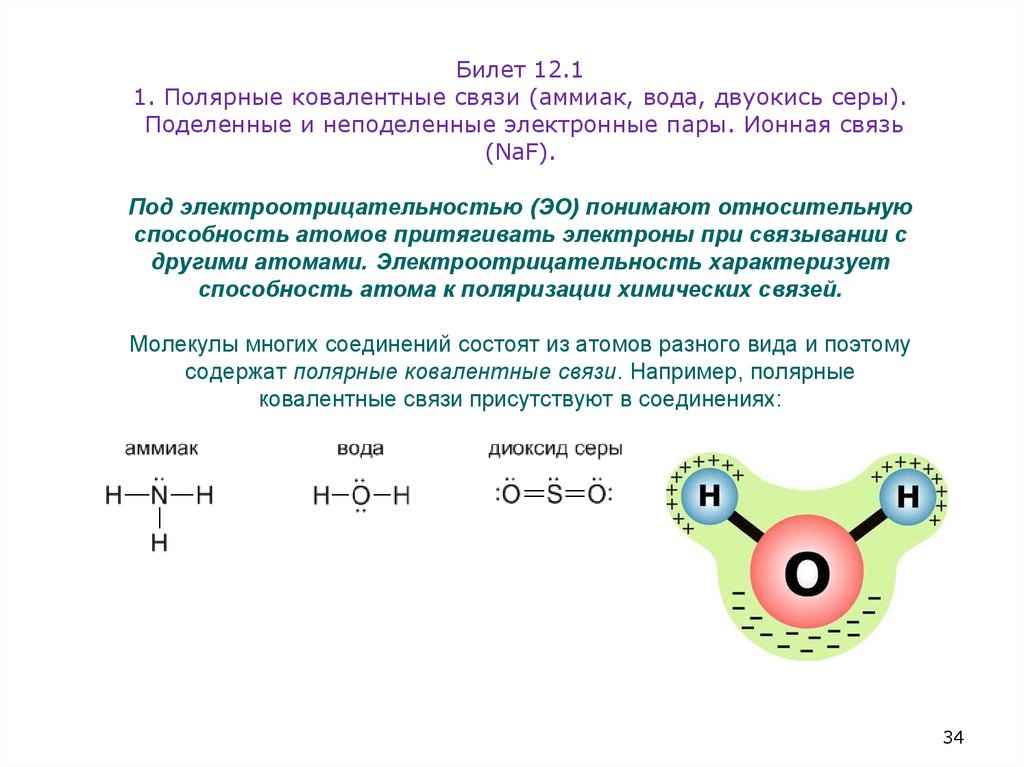
34. Билет 12.1 1. Полярные ковалентные связи (аммиак, вода, двуокись серы). Поделенные и неподеленные электронные пары. Ионная
связь(NaF).
Под электроотрицательностью (ЭО) понимают относительную
способность атомов притягивать электроны при связывании с
другими атомами. Электроотрицательность характеризует
способность атома к поляризации химических связей.
Молекулы многих соединений состоят из атомов разного вида и поэтому
содержат полярные ковалентные связи. Например, полярные
ковалентные связи присутствуют в соединениях:
34
35.
12.2. Молекула кислорода.В молекуле кислорода (O2) валентные орбитали (орбитали, которые
участвуют в образовании химической связи) расположены на
внешнем энергетическом уровне атома кислорода. Атом кислорода
имеет две p-орбитали, на которых находятся электроны, способные
образовать химическую связь.
35
36.
Билет 1313.1. Сродство к электронам, образование
отрицательных ионов.
Энергия сродства к электрону (ε) – это энергия,
выделяющаяся в процессе присоединения электрона к
свободному нейтральному атому (А):
А + e− = А− + ε
Зависимость энергии сродства к электрону от электронной
конфигурации атома1
Элемент
Li
Be
B
C
N
O
F
Электронная
конфигурация
s1
s2
s2p1
s2p2
s2p3
s2p4
s2p5 s2p6
ε, эВ
Ne
-0,59 0,19 -0,30 -1,27 0,21 -1,47 -3,45 0,22
_____________________
1. Таблица с сайта http://ru.wikipedia.org/
36
37.
13.237
38. Билет 14.1. Ионная связь
Na: 1s2 2s2 2p6 3s1F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
В электронных формулах нам важны только электронные
конфигурации внешних уровней (они подчеркнуты). Запишем
реакцию с помощью формул Льюиса:
В отличие от предыдущего случая в дополнение к ковалентной
составляющей химической связи в молекуле Na+:F– добавляется
еще и электростатическое притяжение между ионами натрия и
фтора и этот факт делает связь прочнее.
38
39.
14.39
40.
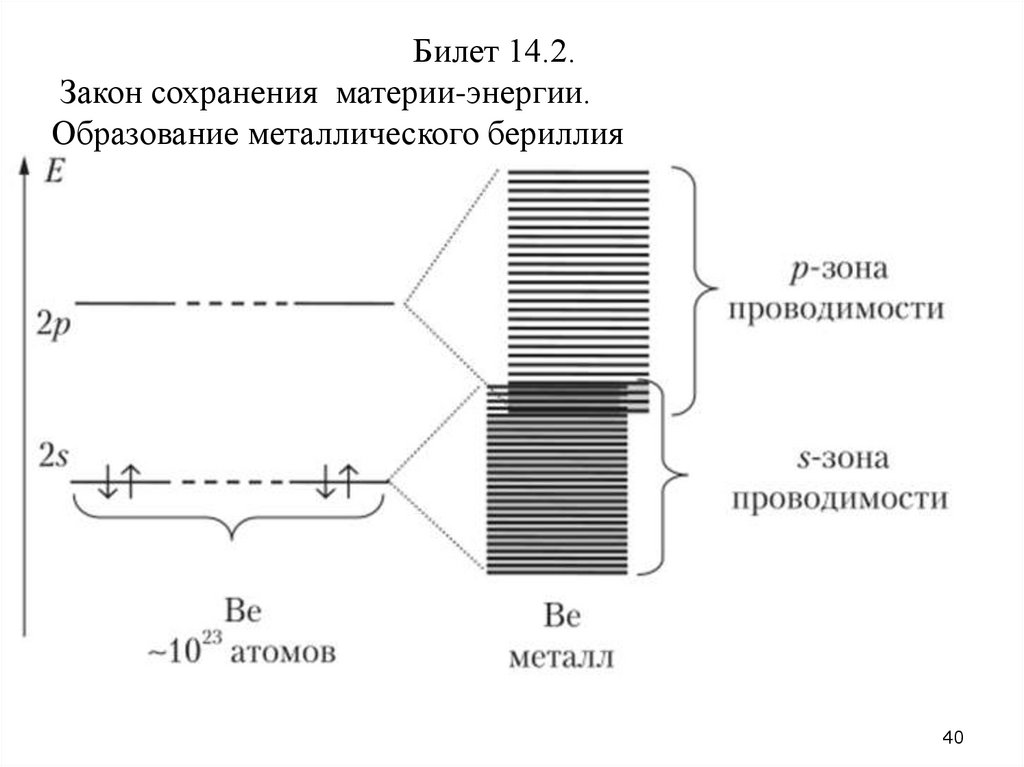
Билет 14.2.Закон сохранения материи-энергии.
Образование металлического бериллия
40
41.
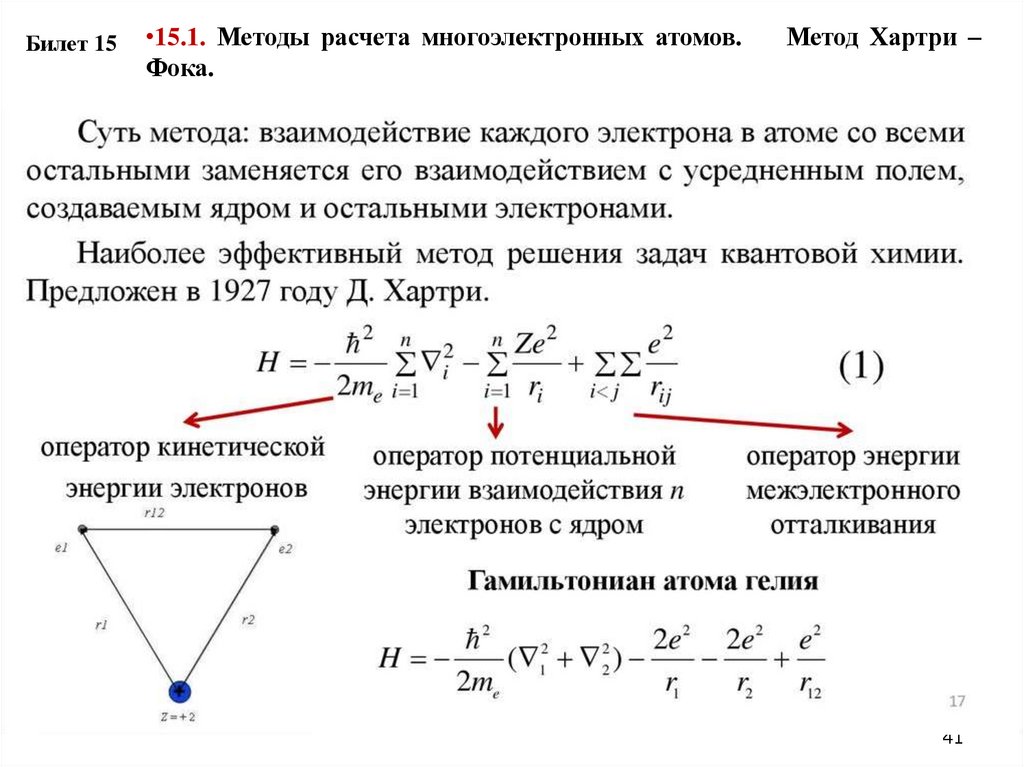
Билет 15•15.1. Методы расчета многоэлектронных атомов.
Фока.
Метод Хартри –
41
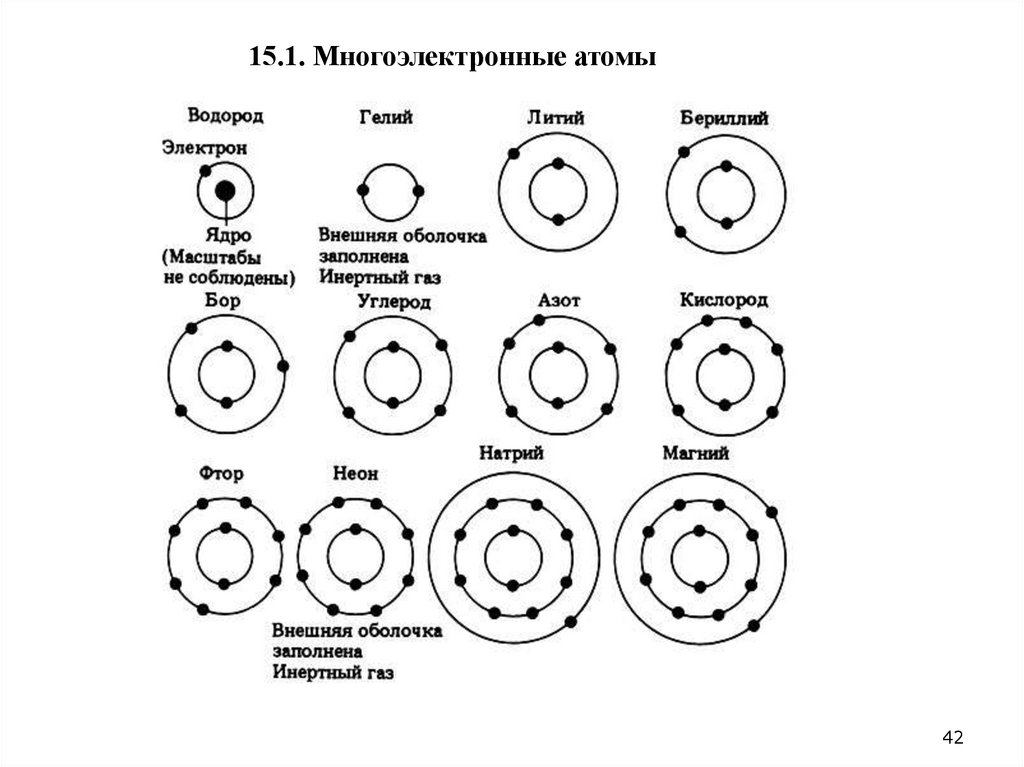
42.
15.1. Многоэлектронные атомы42
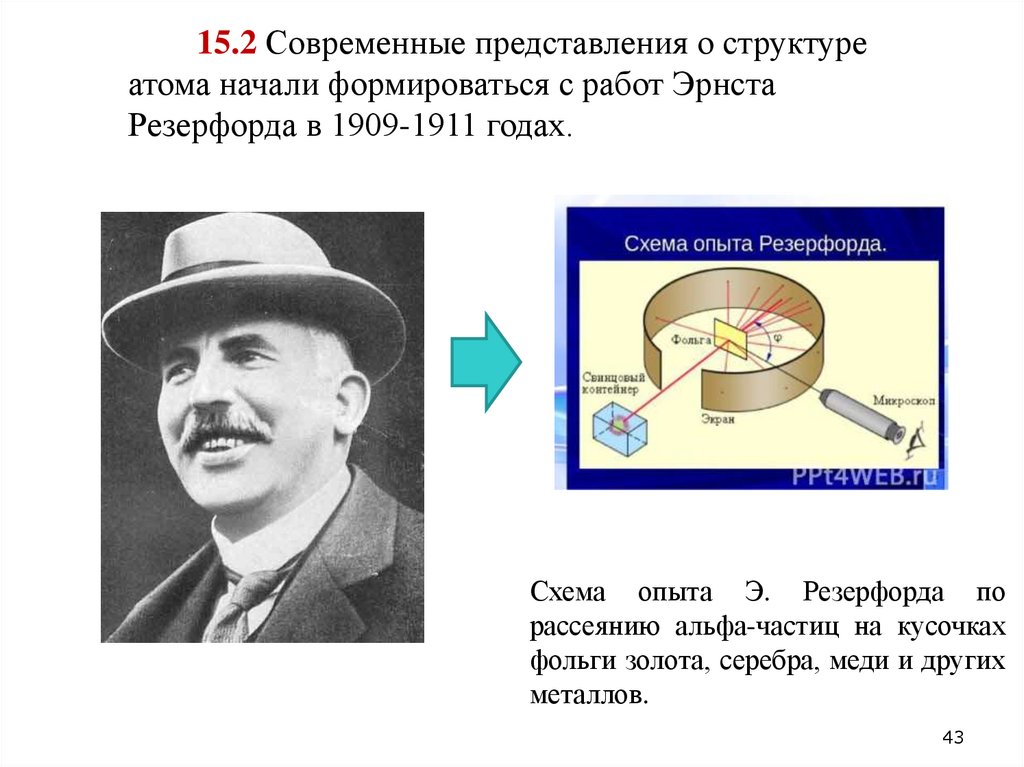
43.
15.2 Современные представления о структуреатома начали формироваться с работ Эрнста
Резерфорда в 1909-1911 годах.
Схема опыта Э. Резерфорда по
рассеянию альфа-частиц на кусочках
фольги золота, серебра, меди и других
металлов.
43
44.
15.2. Рассеяние отдельных α-частиц на большие углыРезерфорд объяснил тем, что положительный заряд в атоме
не распределен равномерно в шаре радиусом 10-10м, как
предполагали ранее, а сосредоточен в центральной части
атома (атомном ядре) в области значительно меньших
размеров. Расчеты Резерфорда показали, что для
объяснения опытов по рассеянию α-частиц нужно принять
радиус атомного ядра равным примерно 10-15м.
44
45.
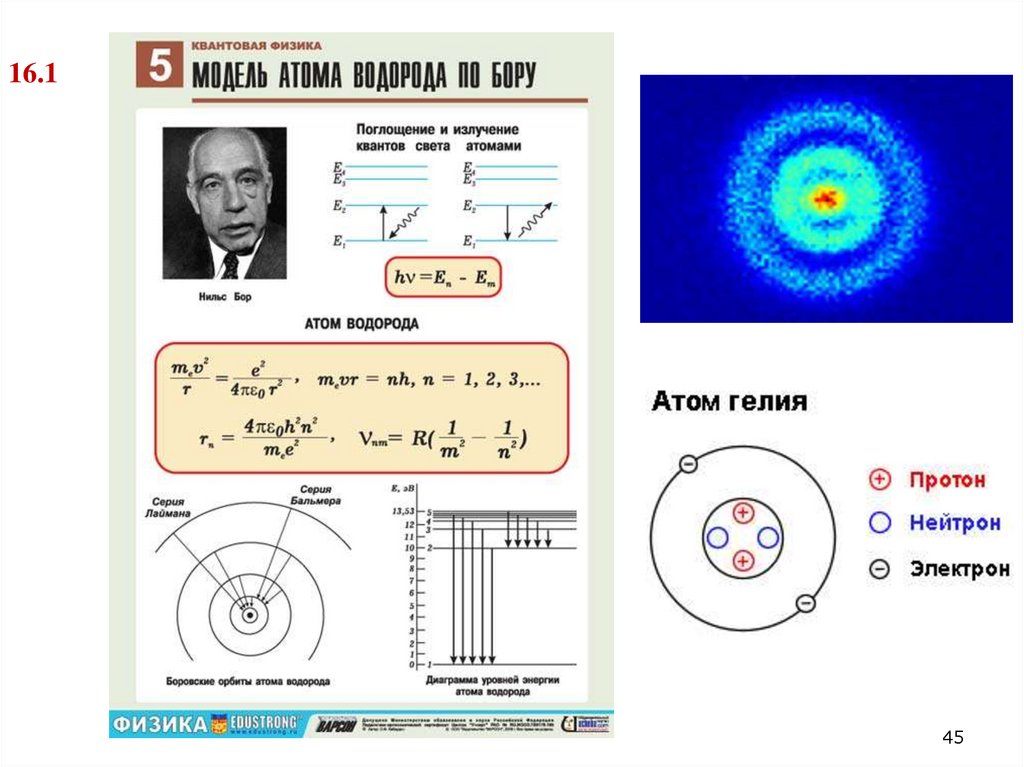
16.145
46.
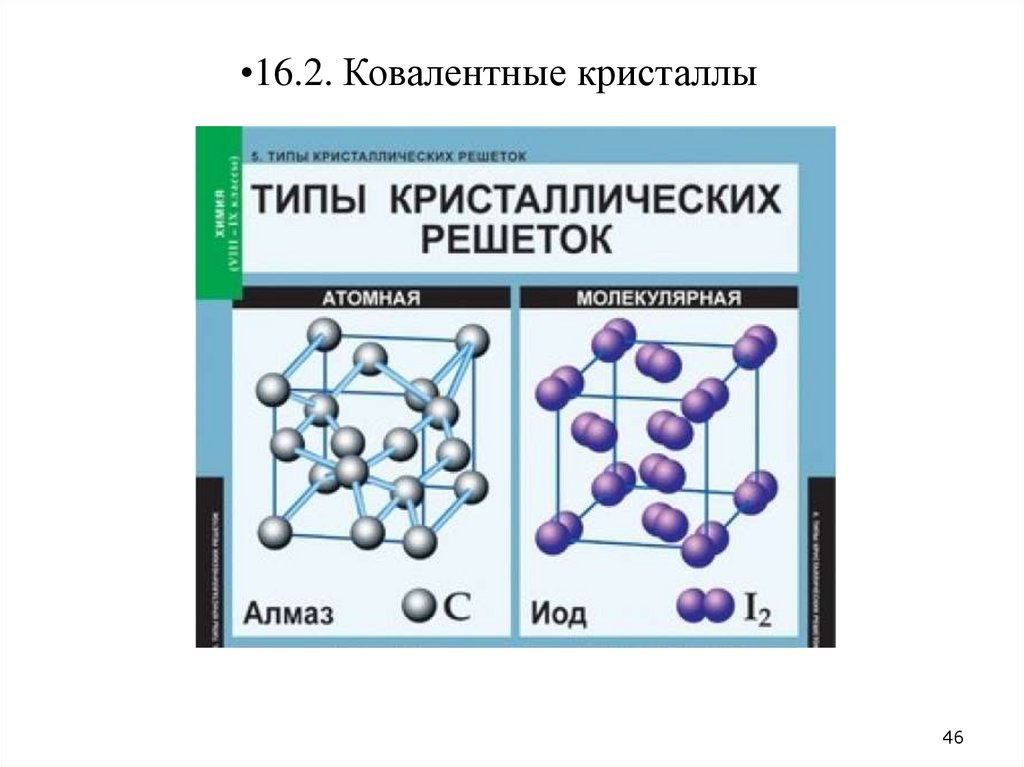
•16.2. Ковалентные кристаллы46
47.
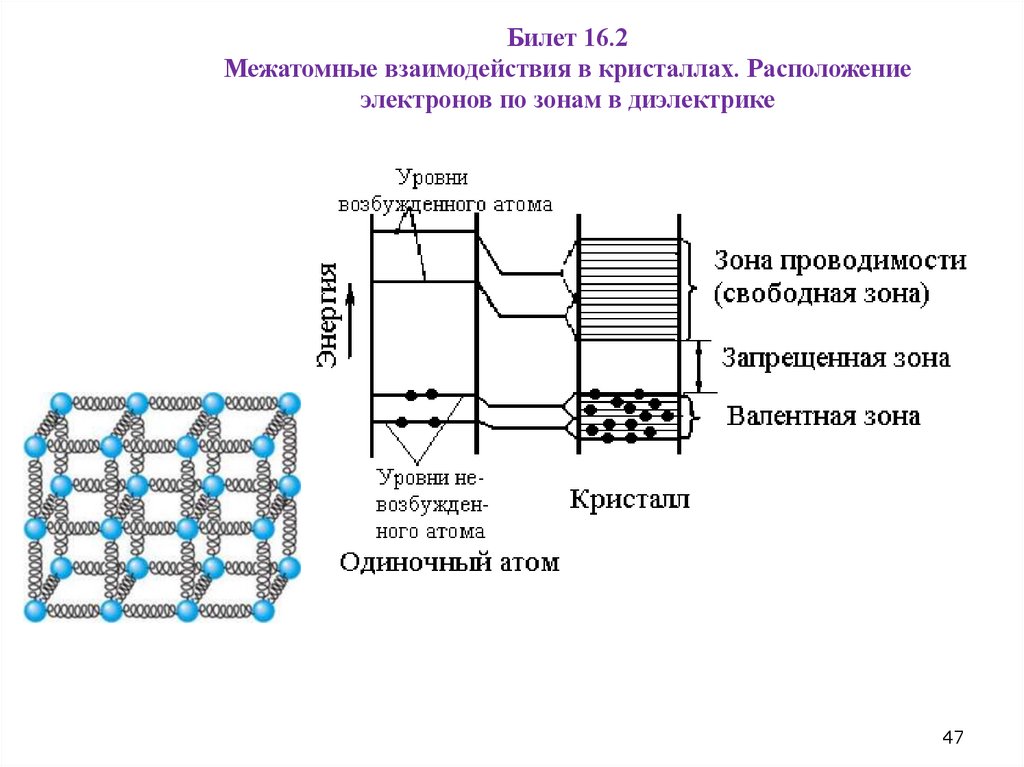
Билет 16.2Межатомные взаимодействия в кристаллах. Расположение
электронов по зонам в диэлектрике
47
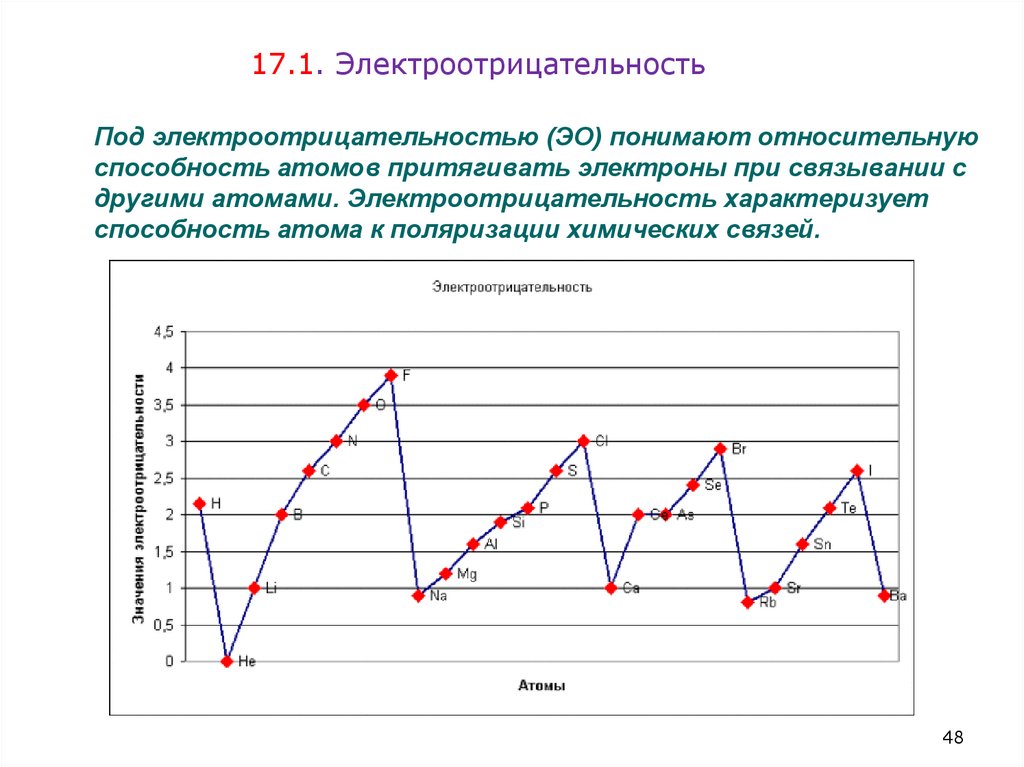
48. Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими
17.1. ЭлектроотрицательностьПод электроотрицательностью (ЭО) понимают относительную
способность атомов притягивать электроны при связывании с
другими атомами. Электроотрицательность характеризует
способность атома к поляризации химических связей.
48
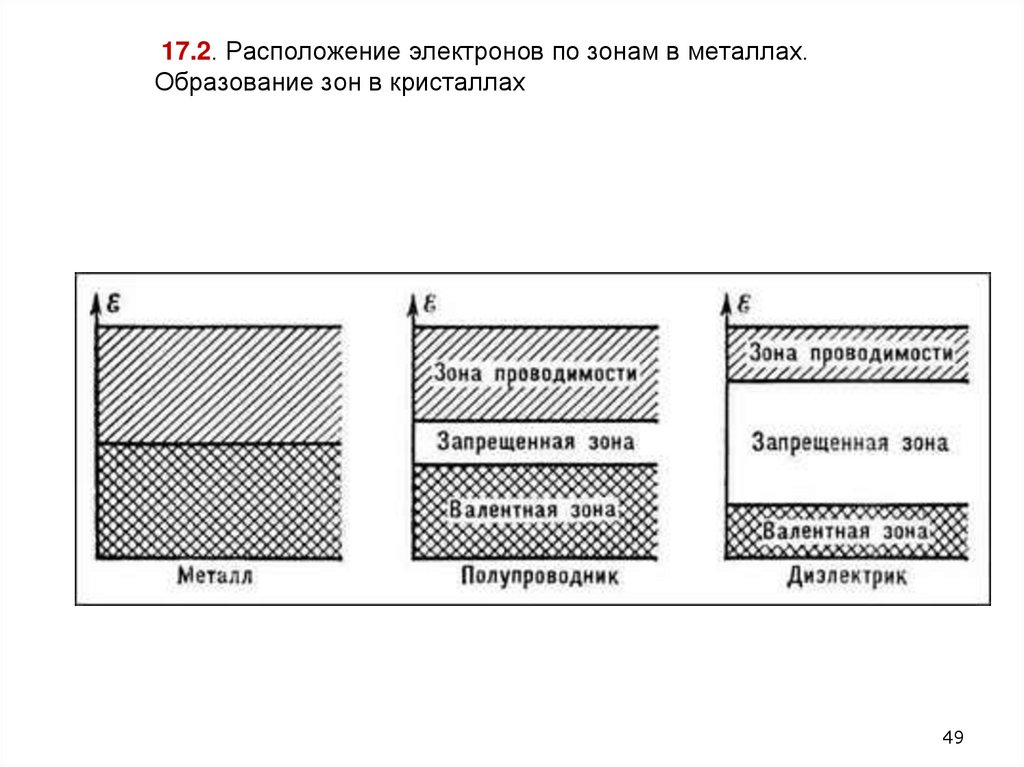
49. 17.2. Расположение электронов по зонам в металлах. Образование зон в кристаллах
4950.
Билет 18.11. Элементы с переменной валентностью.
Сера располагает свои 16 электронов на
2
4
1-м, 2-м и 3-м уровнях: 1s2 2s2 2p6 3s2 3p4 валентные...3s 3p
В основном (не возбужденном) состоянии сера двухвалентна. В
реакции с атомами водорода она образует соединение H2S потому,
что у нее на двух p-орбиталях (из трех имеющихся) находится по
одному электрону, и остается место для спаривания еще с двумя
"чужими" электронами водородных атомов.
50
51.
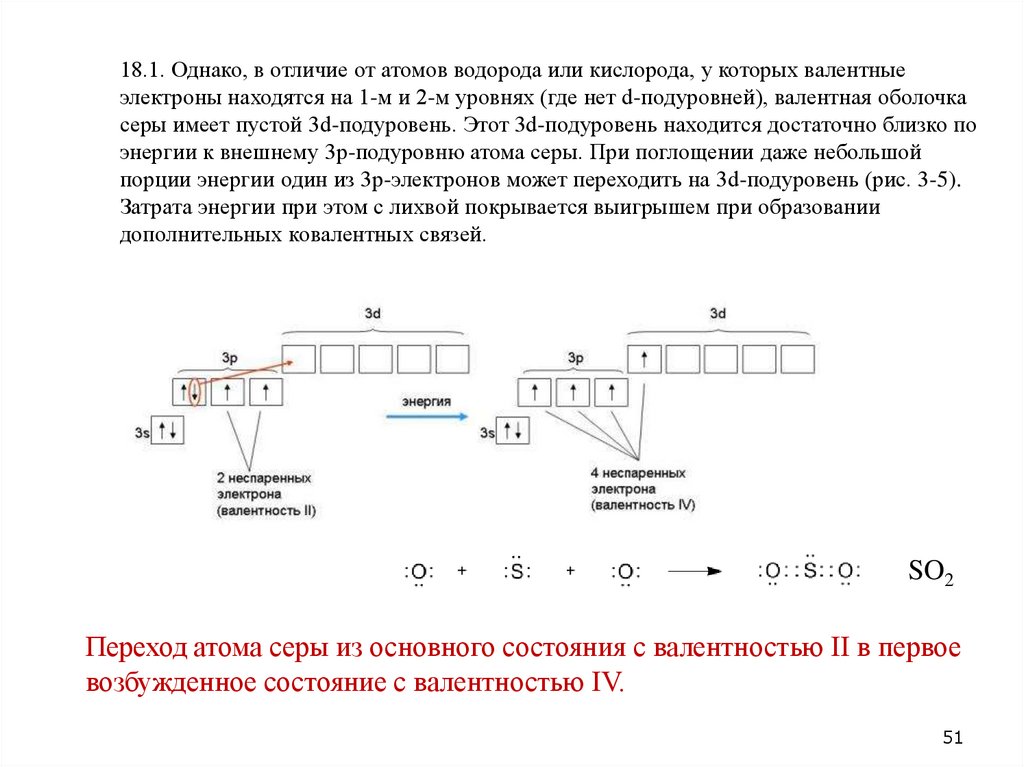
18.1. Однако, в отличие от атомов водорода или кислорода, у которых валентныеэлектроны находятся на 1-м и 2-м уровнях (где нет d-подуровней), валентная оболочка
серы имеет пустой 3d-подуровень. Этот 3d-подуровень находится достаточно близко по
энергии к внешнему 3p-подуровню атома серы. При поглощении даже небольшой
порции энергии один из 3p-электронов может переходить на 3d-подуровень (рис. 3-5).
Затрата энергии при этом с лихвой покрывается выигрышем при образовании
дополнительных ковалентных связей.
SO2
Переход атома серы из основного состояния с валентностью II в первое
возбужденное состояние с валентностью IV.
51
52.
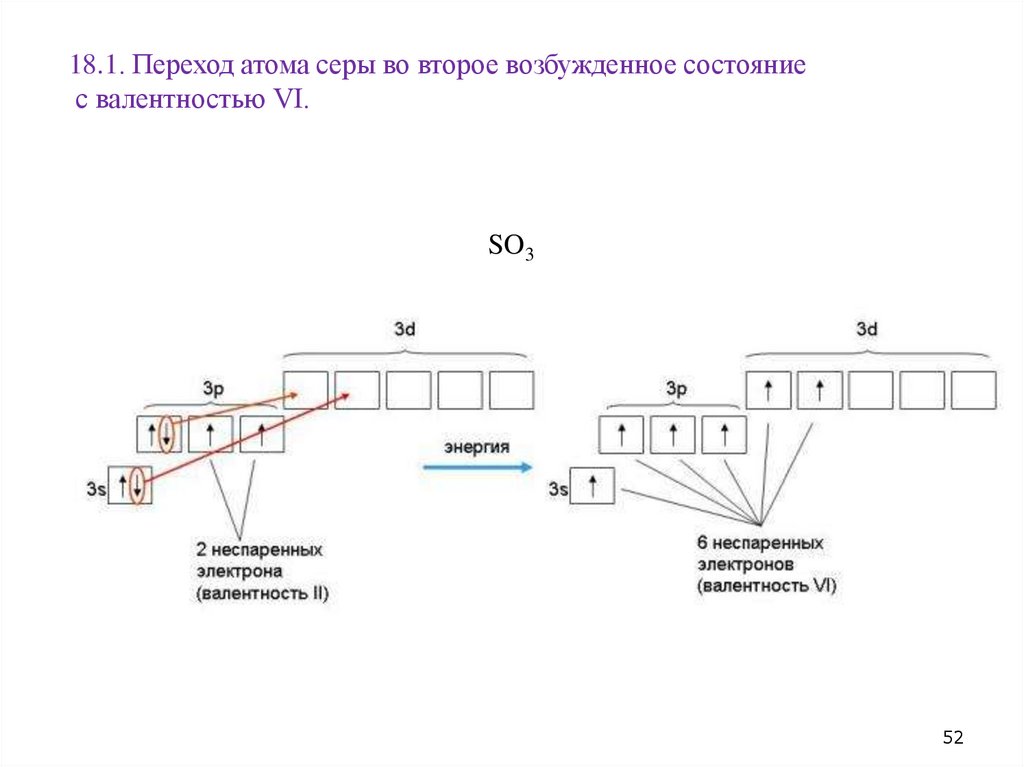
18.1. Переход атома серы во второе возбужденное состояниес валентностью VI.
SO3
52
53.
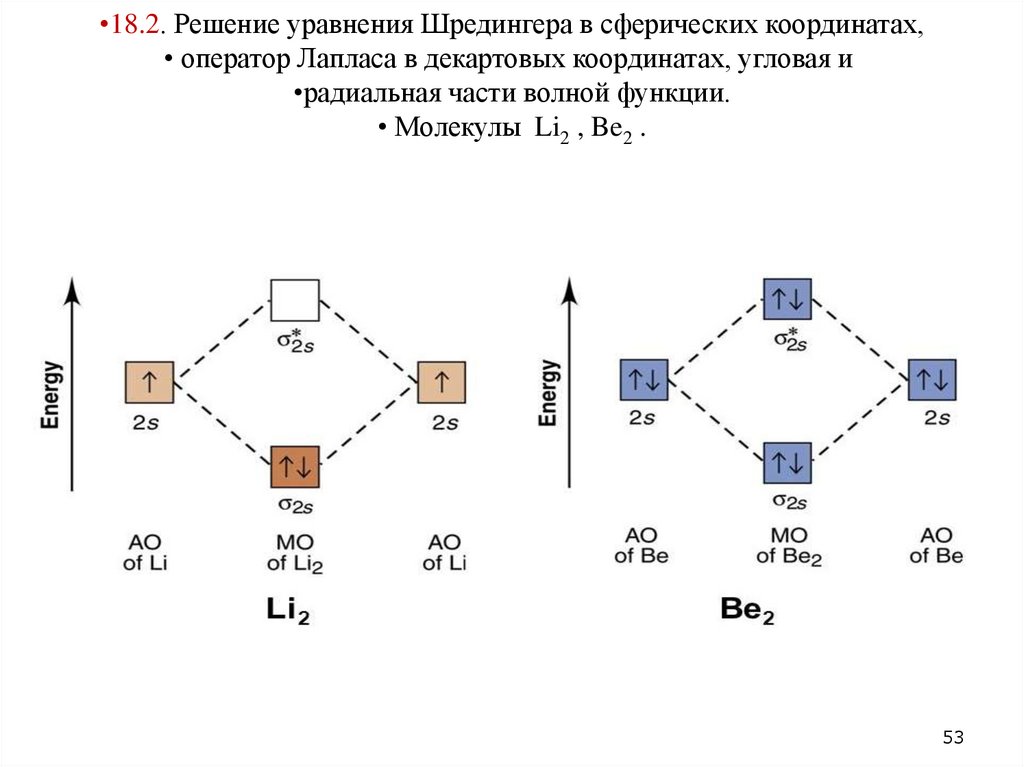
•18.2. Решение уравнения Шредингера в сферических координатах,• оператор Лапласа в декартовых координатах, угловая и
•радиальная части волной функции.
• Молекулы Li2 , Be2 .
53
54.
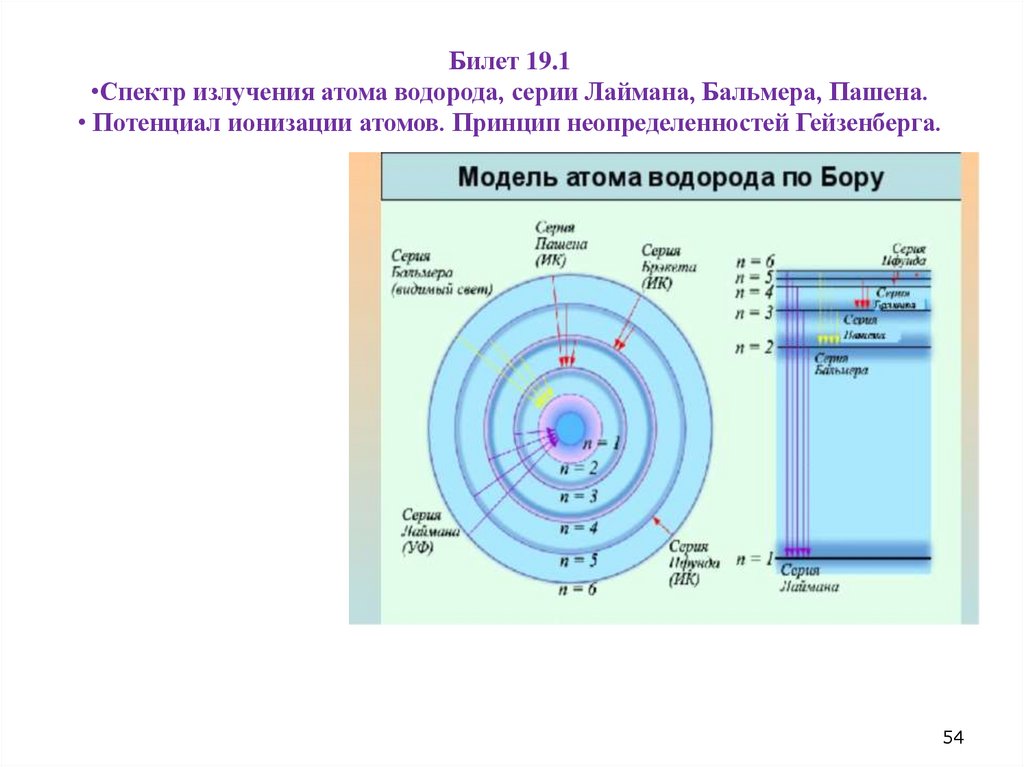
Билет 19.1•Спектр излучения атома водорода, серии Лаймана, Бальмера, Пашена.
• Потенциал ионизации атомов. Принцип неопределенностей Гейзенберга.
54
55.
20.2 Принцип неопределенности55
56.
20.157.
Билет 19.21. МО в молекуле Li2
Перекрывание одинаковых 1s-орбиталей атомов лития даст
две молекулярные орбитали (связывающую и
разрыхляющую), которые согласно принципу минимума
энергии будут полностью заселены четырьмя электронами.
Выигрыш в энергии, получаемый в результате перехода двух
электронов на связывающую молекулярную орбиталь, не
способен компенсировать ее потери при переходе
двух других электронов на разрыхляющую молекулярную
орбиталь. Вот почему вклад в образование химической
связи между атомами лития вносят лишь электроны
внешнего (валентного) электронного слоя. Перекрывание
валентных 2s-орбиталей атомов лития приведет также к
образованию одной -связывающей и одной разрыхляющей
молекулярных орбиталей. Два внешних электрона займут
связывающую орбиталь, обеспечивая общий выигрыш в
энергии (кратность связи равна 1).
57
58.
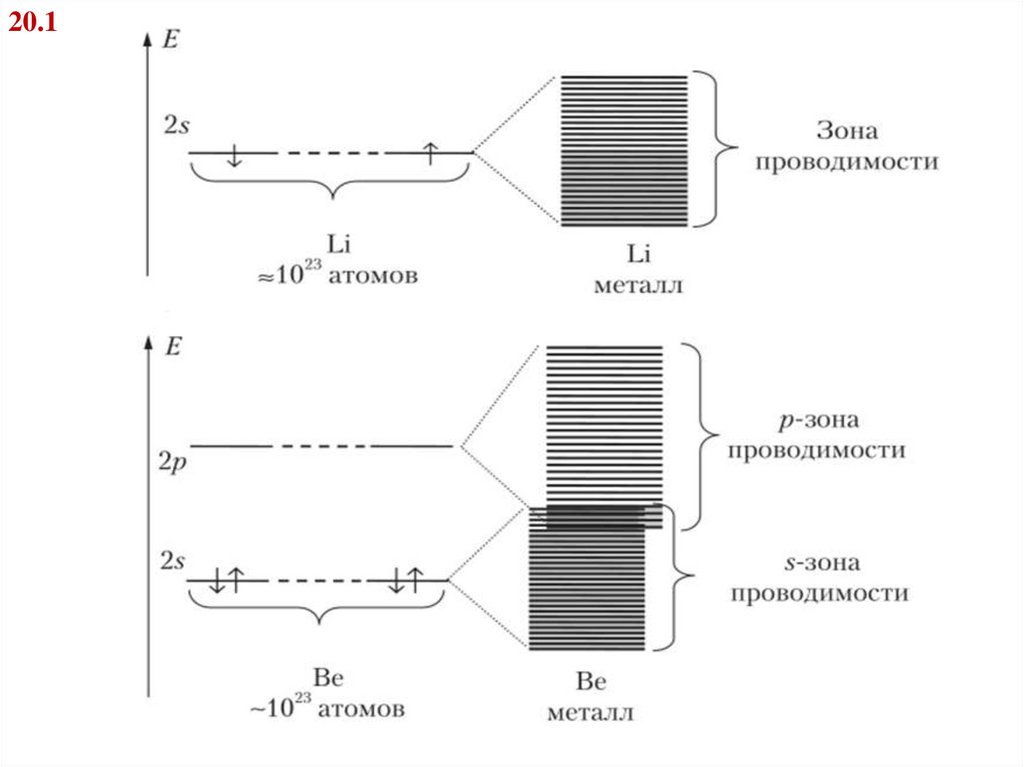
Билет 2020.1. Условие образование металлов из щелочных элементов
, показать на примере лития.
58
59.
Билет 20.2Принцип неопределённости Гейзенбе́рга (или Га́йзенберга) в
квантовой механике — фундаментальное соображение (соотношение
неопределённостей), устанавливающее предел точности
одновременного определения пары характеризующих систему
квантовых наблюдаемых, описываемых некоммутирующими
операторами (например, координаты и импульса, тока и напряжения,
электрического и магнитного поля). Более доступно он звучит так: чем
точнее измеряется одна характеристика частицы, тем менее точно
можно измерить вторую.
59
60.
20.2 Принцип неопределенности1. Наблюдаемые величины – результат процесса
измерения – взаимодействия системы с телом
(«прибором»), с достаточной точностью
подчиняющимся классической механике.
2. Процесс измерения в общем случае изменяет
состояние квантовой системы и этого влияния
принципиально невозможно избежать.
3. Не все физические величины измеримы
одновременно.
Δx · Δp ≥ h
60
61.
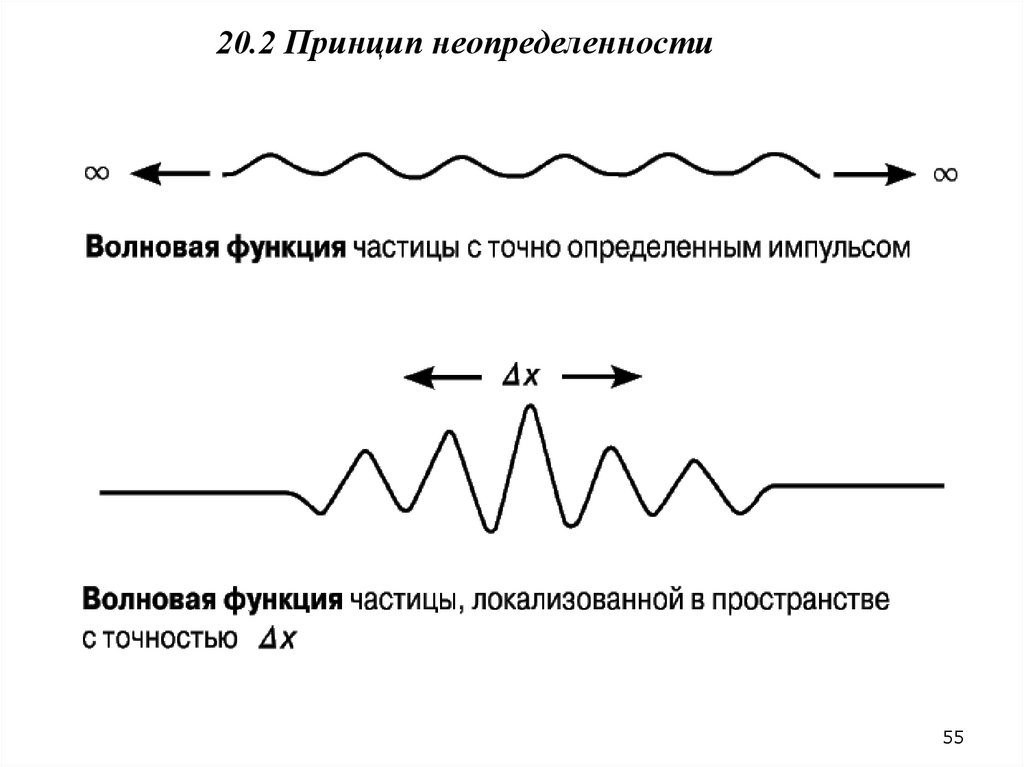
20.2.Волновая функция. Принцип неопределенностей Гейзенберга.61
62.
Билет 2121.1. Фазовые превращения серы
62
63.
21.1.63
64.
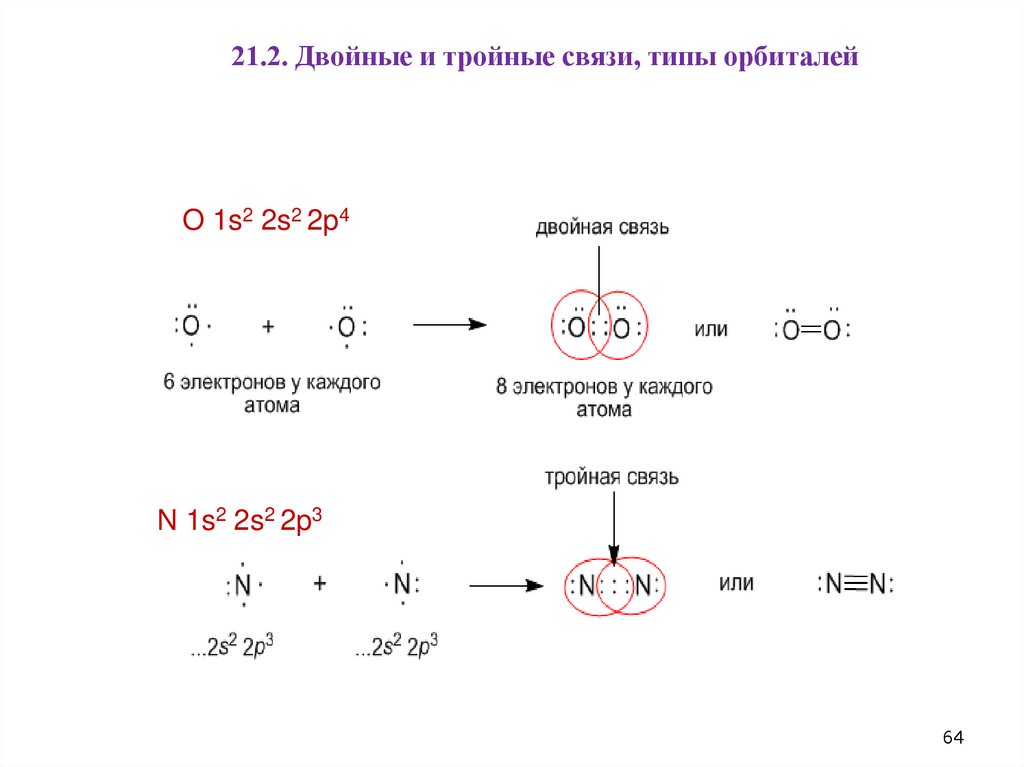
21.2. Двойные и тройные связи, типы орбиталейO 1s2 2s2 2p4
N 1s2 2s2 2p3
64
65.
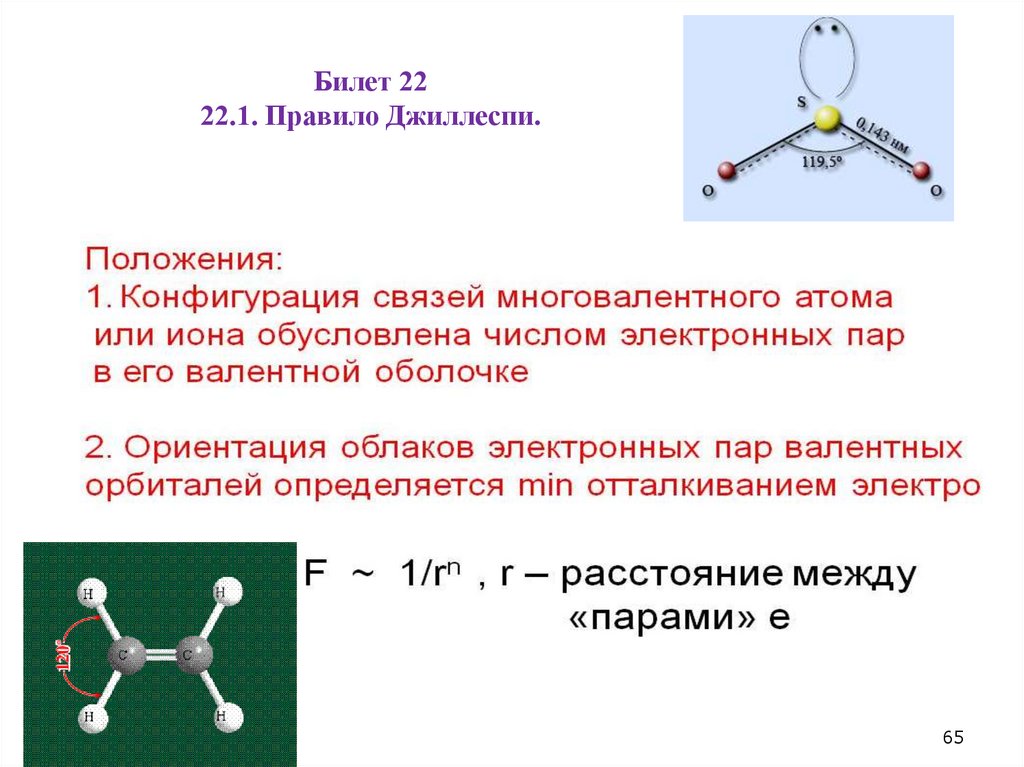
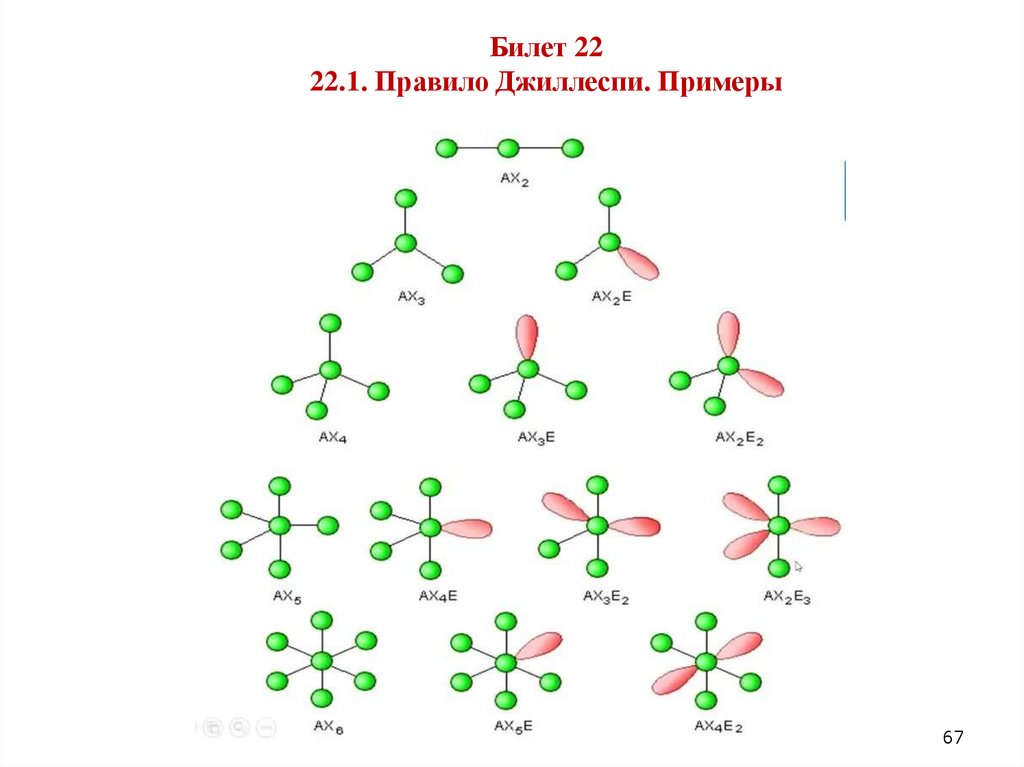
Билет 2222.1. Правило Джиллеспи.
65
66.
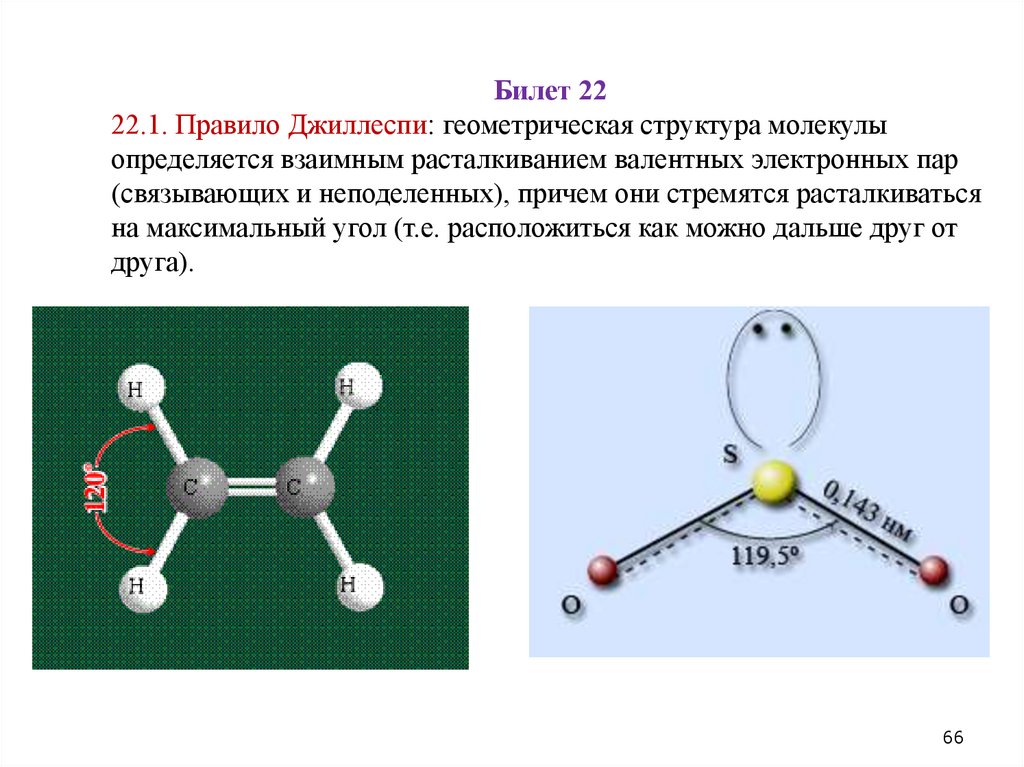
Билет 2222.1. Правило Джиллеспи: геометрическая структура молекулы
определяется взаимным расталкиванием валентных электронных пар
(связывающих и неподеленных), причем они стремятся расталкиваться
на максимальный угол (т.е. расположиться как можно дальше друг от
друга).
66
67.
Билет 2222.1. Правило Джиллеспи. Примеры
67
68.
22.2. Квантовые числа для атомов, что они отражают?Модели строения атома. Многоэлектронные атомы.
68
69.
•23.1Потенциал ионизации атомов и электроотрицательность.Потенциал ионизации атомов и электроотрицательность — понятия,
которые характеризуют свойства атомов элементов.
Потенциал ионизации — это минимальная энергия, необходимая для
отрыва электрона от атома с образованием положительно заряженного
иона. Электроотрицательность — это способность атома притягивать
к себе валентные электроны от других атомов.
Изменение электроотрицательности в периодической системе:
В периоде электроотрицательность растёт слева направо при
накоплении электронов на внешнем слое.
В группе электроотрицательность убывает сверху вниз при увеличении
числа электронных слоёв и увеличении атомных радиусов.
69
70.
Билет 2323.1. Правило Гунда
70
71.
Билет 23.2 Правило Гунда71
72.
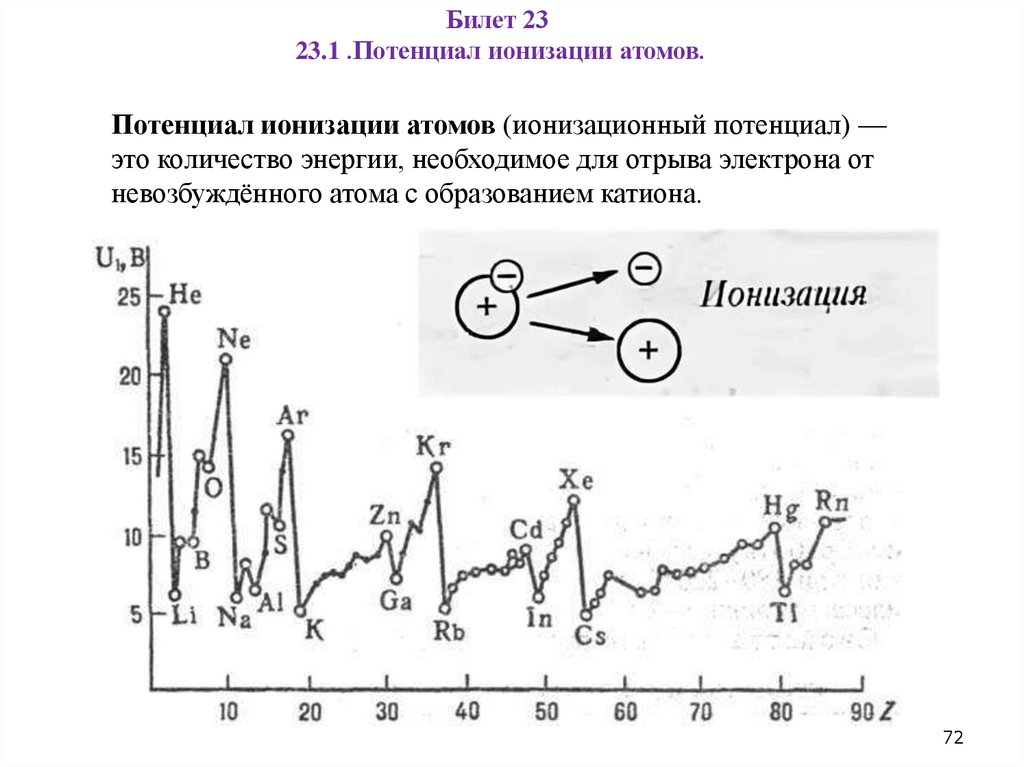
Билет 2323.1 .Потенциал ионизации атомов.
Потенциал ионизации атомов (ионизационный потенциал) —
это количество энергии, необходимое для отрыва электрона от
невозбуждённого атома с образованием катиона.
72
73.
23.1 .Потенциал ионизации атомов.Периодичность изменения: значения потенциала ионизации
изменяются в зависимости от атомного номера элемента:
В группах — потенциал ионизации уменьшается с увеличением
атомного номера элемента. Это связано с большей удалённостью
валентных электронов от ядра и их более лёгким отрывом по мере
увеличения количества электронных слоёв.
В периодах слева направо — заряд ядра возрастает, а радиус атома
уменьшается, поэтому потенциал ионизации постепенно увеличивается.
73
74.
23.2. Принцип исключения Паули и правило Гундав заполнении атомных оболочек многоэлектронных атомов
74
75.
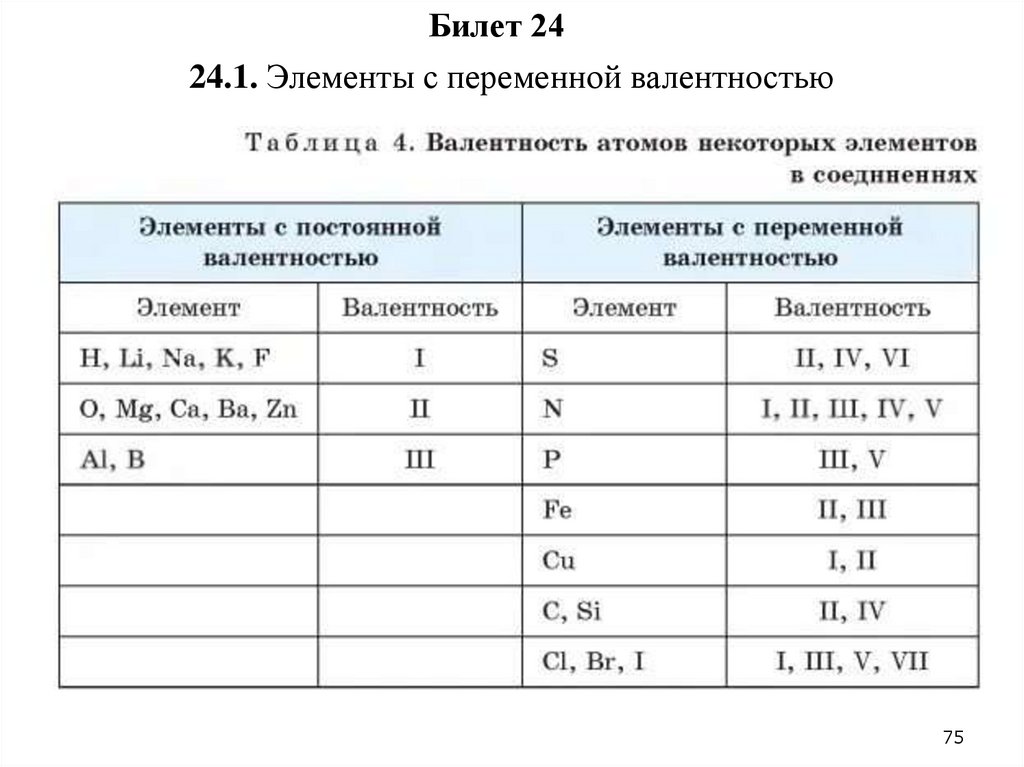
Билет 2424.1. Элементы с переменной валентностью
75
76. причины переменной валентности:
24.1.причины переменной валентности:
Строение электронных оболочек. Валентность элемента зависит от
числа электронов в его внешней электронной оболочке, и когда у
элемента есть несколько энергетических уровней электронов, он может
образовывать соединения, меняя количество электронов во внешней
оболочке.
Изменение окислительного состояния. Элементы могут менять своё
окислительное состояние (число окисления) в различных химических
соединениях.
Способность к образованию разных типов связей. Некоторые
элементы, например металлы переходных групп, обладают способностью
образовывать разные типы химических связей и координационных
соединений, что может влиять на их валентность в разных соединениях.
76
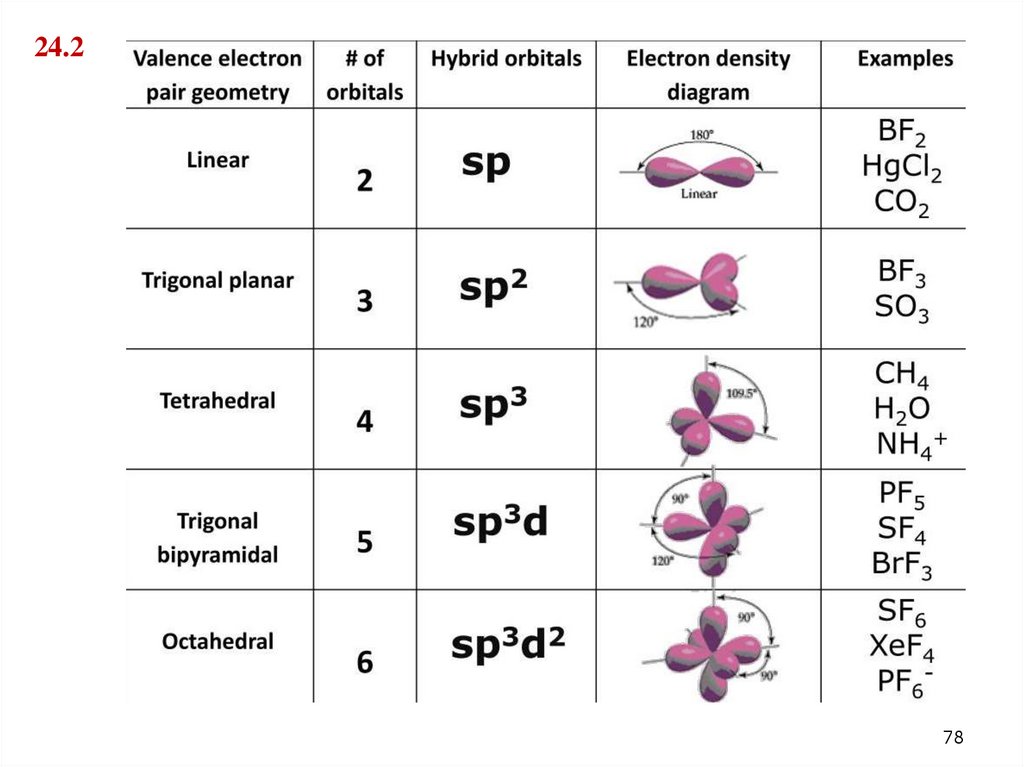
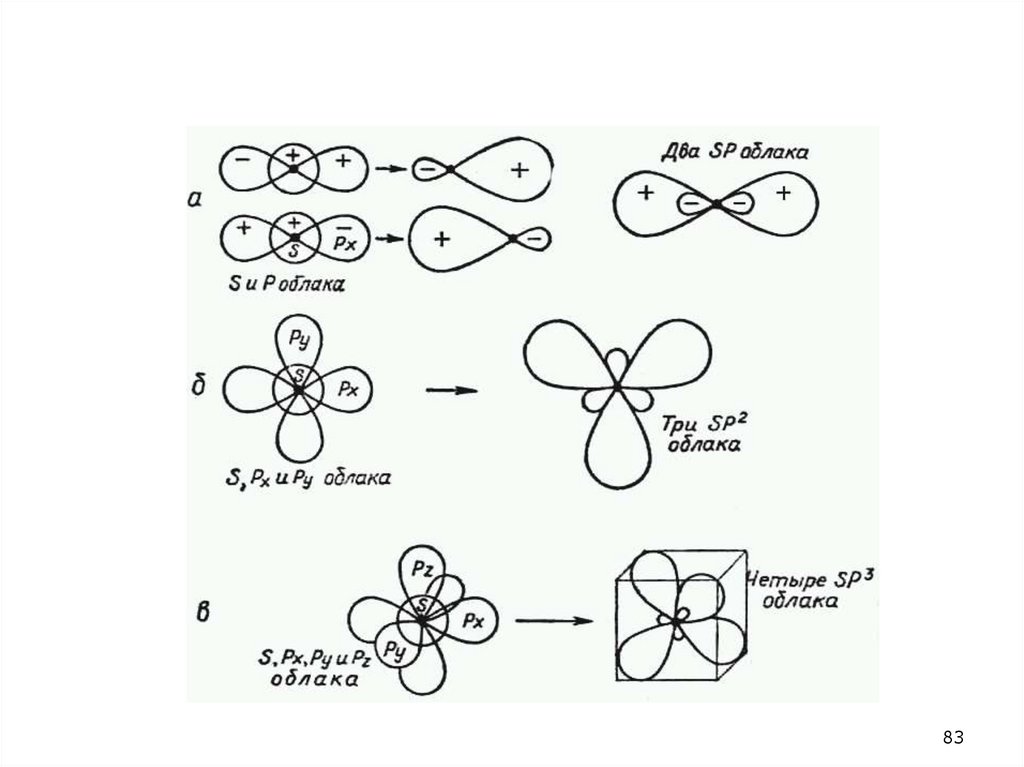
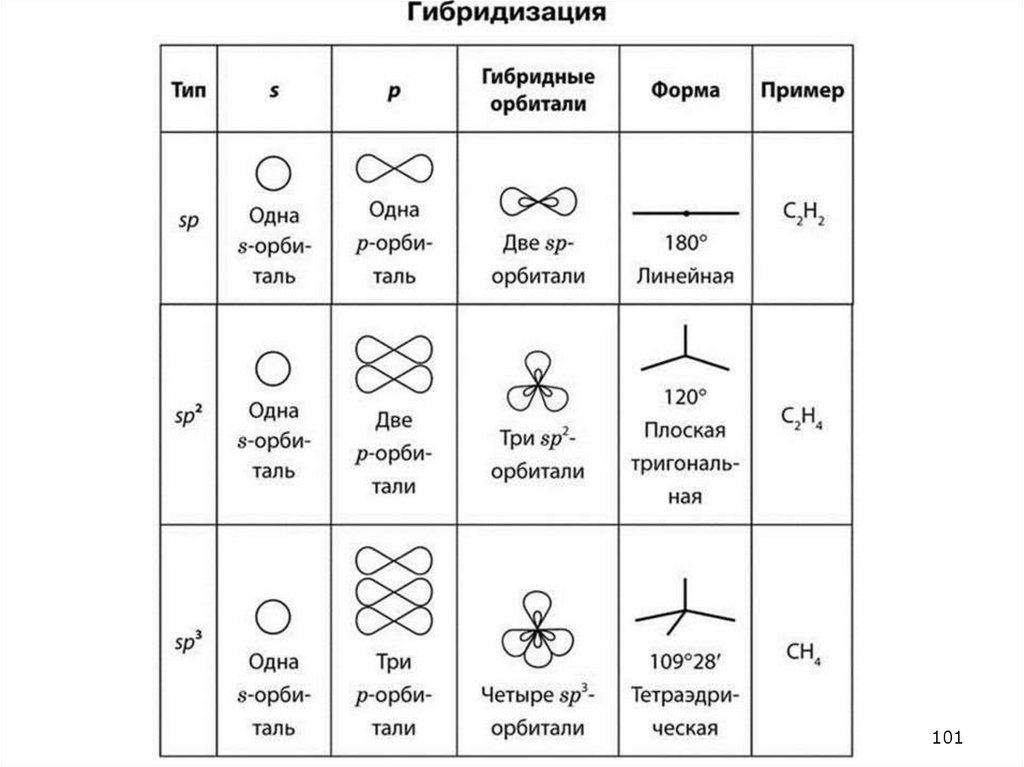
77. 24.2. Гибридизация атомных орбиталей, sp1 , sp2 sp3 примеры
7778.
24.278
79.
Билет 2525.1.
Степень окисления представляет собой условный заряд атома в
соединении, если считать, что связь в нём ионная
Степень окисления равна числу электронов, смещённых от атома или к
атому. Если электроны смещаются от атома, то степень окисления
положительная, а если смещение происходит к атому, то степень
окисления отрицательная.
/
79
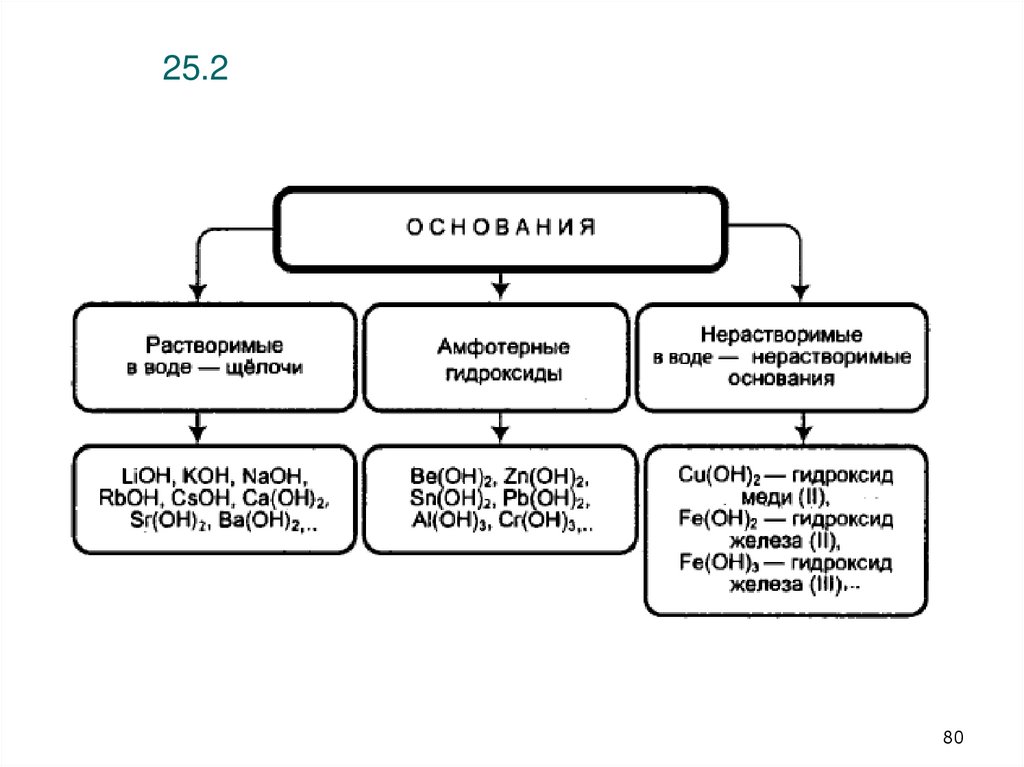
80. 25.2
25.1.80
81.
8182.
8283.
8384.
Степень окисления углерода в различных веществах может быть разной. Онаопределяется разностью между числом электронных пар, смещённых к атому
углерода, и числом электронных пар, оттянутых от него. Если число
смещённых к атому углерода пар больше, чем оттянутых, то степень
окисления отрицательная.
84
85.
Некоторые примеры веществ, в которых атом углерода имеет степеньокисления 0: графит, алмаз, фуллерен.
Некоторые примеры соединений углерода со степенью окисления -4:
Метан (CH4).
Карбиды металлов, например, карбид алюминия (Al4C3).
Бинарные соединения с неметаллами, такие как карбид кремния (SiC).
Некоторые примеры соединений углерода, в которых атом углерода имеет
степень окисления +4:
Оксид углерода (IV) — CO2.; Угольная кислота — H2CO3.
Карбонаты — MeCO3.; Гидрокарбонаты — MeHCO3.
Карбид кальция (CaC2) — пример вещества, в котором углерод имеет
степень окисления −1.
Степень окисления +2:
оксид углерода (II) — СО; муравьиная кислота — HCOOH.
86.
20.1 Межатомные взаимодействия вкристаллах
3. Металлическая связь – металлические кристаллы
(все металлы, в т.ч. Fe, Al, Mg, Cu, W, V, Zr)
Ионы
металла
Коллективизированные
электроны
Схематическое изображение
металлического кристалла1
Зависимость полной энергии двух
металлических атомов от
межатомного состояния2
______________
1. Рисунок с сайта http://www.ndt-ed.org/
2. Физическое металловедение. Под ред. Р. Кана. Пер. с англ. Вып. I. М.:Мир, 1968, 492 с.
86
87.
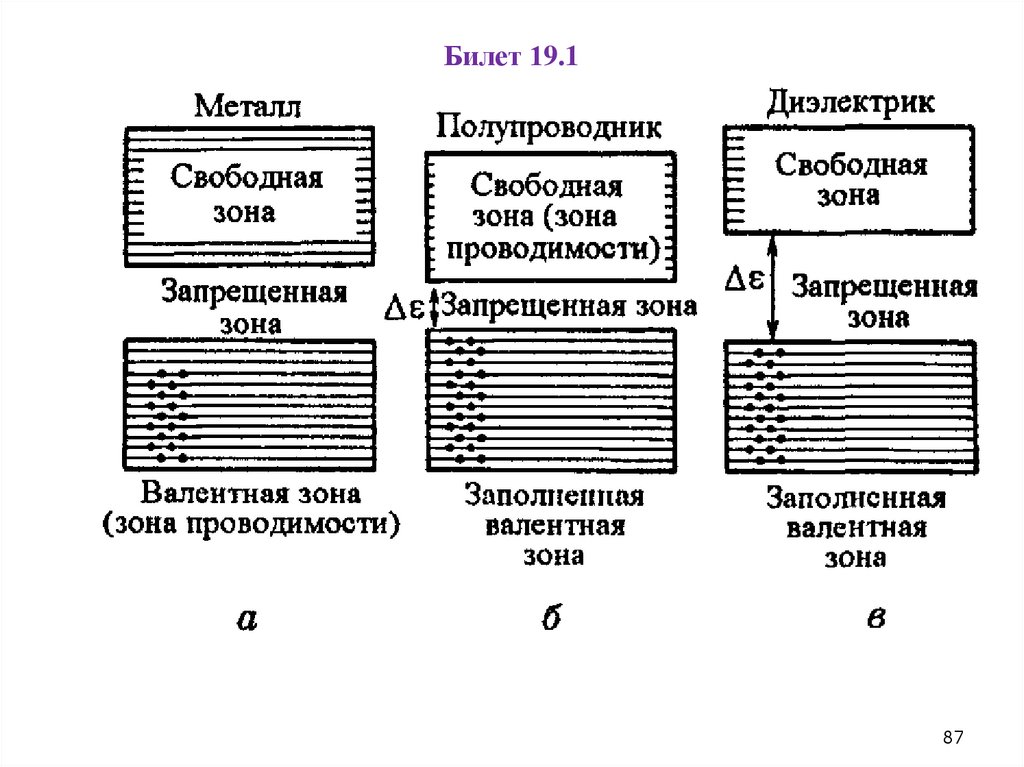
Билет 19.187
88.
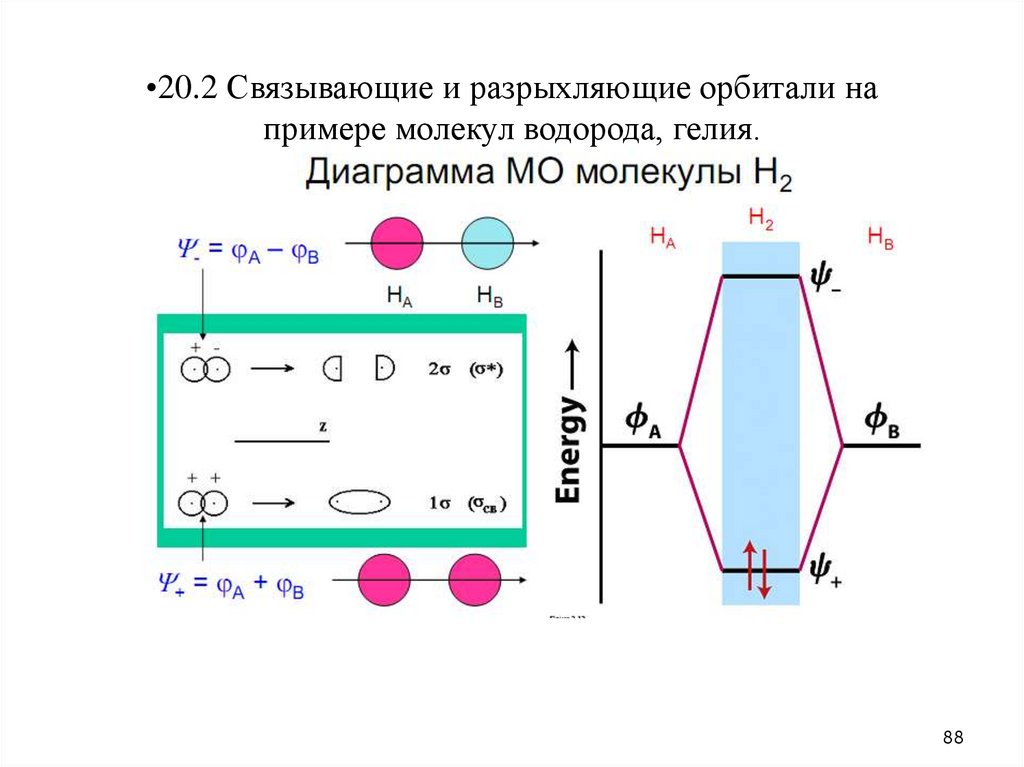
•20.2 Связывающие и разрыхляющие орбитали напримере молекул водорода, гелия.
88
89.
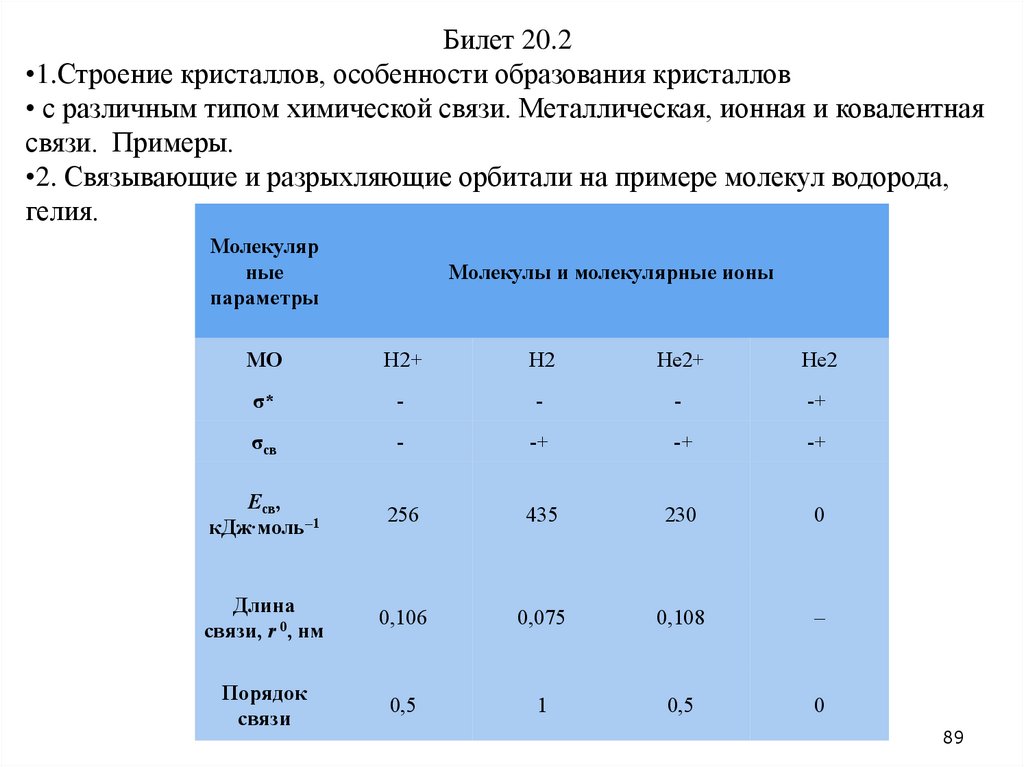
Билет 20.2•1.Строение кристаллов, особенности образования кристаллов
• с различным типом химической связи. Металлическая, ионная и ковалентная
связи. Примеры.
•2. Связывающие и разрыхляющие орбитали на примере молекул водорода,
гелия.
Молекуляр
ные
параметры
Молекулы и молекулярные ионы
МО
H2+
H2
He2+
He2
σ*
-
-
-
-+
σсв
-
-+
-+
-+
Eсв,
кДж∙моль–1
256
435
230
0
Длина
связи, r 0, нм
0,106
0,075
0,108
–
Порядок
связи
0,5
1
0,5
0
89
90.
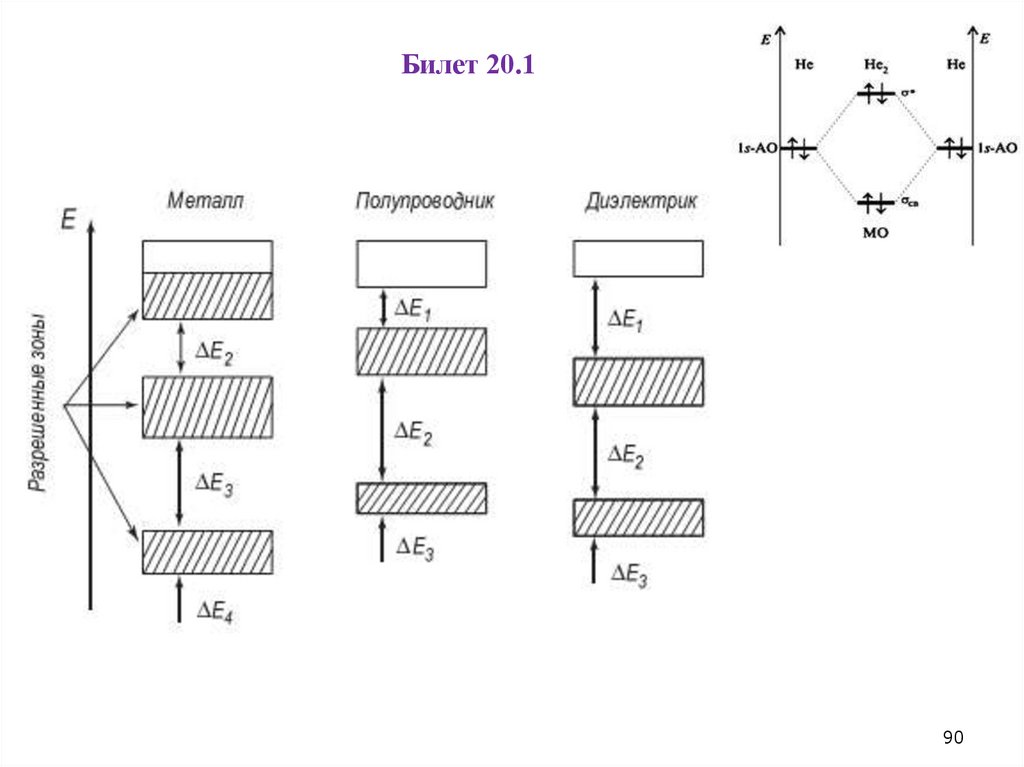
Билет 20.190
91.
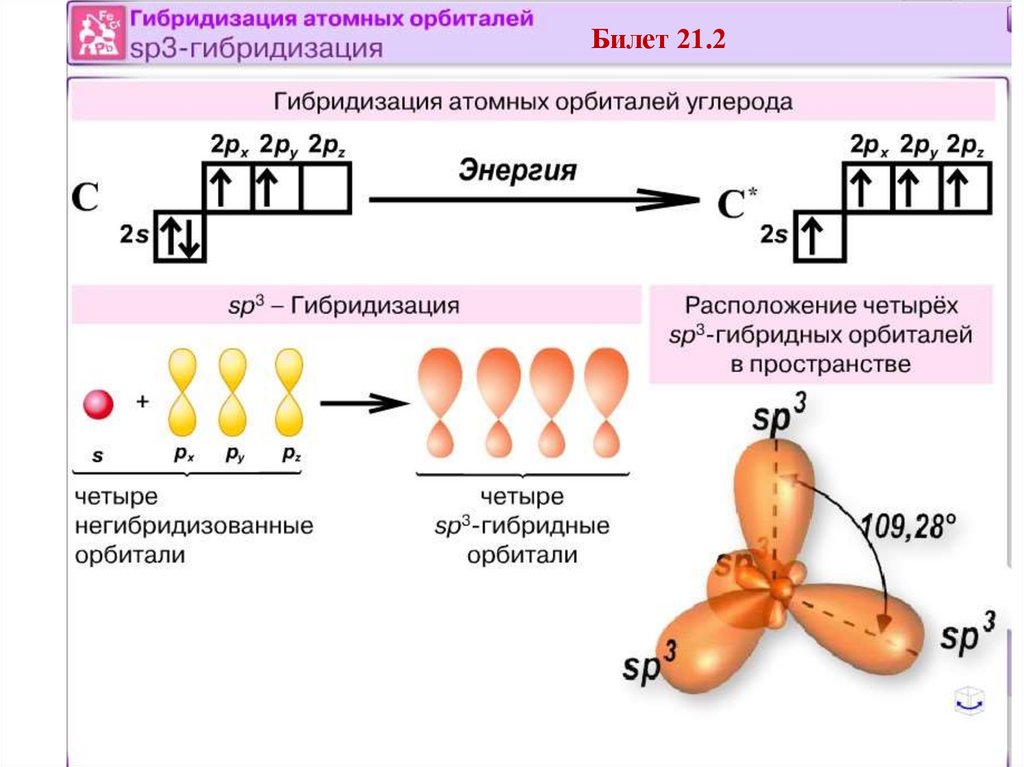
Билет 21•2. Гибридизация атомных орбиталей, sp3. Примеры : кремний,
графит и др.
91
92.
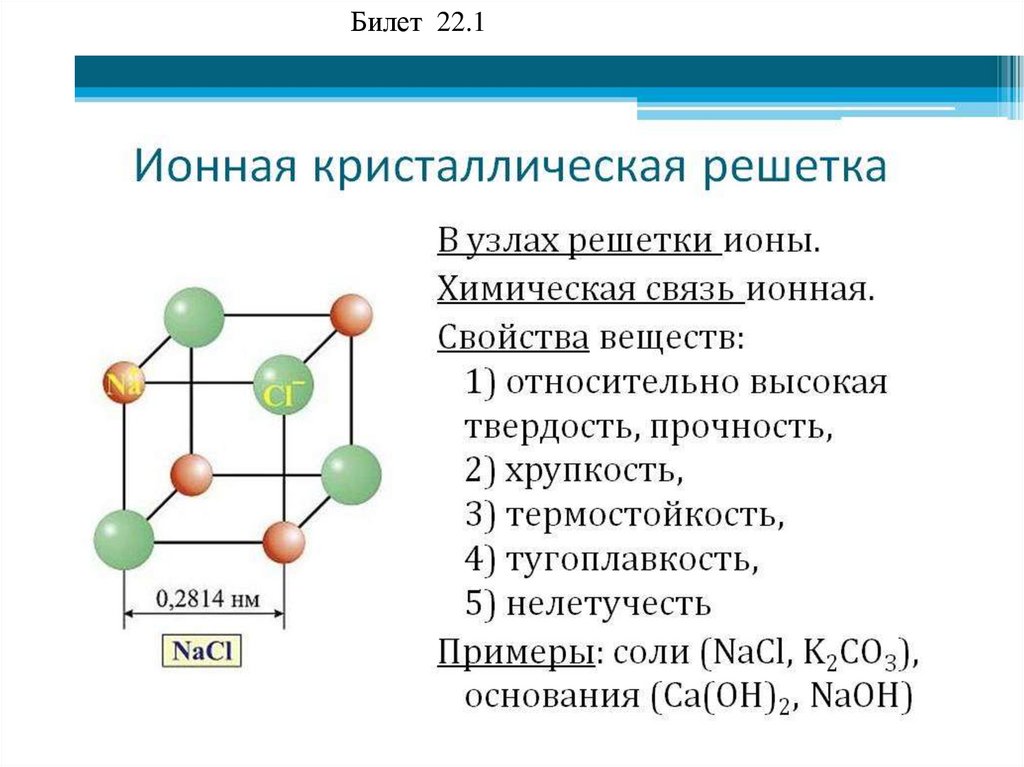
Билет 22.192
93. 22.1 Ионная связь – предельный случай поляризации связей
Na: 1s2 2s2 2p6 3s1F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
В электронных формулах нам важны только электронные
конфигурации внешних уровней (они подчеркнуты). Запишем
реакцию с помощью формул Льюиса:
В отличие от предыдущего случая в дополнение к ковалентной
составляющей химической связи в молекуле Na+:F– добавляется
еще и электростатическое притяжение между ионами натрия и
фтора и этот факт делает связь прочнее.
93
94.
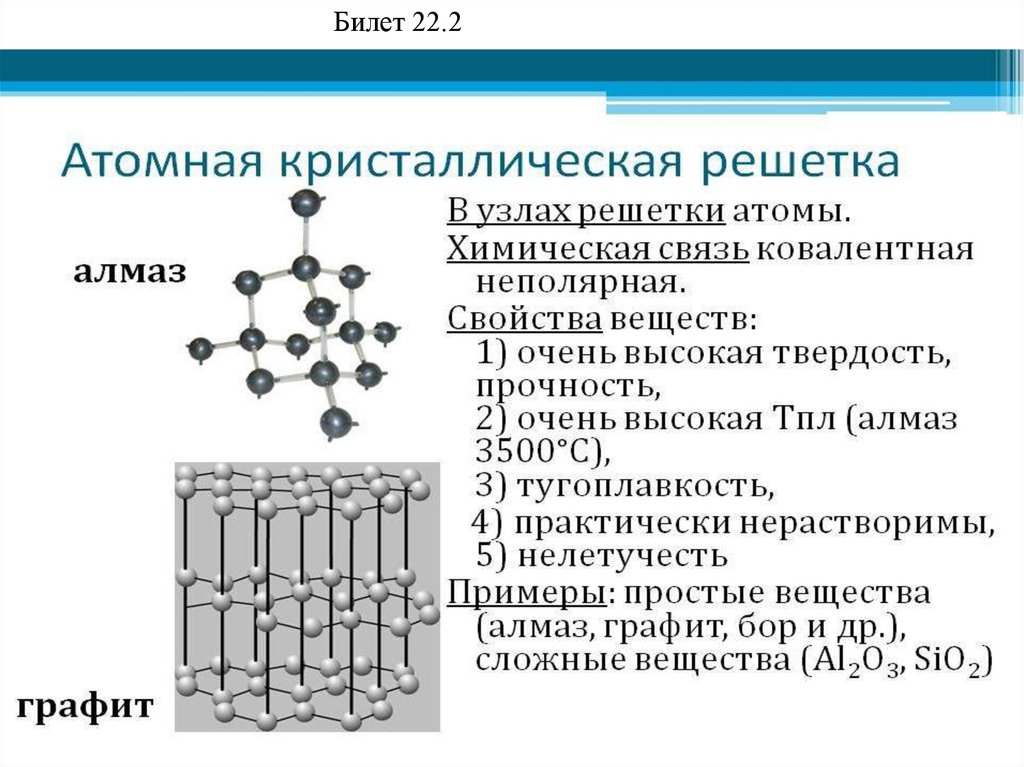
Билет 22.294
95.
Билет 22.195
96.
Билет 22.196
97.
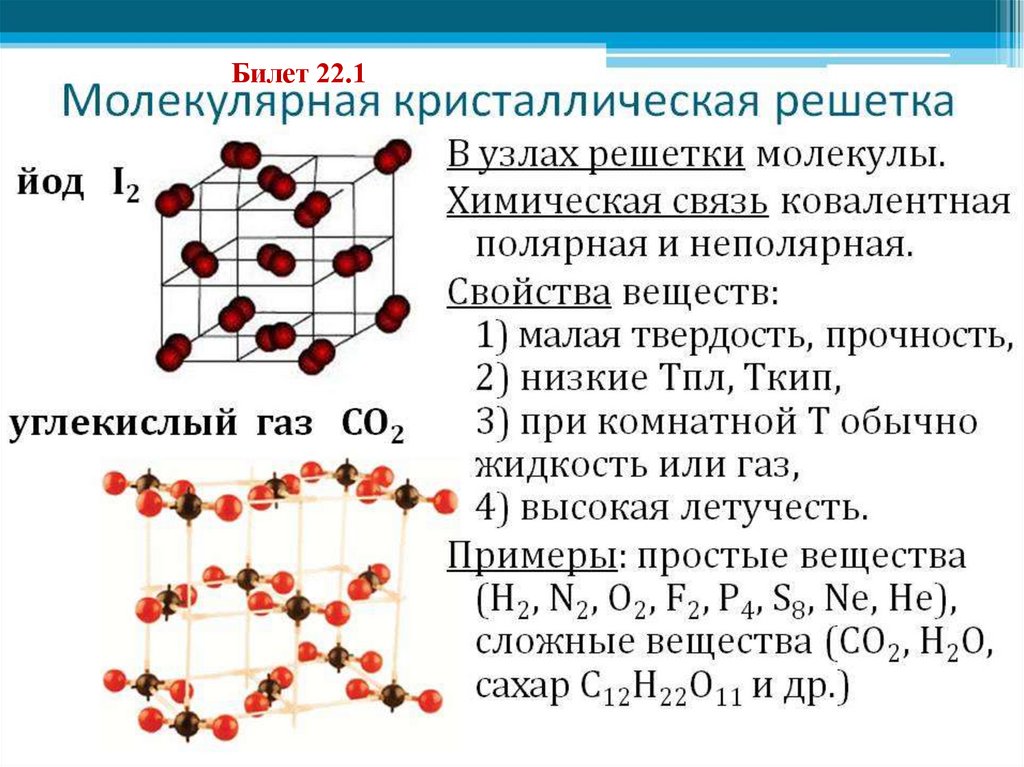
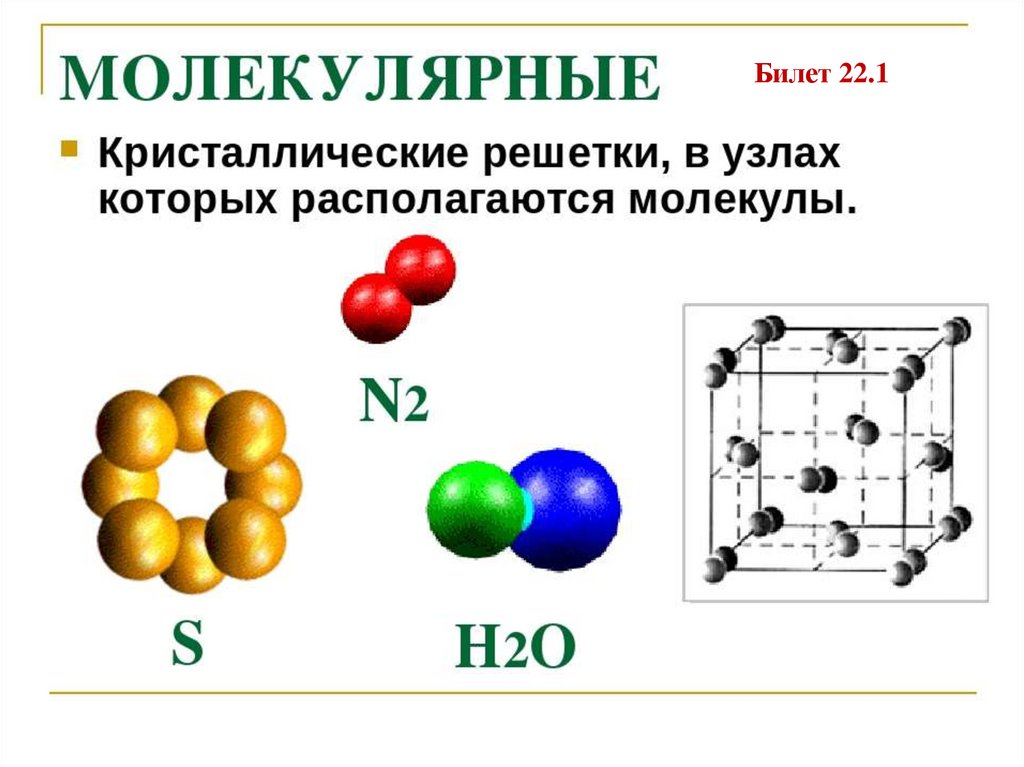
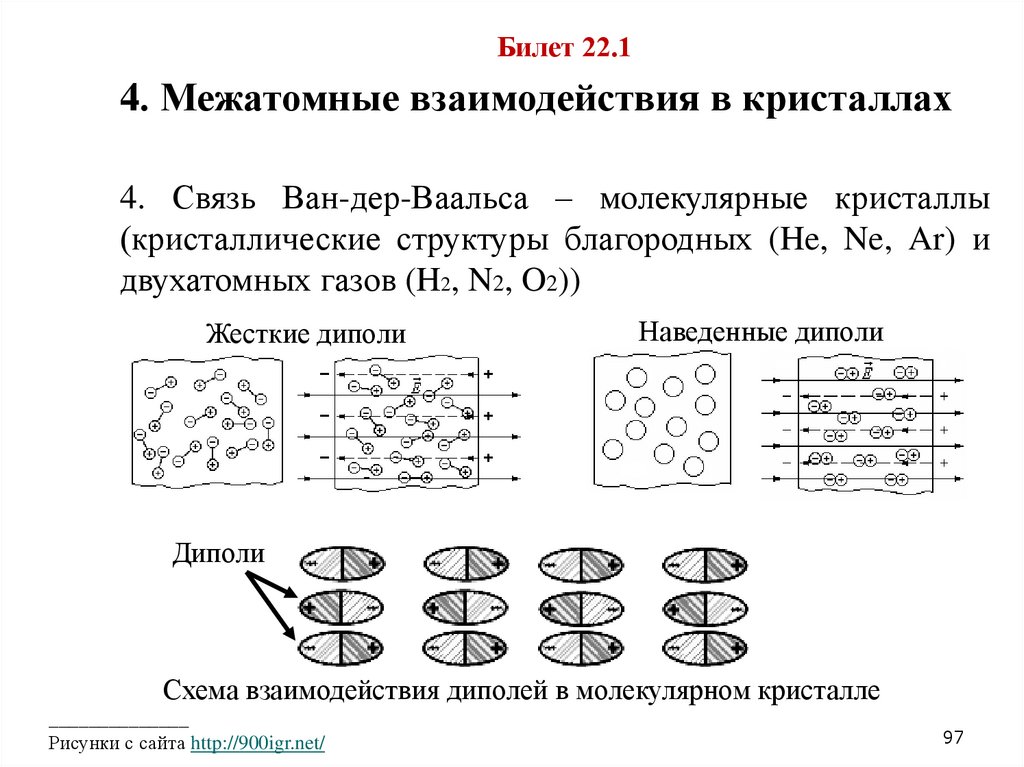
Билет 22.14. Межатомные взаимодействия в кристаллах
4. Связь Ван-дер-Ваальса – молекулярные кристаллы
(кристаллические структуры благородных (He, Ne, Ar) и
двухатомных газов (H2, N2, O2))
Жесткие диполи
Наведенные диполи
Диполи
Схема взаимодействия диполей в молекулярном кристалле
______________
Рисунки с сайта http://900igr.net/
97
98.
23.298
99.
24.199
100.
Физические свойства бериллия24.2
Бериллий – относительно твердый (5,5 баллов по шкале Мооса
модуль упругости 300 Гпа, у стали 200), хрупкий металл серебристого
цвета. Один из самых твердых металлов (уступает только Os,W и U.
Скорость звука в берилии высока 12600 м/с, что в 2-3 раза больше чем
в других металлах. Добавка 0,5 % бериллия в сталь позволяет
изготовить пружины, которые остаются упругими до температуры
красного каления.
Оксид бериллия является наиболее теплопроводным из всех оксидов,
его теплопроводность при комнатной температуре выше, чем у
большинства металлов и почти всех неметаллов (кроме алмаза и карбида
кремния). Он служит высокотеплопроводным высокотемпературным
изолятором и огнеупорным материалом для лабораторных тиглей и в
других специальных случаях
101.
101102.
Билет 21.2102




















































 chemistry
chemistry








