Similar presentations:
Red-Ox процессы. Лекция 6
1. Лекция 6. Red-Ox процессы
шцпм.интернатЛекция 6.
Red-Ox процессы
2.
Степень окисления. Способ протеканияреакции
Любая реакция это:
- перенос отдельного
электрона(-ов) - ОВР
- перенос иона(-ов)
- перенос радикала
- координация НЭП* или
лигандных центров с
повышенной ЭП
Виды разрыва химической связи:
- гомолитический
- гетероциклический
2
3.
Окислитель vs восстановитель3
4.
Окисление vs восстановление4
5.
Ионная форма уравнения реакции5
6.
«Сила» окислителяОт чего зависит сила окислителя?
1.Электроотрицательность, степень
окисления, экранирование.
2.Кислотность среды.
3.Концентрация окислителя.
4.Температура.
6
7.
Влияние среды на некоторые окислителиРассмотрим манганат-ион MnO4- и дихромат-ион Cr2O72-
7
8.
ОВР процесс – методы уравнять реакциюэлектронный
баланс:
- есть только окислитель
и восстановитель
- происходит перенос
отдельных электронов
электронно-ионный
баланс:
- есть окислитель,
восстановитель и среда
реакции
- рассматриваем поток
электронов как процесс
полуреакции
8
9.
Метод электронного балансаKMnO₄ + K₂SO₃ + H₂SO₄ → MnSO₄ + K₂SO₄ + H₂O
9
10.
Задача №1Уравнять реакцию, используя представления о методе
электронного баланса:
K2Cr2O7 + H2SO4 + FeSO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
10
11.
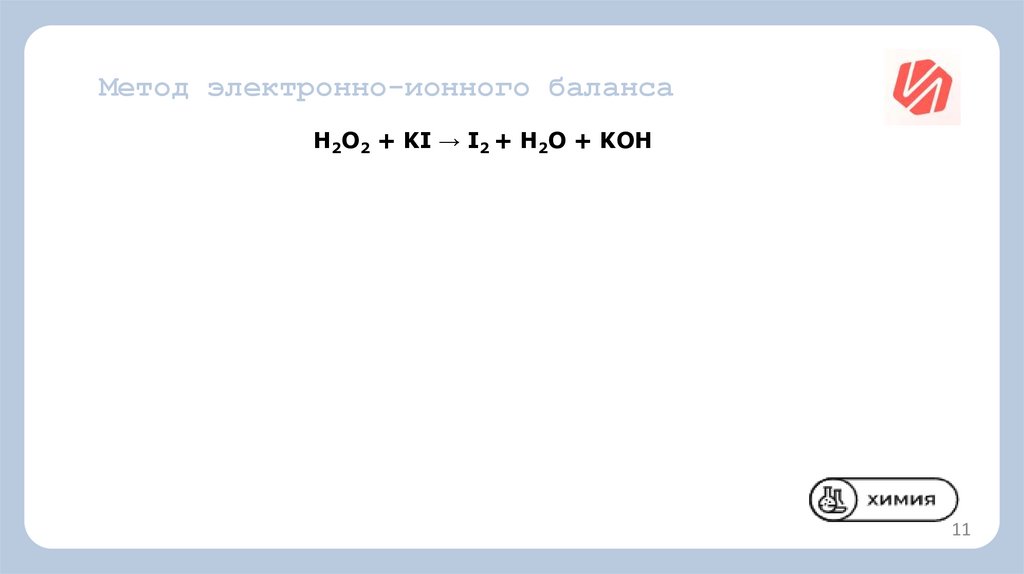
Метод электронно-ионного балансаH2O2 + KI → I2 + H2O + KOH
11
12.
Задача №2Уравнять реакцию, используя представления о методе
электронно-ионного баланса:
KI + KClO3 → KCl + I2 + KOH
12
13.
Задача №3[Cr(N2H4CO)6]4[Cr(CN)6]3 + KMnO4 + H2S2O7 → K2Cr2O7 + MnSO4 + C13H10 +
N2O5 + K2S4O6 + H2O
13
14.
Задача №4FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + H2O
14
15.
Задача №5NO + K2Cr2O7 + H2SO4 → HNO3 + Cr2(SO4)3 + K2SO4 + H2O
15
16.
Предсказательная способность химииэлементов и понятия об ОВР
Необходимо закончить и уравнять реакции
1) SO2 + KMnO4 + H2O →
2) NH3 + O2 →
3) S + H2SO4 →
4) C2H5OH + K2Cr2O7 + H2SO4 →
5) P + HNO3 →
6) CuSO4 + KI →
16















 chemistry
chemistry








