Similar presentations:
Окислительно-восстановительные реакции. Подготовка к ЕГЭ по химии. Задание №30
1.
ПОДГОТОВКА К ЕГЭ ПО ХИМИИЗАДАНИЕ №30
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ
Панфилова Анна Евгеньевна
учитель химии МОУ «СОШ ст. Курдюм
им. Героя Советского Союза П.Т. Пономарева»
2018 г.
2.
ЗАДАНИЯ №30 - 31 (ЕГЭ 2019 Г.)(С ЕДИНЫМ КОНТЕКСТОМ)
2 балла
2 балла
Экзаменуемому следует записать
только по одному варианту ответа на задания 30 и 31!
2
3.
ЗАДАНИЕ №30 (ЕГЭ 2019 Г.)Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия,
сульфат бария, гидроксид калия. Допустимо использование водных растворов
веществ.
3
4.
ЗАДАНИЕ №31 (ЕГЭ 2019 Г.)Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия,
сульфат бария, гидроксид калия. Допустимо использование водных растворов
веществ.
4
5.
ЗАДАНИЕ №30 (ЕГЭ 2019 Г.)Проверяемые умения:
Определять степень окисления химических элементов,
окислитель и восстановитель;
Прогнозировать продукты окислительновосстановительных реакций, в том числе с учетом
характера среды (кислой, щелочной, нейтральной);
Составлять уравнения окислительно-восстановительных
реакций:
Составлять электронный баланс, на его основе
расставлять коэффициенты в уравнениях реакций
5
6.
Для выполнения заданий 30, 31 используйте следующийперечень веществ:
бихромат калия, карбонат калия, сульфит натрия, серная
кислота, оксид кремния (IV). Допустимо использование
водных растворов веществ.
30. Из предложенного перечня веществ выберите
вещества, между которыми возможна окислительновосстановительная реакция, и запишите уравнение этой
реакции. Составьте электронный баланс, укажите
окислитель и восстановитель.
31. Из предложенного перечня веществ выберите вещества,
между которыми возможна реакция ионного обмена.
Запишите молекулярное, полное и сокращённое ионное
уравнения этой реакции.
6
7.
Записываем формулы веществK2Cr2O7 , K2CO3 , Na2SO3 , H2SO4 ,
SiO2
Определяем степени окисления атомов
+1
+6
-2
+1
+4
-2
K 2Cr 2O 7 , K 2C O 3
+1 +4 -2
+1 +6 -2
Na 2S O 3 , H 2S O 4 ,
+4 -2
Si O 2
8.
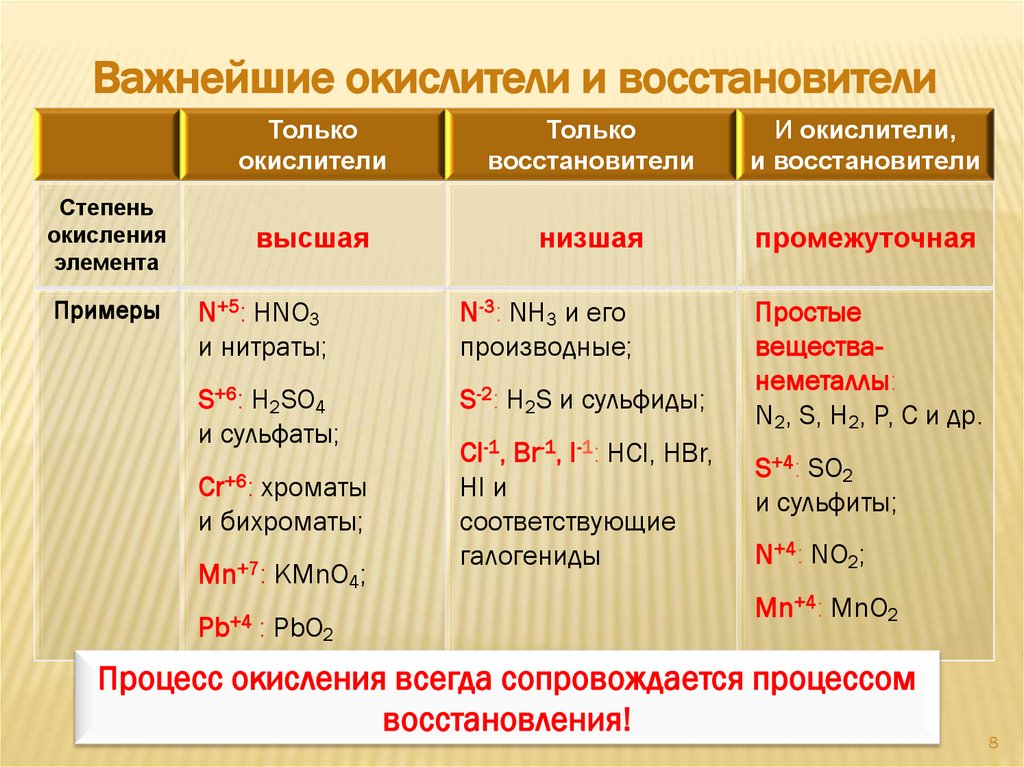
Важнейшие окислители и восстановителиСтепень
окисления
элемента
Примеры
Только
окислители
Только
восстановители
И окислители,
и восстановители
высшая
низшая
промежуточная
N+5: HNO3
и нитраты;
N-3: NH3 и его
производные;
S+6: H2SO4
и сульфаты;
S-2: H2S и сульфиды;
Простые
веществанеметаллы:
N2, S, H2, P, С и др.
Cr+6: хроматы
и бихроматы;
Mn+7: KMnO4;
Pb+4 : PbO2
Cl-1, Br-1, I-1: HCl, HBr,
HI и
соответствующие
галогениды
S+4: SO2
и сульфиты;
N+4: NO2;
Mn+4: MnO2
Процесс окисления всегда сопровождается процессом
восстановления!
8
9.
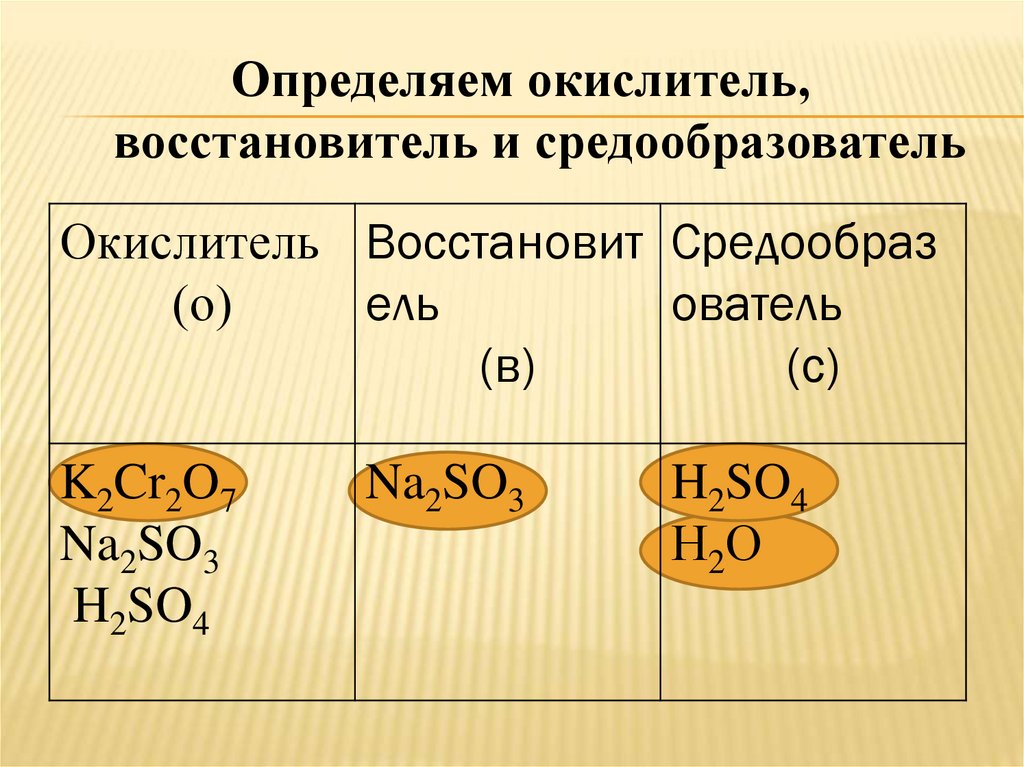
Определяем окислитель,восстановитель и средообразователь
Окислитель Восстановит Средообраз
(о)
ель
ователь
(в)
(с)
K2Cr2O7
Na2SO3
H2SO4
Na2SO3
H2SO4
Н2О
10.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕСВОЙСТВА СОЕДИНЕНИЙ ХРОМА
Хроматы (K2CrO4) и бихроматы (K2Cr2O7)
– сильные окислители. В кислой среде восстанавливаются до
соединений Cr+3 , образуя соответствующие соли (CrCl3,
Cr2(SO4)3, Cr(NO3)3):
Катион Cr3+ проявляет сильную восстановительную активность в
щелочной среде, окисляясь до хромат-иона CrO42- (но не до
бихромат-иона Cr2O72-!):
10
11.
Прогнозируем продукты ОВР с учетом характера средыСоставляем уравнение ОВР
Составляем электронный баланс, на его основе расставляем
коэффициенты в уравнении реакции
Указываем окислитель и восстановитель
Среда кислая
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 +
K2SO4 + 4H2O
1 2Cr+6 + 6e- → 2Cr+3
бихромат калия за счет Cr+6 − окислитель
3 S+4 − 2e- → S+6
сульфит натрия за счет S+6 − восстановитель
11
12.
Среда нейтральная (слабощелочная за счетгидролиза сульфита)
3Na2SO3 + K2Cr2O7 + 4H2O = 3Na2SO4 + 2Cr(OН)3
+ 2KOН
13.
АЛГОРИТМ ВЫПОЛНЕНИЯ ЗАДАНИЯ №301. Правильно записать формулы веществ из предложенного
перечня
2. Определить степени окисления элементов, входящих в
состав веществ
3. Выбрать вещество – окислитель, вещество –
восстановитель, вещество – средообразователь
4. Спрогнозировать продукты ОВР с учетом характера
среды
5. Составить уравнение ОВР
6. Составить электронный баланс, на его основе расставить
коэффициенты в уравнении реакции
7. Указать окислитель и восстановитель
14.
ПОДГОТОВКА К ЕГЭ №30ОВР
восстановители
• Типичные окислители и
• Наиболее часто встречающиеся
«Классические»
на запоминание
«Неклассические» •• Реакции
Нетипичные окислители и
восстановители (неявные)
ОВР
Эксперимент
Оформление
15.
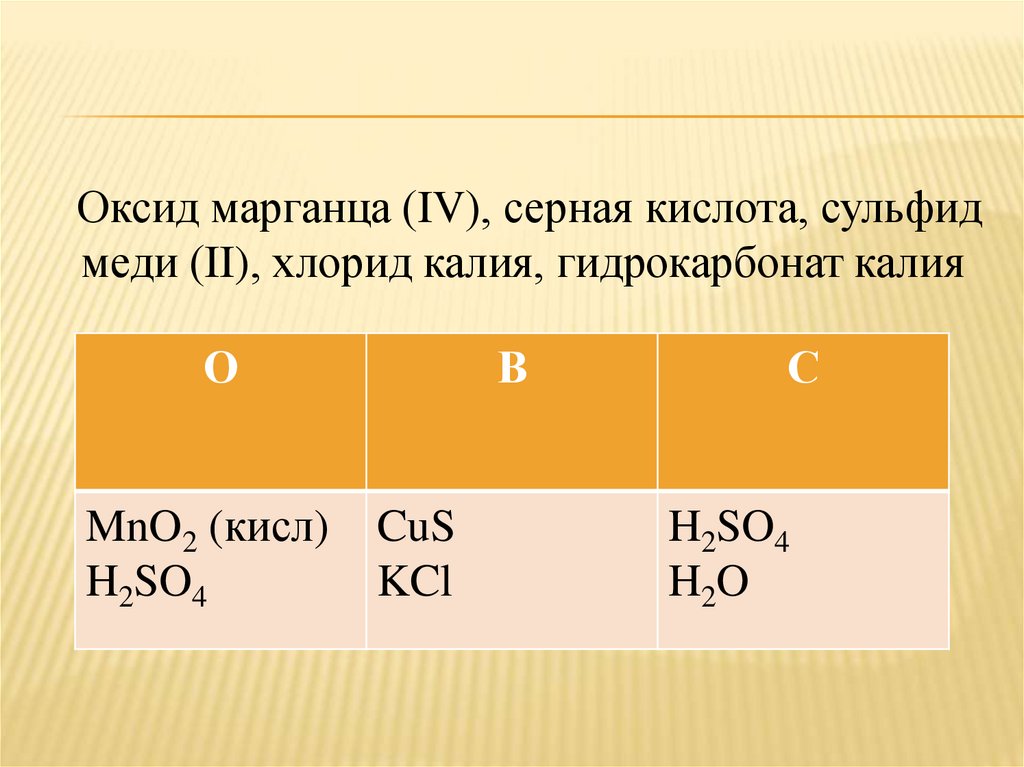
Оксид марганца (IV), серная кислота, сульфидмеди (II), хлорид калия, гидрокарбонат калия
О
MnO2 (кисл)
H2SO4
В
CuS
KCl
С
H2SO4
H 2O
16.
CuS + 4H2SO4 = CuSO4 + 4SO2 +4H2OMnO2 + 2KCl + 2H2SO4 = MnSO4 + Cl2 +
K2SO4 + 2H2O
17.
Хлор, фтор, фтороводород, хлорат калия,гидроксид натрия.
2KClO3 = 2KCl + 3O2 НЕЛЬЗЯ!
Cl2 + H2O = HCl + HClO НЕЛЬЗЯ!
Cl2 + 2NaOH = NaCl + NaClO + H2O
KClO3 + F2 +2 NaOH = KClO4 + 2NaF + H2O
18.
ЗАДАНИЯ ДЛЯ ТРЕНИРОВКИ1. KIO3 + … + H2SO4 → I2 + K2SO4 + H2O
2. KNO2 + K2Cr2O7 + … → KNO3 + Cr(NO3)3 + H2O
3. P + HClO3 + … → HCl + …
4. SO2 + K2Cr2O7 + … → K2SO4 + … + H2O
5. Al + K2Cr2O7 + … → … + Cr2(SO4)3 + K2SO4 + H2O
6. NH3 + KClO → N2 + KCl + … .
7. Cl2 + NH3· H2O → NH4Cl + N2 + … .
8. KMnO4 + NH3 → MnO2 + N2 + … + …
9. Zn + KNO3 + … → NH3 + K2ZnO2 + … .
10. SO2 + KMnO4 + … → MnSO4 + … + H2SO4
11. K2Cr2O7 + HCl (разб) + FeCl2 → FeCl3 + … + KCl +
….
12. KNO3 + K2CO3 + Cr2O3 → KNO2 + … + CO2
13. FeSO4 + H2SO4 + MnO2 → Fe2(SO4)3 + … + … .
14. NaBr + NaBrO3 + H2SO4 → … + Na2SO4 + H2O
19.
15. NaI + H2SO4 (конц) → … + H2S + Na2SO4 + …16. Na2O2 + FeSO4 + … → Fe2(SO4)3 + Na2SO4 + …
17. Be + NaOH + H2O → … + H2
18. H2O2 + Na3[Cr(OH)6] → … + H2O + NaOH
19. Na2Cr2O7 + H2S + H2SO4 → … + … + H2O +
Na2SO4
20. H2S + K2Cr2O7 + H2SO4 → … + … + … + …
21. FeSO4 + H2O2 + H2SO4 → … + …
22. MnSO4 + NaClO + NaOH → MnO2 + … + … + …
23. C + H2SO4(конц) → … + … + …
24. KMnO4 + Na2S + H2SO4 → … + … + Na2SO4 +
K2SO4 + H2O
25. KMnO4 + K2S + H2O → … + … + KOH
26. NaMnO4 + Na2SO3 + … → Na2MnO4 + … + H2O
27. K2Cr O4 + (NH4)2S + KOH + H2O → … + S + NH3
20.
НОВЫЙ ВАРИАНТ №30 (ФИПИ)1. Иодид калия, серная кислота, гидроксид алюминия,
оксид марганца(IV), нитрат магния.
2. сероводород, концентрированная азотная кислота,
сульфат алюминия, оксид фосфора(V), нитрат меди(II).
3. пероксид водорода, гидроксид калия, оксид хрома(III),
фосфат серебра, сульфат аммония.
4. дихромат калия, серная кислота, карбонат аммония,
оксид кремния, нитрит калия.
5. хромат натрия, бромид натрия, фторид калия, серная
кислота, нитрат магния.
6. бром, нитрат бария, сульфат аммония,
концентрированная соляная кислота, перманганат калия.
7. нитрат аммония, дихромат калия, серная кислота,
сульфид калия, фторид магния.
21.
8. сульфат аммония, гидроксид калия, перманганаткалия, нитрит калия, оксид меди(II).
9. концентрированная соляная кислота, оксид
фосфора(V), оксид марганца(IV), фторид аммония,
нитрат кальция.
10. концентрированная соляная кислота, оксид
углерода(IV), перманганат калия, фосфат калия,
нитрат железа(III).
11. нитрат цинка, сульфит натрия, бром, гидроксид
калия, оксид меди(II).
12. хлорат калия, гидроксид натрия, сульфат
алюминия, оксид хрома(III), оксид магния.
13. фтороводород, карбонат аммония, сульфат
железа(II), дихромат калия, серная кислота.
14. хромат натрия, серная кислота, гидрокарбонат
магния, оксид фосфора(V), нитрит натрия.
22.
15. гидроксид магния, сероводород, нитратсеребра, дихромат натрия, серная кислота.
16. сульфит калия, дихромат калия, серная
кислота, гидроксид хрома(III), оксид кремния.
17. перманганат калия, иодид калия, фторид
аммония, ацетат натрия, сульфат магния.
18. гипохлорит натрия, гидроксид натрия,
фторид цинка, оксид хрома(III), оксид
кремния.
19. сера, концентрированная азотная кислота,
оксид углерода(IV), фторид серебра, ацетат
кальция.
20. перманганат калия, фосфин, серная кислота,
нитрат лития, гидроксид алюминия.



















 chemistry
chemistry








