Similar presentations:
Введение в эндокринологию Лекция 3
1. Московский Государственный Университет им. М.В.Ломоносова Биологический факультет Кафедра физиологии человека и животных
Факультет космических исследованийВведение в эндокринологию
Лекция 3
Сиротина Наталья Сергеевна
2025
2.
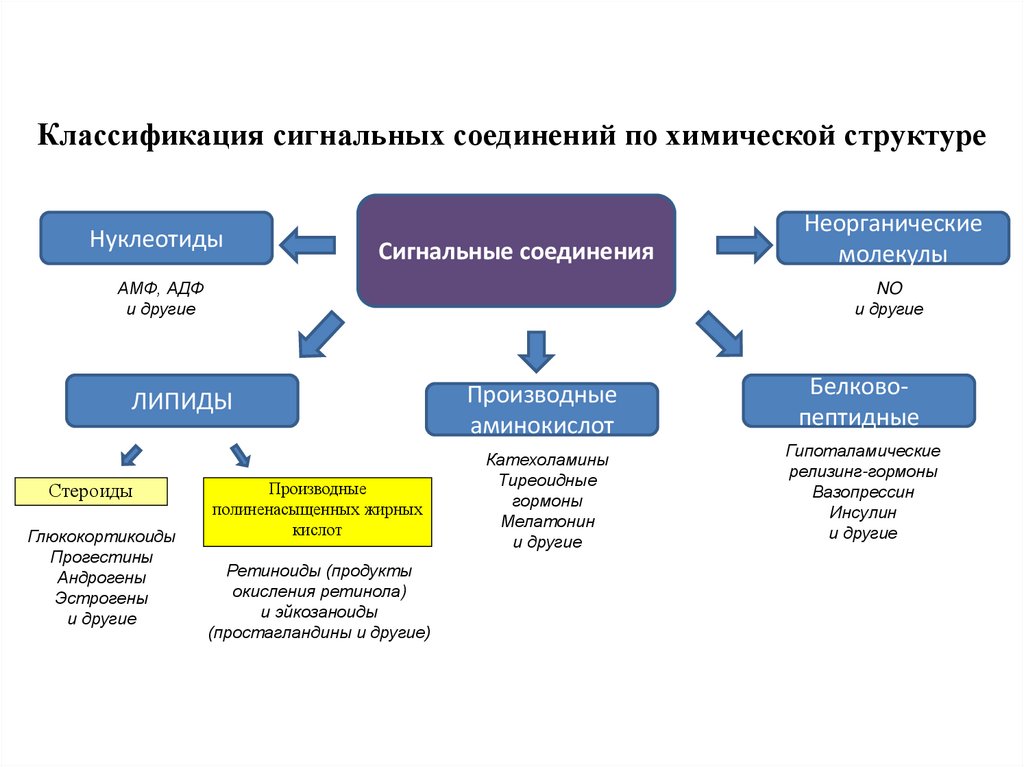
Классификация сигнальных соединений по химической структуреНуклеотиды
Сигнальные соединения
АМФ, АДФ
и другие
NO
и другие
ЛИПИДЫ
Стероиды
Глюкокортикоиды
Прогестины
Андрогены
Эстрогены
и другие
Неорганические
молекулы
Производные
полиненасыщенных жирных
кислот
Ретиноиды (продукты
окисления ретинола)
и эйкозаноиды
(простагландины и другие)
Производные
аминокислот
Белковопептидные
Катехоламины
Тиреоидные
гормоны
Мелатонин
и другие
Гипоталамические
релизинг-гормоны
Вазопрессин
Инсулин
и другие
3.
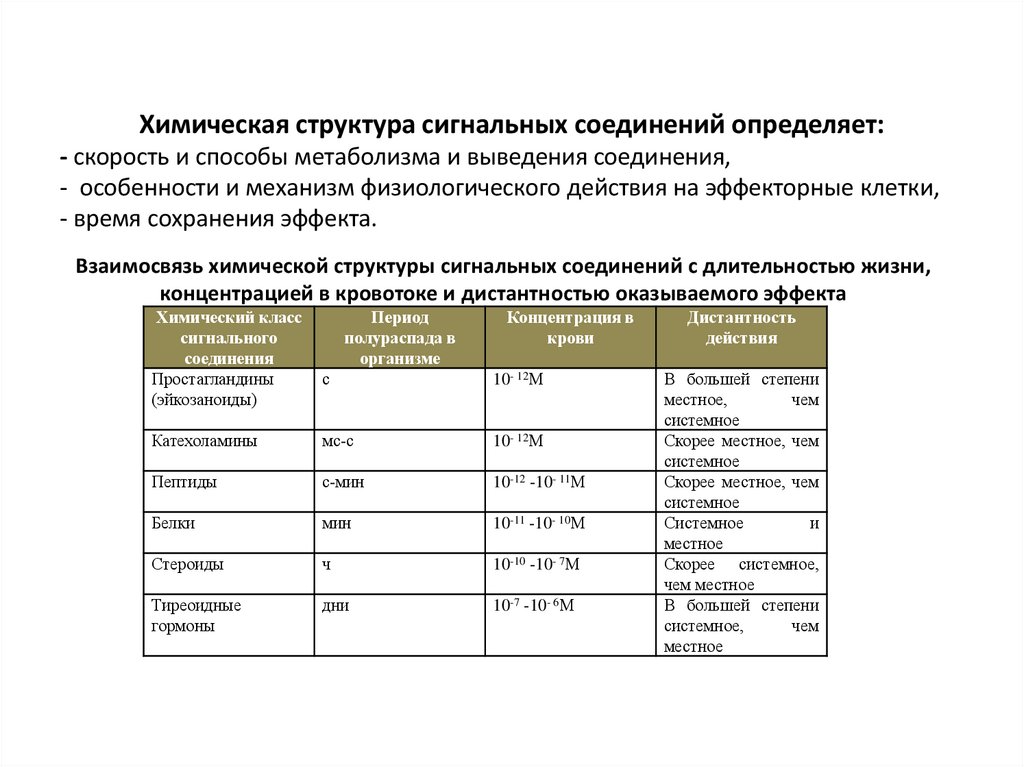
Химическая структура сигнальных соединений определяет:- скорость и способы метаболизма и выведения соединения,
- особенности и механизм физиологического действия на эффекторные клетки,
- время сохранения эффекта.
Взаимосвязь химической структуры сигнальных соединений с длительностью жизни,
концентрацией в кровотоке и дистантностью оказываемого эффекта
Химический класс
сигнального
соединения
Простагландины
(эйкозаноиды)
Период
полураспада в
организме
Концентрация в
крови
с
10- 12М
Катехоламины
мс-с
10- 12М
Пептиды
с-мин
10-12 -10- 11М
Белки
мин
10-11 -10- 10М
Стероиды
ч
10-10 -10- 7М
Тиреоидные
гормоны
дни
10-7 -10- 6М
Дистантность
действия
В большей степени
местное,
чем
системное
Скорее местное, чем
системное
Скорее местное, чем
системное
Системное
и
местное
Скорее системное,
чем местное
В большей степени
системное,
чем
местное
4.
5.
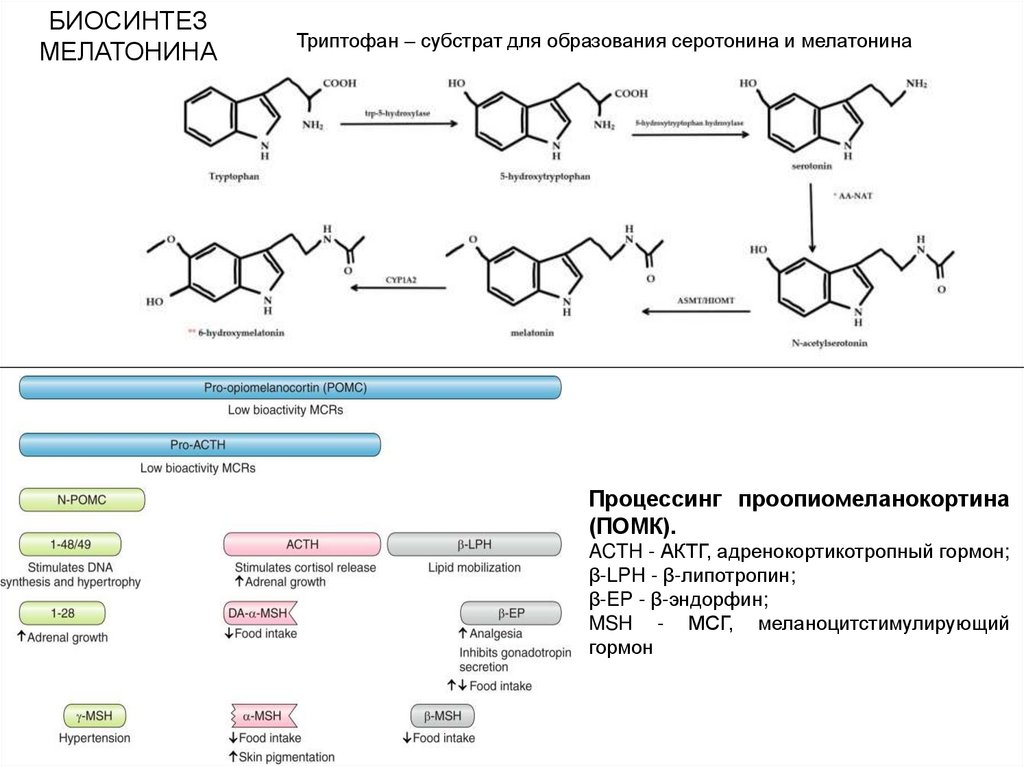
БИОСИНТЕЗМЕЛАТОНИНА
Триптофан – субстрат для образования серотонина и мелатонина
Процессинг проопиомеланокортина
(ПОМК).
ACTH - АКТГ, адренокортикотропный гормон;
β-LPH - β-липотропин;
β-EP - β-эндорфин;
MSH - МСГ, меланоцитстимулирующий
гормон
6. Пункты регуляторного воздействия на продукцию гормонов
1. Этапы биосинтеза2. Секреция
3. Ритмичность секреции
Типы регуляторного контроля
1. Нервная регуляция
2. Нейро-эндокринная регуляция
3. Эндокринная регуляция
4. Регуляция продуктами обмена
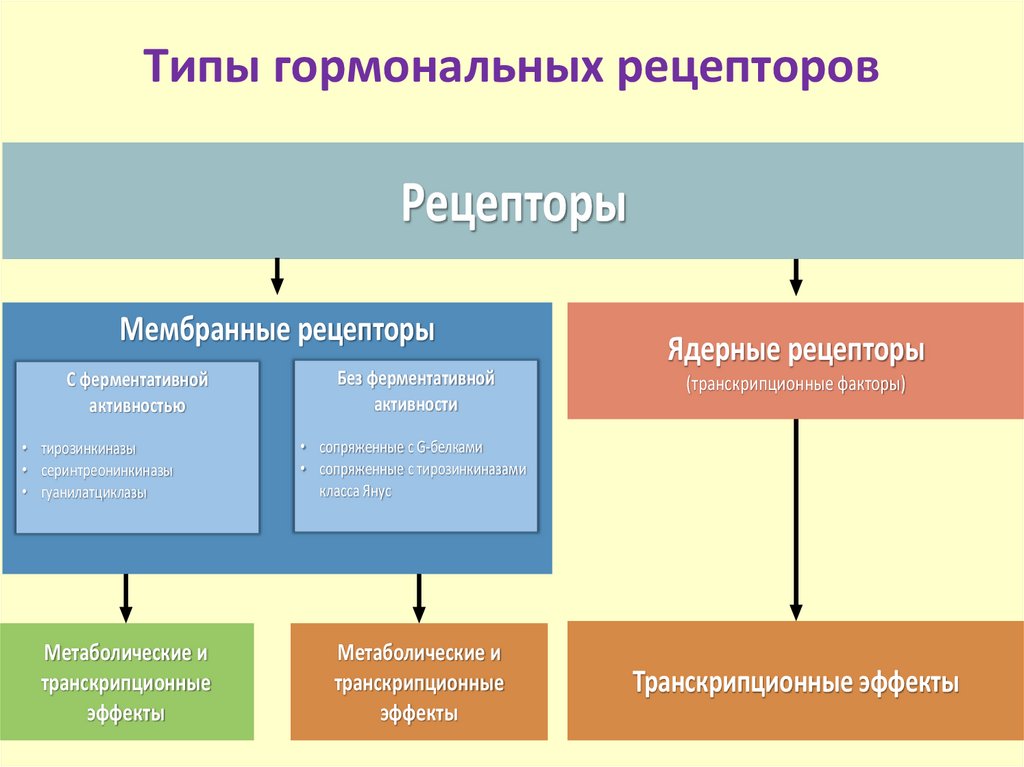
7. Типы гормональных рецепторов
РецепторыМембранные рецепторы
С ферментативной
активностью
• тирозинкиназы
• серинтреонинкиназы
• гуанилатциклазы
Метаболические и
транскрипционные
эффекты
Без ферментативной
активности
Ядерные рецепторы
(транскрипционные факторы)
• сопряженные с G-белками
• сопряженные с тирозинкиназами
класса Янус
Метаболические и
транскрипционные
эффекты
Транскрипционные эффекты
8.
Рецепторы безферментативной активности
ассоциированные с Gбелками
9. Мембранные рецепторы:
•мембранные гликозилированные белки•инициируют физические, метаболические и
транскрипционные эффекты в клетках
•лиганд+рецептор активация передача сигнала
внутрь клетки гормонзависимая инактивация
рецептора
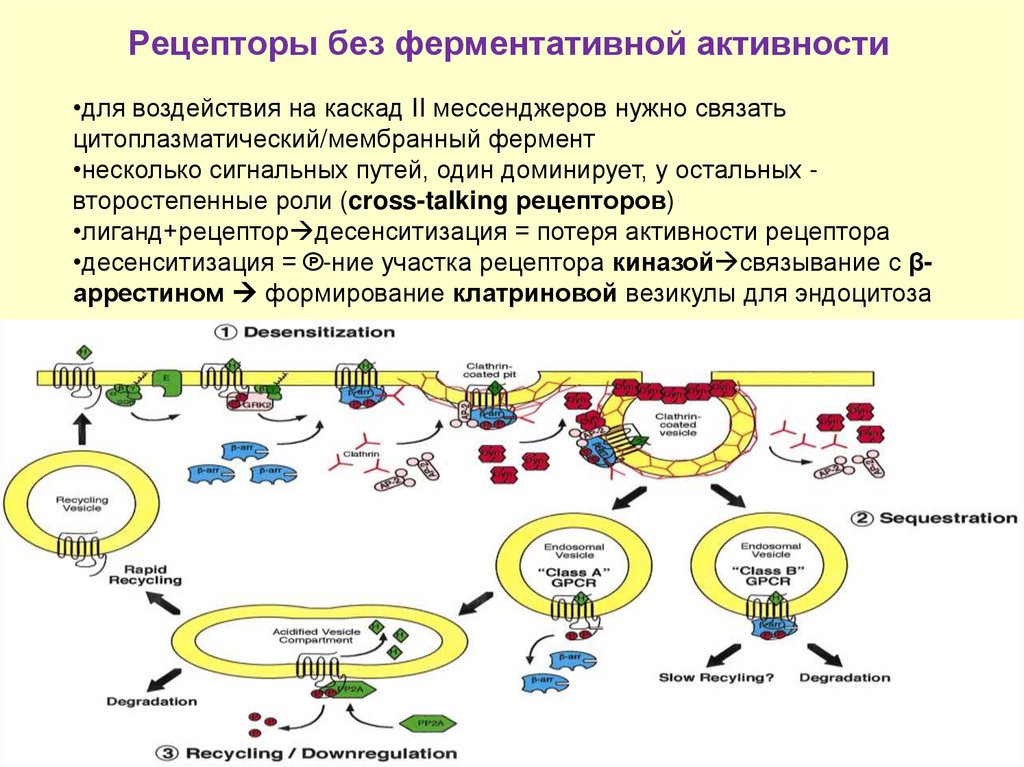
10. Рецепторы без ферментативной активности
•для воздействия на каскад II мессенджеров нужно связатьцитоплазматический/мембранный фермент
•несколько сигнальных путей, один доминируeт, у остальных второстепенные роли (cross-talking рецепторов)
•лиганд+рецептор десенситизация = потеря активности рецептора
•десенситизация = ℗-ние участка рецептора киназой связывание с βаррестином формирование клатриновой везикулы для эндоцитоза
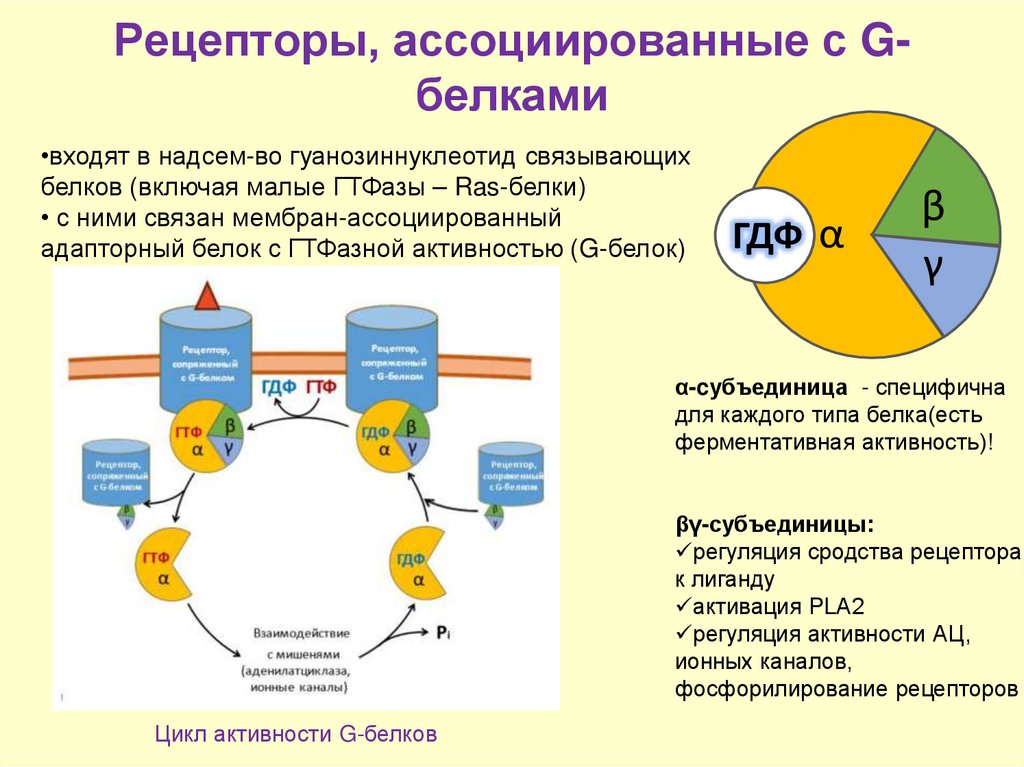
11. Рецепторы, ассоциированные с G-белками
Рецепторы, ассоциированные с Gбелками•входят в надсем-во гуанозиннуклеотид связывающих
белков (включая малые ГТФазы – Ras-белки)
• с ними связан мембран-ассоциированный
адапторный белок с ГТФазной активностью (G-белок)
ГДФ α
β
γ
α-cубъединица - специфична
для каждого типа белка(есть
ферментативная активность)!
βγ-субъединицы:
регуляция сродства рецептора
к лиганду
активация PLА2
регуляция активности АЦ,
ионных каналов,
фосфорилирование рецепторов
Цикл активности G-белков
12. Классификация G-белков
Gs – активируют аденилатциклазную системуGi – ингибируют аденилатциклазную систему
Gq – активируют фосфолипазу С и фосфоинозитидную
систему
и другие
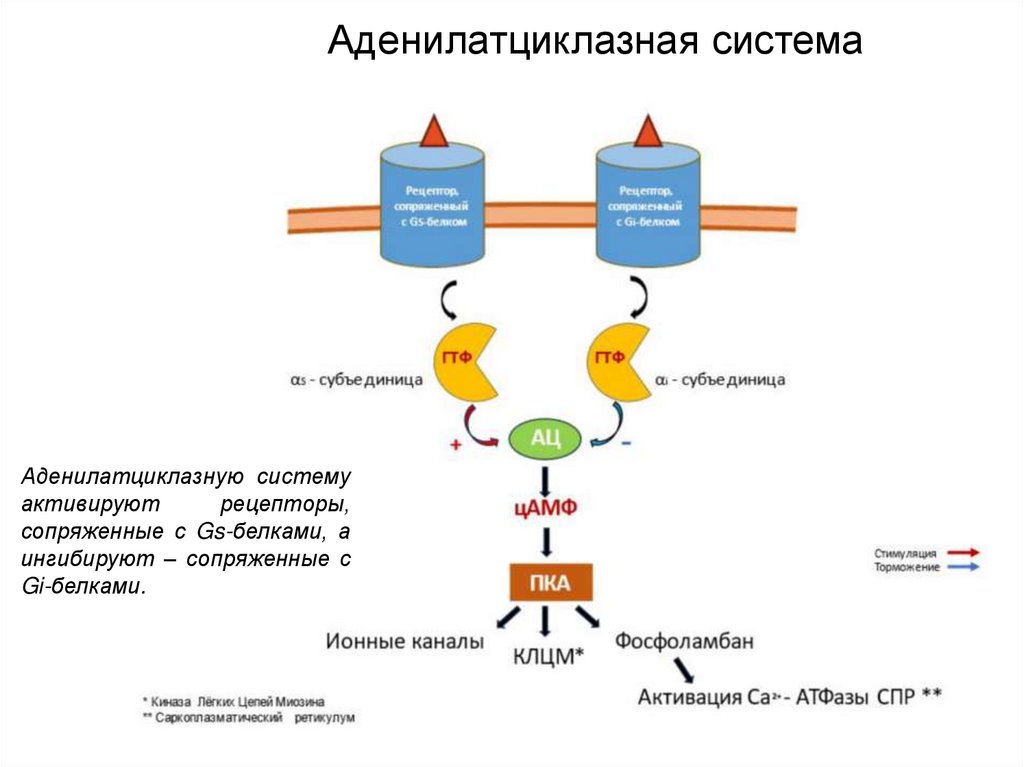
13.
Аденилатциклазная системаАденилатциклазную систему
активируют
рецепторы,
сопряженные с Gs-белками, а
ингибируют – сопряженные с
Gi-белками.
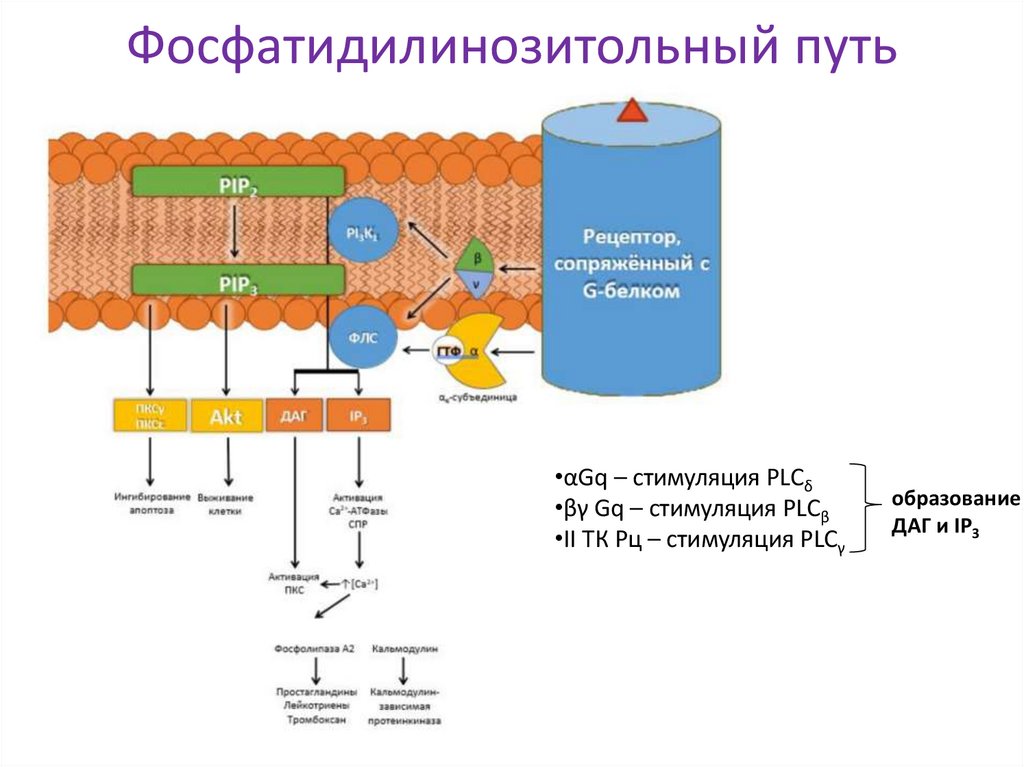
14. Фосфатидилинозитольный путь
•αGq – стимуляция PLCδ•βγ Gq – стимуляция PLСβ
•II ТК Рц – стимуляция PLСγ
образование
ДАГ и IP3
15.
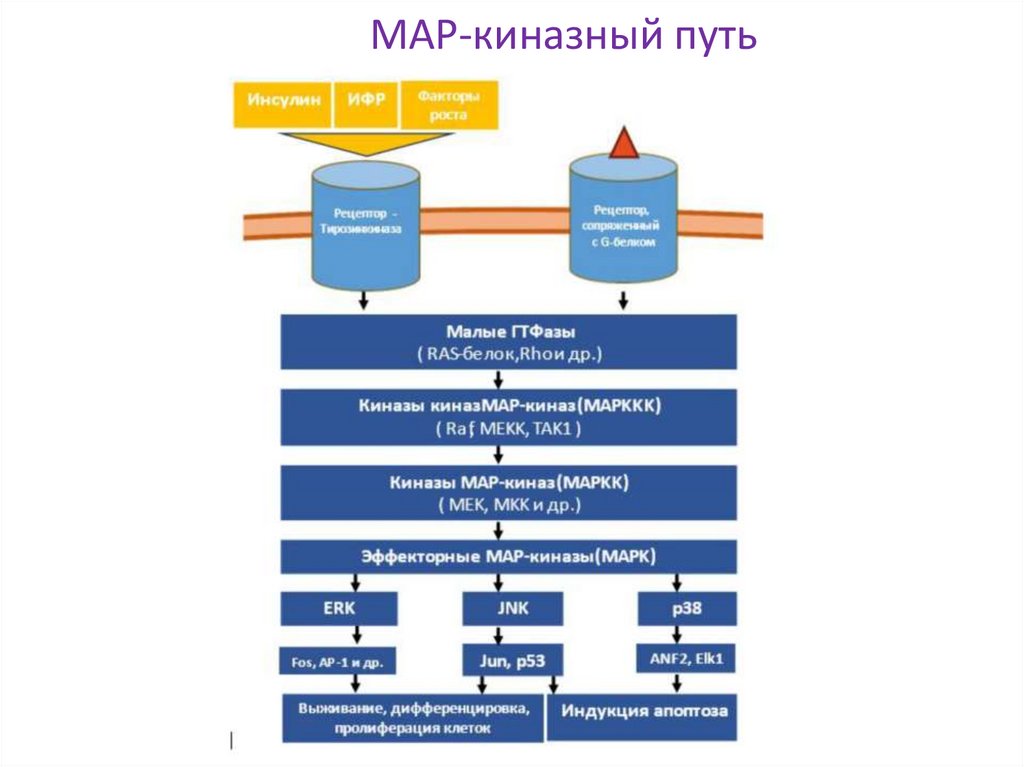
МАР-киназный путь16. Рецепторы, ассоциированные с тирозинкиназами класса Janus
Три семейства рецепторов:•Семейство рецепторов СТГ, лептина, эритропоэтина и интерлейкинов (кроме
IL-10)
•Семейство рецепторов интерферонов и IL-10
•Семейство рецепторов Т- и В-лимфоцитарных антигенов
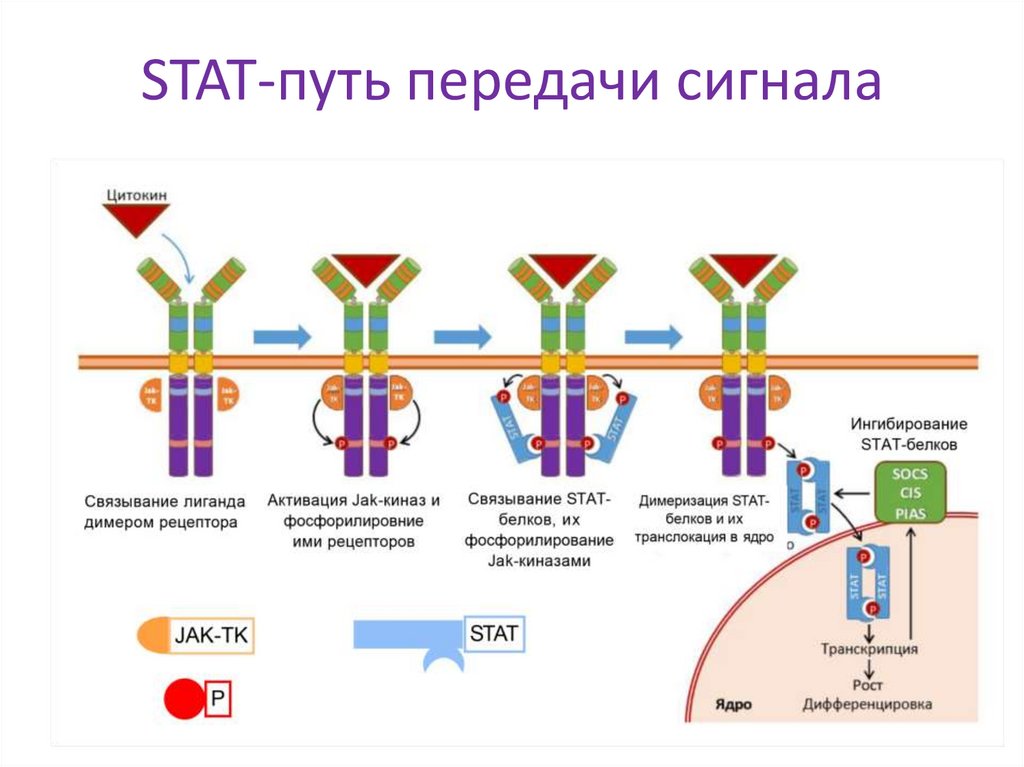
Особенности рецепторной передачи:
•Нужна димеризация рецепторов вокруг молекулы гормона
•[Агонист] = [рецептор] передача сигнала по такому механизму
невозможна, так как каждый рецептор связан с лигандом, что препятствует
их димеризации
•Передача
сигнала
по
3
путям:
STAT,
МАР-киназному
и
фосфатидилинозитольному путям
17.
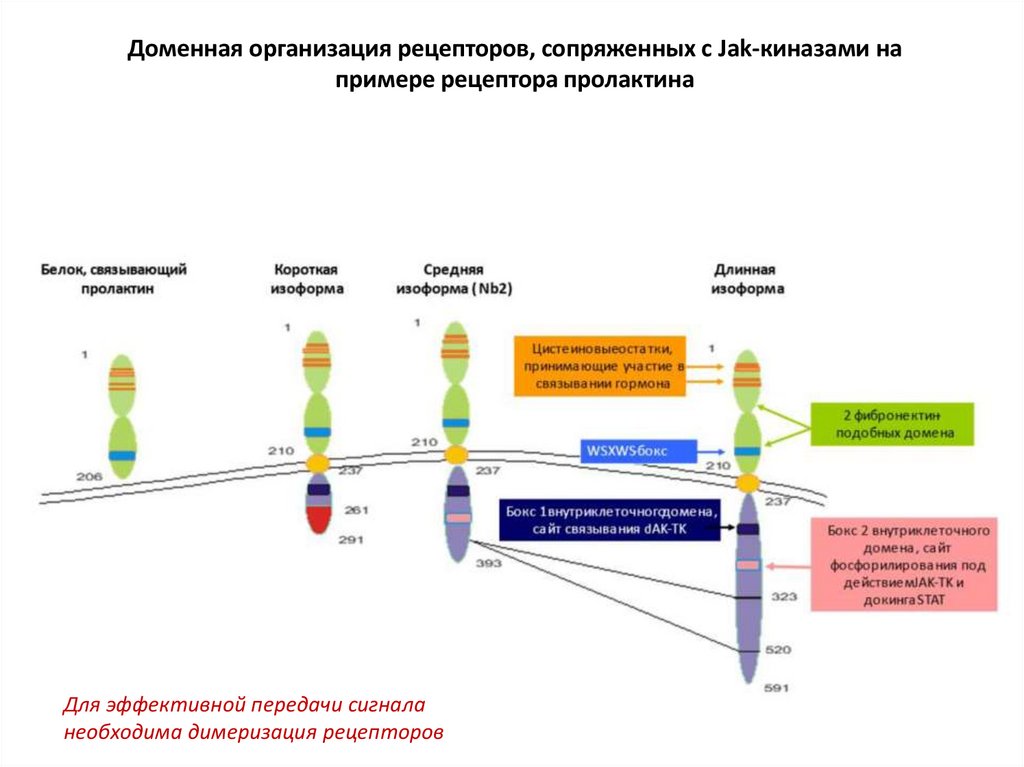
Доменная организация рецепторов, сопряженных с Jak-киназами напримере рецептора пролактина
Для эффективной передачи сигнала
необходима димеризация рецепторов
18. STAT-путь передачи сигнала
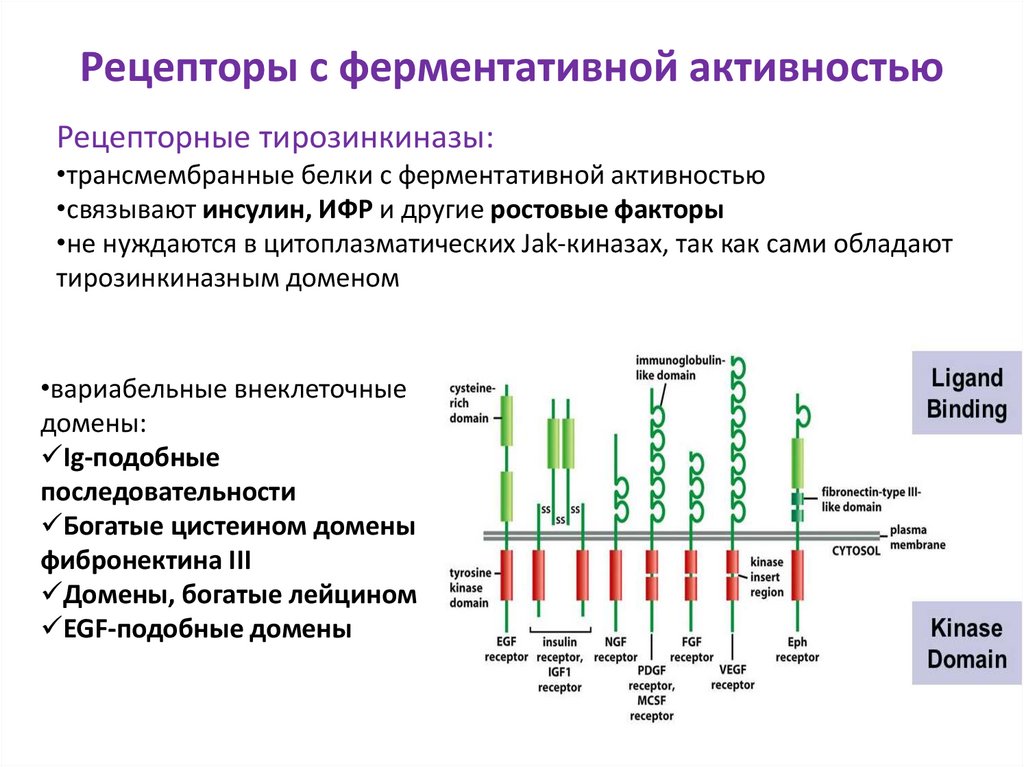
19. Рецепторы с ферментативной активностью
Рецепторные тирозинкиназы:•трансмембранные белки с ферментативной активностью
•связывают инсулин, ИФР и другие ростовые факторы
•не нуждаются в цитоплазматических Jak-киназах, так как сами обладают
тирозинкиназным доменом
•вариабельные внеклеточные
домены:
Ig-подобные
последовательности
Богатые цистеином домены
фибронектина III
Домены, богатые лейцином
EGF-подобные домены
20.
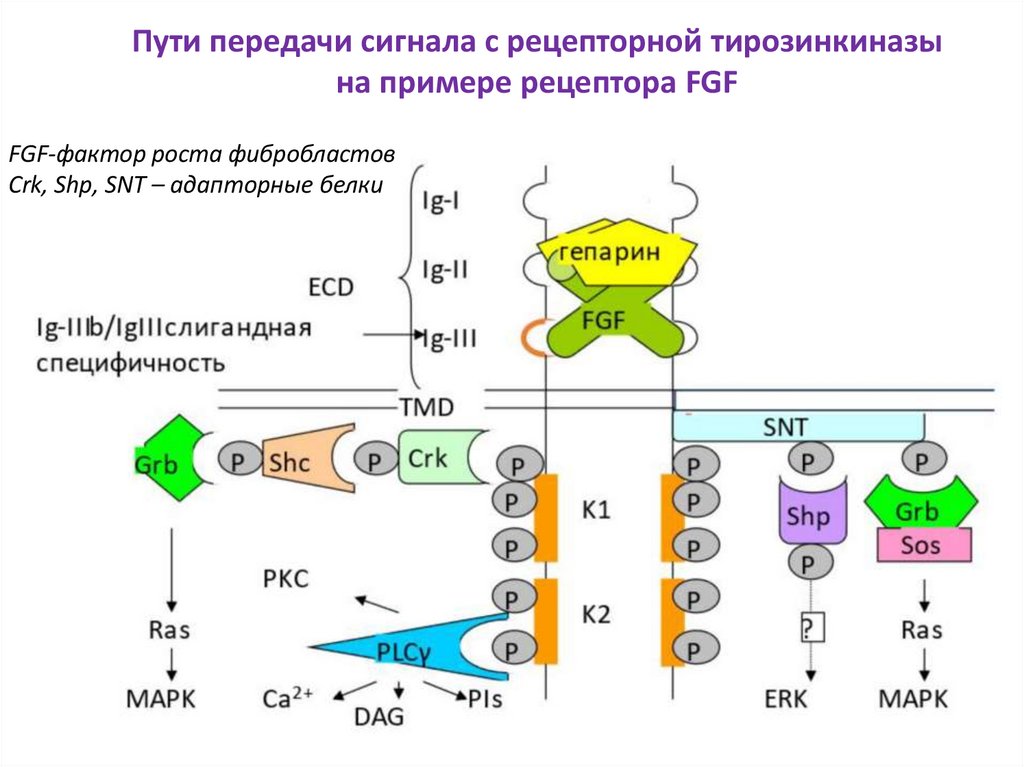
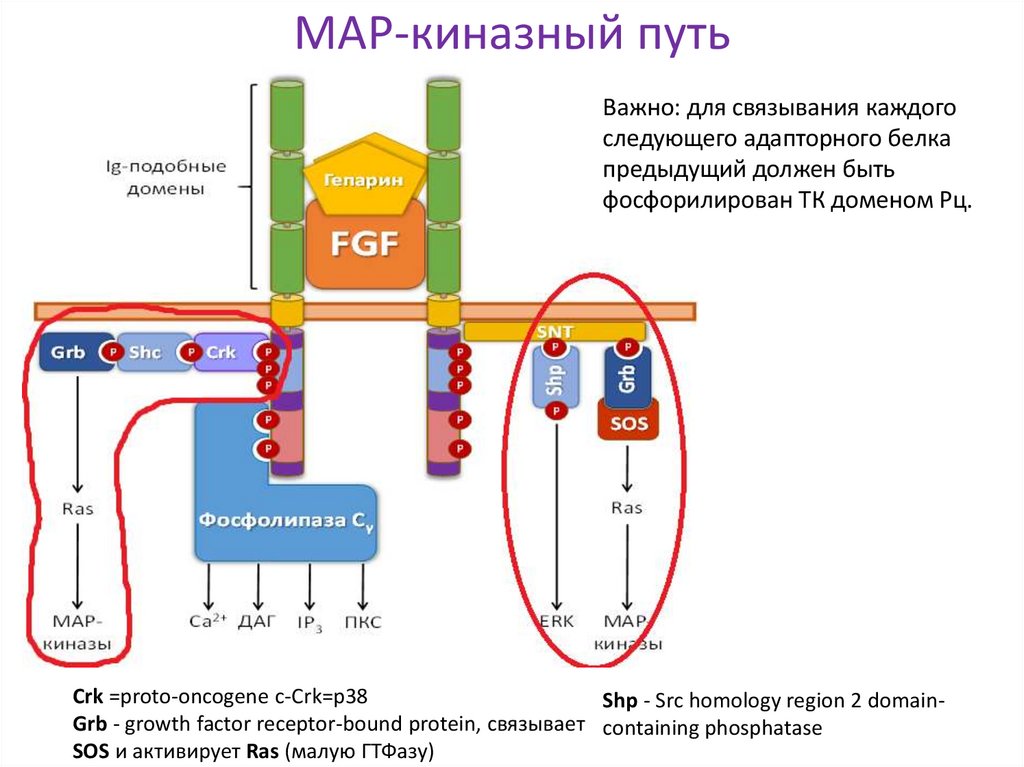
Пути передачи сигнала с рецепторной тирозинкиназына примере рецептора FGF
FGF-фактор роста фибробластов
Crk, Shp, SNT – адапторные белки
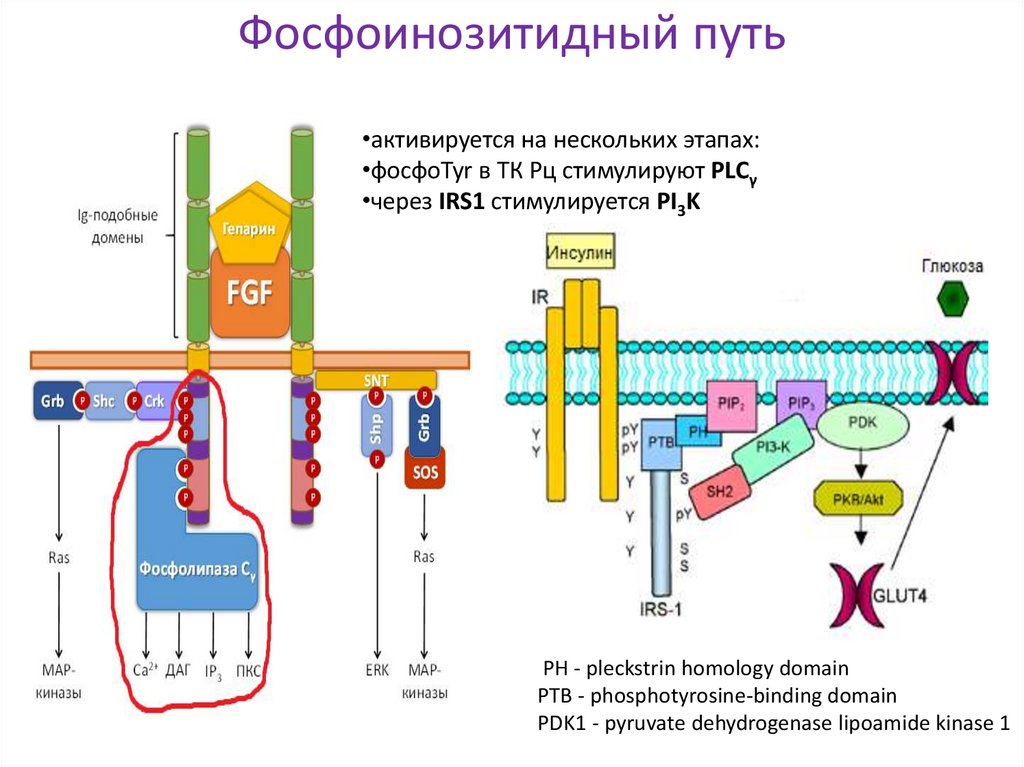
21. Фосфоинозитидный путь
•активируется на нескольких этапах:•фосфоTyr в ТК Рц стимулируют PLСγ
•через IRS1 стимулируется PI3K
PH - pleckstrin homology domain
PTB - phosphotyrosine-binding domain
PDK1 - pyruvate dehydrogenase lipoamide kinase 1
22. МАР-киназный путь
Важно: для связывания каждогоследующего адапторного белка
предыдущий должен быть
фосфорилирован ТК доменом Рц.
Crk =proto-oncogene c-Crk=p38
Shp - Src homology region 2 domainGrb - growth factor receptor-bound protein, связывает containing phosphatase
SOS и активирует Ras (малую ГТФазу)
23. Рецепторные серинтреонинкиназы
•Связывают активин, ингибин, TGFβ, АМГ, белки мофогенезакости, миостатин в виде димеров
•Состоят из рецепторов 2 типов: с конститутивной активностью
(пара Рц II типа) и индуцибельной активностью, активир ℗нием (пара Рц I типа)
•Механизм: 2гормон+2Рц II ℗-ние 2Рц I активация 2Рц I
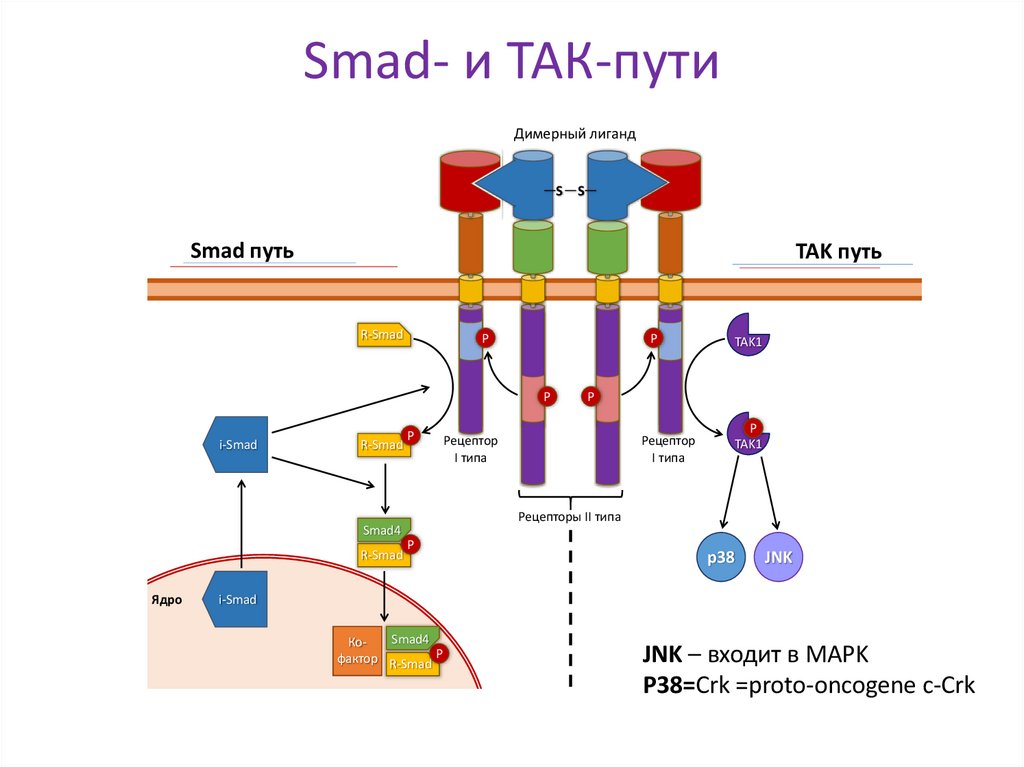
•Сигнальные пути: SMAD- и TAK-пути
24. Smad- и ТАК-пути
Димерный лигандS S
Smad путь
TAK путь
R-Smad
Р
Р
Р
i-Smad
R-Smad
Р
Ядро
Р
Рецептор
I типа
Рецептор
I типа
Р
TAK1
Рецепторы II типа
Smad4
R-Smad
TAK1
Р
p38
JNK
i-Smad
Smad4
Кофактор R-Smad Р
JNK – входит в MAPK
P38=Crk =proto-oncogene c-Crk
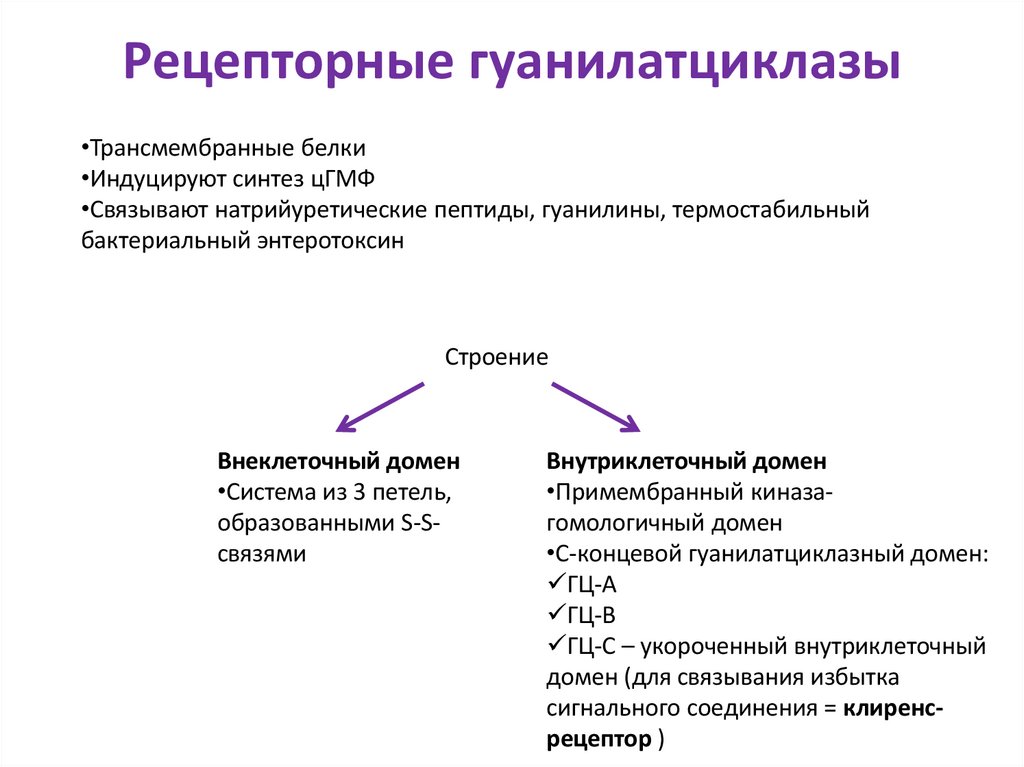
25. Рецепторные гуанилатциклазы
•Трансмембранные белки•Индуцируют синтез цГМФ
•Связывают натрийуретические пептиды, гуанилины, термостабильный
бактериальный энтеротоксин
Строение
Внеклеточный домен
•Система из 3 петель,
образованными S-Sсвязями
Внутриклеточный домен
•Примембранный киназагомологичный домен
•С-концевой гуанилатциклазный домен:
ГЦ-А
ГЦ-В
ГЦ-С – укороченный внутриклеточный
домен (для связывания избытка
сигнального соединения = клиренсрецептор )
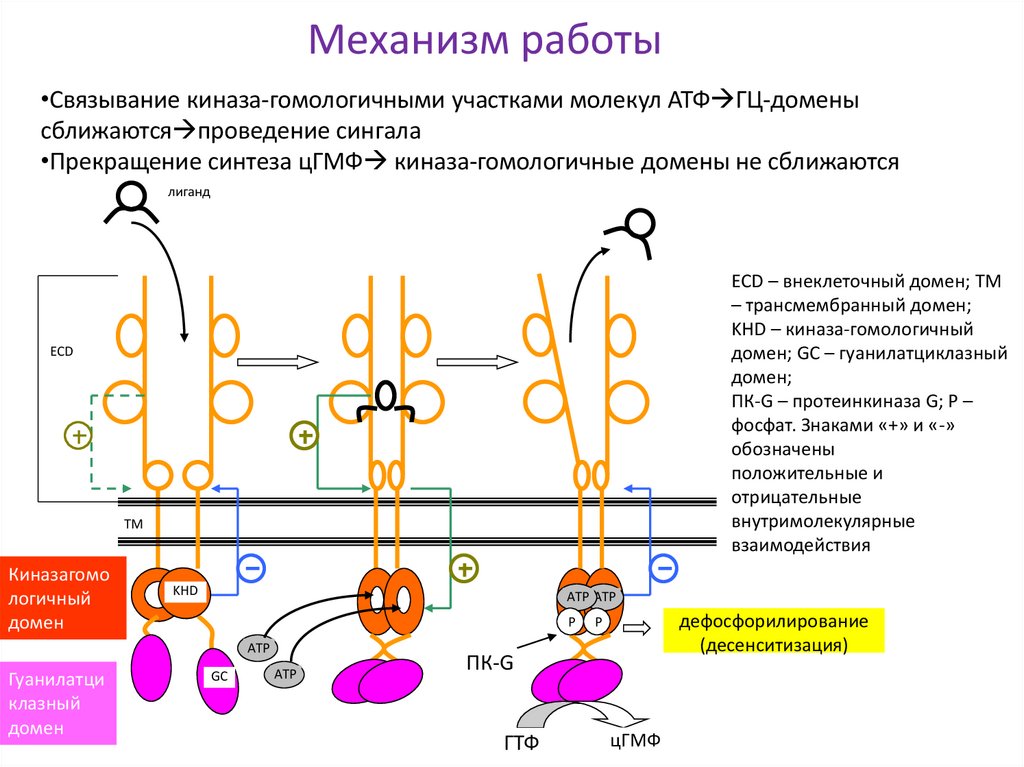
26. Механизм работы
•Связывание киназа-гомологичными участками молекул АТФ ГЦ-доменысближаются проведение сингала
•Прекращение синтеза цГМФ киназа-гомологичные домены не сближаются
лиганд
ECD – внеклеточный домен; TM
– трансмембранный домен;
KHD – киназа-гомологичный
домен; GC – гуанилатциклазный
домен;
ПК-G – протеинкиназа G; P –
фосфат. Знаками «+» и «-»
обозначены
положительные и
отрицательные
внутримолекулярные
взаимодействия
ECD
TM
Киназагомо
логичный
домен
KHD
ATP ATP
P
ATP
Гуанилатци
клазный
домен
GC
ATP
дефосфорилирование
(десенситизация)
P
ПК-G
ГТФ
цГМФ
27. Ядерные рецепторы
28.
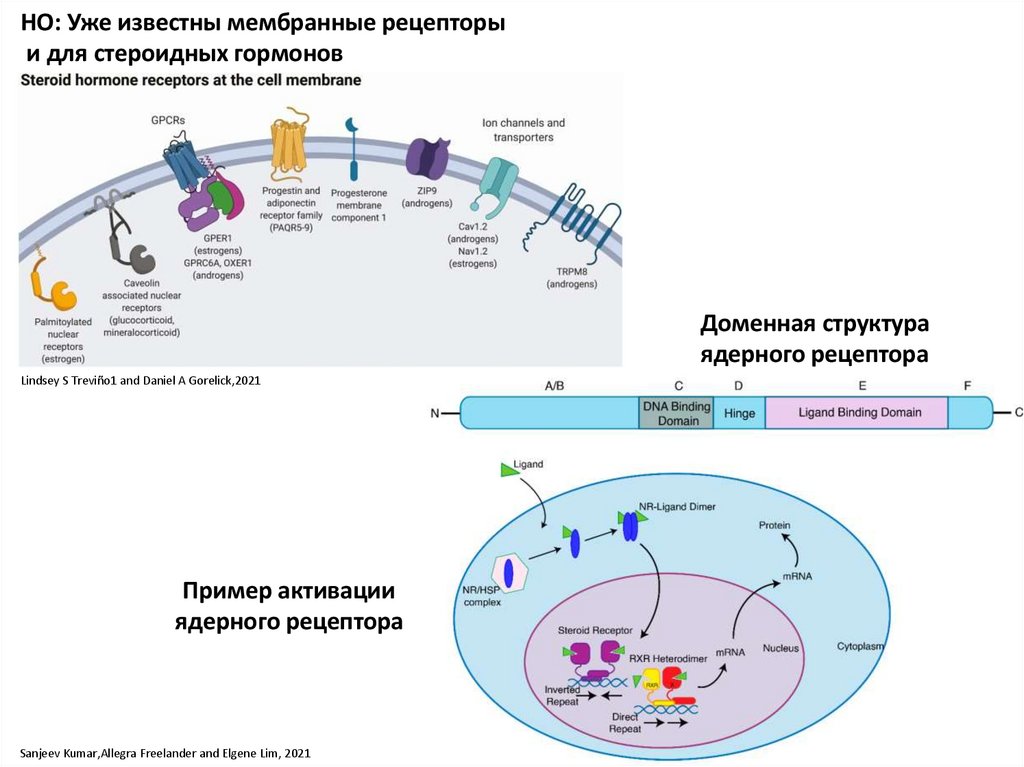
НО: Уже известны мембранные рецепторыи для стероидных гормонов
Доменная структура
ядерного рецептора
Lindsey S Treviño1 and Daniel A Gorelick,2021
Пример активации
ядерного рецептора
Sanjeev Kumar,Allegra Freelander and Elgene Lim, 2021
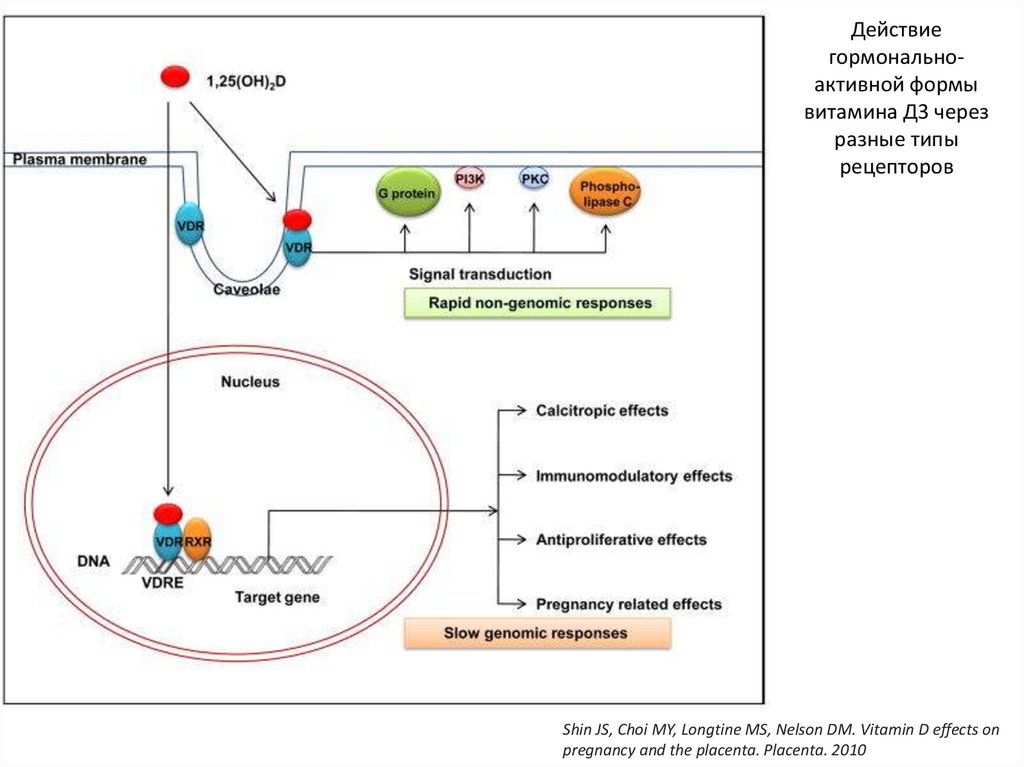
29.
Действиегормональноактивной формы
витамина Д3 через
разные типы
рецепторов
Shin JS, Choi MY, Longtine MS, Nelson DM. Vitamin D effects on
pregnancy and the placenta. Placenta. 2010









 biology
biology