Similar presentations:
Влияние химических свойств радионуклидов на пути миграции в биосфере. Химические свойства элементов. Лекция 8
1. 16.03.2022
ЛЕКЦИЯ 8Влияние химических свойств
радионуклидов на пути миграции в
биосфере
Химические свойства элементов,
имеющих радиоэкологически значимые
изотопы
Байтимирова Марина Олеговна
2. Содержание лекции
Влияние химических свойств радионуклидовна пути миграции в биосфере. Проблема
кумуляции (самопроизвольного накопления).
Ядерно-физические
характеристики
и
химические свойства радионуклидов щелочных
и щелочноземельных элементов.
Редкоземельные
элементы
(РЗЭ);
актиноиды
(торий,
уран,
плутоний);
тугоплавкие оксиды (цирконий,
ниобий);
благородные металлы; галогены; благородные
газы.
Ядерно-физические
характеристики
радиоэкологически значимых изотопов.
2
3. Формы радионуклидов в окружающей среде
Радионуклиды существуют в окружающей среде в разныхформах в зависимости от условий выброса и переноса. Их
можно разделить на химические группы, обладающие
сходством химических свойств:
газы,
аэрозоли,
частицы.
От химических свойств радионуклида будет зависеть и его
поведение в водной среде. Радионуклид может находиться
в воде,
сконцентрироваться в твердой фазе или
в живом веществе.
В окружающей среде протекают процессы как рассеяния,
так и самопроизвольного накопления радионуклидов.
3
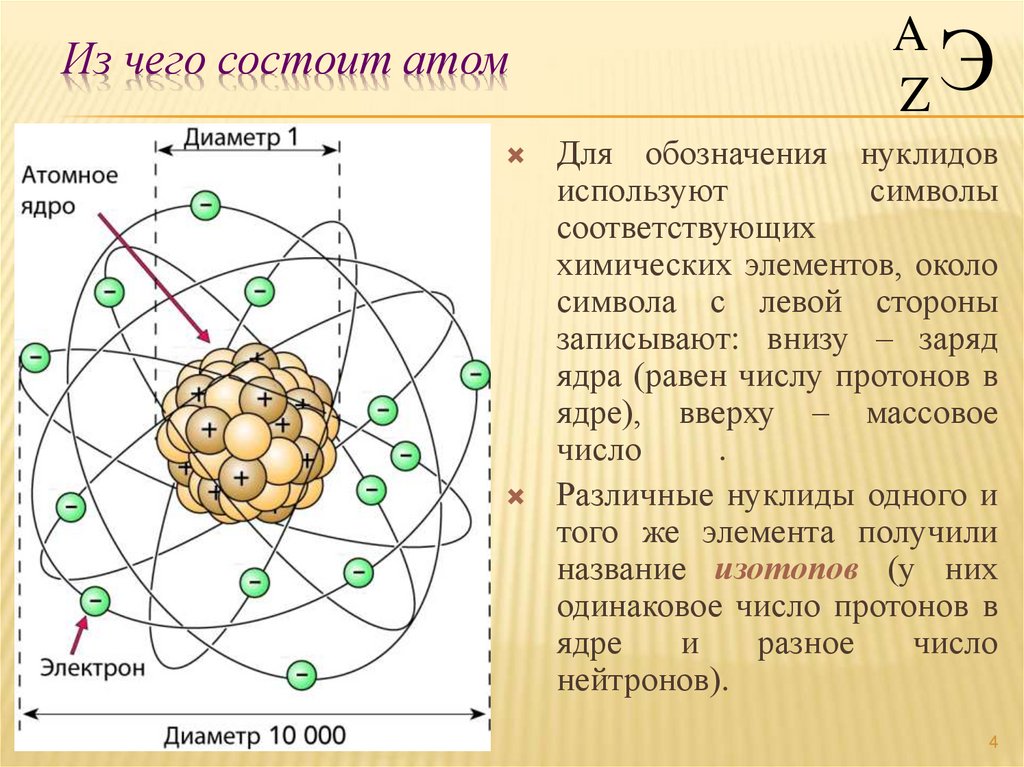
4. Из чего состоит атом
AZ
Э
Для обозначения нуклидов
используют
символы
соответствующих
химических элементов, около
символа с левой стороны
записывают: внизу – заряд
ядра (равен числу протонов в
ядре), вверху – массовое
число
.
Различные нуклиды одного и
того же элемента получили
название изотопов (у них
одинаковое число протонов в
ядре
и
разное
число
нейтронов).
4
5. Энергетические уровни атома цезия
56. Степень окисления элемента
Степень окисления – число зарядов, приходящихся на каждыйатом данного элемента в конкретном соединении.
! Изотопы, входящие в состав разных соединений и имеющие
разные степени окисления, будут различаться по своему
химическому поведению.
Химическое поведение радионуклида будет зависеть от нескольких
факторов.
1. От степени окисления.
2. От форм состояния радионуклида в растворе.
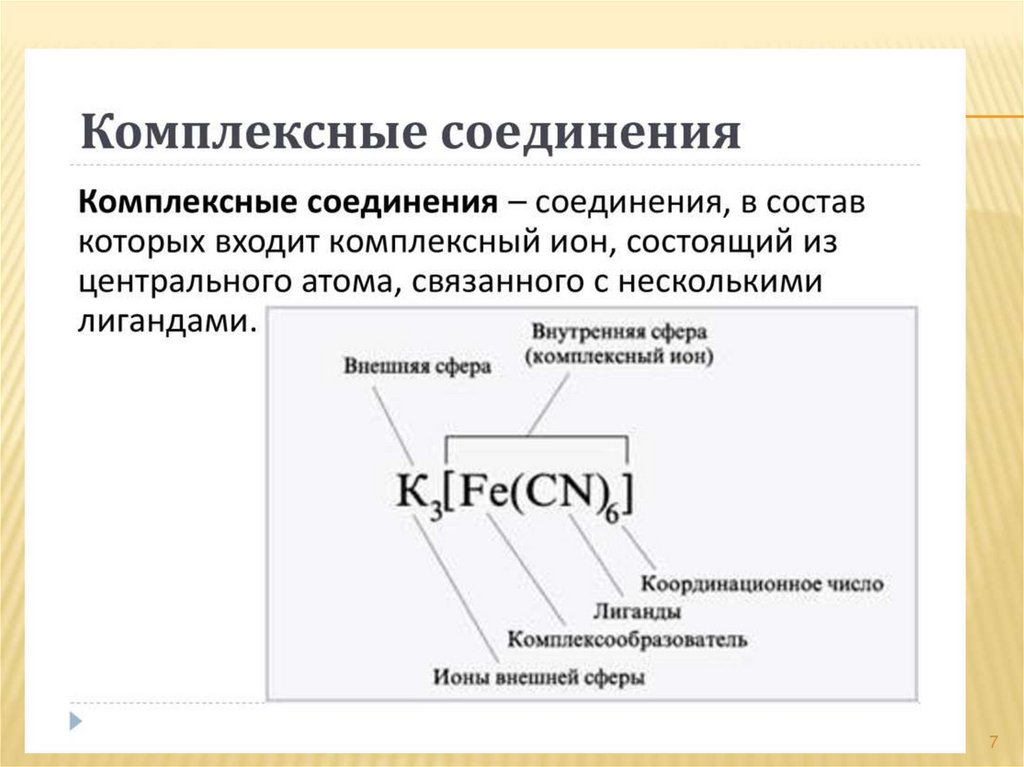
2.1. Простые ионы.
2.2. Комплексные ионы.
2.3. Продукты гидролиза – моноядерные и полиядерные
гидроксокомплексы.
2.4. Коллоиды.
6
2.5. Взвеси радиоактивные.
7.
78. Коллоидные частицы
Коллоидные частицы, в отличие от взвесей, образуются при химическомвзаимодействии веществ. Рассмотрим в общем виде образование твёрдой фазы
(в виде частиц коллоидных размеров) по реакции:
М*А + МеАn (изб) = М*Аn + МеА,
где М* – радионуклид, Аn – анион-осадитель.
Тогда образующиеся частицы труднорастворимого соединения будут иметь
следующую структуру:
m[MAn] nAn pMe}-(n-p)qMe, где m >> n; n = p + q;
агрегат
ядро
частица
мицелла
m – количество молекул MAn в ядре частицы;
n – количество анионов (An-), прочно адсорбированных на поверхности
агрегата. Они называются потенциалопределяющими, и поскольку имеют
8
заряд, то ядро будет заряжено. Потенциалообразующий слой выполняет
9.
910. Щелочные элементы
В периодической системе элементов Менделеева щелочныеэлементы расположены в I группе и имеют степень окисления
+1. Радиусы ионов Ме+ в кристаллах по Полингу, Å:
Большинство солей щелочных металлов легко
растворимы в воде.
Cs является слаболетучим элементом (способен
образовывать летучие оксиды и пероксиды),
однако более летучим, чем Sr.
Химические аналоги Cs – K и Na (по радиусу
иона ближе калий).
В растворе Cs в основном находится в ионной
форме, не образует ни истинных, ни
псевдоколлоидов в широком интервале рН.
Li 0,60;
Na 0,97;
K 1,33;
Rb 1,48;
Cs 1,69.
10
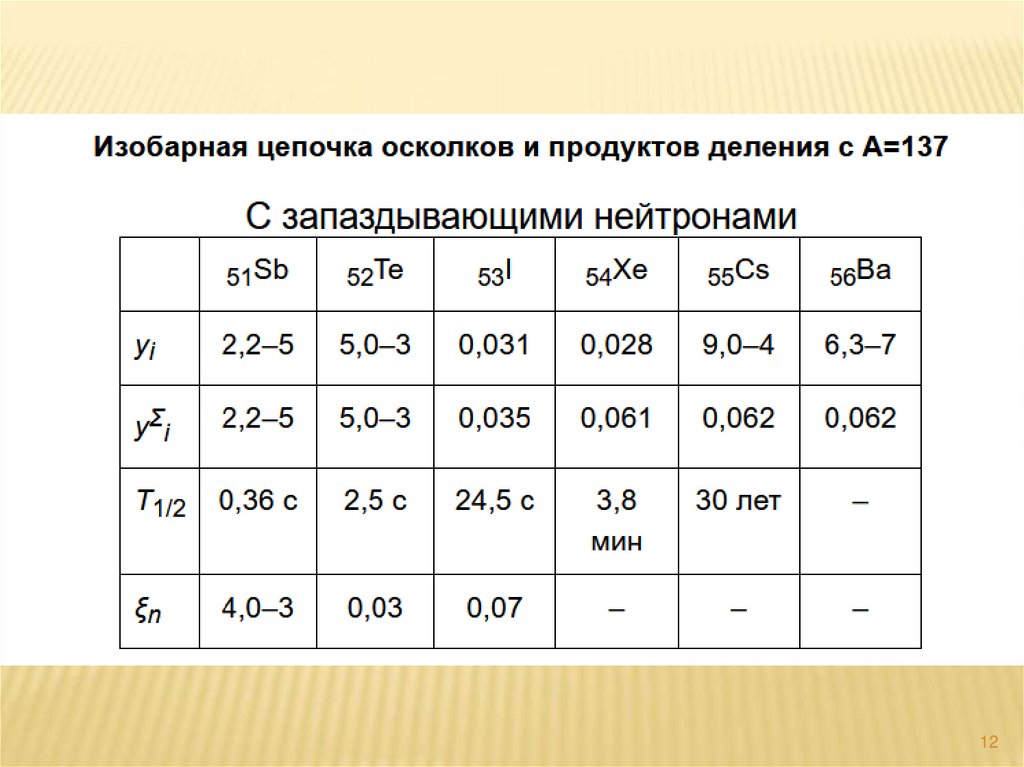
11. Цезий - 137Cs
137Cs – продукт ядерного деления свысоким выходом равным
6,2 % и периодом полураспада Т1/2 = 30 лет.
Тип распада – β –, испускает две группы β-частиц разной энергии,
изомерный переход (ИП)
сопровождается
испусканием γквантов:
I группа β-частиц имеет выход 92 % , Е max, 1 = 0,518 МэВ;
II группа β-частиц – выход 8 %, Е max, 2 = 1,18 МэВ.
Разница между максимальными энергиями
β-частиц даёт энергию
ИП = 1,18 – 0,518 = 0, 661 МэВ.
11
12.
1213. Щелочно-земельные элементы
Щелочно-земельные элементы расположены воII группе
периодической системы элементов Менделеева и имеют степень
окисления +2. Радиусы ионов Ме2+ в кристаллах по Полингу, Å:
Mg 0,65
Повышается
Ca 0,99
способность
Sr 1,13
образовывать
псевдоколлоиды
Ba 1,35
Ra 1,40
Долгоживущие искусственные изотопы, имеющие большой
выход при делении.
Химические свойства Sr и Ra схожи со свойствами других
щелочно-земельных элементов. Химия элементов I и II группы
достаточно простая. Щелочно-земельные элементы в растворе
преимущественно находятся в ионном состоянии, могут
образовывать псевдоколлоиды.
13
14. Стронций – 90Sr, 89Sr, Радий – 226Ra, 228Ra.
имеет выход при делении 5,3 % (легкий максимум),Т1/2 = 29,12 года, тип распада – β- (Eβ, Sr = 0,55 МэВ; Еβ,Y = 2,27
МэВ).
90Sr
90
Sr 90Y 90Zr(стаб.).
имеет период полураспада Т1/2 = 50,52 дней, тип распада – β90Sr более долгоживущий изотоп, поэтому более опасен для
экосистем.
89Sr
Из долгоживущих изотопов радия особо следует выделить:
226Ra, Т
238U
1/2 = 1600 лет, тип распада – α, входит в семейство
228Ra, Т
- , входит в семейство 232Th.
=
5,77
лет,
тип
распада
–
β
1/2
14
15. Редкоземельные элементы (РЗЭ)
Редкоземельные элементы (РЗЭ) расположены в III группепериодической системы элементов Менделеева. Имеют сложную
химию, связанную с многообразием образуемых форм. Радиусы
ионов Ме3+ по Белову и Бокию, Å:
Sc
0,83
всего 18
Y
0,97
элементов
La→ Lu (лантан → лютеций)
1,04 – 0,80
Ас
1,11
С радиоэкологической точки зрения нас интересуют изотопы
элементов: Y, лантаноидов – La, Ce и Pr.
Их основная степень окисления +3, но для Се и Pr встречается и
аномальная степень окисления +4, однако такую степень
окисления в растворе Pr не проявляет.
Радиусы ионов по Белову и Бокию , Å:
Се3+
1,02
15
Pr3+
1,00
16. РЗЭ
90Y – продукт распада 90Sr, является жестким β-излучателем.Имея небольшой период полураспада Т1/2 = 64 часа в
окружающей среде будет присутствовать до тех пор, пока там будет
находиться материнский радионуклид 90Sr .
Генетически связанная пара радионуклидов 144Се – 144Pr.
144Се является продуктом деления с выходом ≈ 5,3 %, Т
1/2 = 285
суток,
144Pr – продукт радиоактивного распада 144Се, Т
1/2 = 17,28 мин,
144Се – мягкий β--излучатель, испускает 4 группы β-частиц разной
энергии, 144Pr – жесткий β – излучатель. Ряд изомерных переходов
сопровождается испусканием γ-квантов.
Изотопы лантана – 138 La (Т1/2 = 1,1·1011 лет), 140La (T1/2 = 40,3 ч),
являющиеся продуктами ядерного деления. Именно эти изотопы
присутствовали в спектре долгоживущего радиоактивного
загрязнения вокруг Чернобыля
16
17. Актиноиды
ЭлементАтомный номер
Степень
окисления
Ас (актиний)
89
3
Th (торий)
90
4
Pa (протактиний) 91
3, 4, 5
U (уран)
92
3, 4, 5, 6
Np (нептуний)
93
3, 4, 5, 6, 7
Pu (плутоний)
94
3, 4, 5, 6, 7
Am (америций)
95
2, 3, 4, 5, 6
Cm (кюрий)
96
3, 4
17
18. Торий
Th – природный радиоактивный элемент (все его изотопырадиоактивны).
Кларк тория в земной коре оценивается от 9,6 · 10-4 до 2 · 10-3 масс. %.
Основные минералы тория – торианит (ThО2 с примесью UO2 и CeO2),
торит и гуттонит (Th(SiO4)4), монацит – смесь ортофосфатов тория и
редких земель.
Th по химическим свойствам более похож на Ce, так как имеет
близкий к нему радиус иона. Радиусы ионов по Белову и Бокию, Å:
Координационное число тория в водных растворах – 8.
В кислых растворах, рН которых менее 3, Th4+
гидратирован мало. При больших значениях рН имеет
место сильный гидролиз: моноядерный и
полиядерный с последующим образованием
коллоидов. При микроконцентрации Th образование
коллоидов возможно при рН >3,5.
Th4+ - 0,95
Се4+ - 0,88
Zr4+ - 0,82
18
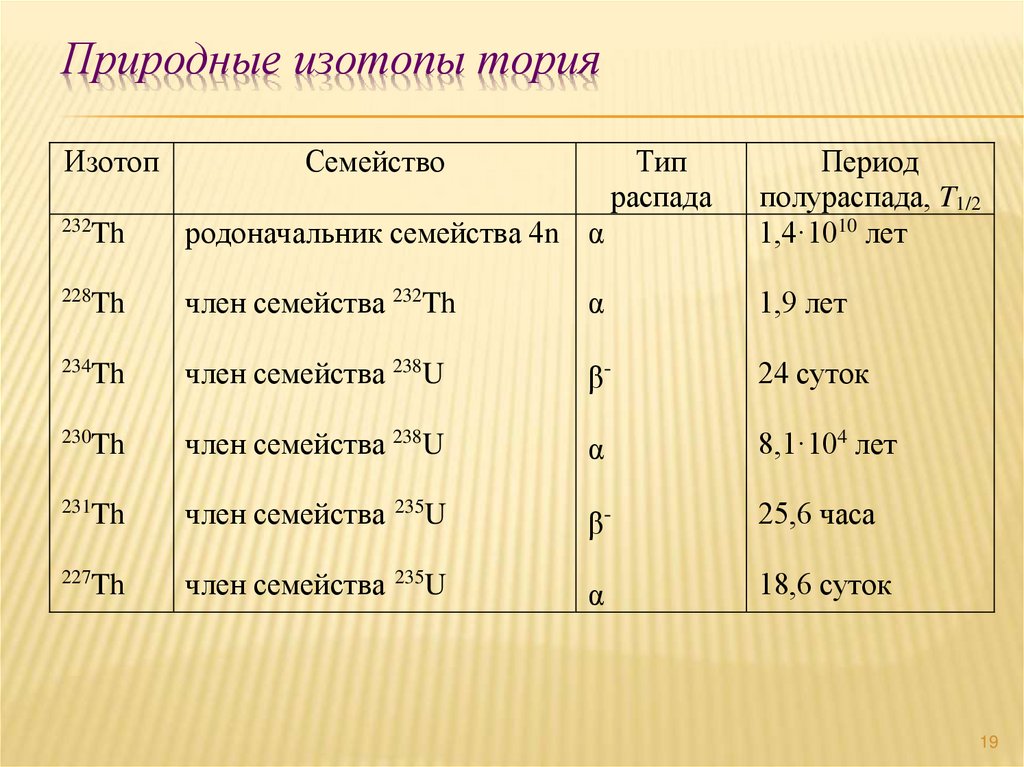
19. Природные изотопы тория
ИзотопСемейство
Тип
распада
232
Th
родоначальник семейства 4n α
Период
полураспада, T1/2
1,4·1010 лет
228
Th
член семейства 232Th
α
1,9 лет
234
Th
член семейства 238U
β-
24 суток
230
Th
член семейства 238U
α
8,1·104 лет
231
Th
член семейства 235U
β-
25,6 часа
227
Th
член семейства 235U
α
18,6 суток
19
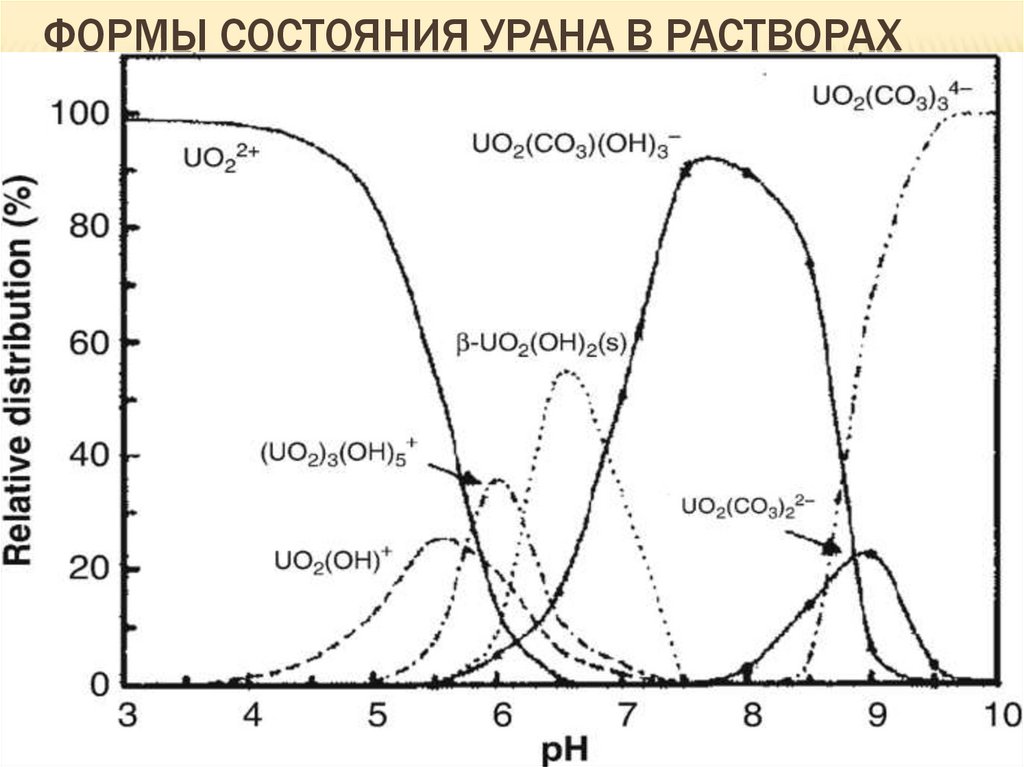
20. Уран
U проявляет +4, +6.Химические свойства урана в разных степенях окисления различны.
Радиусы ионов по Белову и Бокию, Å:
U4+ 0,95
U6+ 0,83
Самая устойчивая степень окисления +6. Ион U4+ в чистом виде не
встречается, так как сильно гидролизован:
U4+ + 2H2O → U(OH)3+ + H3O+.
Гидролиз в кислых растворах подавляется. U со степенью окисления
+4 образует в растворе полиядерные продукты гидролиза, плохо
растворимые => присутствует в донных отложениях.
В природных растворах U присутствует только в степени окисления
+6 в виде иона уранила ( UO22+ ). Он стабилен при рН=2,5, при
больших значениях рН идет гидролиз.
20
21. Формы состояния урана в растворах
ФОРМЫ СОСТОЯНИЯ УРАНА В РАСТВОРАХ21
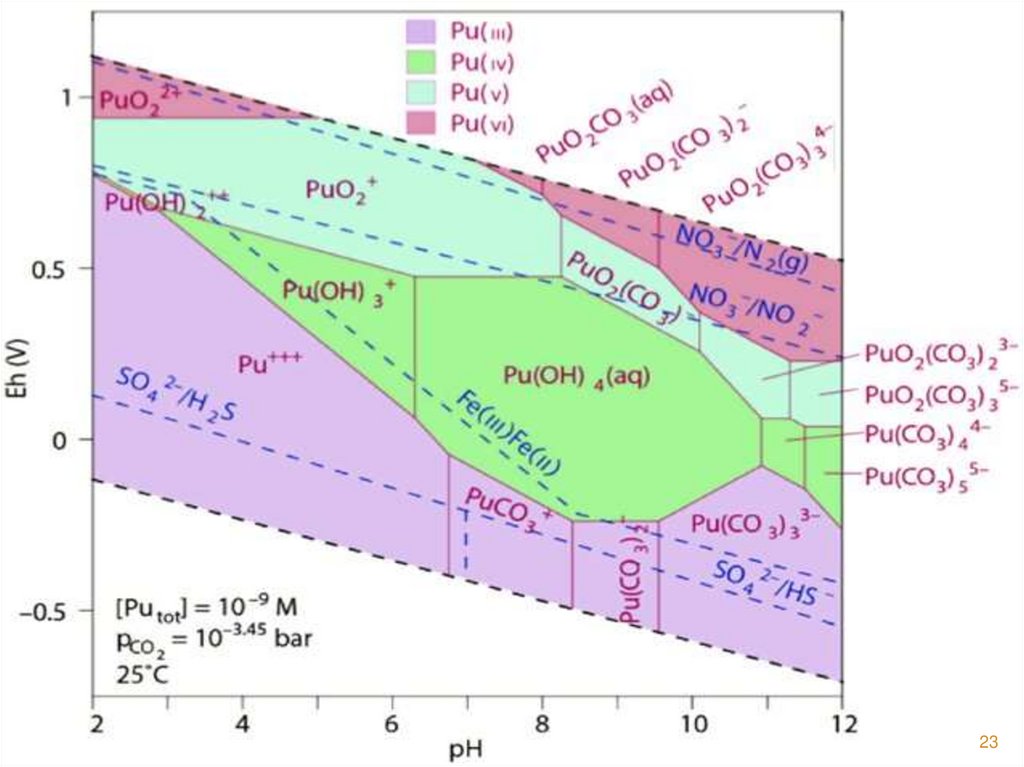
22. Плутоний
Получен синтетическим путем.В водных растворах проявляет ст. окисления: +3, +4, +5, +6, +7 (Pu7+
получен в щ. ср.).
Имеет многообразные химические свойства.
Радиусы ионов по Белову и Бокию, Å:
Pu4+ 0,86
U4+ 0,95;
Th4+ 0,95.
В растворе присутствуют: Pu3+, Pu4+, PuO2+, PuO22+.
Ион PuO2+ обладает малой способностью к гидролизу
и комплексообразованию.
При рН 3,6 в растворе существует PuO22+ .
Устойчивость комплексов убывает в ряду:
Ме4+ > MeO22+ > Me3+ > MeO2+.
Более устойчивы комплексы Pu4+, менее устойчивы – МеО2+ .
22
23.
2324. Тугоплавкие металлы
Zr, Nb.имеют высокую Тпл и практически не летучи.
Радиусы ионов по Белову и Бокию , Å:
Zr4+ - 0,82
Nb5+ - 0,66
Генетически связанная пара радионуклидов 95Zr – 95Nb.
Выход при делении с учетом выхода предшественников по цепочке
составляет 6,5 %. Тип распада: -, γ.
Энергия излучения:
Zr - Е γ = 0,72 МэВ; 0,76 МэВ; Е - = 0,364 МэВ; 0,397МэВ;
Nb - E γ = 0,77МэВ; Е - = 0,1597 МэВ.
95
40
Zr
β
63,8сут.
95
41
Nb
β
35,1сут.
95
42
Mo стаб.
24
25. Благородные металлы
Мо, Тс, Ru, Rh, Pd.Ru – переходный металл, расположен в VIII группе.
Cт. окисления +4 (в NO3-, SO42- и Cl- растворах),
в восстановит. ср. может быть: +3 и +2.
В окислит. ср. образует - RuO3 и RuO4, => распространение на
большие расстояния и загрязнение окружающей среды.
выход 6 % и Т1/2 = 1,01 года = 368,2 сут., является - излучателем с энергией Е - = 0,039 МэВ, дочерний изотоп
родия 106Rh распадается испуская γ-излучение.
106Ru имеет
103Ru имеет период полураспада
Т1/2 = 39,3 дней.
25
26. Галогены
летучие элементы VII группы, очень активны химически,растворимы в воде.
ПД образуются при ядерных испытаниях и работе реакторов:
129I (T
7 лет);
=
1,57
·
10
1/2
131I (T
1/2 = 8 дней), тип распада и γ.
Специфика йода состоит в многообразии образуемых им
соединений: I2, летучих органических йодидов, в виде
абсорбированного на твердых частицах.
Химически реагирует с другими элементами, образуя летучие
соединения, например, CsI. Cт. окисления: –1, 0, +1, +5, +7.
I концентрируется в щитовидной железе, причем поглощение его
растворимых форм происходит через кожу, легкие и
пищеварительный тракт.
26
27. Благородные газы
Ar, Kr, Xe, Rn.Благородные газы – бесцветные, безвкусные, за исключением Xe,
химически инертны. Из-за химической инертности
радиоактивных благородных газов (РБГ) существуют трудности в
их улавливании, а подвижность в атмосфере приводит к
загрязнению окружающей среды.
Растворимость РБГ понижается в ряду
Rn > Xe > Kr > Ar ,
и возрастает с понижением температуры.
27
28. Благородные газы
133Xe (Т1/2 = 5,27 сут)
135Xe (Т
1/2 = 9,14 ч),
88Kr (Т
1/2 = 2,8 ч),
87Kr (Т
1/2 = 76 мин),
85Kr (Т
1/2 = 10,76 года) => обусловлено долговременное
загрязнение атмосферы
28
29. Благородные газы
Выход 133Xe при делении ~ 6,6 %, тип распада – - , γ.Если в реакторе образуется 137Xe, то попадая в биосферу, он
распадается:
137
Xe 137Cs.
Вследствие этого может происходить долговременное
загрязнение больших территорий изотопом 137Cs.
41Ar –
активационного происхождения, образуется при захвате
нейтрона ядром 40Ar. Его содержание в выбросах невелико, не
превышает 0,3 % общей активности.
29
30. Изотоп углерода - 14C и тритий
14С и 3Hотносятся к активационным газам.
Накопление 3H и 14С в окружающей среде обусловлено
естественными и искусственными процессами.
3H (Т
1/2 = 12,43 года), , Е max = 0,018 МэВ:
3
1
H 23 He + β ( 23 He – изотоп гелия).
14С
(Т1/2 = 5600 лет) при выбросах окисляется до 14СО2 и
включается в процесс фотосинтеза => накапливается в живом
веществе и продуктах его разложения, распределяться между
компонентами экосистем.
14С особенно опасен тем, что входит в строение молекул гена.
30






















 physics
physics








