Similar presentations:
Координационные соединения железа
1. КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ ЖЕЛЕЗА
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙУНИВЕРСИТЕТ
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ
ЖЕЛЕЗА
Студент 1 курса специальности
«Химия»
Бинда Владислав Валерьевич
Научный руководитель:
ассистент кафедры
неорганической химии
Якубовская З.А.
2.
Цель работы:• Систематизация знаний, касающихся координационных соединений
железа
• Синтез комплексного соединения K3[Fe(C2O4)3]
Актуальность работы:
• Аналитическая химия – качественные реактивы
• Медицина – препараты железа
2
3.
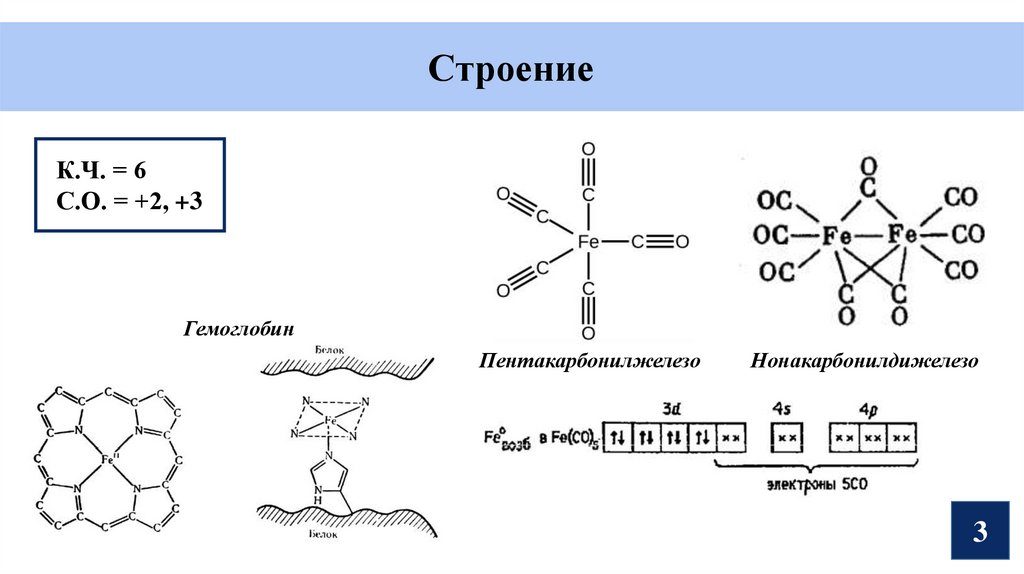
СтроениеК.Ч. = 6
С.О. = +2, +3
Гемоглобин
Пентакарбонилжелезо
Нонакарбонилдижелезо
3
4.
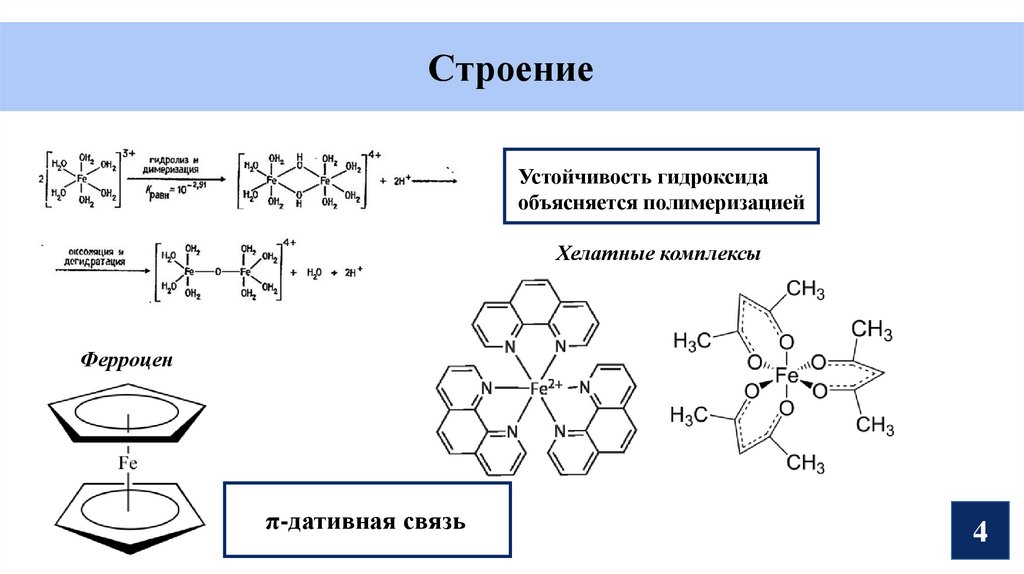
СтроениеУстойчивость гидроксида
объясняется полимеризацией
Хелатные комплексы
Ферроцен
π-дативная связь
4
5.
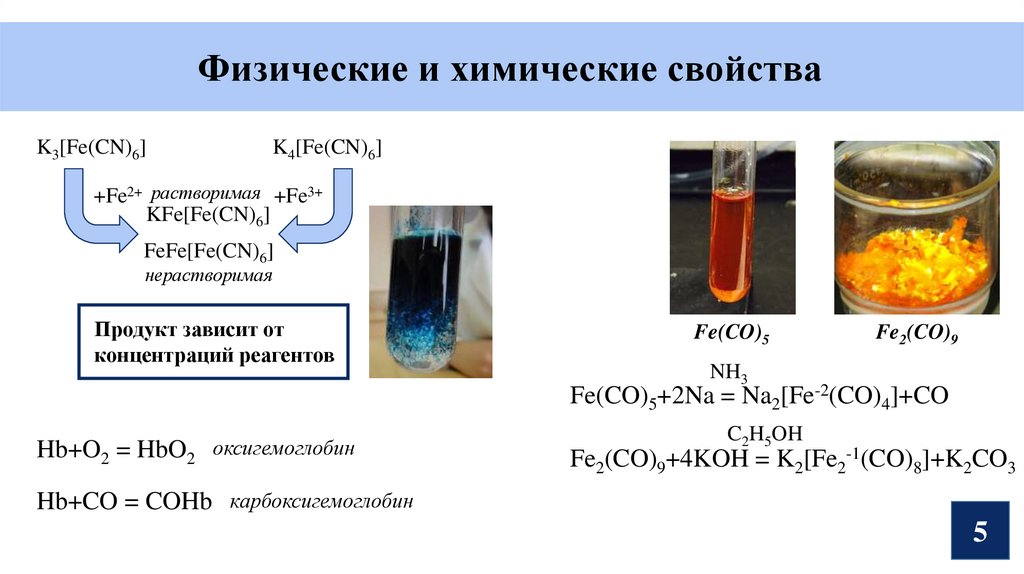
Физические и химические свойстваK3[Fe(CN)6]
K4[Fe(CN)6]
+Fe2+ растворимая +Fe3+
KFe[Fe(CN)6]
FeFe[Fe(CN)6]
нерастворимая
Продукт зависит от
концентраций реагентов
Fe(CO)5
Fe2(CO)9
NH3
Fe(CO)5+2Na = Na2[Fe-2(CO)4]+CO
Hb+O2 = HbO2
оксигемоглобин
C2H5OH
Fe2(CO)9+4KOH = K2[Fe2-1(CO)8]+K2CO3
Hb+CO = COHb карбоксигемоглобин
5
6.
Физические и химические свойства6[Fe(phen)3]2++BrO3-+6H+ = 6[Fe(phen)3]3++Br-+3H2O Увеличение pH способствует
протеканию обратной реакции
hυ
Катион ферроцения
2K3[Fe+3(C2O4)3] = 2K2[Fe+2(C2O4)2]+K2C2O4+2CO2
2Fe(cp)2+H2O2 = 2Fe(cp)2++H2O
Ферроцен способен
возгоняться в
инертной атмосфере
6
7.
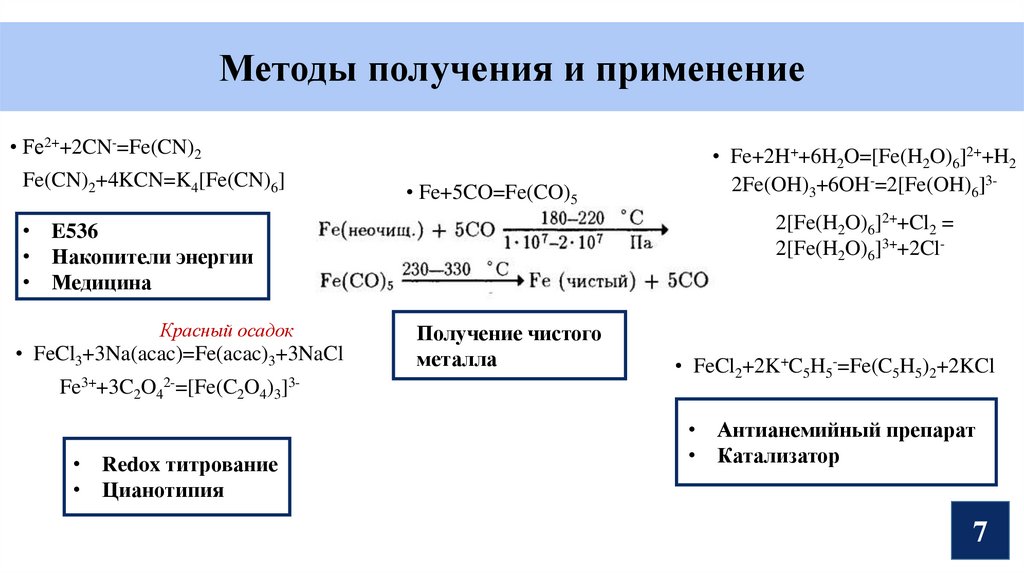
Методы получения и применение• Fe2++2CN-=Fe(CN)2
Fe(CN)2+4KCN=K4[Fe(CN)6]
• Fe+5CO=Fe(CO)5
2[Fe(H2O)6]2++Cl2 =
2[Fe(H2O)6]3++2Cl-
• E536
• Накопители энергии
• Медицина
Красный осадок
• FeCl3+3Na(acac)=Fe(acac)3+3NaCl
Fe3++3C2O42-=[Fe(C2O4)3]3• Redox титрование
• Цианотипия
• Fe+2H++6H2O=[Fe(H2O)6]2++H2
2Fe(OH)3+6OH-=2[Fe(OH)6]3-
Получение чистого
металла
• FeCl2+2K+C5H5-=Fe(C5H5)2+2KCl
• Антианемийный препарат
• Катализатор
7
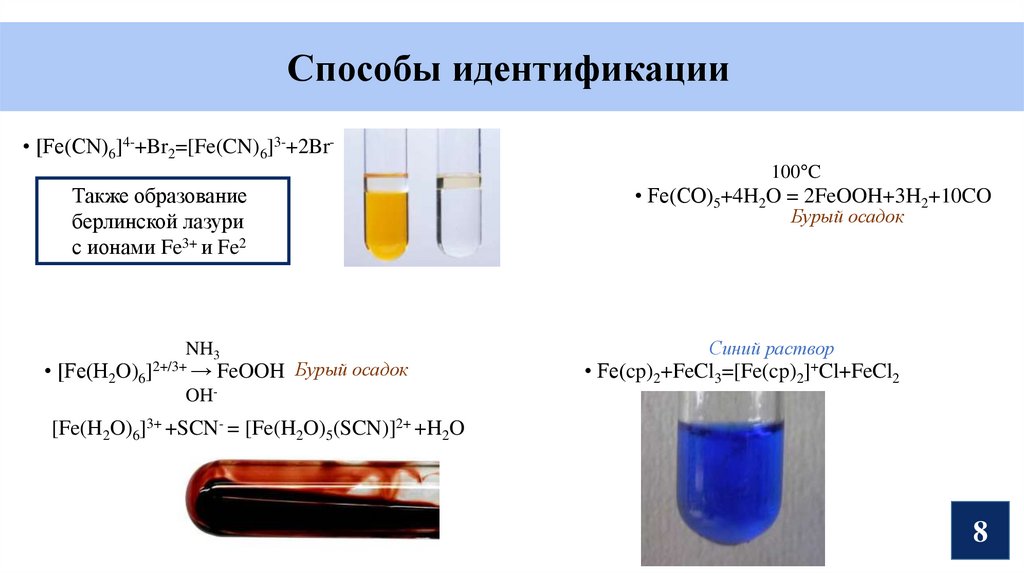
8.
Способы идентификации• [Fe(CN)6]4-+Br2=[Fe(CN)6]3-+2Br100°C
Также образование
берлинской лазури
с ионами Fe3+ и Fe2
NH3
• [Fe(H2O)6]2+/3+ → FeOOH Бурый осадок
• Fe(CO)5+4H2O = 2FeOOH+3H2+10CO
Бурый осадок
Синий раствор
• Fe(cp)2+FeCl3=[Fe(cp)2]+Cl+FeCl2
OH-
[Fe(H2O)6]3+ +SCN- = [Fe(H2O)5(SCN)]2+ +H2O
8
9.
Синтез K3[Fe(C2O4)3]Для изготовления насыщенных растворов
солей растворяют K2C2O4·H2O и
FeCl3·6H2O в воде для получения
насыщенных растворов. Смешивают в
затемненной колбе и для кристаллизации
помещают в эксикатор над серной
кислотой. Кристаллы отфильтровывают,
промывают небольшим количеством
холодной воды и высушивают над серной
кислотой в эксикаторе.
FeCl3+3K2C2O4 = K3[Fe(C2O4)3]+3KCl
9
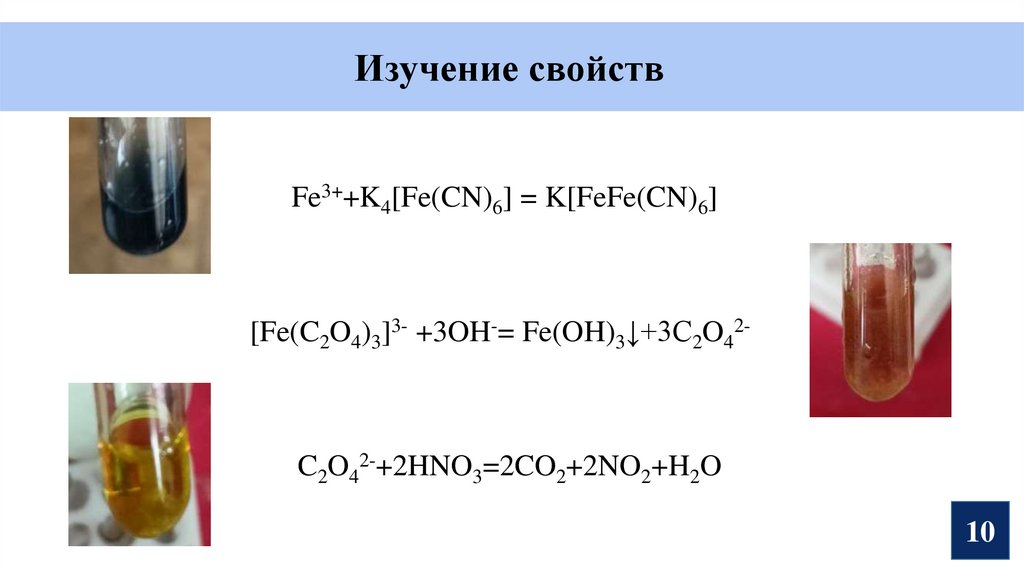
10.
Изучение свойствFe3++K4[Fe(CN)6] = K[FeFe(CN)6]
[Fe(C2O4)3]3- +3OH-= Fe(OH)3↓+3C2O42-
C2O42-+2HNO3=2CO2+2NO2+H2O
10
11.
Выводы1) Комплексы железа характеризуются различными особенностями
структуры
2) Химические свойства сильно зависят от типа лигандов
3) Играют важную роль в аналитической химии и современных
технологиях
11
12.
Список литературных источников1. Ахметов, Н. С. Общая и неорганическая химия : учеб. пособие / Н. С. Ахметов. – 8-е изд. – СПб. : Лань,
2024. – 752 с.
2. Спицын, В. И. Неорганическая химия: учеб. пособие / В. И. Спицын, Л. И. Мартыненко. – М. : Изд-во
МГУ, 1994. – 624 с.
3. Гринвуд, Н. Химия элементов: в 2 т. Т. 2 / Н. Гринвуд, А. Эрншо; пер. с англ. Л. Ю. Аликберовой [и др.]. М.: БИНОМ. Лаборатория знаний, 2008. – 667 с.
4. Степин, Б. Д. Неорганическая химия: учеб. пособие / Б. Д. Степин, А. А. Цветков. – М. : Высш. шк., 1994.
– 608 с.
5. Коттон, Ф. Современная неорганическая химия. Химия переходных элементов: в 3 ч. Ч. 3 / Ф. Коттон,
Дж. Уилкинсон; пер. с англ. М. Н. Варгафтика; под ред. М. Е. Дяткиной. – М. : Мир, 1969. – 592 с.
6. Задачи, вопросы и упражнения по общей и неорганической хмиии / В. В. Свиридов, Г. А. Попкович, Г. И.
Васильева, Ю. О. Афанасьева – 3-е изд., перераб. и доп. – Минск: «Университетское», 1991. – 350 с.
7. Третьяков, Ю. Д. Неорганическая химия : в 3 т. / под ред. Третьякова Ю. Д. Т. 3: Химия переходных
элементов, кн. 2: учебник для студ. высш. учеб. заведений / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф.
М. Спиридонов – М. : Изд. центр «Академия», 2007. – 400 c.
8. Bernalite, Fe(OH)3, a new mineral from Broken Hill, New South Wales: Description and structure / W. D. Birch,
A. Pring, A. Reller, H. W. Schmalle // American Mineralogist. – 1993. – Vol. 78. – P. 827-832.
9. PubChem : [chemical database]. – [USA], 2021. – URL:
https://pubchem.ncbi.nlm.nih.gov/compound/139206713 (date of access: 28.05.2025).
13.
Список литературных источников10. Нельсон, Д. Основы биохимии Ленинджера: в 2 т. Т. 1 / Д. Нельсон, М. Кокс; пер. с англ. Т. П. Масловой;
под ред. А. А. Богданова. – М. : БИНОМ. Лаборатория знаний, 2011. – 592 с.
11. Re-evaluation of sodium ferrocyanide (E 535), potassium ferrocyanide (E 536) and calcium ferrocyanide (E 538)
as food additives / P. Aggett, F. Aguilar, R. Crebelli [et al.] // EFSA Journal. – 2018. – Vol. 16, № 7. – P. 18741900.
12. A review on hexacyanoferrate-based materials for energy storage and smart windows: challenges and
perspectives / A. Paolella, C. Faure, V. Timoshevskii [et al.] // J. Mater. Chem. A. – 2017. – № 36. – P. 1891918932.
13. Prussian blue as an antidote for radioactive thallium and cesium poisoning / M. Altagracia-Martinez, J. KravzovJinich, J. Martinez-Nunez [et al.] // Orphan Drugs: Research and Reviews. – 2012. – № 2. – P. 13-21.
14. Fiorito, P. A. A New Approach toward Cyanotype Photography Using Tris-(oxalato)ferrate(III): An Integrated
Experiment / P. A. Fiorito, A. S. Polo // J. Chem. Educ. – 2015. – Vol. 92, № 10. – P. 1721-1724.
15. Третьяков, Ю. Д. Неорганическая химия : в 3 т. / под ред. Третьякова Ю. Д. Т. 2: Химия непереходных
элементов : учебник для студ. высш. учеб. заведений / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М.
Спиридонов – М. : Изд. центр «Академия», 2004. – 368 c.
16. Руководство по неорганическому синтезу : учеб. пособие для вузов / И. Г. Горичев, Б. Е. Зайцев, Н. А.
Киприянов [и др.]. – М. : Химия, 1997. – С. 313-314.
17. Химия ферроцианидов / И. В. Тананаев, Г. Б. Сейфер, Ю. Я. Харитонов, В. Г. Кузнецов [и др.]. – М. :
Наука, 1971. – 320 с.







 chemistry
chemistry








