Similar presentations:
Железо, его соединения
1.
Железо,его соединения
2.
3.
Особенности строенияатома
Fe
2
26Fe
8 14 2
2ē, 8ē, 14ē, 2ē
26 протонов
4.
Особенности строенияатома
26Fe
2ē, 8ē, 14ē, 2ē
Fe0 - 2ē → Fe+2
Fe0 - 3ē → Fe+3
26 протонов
5.
Железо – простое веществоБлестящий серебристо-белый металл.
Температура плавления 1539 0С.
Плотность железа 7,87 г/см3.
Железо пластичное и ковкое.
Обладает способностью намагничиваться и
размагничиваться.
6.
Содержание элементов вземной коре
кальций
железо
алюминий
кислород
остальные
Минералы
Магнитный железняк, или магнетит
Fe3O4
Красный железняк, или гематит
Fe2O3
Бурый железняк, или лимонит
2Fe2O3 · 3H2O
Железный колчедан, или пирит
Второе место по распространённости
FeS2
среди металлов.
Гидрокарбонат железа
Fe(HCO3)2
7.
Технически чистоежелезо
Низкоуглеродистая сталь,
содержащая 0,02-0,04% углерода.
Небольшое содержание
кислорода, серы, азота и фосфора.
Химически чистое
железо
Почти не корродирует.
8.
«Железо» ― это«капнувший с неба,
небесный»
9.
Метеорит массой 60 тМетеорит массой 30 т
10.
11.
ЖелезоОснова техники и
машиностроения
Способно
изменять свои
технические
характеристики
Широко
используют чугун
и сталь.
Оксид железа
(III) используют
для получения
красителей
12.
Получение:t
2Fe2O3 + 3C = 4Fe + 3CO2
t
Fe2O3 + 3CO = 2Fe + 3CO2
Восстановление углём
Восстановление оксидом
углерода (II)
t
Fe2O3 + 3H2 = 2Fe + 3H2O
t
Fe2O3 + 2Al = 2Fe + Al2O3
Восстановление водородом
Восстановление алюминием
13.
Химические свойства:Степень окисления +3
Степень окисления +2
0
2ē
0 t +2-2
0
Сульфид
железа (II)
0
8ē
0
t +3 -1
2Fe + 3Br2 = 2FeBr3
Fe + S = FeS
Восст-ль Ок-ль
3ē
Восст-ль Ок-ль Бромид
железа (III)
0
t
+2
+3
3Fe + 2O2 = Fe3O4 (FeO · Fe2O3)
Восст-ль Ок-ль Железная
окалина
14.
Химические свойства:Степень окисления +2, +3
0
8ē
+1
0
t
3Fe + 4H2O = Fe3O4 + 4H2↑
Восст-ль Ок-ль Железная
окалина
Степень окисления +2
0
2ē
+2
+2
2ē
+1
+2
0
Fe + 2HCl = FeCl2 + H2↑
Восст-ль Ок-ль Хлорид
железа (II)
H2SO4 (конц.)
0
Fe + CuSO4 = FeSO4 + Cu
Восст-ль Ок-ль
Степень окисления +2
HNO3 (конц.)
15.
FeO → Fe(OH)21
2
3
Fe → FeCl2 → Fe(OH)2 → FeO
1) Fe + 2HCl = FeCl2 + H2↑
2) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
t
3) Fe(OH)2 = FeO + H2O
16.
FeO и Fe(OH)2 обладают основными свойствамиFeO + 2H+ = Fe2+ + H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
t
Fe2O3 + CO = 2FeO + CO2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
17.
Fe2O3 → Fe(OH)31
2
3
Fe → FeCl3 → Fe(OH)3 → Fe2O3
t
1) 2Fe + 3Cl2 = 2FeCl3
2) FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
t
3) 2Fe(OH)3 = Fe2O3 + 3H2O
18.
Fe2O3 и Fe(OH)3 проявляют слабовыраженныеамфотерные свойства
Реакции с кислотами
t
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
NaFeO2 — феррит натрия
Реакции с основаниями
t
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
t
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
19.
FeCl2 + 2КOH = Fe(OH)2↓ + 2КClFe2+ + 2OH- = Fe(OH)2↓
FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
Fe3+ + 3OH- = Fe(OH)3↓
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
20.
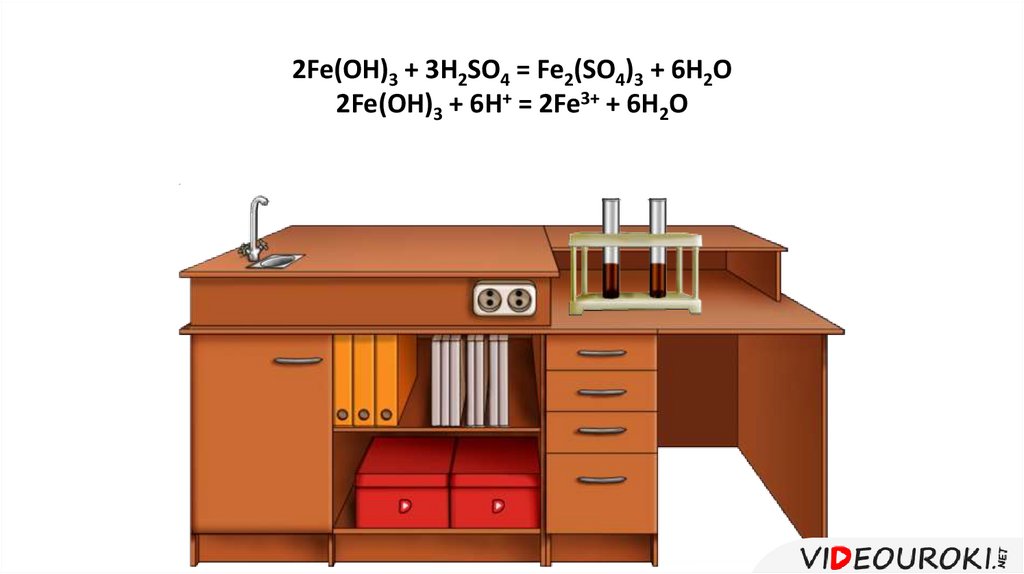
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
21.
FeSO4 · 7H2OЖелезный купорос
22.
Распознавание соединенийжелеза (II)
K4[Fe(CN)6]
K3[Fe(CN)6]
Красная кровяная соль
K3[Fe(CN)6]
FeCl2 + K3[Fe(CN)6] =
KFe[Fe(CN)6]↓ + 2KCl
Распознавание соединений
железа (III)
Жёлтая кровяная соль
K4[Fe(CN)6
FeCl3 + K3[Fe(CN)6] =
KFe[Fe(CN)6]↓ + 2KCl
23.
Распознавание соединенийжелеза (III)
KSCN
NH4SCN
Роданид калия
Роданид аммония
KSCN
Fe3+ + SCN- ↔ FeSCN2+
24.
FeМассовая доля железа в животных организмах составляет около
0,01%.
Fe
В организме человека содержится около 5 г железа.
Fe
Соединения железа применяют при лечении малокровия,
истощении, упадке сил.
Fe
Суточная потребность человека в железе составляет около 0,015 г.
























 chemistry
chemistry