Similar presentations:
Иммуногистохимические методы исследования
1.
12.
История методаАкад. Н.А. Краевский: «Вот бы создать такую краску,
которая отличала бы злокачественную опухоль от
доброкачественной!», 1978 г.
2
3.
Историяметода
Гистохимия,
раздел гистологии, изучающий локализацию различных
химических веществ и продуктов их метаболизма в тканях. Некоторые методы
окрашивания позволяют выявлять в клетках те или иные химические вещества.
Возможно дифференциальное окрашивание жиров, гликогена, нуклеиновых
кислот, нуклеопротеинов, определенных ферментов и других химических
компонентов клетки.
Подобраны красители, флуорохромы и ферменты, которые можно
присоединить к специфическим иммуноглобулинам (антителам) и, наблюдая
связывание этого комплекса в клетке, идентифицировать клеточные структуры.
Эта область исследований составляет предмет иммуногистохимии.
3
4.
Иммуногистохимия—
морфологической диагностики
современный
метод
Термин «иммуногистохимия» образован из трех составляющих,
указывающих на три медико-биологические дисциплины — иммунологию,
гистологию и химию, которые послужили основой для этого нового научного
направления.
Иммуногистохимиическое
исследование
метод
микроскопического исследования тканей, обеспечивающий наиболее
специфическое выявление в них искомых веществ и основанный на обработке
срезов
маркированными
специфическими
антителами
к
выявляемому веществу, которое в данной ситуации служит антигеном.
Иммуногистохимия – это метод выявления точной локализации того или
иного клеточного или тканевого компонента (антигена) благодаря связыванию
его меченными антителами
4
5.
Основныезадачи
современном этапе:
иммуногистохимии
на
1) разработка
и
теоретическое
обоснование
новых
методов
молекулярного анализа внутриклеточных структур.
2) изучение продуктов экспрессии генов,
3) изучение пролиферации и гибели клеток,
4) гисготипирование опухолей (часть молекулярной и клеточной
диагностики),
5) методическое обеспечение иммуноморфологии — области гистологии,
в которой используются иммуногистохимические методы для изучения
тканевой организации, развития тканей и клеточной дифференциации.
5
6.
6Основные
задачи
иммуногистохимии
на
современном этапе:
6) При исследовании опухолей человека с целью определения гистогенеза
недифференцированных опухолевых образований, отдаленных метастазов;
— для дифференцировки различных тканевых компонентов, составляющих
комплексные опухоли;
— с целью прогностической оценки дальнейшего течения заболевания;
— при назначении терапии;
— при эмбриональном развитии;
— при воспалении;
— при репаративной регенерации.
7.
Основныезадачи
иммуногистохимии
на
современном этапе:
7) охарактеризовать острые и хронические лейкозы, лимфогранулематоз и
различные
типы
неходжкинских
лимфом,
эпителиальные,
нейроэктодермальные, мезенхимальные опухоли.
8) оценить органоспецифичность отдаленных метастазов:
9) с помощью антител к PSA выявить рак простаты;
10) выявление в опухолевой ткани рецепторов к эстрогенам и прогестерону
позволяет сделать предположение о метастазе из молочной железы
или эндометрия;
11) с помощью антител к тиреоглобулину выявить опухолевые клетки
фолликулярного рака щитовидной железы.
12) определение органной принадлежности метастазов с помощью антител
к различным цитокератинам.
7
8.
иммуногистохимиина
13) С целью прогностической оценки заболевания, предсказания
«биологического поведения» опухоли, появления метастазов,
эффективности терапии проводят исследование:
― пролиферативной активности (Ki-67),
― выраженности ангиогенеза,
― определение рецепторов факторов роста,
― выявление рецепторов к стероидным гормонам,
― выявление степени анаплазии клеток мутантный белок гена p53
― ИГХ методы позволяют определить чувствительность опухоли к
различным химиопрепаратам
8
Основные
задачи
современном этапе:
9.
История методаИммуногистохимическое исследование (ИГХ).
― В основе ИГХ лежит специфическое взаимодействие тканевых и клеточных
антигенов человека со специально полученными антителами, несущими
на себе разнообразные метки.
― ИГХ-методами можно изучать самые различные молекулы, рецепторный
аппарат клетки, гормоны, ферменты, иммуноглобулины и др.
― Изучая конкретные молекулы, ИГХ позволяет получить информацию о
функциональном
состоянии
клетки,
ее
взаимодействии
с
микроокружением,
определить
фенотип
клетки,
установить
принадлежность клетки к определенной ткани, что имеет решающее
значение в диагностике опухолей, оценке дифференцировки клеток и
гистогенеза.
― ИГХ
служит
также
для
оценки
экспрессии
клеточных
генов
по
9
10.
Историяметода
Основателем нового направления в науке и диагностике и автором
первых методов иммуноцитохимии по праву считают американского
врача-патолога и иммунолога Альберта Хьюитта Кунса (1912—1978).
Под его руководством в 1941г. были впервые получены меченные
флюорохромом антитела, которые были успешно применены в
диагностических целях на замороженных срезах.
10
11.
Историяметода
― Визуализация результатов реакции производилась во флуоресцентном
микроскопе. Однако сначала метод не получил широкого распространения
из-за трудности получения антител, сложности их визуализации и низкой
воспроизводимости результатов.
― Дальнейшие успехи развития иммуногистохимии были связаны с
созданием
пероксидаза-антипероксидазного
метода,
значительно
повысившего чувствительность реакции, и методов выявления антигенов в
фиксированной формалином и заключенной в парафин ткани.
11
12.
Историяметода
В 1975г. Kohleri Milstein разработали принципиально новый способ
получения антител -«метод моноклональных антител» («гибридомная
технология»), который основан на методе гибридизации соматических клеток.
Так появилась возможность получать в большом количестве «чистые»
популяции иммуноглобулинов, как высоко чувствительных биологических
маркеров опухолевых и др. клеток и их компонентов.
12
13.
Историяметода
В России первые иммуногистохимические работы были выполнены в 60-70
годах прошлого века.
1. В 1960 г. – лаборатория акад. Л.А.Зильбера в НИИ микробиологии впервые в
стране применила метод Кунса.
2. 1961-1964 гг. — метод Кунса применён для исследования сосудов в НИИ
морфологии человека В.С. Рукосуевым и Н.А. Пробатовой
3. в 1972-1974 гг. – работы В.Н. Денисова по использованию поликлональных
антител для исследования опухолей мягких тканей (из лаборатории Н.Т.
Райхлина, ВОНЦ им. Н.Н. Блохина)
4. В 1991 .г – выполнены работы М.В. Угрюмова по исследованию ЦНС
13
14.
Историяметода
— В начале 80-х годов был создан для повседневной диагностики опухолей
ряд отечественных моноклональных антител (в Москве, в лабораториях
профессоров А.Ю. Барышникова и Ю.М. Васильева, затем Е.Б. Мечетнера
и А.В. Филатова).
— В отделе иммуноцитохимии Института экспериментальной патологии,
онкологии и радиобиологии им. Р. Е. Кавецкого Национальной Академии
Наук Украины в период с 1983 по 1991 гг. С.П. Сидоренко и Е.П.
Ветровой были получены моноклональные антитела серии «ИПО»
(институт проблем онкологии), среди них наиболее известные - к антигенам
CD95, CD150, ИПО-38.
14
15.
Историяметода
— В Санкт-Петербурге первые иммуногистохимические исследования начались
в 1983 г.
— Более широкое развитие они получили в середине 90-х годов, когда
практическое значение приобрело иммуногистохимическое определение
рецепторов эстрогенов и прогестерона при раке молочной железы.
— В это же время была значительно расширена панель антител для
гистогенетической диагностики сарком мягких тканей и злокачественных
лимфом.
— С конца 90-х годов в лаборатории иммуногистохимические методики
использовались практически при всем разнообразии опухолей.
15
16.
АнтигенАнтитело
-
17.
Антиген
В основе любой иммунологической реакции лежит взаимодействие
антигена с анти телом, которое приводит к формированию комплекса
«антиген-антитело».
Антиген— это любое вещество, которое при попадании в ткани
восприимчивого организма вызывает иммунный ответ, в результате
которого формируются специфические антитела, которые затем связываются
с антигеном.
Антигенами обычно являются высокомолекулярные белки и полисахариды,
реже - полипептиды, липиды и нуклеиновые кислоты.
17
18.
Антиген - АнтителоВ 1897 году Пауль Эрлих впервые
озвучил
гипотезу
образования
антител, получившую название теории
«боковых цепей»
Эрлих полагал, что антитело — это
особый вид молекул, расположенных
в виде рецепторов («боковых цепей»)
на поверхности клеток. Боковые цепи
благодаря
своей
особой
комплементарной конфигурации, то
есть
полностью
соответствующей
молекуле
антигена,
способны
взаимодействовать с ней по принципу
«ключ—замок»,
причем
Пауля Эрлиха (1854–
1915)
19.
АнтителоАнтитела—это растворимые гликопротеины глобулиновой фракции сыворотки
крови, образующиеся в ответ на введение или проникновение антигена (чужеродных веществ, в том числе бактерий, вирусов, токсинов) в организм
теплокровных.
Антитела являются наиболее важными реагентами для использования в
фундаментальных и прикладных исследованиях, что обусловлено их
способностью к высокоспецифическому связыванию с антигеном, вызвавшим
их образование. Применяя определенные методические приемы, можно
добиться образования антител к практически неограниченному набору антигенов.
Антитела принадлежат к группе белков, называемых иммуноглобулинами (Ig),
которые присутствуют в крови иммунизированных животных.
Для сбора фракции сыворотки, которую часто называют антисывороткой, из
крови удаляются клетки и фибрин. Существует пять основных классов
19
20.
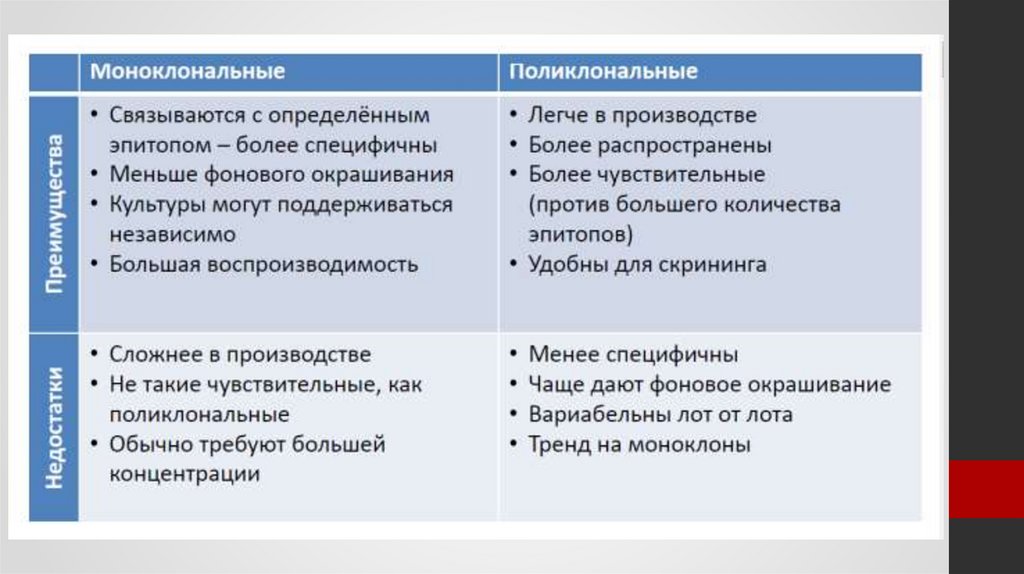
Классификация антител1.
По
способу
получения:
А).
Поликлональные
антитела (ПКАТ): Специфично
связываются с белком, которым
было
иммунизировано
лабораторное животное, но с
различными
участками
(эпитопами) этого белка.
Б).
Моноклональные
антитела (МКАТ): Специфично
связываются лишь с одним
эпитопом
антигена,
имеют
одинаковое
молекулярное
строение
и
обладают
одинаковой специфичностью.
2.
По
видовой
животного:
А). кроличьи,
Б). мышиные
и т.д.
принадлежности
3. По форме:
А).
Готовые
использованию (RTU)
Б). Концентрированные
к
20
21.
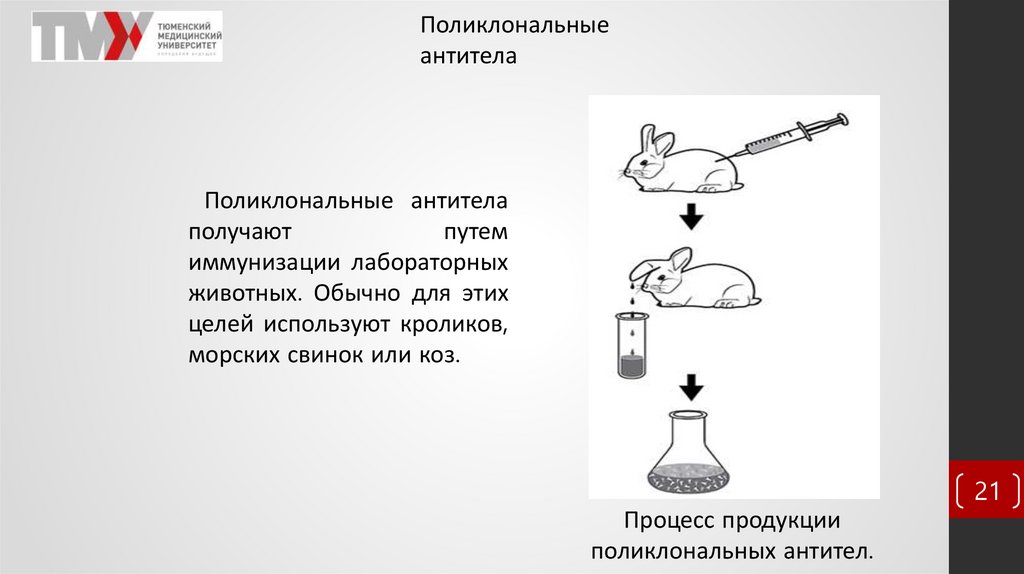
Поликлональныеантитела
Поликлональные антитела
получают
путем
иммунизации лабораторных
животных. Обычно для этих
целей используют кроликов,
морских свинок или коз.
21
Процесс продукции
поликлональных антител.
22.
Получение антителМоноклональные антитела получают с помощью метода гибридомной
технологии (1975г. Kohleri Milstein) . Гибридомы - это клоны - продуценты
моноклональных антител.
1. Для их получения лабораторные животные подвергаются иммунизации,
затем из их селезенки выделяют иммунные В-лимфоциты (клетки,
способные к продукции специфических клонов антител).
2. Иммунные В-лимфоциты соединяют с клетками миеломы, которые сами
не могут производить специфические антитела, но способны к
неограниченному размножению in vitro. (Клетки миеломы для гибридомной
технологии берут из клеточной линии множественной миеломы человека).
3. Отобранные клетки вводят в брюшную полость мышей, где гибридома
размножается, подобно раковым клеткам материнской миеломы, секретируя
антитела во внутриполостную жидкость с образованием асцита.
22
23.
Моноклональныеантитела
― Благодаря высокой специфичности моноклональные антитела являются
первичными антителами, то есть антителами для выявления искомого
антигена, так как они дают слабое неспецифическое связывание, а значит, и
меньшее фоновое окрашивание.
― По сравнению с поликлональными антителами они обладают большей
гомогенностью, что обеспечивает высокую воспроизводимость результатов.
― Однако связывание с единственным эпитопом обусловливает низкую
чувствительность, проявляющуюся в слабом иммуноокрашивании на
срезах.
― Высока вероятность того, что фиксатор сделает этот единственный эпитоп
недоступным для антител, в результате чего иммуноокрашивания вообще
не произойдет.
― Методы получения моноклональных антител более сложные и трудоемкие,
чем методы получения поликлональных иммунных сывороток, что
23
24.
25.
Особенностиантигеном
Антитела,
реагирующие
с
одним
единственным эпитопом антигена, называют моноклональными.
Связывание с единственным эпитопом
обусловливает низкую чувствительность,
проявляющуюся
в
слабом
иммуноокрашивании на срезах.
Высока вероятность того, что фиксатор
сделает этот единственный эпитоп
недоступным для антител, в результате
чего иммуноокрашивания вообще не
произойдет.
связывания
антитела
с
25
26.
Особенностиантигеном
связывания
антитела
с
Большие
молекулы
антигена (например, белки)
имеют несколько эпитопов,
поэтому они стимулируют
образование
антител
нескольких видов к разным
эпитопам этого антигена.
Такие антитела называют
поликлональными.
26
27.
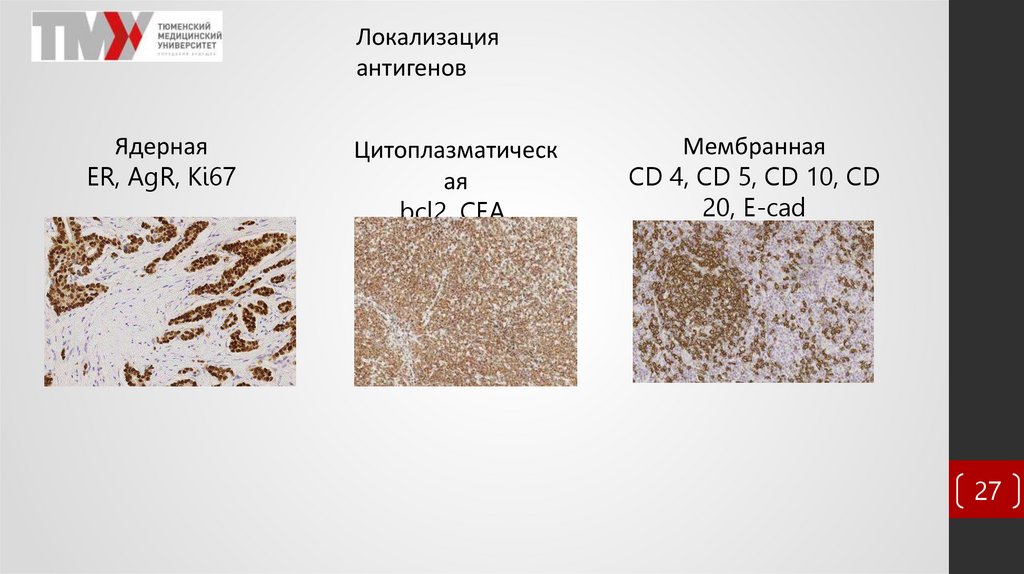
Локализацияантигенов
Ядерная
ER, AgR, Ki67
Цитоплазматическ
ая
bcl2, CEA,
faktorVIII
Мембранная
CD 4, CD 5, CD 10, CD
20, E-cad
27
28.
Этапы иммуногистохимическогоисследования
Преаналитическая стадия
— обработка формалином
— обработка декальцинацинирующими агентами
— высушивание препарата
Аналитическая стадия
— выбор панели маркеров
— выбор фрагмента, содержащего репрезентативный участок образования и
нормальную неизмененную фоновую ткань
Постаналитическая стадия
— предупреждение выдачи ошибочных и сомнительных результатов,
— выработка мер по их устранению;
— проверка квалифицированным специалистом результата анализа на
предмет его достоверности.
29.
1. Фиксация.―Лучшим фиксатором для белков клетки, является 10% нейтральный
забуференный формалин;
―В тех случаях, когда формалин использовать нельзя, используют спирт или
ацетон. В частности, антигены промежуточных филаментов лучше
выявлять на свежезамороженных срезах или тканях, фиксированных в
спиртах.
― Для определения виментина следует использовать жидкость Карнуа
―Объем фиксатора должен в 15-20 раз превышать объем фиксируемого
образца ткани.
―За 24 часа фиксатор проникает в плотную ткань на глубину 2-3 мм, в
пористую
ткань
–
5
мм.
Рекомендуется использовать кусочки тканей толщиной не более 3 мм.
Оптимальный срок фиксации – 6-8 часов для биопсийного материала и
24-48 (оптимально 24) часа для операционного.
29
Этапы иммуногистохимического исследования
1. Подготовка ткани
30.
302. Демаскировка антигенов:
1) Обработка
протеолитическими
ферментами,
способствующая
высвобождению участков антигена. Фермент протеиназа К. Применяется,
как правило, для цитокератинов и некоторых других клеточных антигенов.
2) Способ «освобождения» антигенов путем нагревания, при этом
отмечается усиление иммуногистохимической реакции на срезах,
фиксированных в формалине. Как правило, нагревание срезов проводят в
10 мМ цитратном буфере при рН 6,0. Высокотемпературная обработка
срезов приводит к разрушению метиленовых мостиков и открыванию
антигенов.
используют микроволновую печь ( для Cd20 и др.)
скороварки (Ki-67, р53),
водяную баню ( для HER2)
Иммуноавтостейнеры – «PT-модуль» фирмы Дако.
31.
313. Взаимодействие с антителами
Антитела, которые используются в иммунологических методиках,
получают путем повторной иммунизации различных животных (чаще
мышей, кроликов, крыс, овец, лошадей, коз и др.) определенным
антигеном. После выработки антител у иммунизированного животного
берут сыворотку крови и очищают ее от других сывороточных
протеинов, получая поликлональные антитела.
32.
324. Визуализация результатов реакции «антиген – антитело».
Антитела обладают свойством прочно связываться с тканевыми
антигенами, при этом не связанные антитела можно удалить отмыванием
срезов.
Окрашенные продукты реакции являются нерастворимыми, они оседают в
месте взаимодействия антител.
Для выявления образовавшегося в процессе реакции комплекса «антиген
– антитело», используют различные метки, связанные с Fc-фрагментом
антител: ферменты, флуорохромы, биотин, металлы.
33.
335. Блокировка эндогенной активности ферментов
1). Эндогенная активность пероксидазы.
Пероксидазная активность встречается во многих клетках организма:
эритроцитах (гемоглобин), миоцитах (миоглобин), макрофагах и
нейтрофилах (цитохромы), гепатоцитах и эпителии почек (каталаза). Для
нейтрализации эндогенной пероксидазной активности на срезы на 10
мин наносят 1-3% раствор перекиси водорода. Пероксидаза содержится
в большом количестве в нейтрофилах и эозинофилах, поэтому для
окраски мазков крови, костного мозга и иммунокомпетентных органов
использование этого фермента не рекомендуется.
2). Эндогенная активность щелочной фосфатазы.
Блокирование щелочной фосфатазы осуществляют 5 мМ раствором
левамизоля. ЩФ клеток кишечника и плаценты не ингибируется
левамизолом, лучше использовать другой фермент.
3). Эндогенная активность биотина
Биотин - витамин Н присутствует в печени, почках и др. органах. Для
предотвращения неспецифической реакции перед осуществлением
блокирования эндогенной пероксидазы проводят инкубацию срезов в
0,1% р-ре авидина, а затем в 0,01% растворе биотина в Трис-буфере
34.
1. Иммуногистохимия на парафиновых срезах.Образцы заключаются в парафин, режутся на микротоме и
помещаются на предметные стекла;
срезы освобождают от парафина,
проводят демаскирование
антигенов, блокируют неспецифическое связывание белков и
эндогенную пероксидазную активность и затем проводят
инкубацию с первичными антителами.
2. Иммуногистохимия на криостатных срезах.
Срезы толщиной 5 мкм помещают на покрытые поли-L-лизином
стекла и высушивают в течение 12 часов при комнатной
температуре. Срезы фиксируют, погружая в холодный ацетон -20 °С,
либо другой фиксатор (этиловый спирт, формалин и т.п.) на 2 мин.
Стекла высушивают на воздухе и проводят регидратацию в 1%
неиммунной бычьей сыворотке в солевом фосфатном буфере (PBS),
затем осуществляют иммуногистохимическую реакцию.
34
Этапы иммуногистохимического исследования
35.
• Прямой• Непрямой
• методы с использованием ферментных иммунных
комплексов
• авидин-биотиновые методы
35
Методы ИГХ
36.
36Прямой метод - разработан A.H. Coons, M.H. Kaplan (1950).
Меченые ФИТЦ (флуоресцеинизотиоцианатом) первичные антитела наносили
непосредственно на срезы. После инкубации несвязанные антитела смывали
фосфатным буфером и с помощью ультрафиолетового света выявляли места
локализации антигенов по зеленоватой флюоресценции (РИФ). До сих пор
используется при экспресс-анализе.
Недостаток метода:
• наличие флюоресцентного микроскопа при использовании флюоресцентного
красителя;
• проблема сопоставления иммуногистохимических реакций с
морфологическим строением препарата
37.
Первичные немеченые антитела наносят на срезы, их избыток смываетсябуфером. Затем наносятся вторичные меченые антитела к животномудонору первой антисыворотки. В этом случае первичные антитела,
связавшиеся с антигенами исследуемой ткани являются антигенами для
меченых вторичных антител. В качестве метки вторых антител
используются
флуоресцентные красители (флуоресцин, родамин),
ферменты (пероксидаза хрена), а также коллоидное золото.
37
Непрямой метод.
Был также описан A.H. Coons с соавт. (1955).
Этот метод более чувствителен, чем прямой. Особенность метода в том,
что первичные (специфические) антитела выявляются мечеными
вторичными антителами к иммуноглобулинам животного, у которого
выработаны первичные антитела.
Преимущества метода:
• Используется одно меченое антитело с большим количеством первых
антител, полученных от одного вида животного.
• Высокая чувствительность метода
38.
38Существует несколько вариантов непрямого метода
1. Не конъюгированный антигенно-ферментный метод – мостовая
методика.
Наносят первичные, вторичные и конечные антитела, которые не
конъюгируются с маркерами. В свою очередь, вторичные антитела
используются как мостик между первичными антителами и
конечными, которые также не конъюгируются. За последним слоем
антител наносится пероксидаза хрена, которая присоединяется путем
реакции антиген-антитело и затем проявляется гистохимически.
39.
Первый слой составляют кроличьи антитела, реагирующие стканевыми антигенами, второй слой образует неконъюгированная
вторичная сыворотка козы против кроличьих антител в избытке, третий
слой - кроличий ПАП комплекс.
Кроличьи ПАП молекулы реагируют только с антикроличьими
иммуноглобулинами козы второго слоя, и это обеспечивает отсутствие
неспецифического связывания с тканью, что дает высокое окрашивание
и отсутствие фона.
39
2. Пероксидазно-антипероксидазный метод (ПАП метод).
Развитие этого метода L.A. Sternberger (1979) оказало большое
влияние на иммуногистохимию.
40.
403. Авидин-биотиновый метод.
Наиболее часто используемый непрямой метод.
По чувствительности превосходит ПАП метод и практически вытеснил
его из практики. В основе метода лежит способность авидина
(высокомолекулярного белка), получаемого из яичного белка к прочному
связыванию с низкомолекулярным витамином –биотином, входящим в
состав яичного желтка.
первый слой представляют первичные кроличьи антитела;
второй
слой
составляют
биотинилированные
антикроличьи
иммуноглобулины козы;
третий слой представлен авидин-биотиновым комплексом.
41.
414. Метод блокирования неспецифического взаимодействия с тканевым
биотином был предложен G.S. Wood и R. Warnke (1981)- АВС – метод.
Немеченные первичные антитела соединяются с антигеном, меченные
биотином вторичные антитела соединяются с первичными, добавляется
комплекс авидин-биотин-фермент, который присоединяется к биотину
вторичных антител, давая специфическое окрашивание.
42.
425. Методы визуализации иммуногистохимической реакции с использованием
конъюгатов полимеров.
• За счет увеличения концентрации фермента повышается чувствительность
метода.
• При этом с полимером могут быть конъюгированы как первичные антитела,
так и молекулы фермента EPOS (Enhanced Polymer One Stepstaining)
фирмы Dako - так называемый одношаговый метод EPOS. Полимер
декстран связан как с молекулой первичного антигена, так и с молекулой
фермента. Более широко применяется двухшаговый метод, при котором
полимер связан со вторичными антителами и ферментом.
• EnVision, фирмы Dako - иммуногистохимическая реакция проводится в два
этапа, при этом достигается высокая чувствительность по сравнению с
другими методами визуализации.
• Наборы выпускают фирмы «Дако», «NovoCastra» и LabVision. В России
широко распространен набор фирмы «Дако» «EnVision». Чувствительность
метода вше, чем LSAB
43.
436. Наибольшую популярность в настоящее время получили
иммуногистохимические методики, использующие для визуализации
реакции ферменты пероксидазу хрена или щелочную фосфатазу, с
использованием стрептавидинбиотинового комплекса.
Стрептавидин – белок, который получают из Streptomyces avidinii.
В отличие от авидина стрептавидин не связывается с эндогенным
биотином, что уменьшает фоновое окрашивание и повышает
чувствительность метода.
Фирма Daco выпускает широко используемые наборы антител LSAB2
LSAB+
Разработаны мультимерные системы – наборы REVEAL, Spring
Bioscience, обеспечивающие лучшее окрашивание.
44.
44Важными условиями проведения иммуногистохимической реакции
является подбор титра антител.
Титром антител называют максимальное разведение сыворотки, при
котором наблюдается выраженное специфическое окрашивание без
неспецифического фонового окрашивания окружающих тканей.
Все коммерческие антитела имеют инструкции с описанием
оптимального разведения, однако часто подбирать титр антител
приходится экспериментально, поскольку этот показатель зависит от
таких причин, как длительность инкубации первичной сыворотки,
окружающая
температура,
выбранная
система
визуализации
распределения первичных антител и т.п.
45. Протокол иммуногистохимической реакции, предлагаемый компанией Dako.
1. Приготовить парафиновые срезы на стеклах, покрытых поли-L-лизином, провести депарафинирование и регидратацию в TBS(Dako TBS, S196830, добавить 0,05% Tween 20).
2. Удалить избыток жидкости вокруг срезов и капнуть 1% р-р перекиси водорода 10 мин.
3. Промыть в TBS.
4. Удалить избыток жидкости вокруг срезов.
5. Нанести первичные антитела (мышиные или кроличьи). Инкубировать 30 мин при комнатной температуре во влажной
камере.
6. Промыть в TBS.
7. Удалить избыток жидкости вокруг срезов.
8. Нанести вторичные антитела (смесь антимышиных или антикроличьих биотинилированных антител). Инкубировать 15-30
мин при комнатной температуре во влажной камере.
9. Промыть в TBS
10. Удалить избыток жидкости вокруг срезов.
11. Нанести конъюгированный с пероксидазой стрептавидин. Инкубировать 15-30 мин при комнатной температуре во влажной
камере.
12. Промыть в TBS
10. Удалить избыток жидкости вокруг срезов.
11. Нанести конъюгированный с пероксидазой стрептавидин. Инкубировать 15-30 мин при комнатной температуре во влажной
камере.
12. Промыть в TBS
13.Удалить избыток жидкости вокруг срезов.
14. Провести гистохимическое выявление пероксидазной активности с раствором диаминобензидина 5-10 мин.
15. Промыть в воде.
16. Докрасить ядра гематоксилином Майера 1-2 мин.
17. Промыть срезы в проточной воде.
18. Провести дегидратацию в восходящей батареи спиртов.
45
Протокол иммуногистохимической реакции, предлагаемый компанией Dako.
46.
Подготовка материалаисследования
для
иммуногистохимического
46
47.
Подготовка материала для иммуногистохимическогоисследования
При взятии материала для ИГХ-исследования следует строго соблюдать
все требования, которые предъявляются к этой процедуре при обычном
патоморфологическом исследовании.
Материал не должен подсыхать перед погружением в фиксирующую
среду, его не следует промывать гипотоническими средами (например,
водой).
Фрагменты материала не должны быть слишком крупными, поскольку
большие размеры фиксируемых кусочков не позволяют добиться
равномерности фиксации и хорошей сохранности центральных областей
объекта, что в последующем проявляется различными артефактами.
47
48.
Фрагменты тонкостенных полых органов и пленочные препаратынеобходимо фиксировать в расправленном состоянии. Лучше всего
для этого использовать восковые пластины. Фрагменты картона и
плотной бумаги менее пригодны.
48
49.
Пагогистологический материал, включая операционные биопсии,желательно фиксировать в нейтральном формалине или цинк-формалине,
который по времени фиксации и обеспечению способности препаратов к
восприятию обзорных окрасок полностью подобен обычному формалину.
49
50.
После окончания фиксации остатки фиксирующих веществ необходимо удалить из материала, тщательно промыв его в дистиллированной воде. Заливка должна быть осуществлена в течение 2-5 сутпосле завершения фиксации.
При обезвоживании материала могут быть использованы:
хлороформ, петролейный эфир, ортоксилол, метилсалицилат,
метилбензоат, неоптическое кедровое масло, пихтовое масло,
терпинеол.
Заливку можно проводить, используя парафин любых коммерческих
марок. При заливке не рекомендуется использовать температуры
выше 60 С.
50
51.
Изготовление срезов для ИГХ-исследования следует проводить наротационных и санных микротомах, обеспечивающих точную
подачу и необходимый диапазон толщины срезов (3-7 мкм).
После микротомии срезы помещаются в емкость с водой и далее
перемещаются на стекла, покрытые адгезивным составом.
51
52.
Иммуногисгохимияисследовании
при
гистологическом
52
53.
В настоящее время иммуногистохимическое исследование, как правило,не является самостоятельным методом диагностики, а служит
высокоинформативным дополнением к гистологическому исследованию.
Требования, предъявляемые к препарату, окрашенному с использованием
методов иммуногистохимии, в значительной степени совпадают с
требованиями, предъявляемыми к хорошему гистологическому препарату,
изготовленному для последующего проведения световой микроскопии.
53
54.
Окрашенный продукт гистохимической реакции осаждается на срезах вместе локализации фермента и, таким образом, визуализирует
распределение маркированного антитела, а следовательно, и тканевого
антигена, с которым соединилось первичное антитело. Интенсивность
окраски конечного продукта реакции пропорциональна его количеству.
Количество конечного продукта зависит от активности и количества
фермента. Поскольку условия реакции в различных местах среза в целом
сопоставимы, то повышенная интенсивность осаждения конечною
продукта реакции в том или ином локусе будет соответствовать
большему количеству находящеюся там фермента и, соответственно,
тканевою антигена, с которым взаимодействовали меченые ферментом
антитела.
54
55.
В качестве ферментов-маркеров используют пероксидазу илищелочную фосфатазу, так как они демонстрируют сравнительно более
высокую интенсивность и устойчивость окрашенных продуктов
гистохимической реакции. Необходимо учитывать, что в срезах тканей
могут присутствовать эндогенные ферменты, которые также способны
взаимодействовать с добавляемым субстратом и катализировать
соответствующие реакции с образованием цветного конечного продукта.
Поэтому перед проведением иммуногистохимической реакции
эндогенные ферменты ингибируют, для того чтобы избирательно
окрашивались только ферменты, конъюгированные с антителами. Для
проверки правильности и полноты блокировки эндогенных ферментов
проводят соответствующие контрольные реакции.
55
56.
Иммуногистохимический метод57.
57Иммуногистохимический метод в онкологии.
Возможности метода:
позволяет определить гистогенез опухоли;
охарактеризовать способность опухоли к пролиферации,
апоптотическую активность, способность к инвазии и адгезии;
определить индивидуальную чувствительность опухоли к
химиопрепаратам
58.
58Для иммуногистохимического анализа опухолей и их метастазов
применяется широкий спектр маркеров, к которым можно отнести:
• тканеспецифические белки – белки промежуточных филаментов (ПФ),
• компоненты базальной мембраны,
• рецепторы,
• молекулы клеточной адгезии и др.
59.
59Достижения в области молекулярной биологии последних лет позволили
клиницистам использовать:
• промежуточные филаменты,
• рецепторы стероидных и пептидных гормонов,
• различные факторы роста и их рецепторы в качестве диагностических,
прогностических факторов опухолей различной локализации и в выборе их
адекватной терапии.
60.
60I. Промежуточные филаменты
Для иммуногистохимической верификации опухолей человека используют
антитела к белкам ПФ.
Основная функция ПФ – вместе с микротрубочками и микрофиламентами
создание внутриклеточного каркаса, механическое поддерживание
плазматической мембраны в местах соприкосновения с другими клетками и
внеклеточным веществом, а также поддержание ядерной оболочки.
В клетке ПФ достаточно стабильны, даже после обработки клеток
детергентами они остаются интактными, в то время как большинство
микротрубочек и микрофиламентов в клетках деполимеризируются до
растворимых форм.
61.
1. Кислые цитокератины R. Moll (1998) они имеют порядковые номера № 920 (молекулярная масса 40-64 кДа)2. Нейтрально-основные цитокератины, № 1-8 (молекулярная масса 52.5-68
кДа);
3. Виментин с молекулярной массой 58 кДа в мезенхимальных клетках:
фибробластах, остеоцитах и остеобластах, хондроцитах, шванновских клетках,
меланоцитах кожи, лейкоцитах, плазматических клетках, эндотелии сосудов,
некоторых эпителиальных клетках
десмин мышечных клеток (молекулярная масса 53 кДа) – в клетках
скелетных мышц, кардиомиоцитах, гладкомышечных клетках
висцеральных органов и кровеносных сосудов
глиальный фибриллярный кислый белок (молекулярная масса 55 кДа)
– маркер астроцитарных клеток;
периферин распределяется в нейронах периферической нервной
системы;
4. Белки нейрофиламентов (молекулярная масса 68, 145 и 220 кДа) и альфа-
61
Классификация промежуточных филаментов
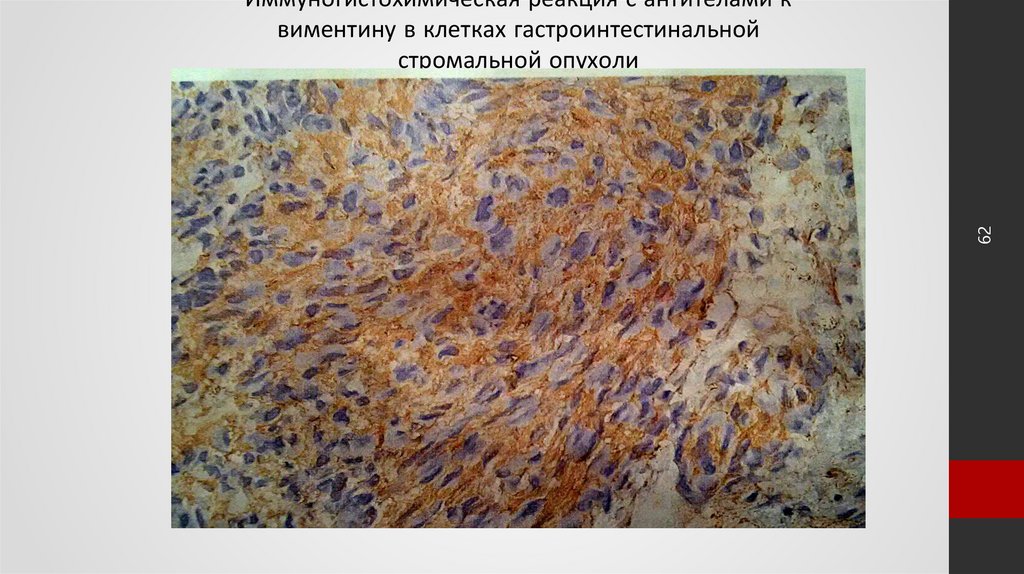
62. Иммуногистохимическая реакция с антителами к виментину в клетках гастроинтестинальной стромальной опухоли
62Иммуногистохимическая реакция с антителами к
виментину в клетках гастроинтестинальной
стромальной опухоли
63.
63Выявление ПФ в опухолевых клетках с помощью специфических
антител к различным ПФ позволяет определить эпителиальное,
мезенхимальное
или
нейроэктодермальное
происхождение
опухолевых клеток, поставить диагноз и назначить адекватное
лечение.
64.
Присутствие цитокератинов в клетке является признаком, которыйможет быть использован для идентификации эпителия: каждому виду
эпителиальных клеток с определенной функцией и локализацией
соответствует характерный набор цитокератиновых полипептидов.
Иммуногистохимическая реакция с антитетелами СК в эпителиальных
клетках локализуется в цитоплазме и на мембранах клеток.
В настоящее время выявлено 20 типов цитокератинов CK1-CK20.
Спектр цитокератинов в эпителиальных клетках зависит от степени
дифференцировки, положения клетки в эпителиальном пласте.
64
Цитокератины – маркеры различных типов эпителия
Цитокератины наиболее многочисленная группа белков ПФ– белки
промежуточных филаментов цитоскелета эпителиальных клеток. Клетки
различных
эпителиев
имеют
разные
молекулярные
формы
цитокератина.
65.
65В норме в однослойном простом эпителии:
CK8 и CK18 - выявляются в клетках печени, поджелудочной железы,
большинстве эндокринных клеток и эпителиальных клетках
проксимальных извитых канальцев почек.
CK7 и CK19 – выявляются в эпителиальных клетках ЖКТ, желчных протоках
и протоках поджелудочной железы, легочных альвеолах, эндометрии и
собирательных трубочках почек
Нормальные клетки фолликулов щитовидной железы экспрессируют CK7,
но не содержат CK19 и CK20.
Железистый эпителий, с выраженным базальным или миоэпителиальным
клеточным слоем (базальные и миоэпителиальные клетки молочной
железы, потовых и слюнных желез, предстательной железы) экспрессирует
CK5, CK14 и CK17, в то время как в секреторном эпителии выявляются
цитокератины CK8, CK18, CK7, CK19.
В многослойном плоском эпителии базальный слой может
экспрессировать CK5 и CK14, а также CK19 (за исключением кожи).
Средний и поверхностный слои неороговевающего многослойного
плоского эпителия слизистых оболочек экспрессируют CK4 и CK13,
в эпидермисе экспрессируются CK1 и CK10.
66.
66В эпителиальных опухолях чаще всего экспрессируется спектр
СК,
присущий нормальным клеткам. В карциномах могут появиться СК,
характерные для эмбрионального развития. Лучевая и химиотерапия
может менять иммуногистохимический профиль опухоли.
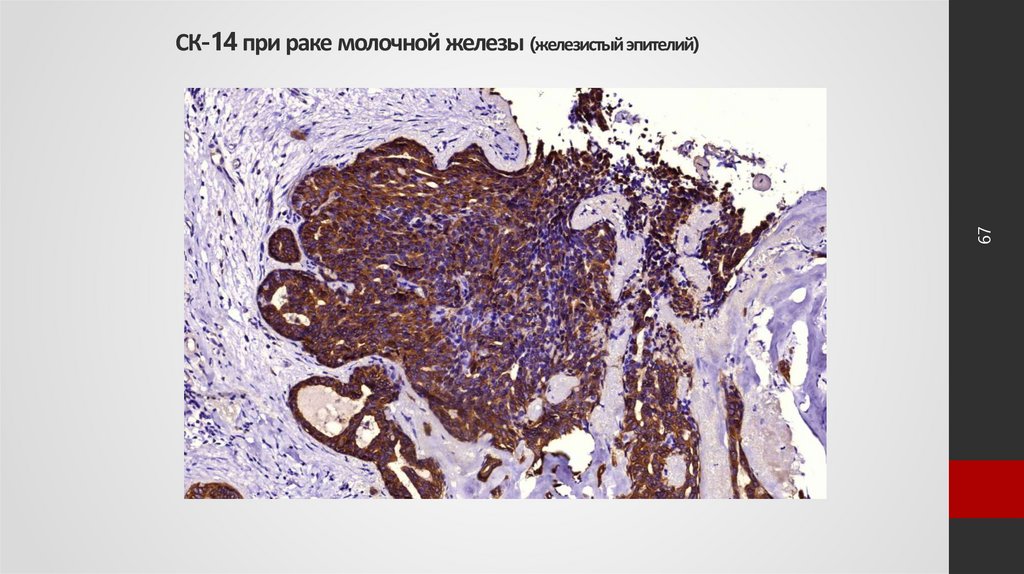
67. СК-14 при раке молочной железы (железистый эпителий)
67СК-14 при раке молочной железы (железистый эпителий)
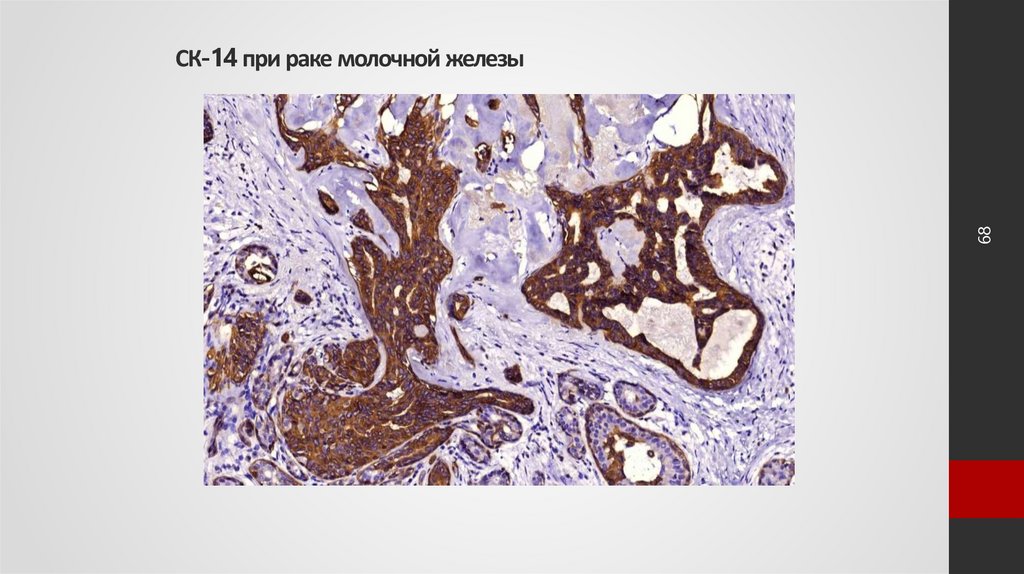
68. СК-14 при раке молочной железы
68СК-14 при раке молочной железы
69. СК-14 при раке молочной железы
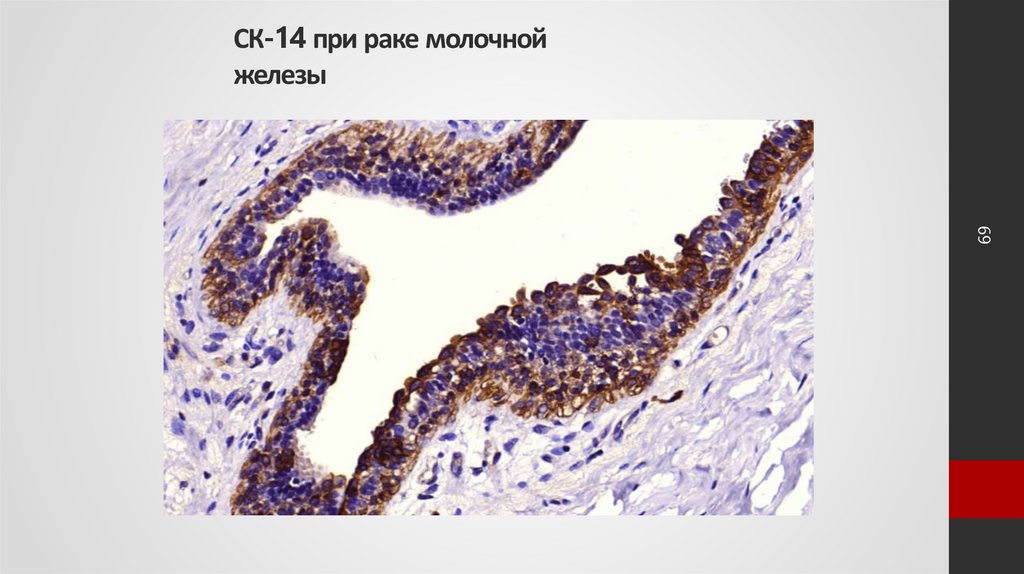
69СК-14 при раке молочной
железы
70. СК-14 при раке молочной железы
70СК-14 при раке молочной железы
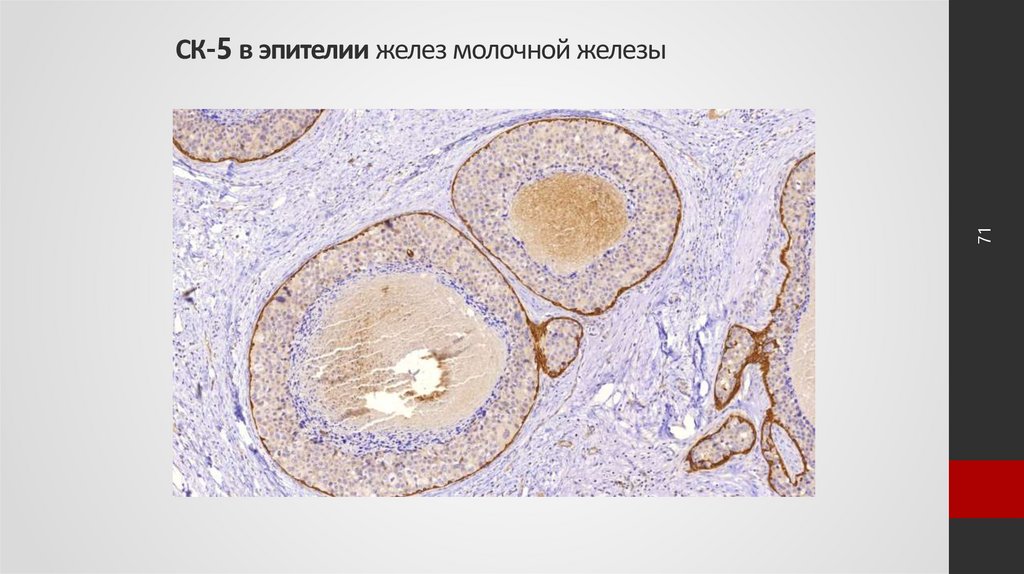
71. СК-5 в эпителии желез молочной железы
71СК-5 в эпителии желез молочной железы
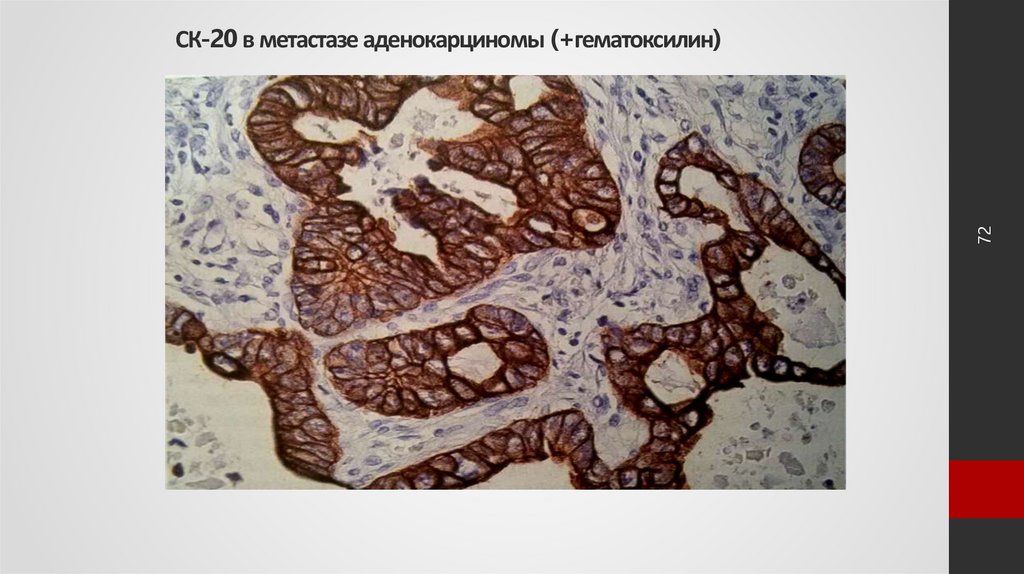
72. СК-20 в метастазе аденокарциномы (+гематоксилин)
72СК-20 в метастазе аденокарциномы (+гематоксилин)
73. СК-7 в аденокарциноме легкого
73СК-7 в аденокарциноме легкого
74.
74Диагностическое значение цитокератинов
Аденокарциномы в основном экспрессируют цитокератины однослойного
эпителия – CK8, CK18, CK19 и часто CK7.
Неэпителиальные опухоли, как правило, цитокератин-негативны, однако
некоторые мезенхимальные опухоли, такие как лейомиома,
рабдомиосаркома, меланома, шваннома и анапластическая крупноклеточная лимфома могут экспрессировать цитокератины CK8, CK18,
CK19.
Некоторые эпителиальные опухоли могут экспрессировать виментин,
поэтому он должен входить в диагностическую панель :
При раке эндометрия,
Почечно-клеточных карциномах;
Фолликулярном раке щитовидной железы;
Саркоматоидных карциномах
75.
75Цитокератины – важные маркеры для иммуногистохимической
классификации недифференцированных опухолей.
используются:
для
дифференциальной
диагностики
рака
с
большинством
неэпителиальных опухолей;
для выявления микрометастазов или разбросанных опухолевых клеток в
лимфатических узлах и костном мозге;
для выявления инфильтрирующего роста при раках желудка и молочной
железы.
76.
76Переход рака на месте в инвазивную стадию при раке предстательной
и молочной желез определяют с помощью CK5, так как он выявляет
базальные эпителиальные и миоэпителиальные клетки.
Экспрессия CK7 без коэкспрессии CK20 характерна для
аденокарциномы легких, молочной железы, эндометрия и щитовидной
железы, а также для немуцинозной аденокарциномы яичников и
злокачественной мезотелиомы.
экспрессия CK20 и отсутствие экспрессии CK7 характерно для рака
толстого кишечника.
77.
77При раке простаты выявляется специфический антиген простаты (PSA) и
щелочная фосфатаза, специфичная для простаты (PAP),
при раке щитовидной железы – тиреоглобулин,
В клетках печеночноклеточного рака – альфа-фетопротеин,
При раке яичника – СА-125,
При хориоэпителиоме – хорионический гонадотропин.
Клетки эндокринных раков экспрессируют нейрон-специфическую
энолазу (NSE), хромогранин и др
78.
78III. Рецепторы факторов роста
Рецептор эпидермального фактора роста (РЭФР) – это трансмембранный
гликопротеин, после активации которого под действием внутриклеточных
тирозиновых киназ происходит деление клетки.
экспрессируется при раке желудка, молочной железы, предстательной
железы, мочевого пузыря и многих других эпителиальных опухолях
Выявление экспрессии РЭФР характеризует низкую выживаемость
пациентов, является прогностически неблагоприятным признаком, в
связи с тем, что наличие этого маркера связано со стадией,
степенью дифференцировки и плоидностью опухолевых клеток.
Четыре сходных по структуре трансмембранных рецептора
РЭФР (ЕrbB-1), HER-2/neu (ЕrbB-2), HER-3 (ЕrbB-3), HER-4 (ЕrbB-4),
принадлежат к семейству тирозинкиназных рецепторов (продуктов
онкогенов C-erbB), представляют одну из важнейших систем передачи
митотического сигнала.
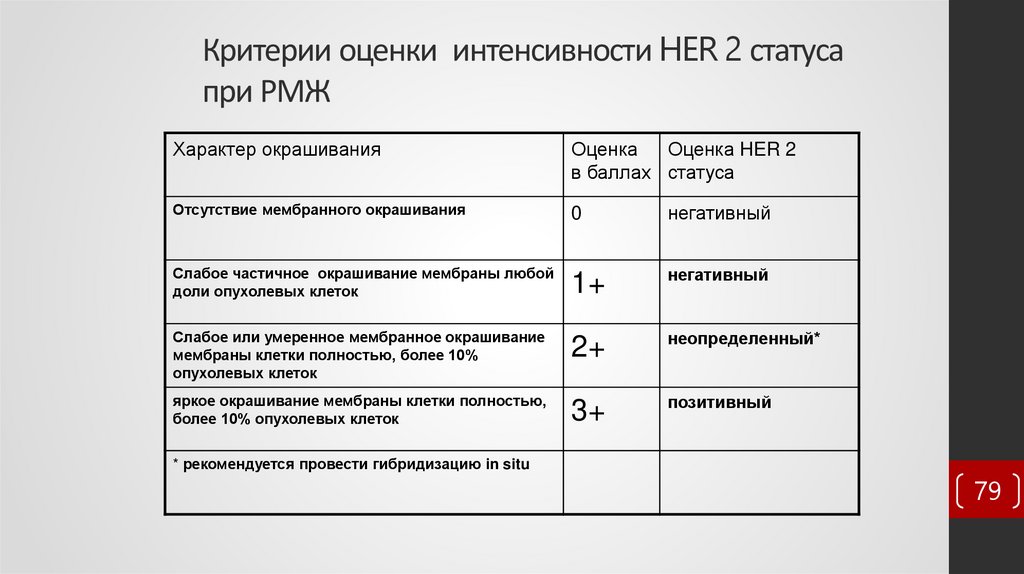
79. Критерии оценки интенсивности HER 2 статуса при РМЖ
Характер окрашиванияОценка
Оценка HER 2
в баллах статуса
Отсутствие мембранного окрашивания
0
негативный
Слабое частичное окрашивание мембраны любой
доли опухолевых клеток
1+
негативный
Слабое или умеренное мембранное окрашивание
мембраны клетки полностью, более 10%
опухолевых клеток
2+
неопределенный*
яркое окрашивание мембраны клетки полностью,
более 10% опухолевых клеток
3+
позитивный
* рекомендуется провести гибридизацию in situ
79
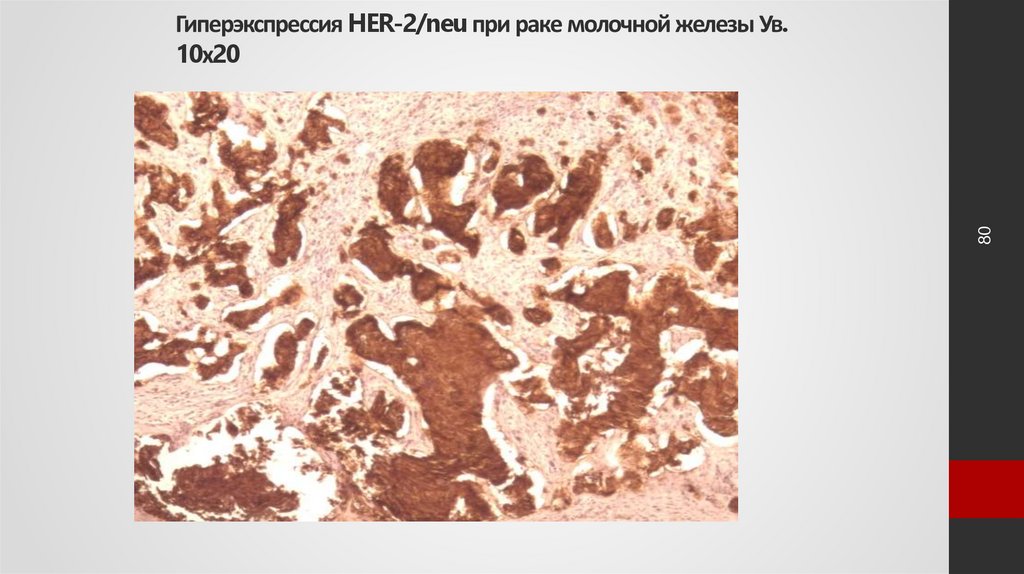
80. Гиперэкспрессия HER-2/neu при раке молочной железы Ув. 10х20
80Гиперэкспрессия HER-2/neu при раке молочной железы Ув.
10х20
81.
81Универсальным маркером для оценки клеточного цикла является белок Ki67, по экспрессии которого можно исследовать пролиферативную активность
клеток.
Антитела к Ki-67 выявляют пролиферирующие клетки, находящиеся в
разных фазах цикла. Это наиболее надежный и четкий маркер
пролиферации.
Антиген Ki-67, выявляемый соответствующими моноклональными
антителами - короткоживущий протеин, он разрушается в течение 1,5-2
часов. Поэтому, антитела к Ki-67 выявляют только делящиеся клетки, так
как Ki-67 не успевает накапливаться и не остается в покоящихся клетках
Ki-67 является надежным индикатором пролиферации практически во всех
опухолевых образованиях человека.
Уровень Ki-67 выражается в процентах по отношению числа положительно
окрашенных ядер клеток на 100 клеток в нескольких полях зрения.
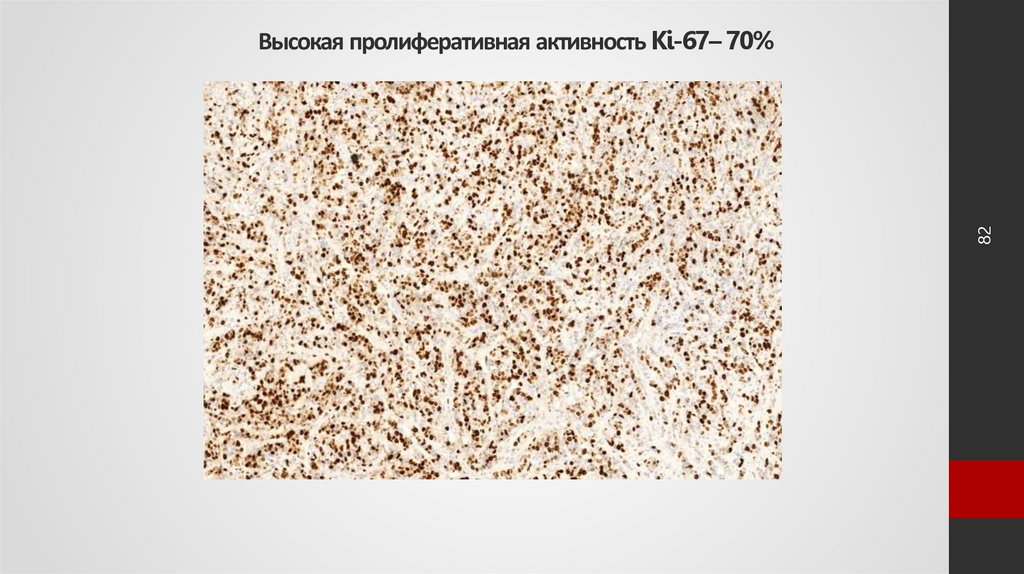
82. Высокая пролиферативная активность Ki-67– 70%
82Высокая пролиферативная активность Ki-67– 70%
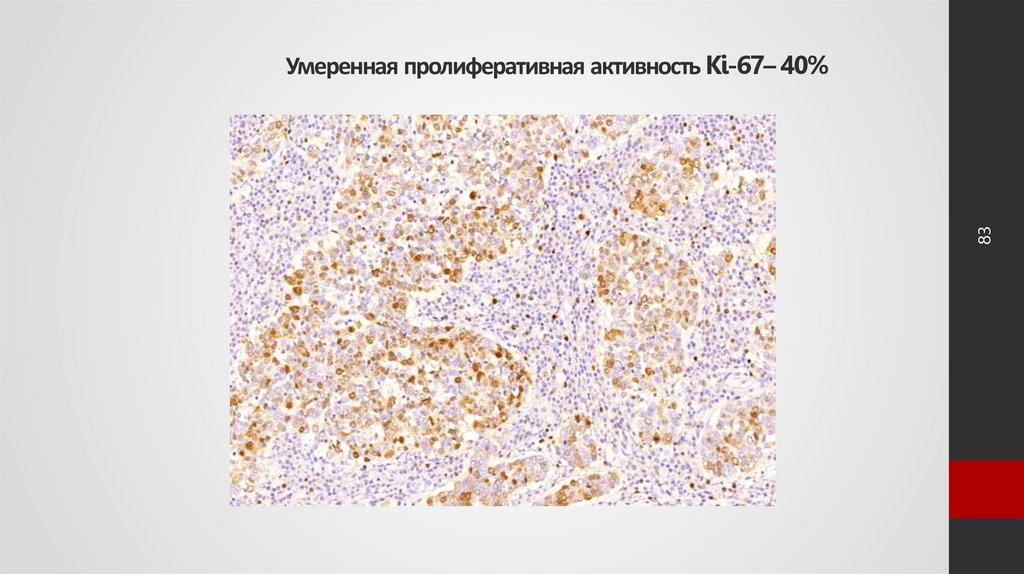
83. Умеренная пролиферативная активность Ki-67– 40%
83Умеренная пролиферативная активность Ki-67– 40%
84.
Некоторые цели иммуногистохимии:Диагностика опухоли на гистогенетическом уровне. Оценка её клеточных
элементов с дифференциальной диагностикой между доброкачественным
и злокачественным составом.
Оценка вида новообразования. От этого зависит прогноз и подбор
методов терапии.
Определение локализации первичной опухоли, если первоначально был
обнаружен метастаз.
Выявление предракового состояния, определение риска злокачественного
перерождения доброкачественных клеток.
Подбор щадящих или радикальных методов терапии, а также изменение
их направления при отсутствии эффективности.
Определение чувствительности злокачественных клеток к химиотерапии.
Помощь в диагностике системных заболеваний соединительной ткани и
болезней почек, позволяет выявлять бактерии и вирусы в изучаемых
тканях.
84
85.
Иммуногистохимическое (ИГХ) исследование помогает не толькодиагностировать опухоль, определить ее нозологический вариант, выявить
первичный опухолевый очаг и обнаружить раковое перерождение клеток, но
также спрогнозировать варианты течения заболевания и успешность лечения.
К факторам, влияющим на прогноз, относятся рецепторы к эстрогенам и к
прогестерону, Ki-67 (маркер активности опухоли), her-2 neu (эпидермальный
фактор роста, определяет чувствительность опухоли к химиопрепарату
трастузумабу/герцептину), VEGF (сосудистый фактор роста), Bcl-2, р53 и др.
85
86.
Практическое применениеидентификация клеток различных типов по их уникальным
маркерным признакам;
изучение синтетических и секреторных процессов;
выявление гормонов и рецепторов к ним.
86
87.
Пример проведения иммуногистохимии при онкологииНапример, иммуногистохимическое исследование на цитокератин 20
помогает выявить, из каких клеток образована опухоль.
Цитокератин 20 (СК-20) – это белок, который вырабатывается в основном
клетками эпителия толстого кишечника, прямой кишки, мочевого пузыря,
мочеточников и мочеиспускательного канала, желчных протоков и
протоков поджелудочной железы.
Иммуногистохимические исследования ткани, полученной при биопсии,
помогают обнаружить клетки этих органов, в ткани, где их не должно
быть. Это возможно при их перемещении – метастазировании опухолей
кишечника, мочевого пузыря и других органов, эпителий которых
содержит СК20. Например, обнаружение СК20 в печени – это признак
метастатической опухоли, что позволяет исключить первичный
гепатоцеллюлярный (из клеток печени) рак.
87
88.
На При помощи ИХГ легко обнаружить в клетках, пораженных HPV, экспрессиюбелков p16 и p18, и их позитивность сильно коррелирует с позитивностью HPV.
Это помогает различить неопухолевую дисплазию (как результат воспаления) и
опухолевую (вызванную вирусом папилломы и способную переродиться в рак),
а также позволяет провести дифференциальную диагностику дисплазии
умеренной и высокой степени тяжести (CIN II/III) и начальных форм рака шейки
матки, выявление поражений, склонных к прогрессированию и развитию
инвазивной карциномы. В дисплазиях умеренной и высокой степени (в 80100% случаев CIN II и практически во всех случаях CIN III) и инвазивном раке
шейки матки определяется усиленная экспрессия белка p16, и она усиливается
по мере нарастания тяжести поражения.
У женщин с плоскоклеточными интраэпителиальными поражениями низкой
степени тяжести очаговая и диффузная экспрессия свидетельствует о
прогрессировании заболевания. Отсутствие или очаговая экспрессия p16 в
поражениях высокой степени может служить дополнительным признаком
88
89.
ИГХ исследование эндометрияПоказаниями для диагностики являются: бесплодие, подготовка к ЭКО, гиперплазия и опухоли
эндометрия, хронический эндометрит. Биологический материал — биоптат эндометрия.
Диагностическая панель состоит из следующих показателей: ER, PR, CD56, CD138, LIF.
ER и PR: Определение рецепторов к эстрогену и прогестерону. Позволяет выявить нарушение
экспрессии эстрогеновых и прогестероновых рецепторов. Это может являться причиной
женского бесплодия. При онкологических заболеваниях иммуногистохимическое исследование
EP, PR позволяет оценить морфологическую структуру и чувствительность образования к
гормональной терапии. Истощение рецепторов к женским гормонам может свидетельствовать о
хроническом воспалении эндометрия.
CD56: Количество зависит от фазы цикла. Присутствие в эндометрии в определенных значениях
является нормой. Резкое увеличение концентрации CD56 позволяет заподозрить хронический
эндометрит.
CD138: Также являются частью структуры здорового эндометрия. Наряду с CD56 служит
маркером хронических воспалительных процессов эндометрия.
LIF: синтезируется эндометрием и его концентрация зависит от фазы менструального цикла.
Количество возрастает к середине I фазы цикла. Этот показатель используют в репродуктологии
89











































































 medicine
medicine chemistry
chemistry








