Similar presentations:
Сочетание нервной анорексии и депрессивного расстройства: взаимодействие нейробиологических механизмов, клинические проявления
1. Сочетание Нервной анорексии и Депрессивного расстройства: взаимодействие нейробиологических механизмов, клинические проявления
иметоды фармакотерапии.
2.
• Сочетание нервной анорексии (НА) и депрессивного расстройства(ДР) представляет собой сложный клинический феномен,
характеризующийся более тяжелым течением обоих
заболеваний, резистентностью к терапии и неблагоприятным
прогнозом. Коморбидность НА и ДР встречается у 36–80%
пациентов, только 30–40% пациентов реагируют на стандартное
лечение.
Calvo-Rivera 2022
Ulfvebrand et al., 2015
3. Гипотезы коморбидности нервной анорексии и депрессии
• Первичная депрессия как фактор риска НА• Согласно этой гипотезе, депрессия, возникающая раньше НА, способствует развитию расстройства пищевого поведения
через такие механизмы, как низкая самооценка, повышенная самокритика и искаженное восприятие тела. Депрессивные
симптомы (например, ангедония или чувство беспомощности) могут провоцировать ограничительное пищевое поведение
как попытку контроля (Calvo-Rivera et al., 2022).
• Вторичная депрессия вследствие НА
• Другая гипотеза предполагает, что депрессивные симптомы развиваются как результат длительного голодания и
нейробиологических изменений при НА. Например, дефицит питательных веществ, дисфункция серотонина и повышенный
кортизол нарушают эмоциональную регуляцию, приводя к апатии, тревоге и подавленному настроению (Lawson et al.,
2009; Mattar et al., 2012).
• Общие генетические и биологические факторы
• 34% общей генетической вариативности объясняют коморбидность двух расстройств.
• Психологические и средовые механизмы
• Такие черты, как перфекционизм, алекситимия или избегающее поведение, могут выступать общими предикторами.
Кроме того, стрессовые события (например, травма) способны запускать как депрессию, так и НА. (Torres et al., 2015).
4. Проблемы диагностики депрессивного расстройства при нервной анорексии
• Проявления НА и ДР частично перекрываются: снижение веса,нарушения сна, утрата энергии могут быть следствием как
сознательного ограничения питания, так и депрессивного
расстройства.
Boehm et al., 2017
5.
Критерии депрессивного эпизода (F32)Сниженное настроение
Критерии нервной анорексии (F50.0)
ИМТ ≤17,5 кг/м2 или ниже
Отчетливое снижение интересов или удовольствия от
деятельности
Потеря веса вызывается самим пациентом
Снижение энергии и повышенная утомляемость
Искажение образа своего тела в виде навязчивой и/или
сверхценной идеи (допустимым для себя считается лишь низкий
вес)
Сниженная способность к сосредоточению и вниманию
Общее эндокринное расстройство, проявляющееся у женщин
аменореей, а у мужчин потерей полового влечения и потенции
Снижение самооценки и чувство неуверенности в себе
Идеи виновности и уничижения
Мрачное и пессимистическое видение будущего
Идеи или действия, касающиеся самоповреждения или
самоубийства
Нарушение сна (преимущественно утренняя диссомния)
Изменения аппетита (↑/↓) и веса (≥5% за месяц)
6.
Трудности в распознавании депрессивных переживаний упациентов с нервной анорексией
• Клинические исследования демонстрируют выраженные
сложности в формулировании депрессивных жалоб у пациентов с
нервной анорексией (НА), что создает значительные
диагностические препятствия. Центральную роль играет высокий
уровень алекситими (TAS-20 ≥75 баллов), что проявляется в
неспособности идентифицировать и вербализовать свои
переживания.
Sandra Torres et al., 2015
7.
Трудности в распознавании депрессивных симптомовОсобую сложность представляет собой маскировка депрессивных
проявлений, когда истинные аффективные нарушения скрываются за
пищевым поведением, выражаясь через ритуализированный контроль
питания, компульсивную активность и перфекционизм в соблюдении
диетических правил. Депрессия усугубляет расстройства пищевого
поведения (Более высокие баллы по шкале EDI при тяжелой депрессии
— Bizeul et al., 2003). Это создает порочный круг, в котором первичные
депрессивные предпосылки и вторичные, индуцированные голоданием
изменения взаимно усиливают друг друга, приводя к формированию
устойчивой коморбидной патологии, резистентной к стандартным
терапевтическим подходам
Maria Pilar Calvo-Rivera et al., 2022
8. Гиперактивность при нервной анорексии
• 38-80% пациентов с нервной анорексией демонстрируютсубъективное ощущение повышенной продуктивности на фоне
выраженного физического истощения, что представляет
значительную диагностическую сложность при выявлении
сопутствующего депрессивного расстройства. Пациенты могут
описывать себя как "полных энергии", несмотря на объективные
признаки истощения.
Visser et al., 2021
9. Нейробиологические механизмы коморбидности и их клинические проявления
• Несмотря на отмеченные сложности диагностики,принципиальное значение для понимания коморбидности НА и
ДР имеет анализ клинических проявлений и их
нейробиологических основ. Эти данные не только проясняют
патогенетические взаимоотношения между расстройствами, но и
открывают новые возможности для разработки
дифференцированных терапевтических стратегий, учитывающих
как общие, так и уникальные нейробиологические мишени при
сочетанной патологии.
10. Сочетание аффективных и тревожно-обсессивных нарушений
Сочетание аффективных и тревожнообсессивных нарушенийКлинические проявления:
• У пациентов с нервной анорексией часто наблюдается сочетание
эмоциональной апатии и выраженной тревожно-обсессивной
симптоматики, что является следствием выраженной дисфункции
серотонинергической системы
Kaye et al., 2013
11. Нейробиологические механизмы:
Депрессивное расстройство(ДР)
Нервная анорексия (НА)
Общий механизм
↓ активности в
префронтальной коре (ПФК) и
лимбической системе →
снижение способности
регулировать тревогу, апатия
↑ активность в
орбитофронтальной коре
(ОФК) и миндалине→
усиление тревоги и
обсессивных мыслей
Дисбаланс в корковолимбических путях→
нарушение регуляции эмоций
и тревоги
Тревога усиливает обсессивно-компульсивные паттерны, что временно снижает дистресс (через усиление
контроля за питанием).
Апатия снижает способность к адаптивному преодолению стресса, в следствие чего пациенты фиксируются
на контролируемых аспектах (вес, питание).
Сочетание НА и ДР создает замкнутый круг, наблюдается "эффект воронки": эмоции и когнитивные
ресурсы сосредоточены только на контроле веса, тогда как остальные сферы жизни воспринимаются как
незначимые.
Cowdrey et al., 2011; Pilmeyer et al., 2022; Steinglass et al., 2012
12.
При начале нутритивной поддержки наблюдается ухудшениесимптоматики. Повышение доступности триптофана при
увеличении питания приводит к резкой гиперстимуляции
рецепторов, приводящая к тревоге, эмоциональной лабильности и
обострению обсессивно-компульсивной симптоматики.
• Начало нутритивной поддержки → быстрое повышение уровня
триптофана → избыточный синтез серотонина (5-HT) в
синаптической щели.
Дисбаланс рецепторной активности:
• Гиперстимуляция 5-HT2A/2C рецепторов (при сохраняющейся
гипофункции 5-HT1A)
Kaye et al., 2008
13. Когнитивные нарушения
• С одной стороны, пациенты демонстрируют исключительнуюскрупулезность и перфекционизм в соблюдении пищевых правил,
(компонент НА), с другой - выраженные трудности в принятии
решений, планировании и когнитивной гибкости в других сферах
жизни (компонент ДР). Когнитивная диссоциация составляет
основу терапевтической резистентности при данной патологии.
Steinglass et al., 2012; Hamilton et al., 2015
14.
Нейробиологические механизмы:• НА и ДР: ↓ Объем дорсолатеральной префронтальной коры (ДЛПФК)
→ нарушение когнитивной гибкости.
• ДР: Снижение активности передней поясной коры (ППК) → снижение
обнаружения ошибок.
• НА и ДР: ↓ Фракционная анизотропия (FA) в верхнем продольном
пучке → разобщение между ПФК и теменными областями →
нарушение интеграции информации, уменьшение объема рабочей
памяти
• НА: Гиперактивация орбитофронтальной коры (ОФК) → навязчивый
анализ пищевых стимулов и перфекционизм в контроле питания:
Нейрокогнитивный профиль таких пациентов характеризуется
выраженным дефицитом исполнительных функций при сохранной (а
иногда и усиленной) работе отдельных когнитивных схем, связанных с
контролем веса и пищевого поведения.
King et al., 2018; Frank et al., 2015, 2018; Hamilton et al., 2015
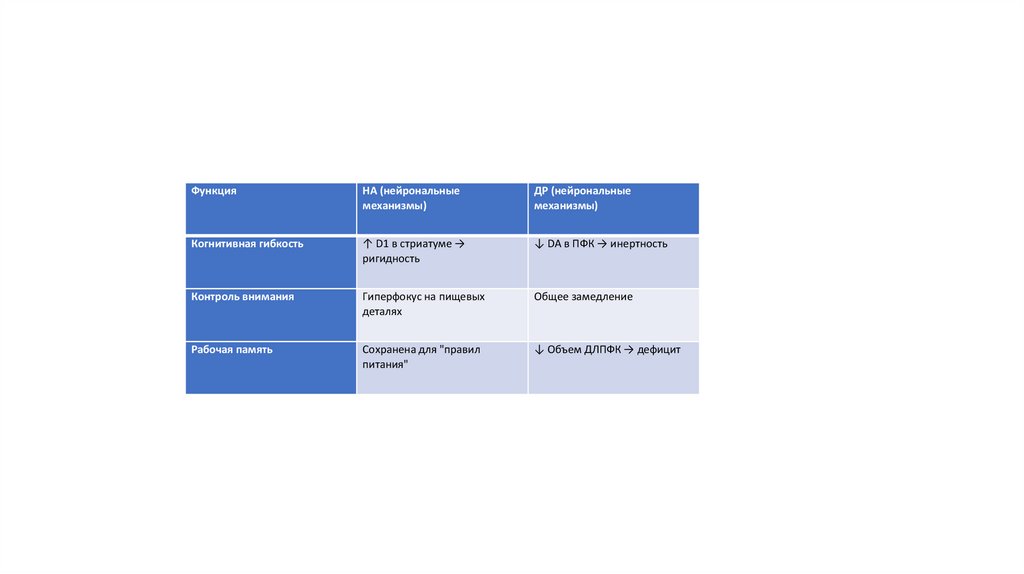
15.
ФункцияНА (нейрональные
механизмы)
ДР (нейрональные
механизмы)
Когнитивная гибкость
↑ D1 в стриатуме →
ригидность
↓ DA в ПФК → инертность
Контроль внимания
Гиперфокус на пищевых
деталях
Общее замедление
Рабочая память
Сохранена для "правил
питания"
↓ Объем ДЛПФК → дефицит
16. Нарушения системы вознаграждения и мотивации
Ангедония: диссоциация между обычными и патологическимистимулами
• У коморбидных пациентов формируется "двойная ангедония" отсутствие удовольствия как от обычных видов деятельности, так и от
еды, при сохранении патологического удовлетворения от контроля над
питанием.
• ДР: Нейробиологические механизмы: ↓ Дофамина (DA) в
вентральном стриатуме → глобальная ангедония.
• НА: Гиперактивация D1-рецепторов в прилежащем ядре, повышение
активности в мезолимбическом пути в следствие голодания у
пациентов с НА создает патологическое подкрепление поведения,
связанного с ограничением питания. Гипофункция D2-рецепторов
приводит к отсутствию удовольствия от приема пищи
Kaye et al., 2013; Frank et al., 2015, 2018; O’Hara et al., 2015; Treadway et al., 2011
17.
Феномен "ангедонии восстановления"В процессе нутритивной реабилитации у пациентов с НА часто
наблюдается ухудшение эмоционального состояния:
• Снижается активность D1 (теряется "вознаграждение" за
голодание), но не восстанавливается функция D2 (еда попрежнему не приносит удовольствия). Ухудшение настроения
наблюдается у 68% пациентов при реабилитации, отсутствие
нормализации DA-трансмиссии сохраняется даже после 6
месяцев терапии.
O'Hara et al., 2015; Attia et al., 2019
18. Нарушения телесного и эмоционально самовосприятия Искажение образа тела:
• При НА наблюдаются выраженные нарушения в обработкесенсорной и интероцептивной информации, что вносит
значительный вклад в развитие и поддержание заболевания.
Сенсорные нарушения проявляются искаженным восприятием
зрительных, тактильных и обонятельных стимулов. Подобные
нарушения не только усугубляют искаженное восприятие тела, но
и затрудняют осознание физиологических потребностей, создавая
порочный круг симптомов.
• Депрессия усугубляет нарушения самовосприятия при НА
усиливая диссоциацию сенсорной, эмоциональной и
когнитивной составляющих телесного образа.
19. Нейробиологические механизмы:
• Структурные изменения:• НА: ↓ Объем передней островковой доли (на 15-20% ↓ нормы) → нарушение
интероцепции
• ↓ Плотность серого вещества в прекунеусе → искаженное восприятие своего тела и
чрезмерная фиксация на деталях
• ДР: ↓ Объем гиппокампа (на 8-10%) → нарушение интеграции телесного опыта с
автобиографической памятью.
Функциональные нарушения:
• НА: ↓ Связь между островком и зрительной корой → несоответствие между
видимым и ощущаемым
• ДР: ↓ Активность в островковой доле → снижение осознания телесных сигналов.
• ↑ Связь между миндалиной и прекунеусом → гипертрофированная
саморефлексия, усиливающая тревогу.
Nandini Datta et al., 2024 Jesper Pilmeyer et al., 2022, Khalsa et al., 2018
20. Алекситимия
• При сочетании наблюдается сложная картина, где каждое израсстройств усиливает и усложняет проявления друг друга. У
таких пациентов наблюдается выраженное затруднение в
распознавании и описании эмоций, характерна замена
эмоциональных переживаний физическими ощущениями:
тревога или печаль интерпретируются как чувство дискомфорта в
теле, что поддерживает пищевые ограничения. Важно отметить,
что даже при успешной коррекции депрессивных симптомов,
алекситимические особенности, связанные непосредственно с
анорексией, часто сохраняются.
21. Нейробиологические механизмы:
• Структурные изменения:• НА и ДР: ↓ Объем правой островковой доли → нарушение осознания телесных
сигналов.
• ДР: ↓ Связь между миндалиной и гиппокампом → диссоциация эмоций и памяти.
• ДР: ↓ Активность в передней поясной коре при попытке описать эмоции.
• НА: ↓ Уменьшение объема серого вещества в соматосенсорной коре, особенно в
областях, отвечающих за восприятие тела (например, постцентральная извилина)→
Гипоактивация при обработке телесных стимулов, что может способствовать
искаженному восприятию тела
• Нарушенная связь между соматосенсорной корой и островковой долей (ключевой
структурой для осознания телесных ощущений и эмоций).
• Нейрокогнитивные тесты и диагностика
• Toronto Alexithymia Scale (TAS-20): Средний балл: 75+ (при норме <51).
Torres et al., 2015; Jesper Pilmeyer et al., 2022
22. Психофармакотерапия
• Основной принцип терапии - этапность лечения:Острая фаза (ИМТ <16):
• Приоритет нутритивной поддержки.
• Данные о применении психофармакотерапии у пациентов с низким
ИМТ (<16 кг/м²) остаются крайне ограниченными, что связано с
несколькими факторами. Во-первых, большинство
рандомизированных контролируемых исследований (РКИ) исключают
таких пациентов из-за высокого риска соматических осложнений и
этических сложностей. Во-вторых, метаболические нарушения
(гипогликемия, электролитный дисбаланс) при тяжелой НА могут
искажать фармакокинетику препаратов, затрудняя интерпретацию
результатов. Эффективность СИОЗС снижена на 62% при ИМТ <16 в
сравнении с ИМТ >18.
Attia et al., 2019; WFSBP, 2023; Guinhut et al., 2021
23.
Препараты, демонстрирующие умеренный эффект в КИ при ИМТ <16 кг/м².
Ключевые мишени:
Серотониновая система (5-HT1A/2A)
Дофаминовые рецепторы (D2/D3)
1. Оланзапин
Дозирвока: 2.5-5 мг/сут
Прирост веса: +0.3 кг/нед в сравнении с плацебо
Эффект: ↓обсессивных мыслей о пище
Ограничения:
Седация у 28% пациентов
Риск метаболических нарушений (уровень глюкозы ↑ на 0.8 ммоль/л)
2. Кветиапин
Дозирвока: 25-50 мг/сут
Результаты:
↓ Тревожности
↓ Меньший риск метаболических эффектов в сравнении с Оланзапином
3. Арипипразол (2-5 мг/сут):
↑ Когнитивная гибкость
↓ Риск метаболических нарушений
АД:
Миртазапин
Дозировка: 15-30 мг/сут
Результаты:
↓ Тревожности (↓ на 30–40% по шкале HAM-A)
WFSBP, 2023
24.
• В рамках наблюдательного исследования применения психофармакотерапии у пациентов с нервнойанорексией с экстремально низким весом при лечении в стационаре был проведён ретроспективный
анализ историй болезни (n = 47) с оценкой состояния пациентов в катамнезе (1–2 года). В
исследование были включены все пациенты обоих полов с диагнозом НА (n = 47) и ИМТ < 13 кг/м2,
которые были госпитализированы в 2021–2022 гг. в стационарное отделение Клиники расстройств
пищевого поведения (КРПП).
• У 19,1 % был диагностирован депрессивный эпизод (F32).
• Антипсихотики были назначены в 44 (93,6 %) случаях в течение первой недели лечения, из них в 26 (59
%) случаях с первого дня. В качестве первого антипсихотика в 37 (84 %) случаях назначали оланзапин.
Доза оланзапина варьировалась от 2,5 до 15 мг/сут, а средняя суточная доза составила 9,54 мг. К
концу стационарного лечения оланзапин принимали 24 (54,5 %) пациента. Антидепрессанты были
назначены в 42 (89,3 %) случаях. В отличие от антипсихотиков, антидепрессанты чаще назначались не
сразу: только в 26 (61,9 %) случаях они были назначены в течение первой недели лечения, у 8 (19,1 %)
пациентов — со второго месяца стационарного лечения. Миртазапин оказался антидепрессантом
первого выбора в 28 (66,7 %) случаях и 21 (75 %) пациент продолжил его прием. Стандартные дозы
составляли 30–45 мг/сут. На момент выписки миртазапин принимали 24 (57,1 %) пациента, сертралин
— 8 (19 %).
• Удовлетворенность лечением составила 82% (опросник ВОЗКЖ-26). 88.9% пациентов
работали/учились в катамнезе. 63.8% пациентов достигли ИМТ >16 кг/м² к моменту выписки. Через 1–
2 года 72.7% сохранили ИМТ >16 кг/м². Пациенты с коморбидной депрессией чаще достигали
целевого ИМТ в 88,89 % случаев.
• По данным других исследований, в которых на ранних этапах не вводилась фармакотерапия: 58%
пациентов с ИМТ <13 кг/м² достигли ИМТ >16 кг/м² через 1 год. 50% пациентов с тяжелой НА отмечают
улучшение при стандартном лечении.
Karpenko et al., 2024; Guinhut et al., 2021; Marzola et al., 2021
25.
Фаза стабилизации (ИМТ 16–18):
Препараты с доказанной эффективностью при НА и ДР
СИОЗС (селективные ингибиторы обратного захвата серотонина):
Флуоксетин (40–60 мг/сут):
Эффективность: снижение рецидивов на 40–50% по сравнению с плацебо
Особенности: может усиливать тревогу в начале терапии
Сертралин (50–150 мг/сут):
Сертралин показал ответ у 40–45% пациентов с НА+ДР
Преимущество: меньше лекарственных взаимодействий
Особенно полезен при коморбидном ОКР
Миртазапин (15–45 мг/сут):
Комбинированная терапия
При резистентных случаях может быть эффективно сочетание:
СИОЗС + низкие дозы оланзапина
Комбинация флуоксетина (60 мг/сут) + оланзапин (5 мг/сут) привела к снижению рецидивов на 50% в сравнении с монотерапией (через 12
месяцев)
Миртазапин + арипипразол (при выраженной тревоге и когнитивных нарушениях)
Сочетание миртазапина (30 мг/сут) + арипипразол (5 мг/сут) привело к снижению тревожности (по шкале HAM-A) на 45% через 8 недель и
улучшению исполнительных функций (тест Trail Making B).
Ограниченность данных, большинство исследований комбинированной терапии — открытые или ретроспективные.
Поддерживающая фаза: минимум 12 месяцев терапии после ремиссии
Attia et al., 2019; Davis et al., 2023; Frank et al., 2023
26. Заключение
• Современные подходы к лечению коморбидности нервнойанорексии (НА) и депрессивного расстройства (ДР) требуют
комплексного понимания нейробиологических механизмов и
клинических особенностей данной группы пациентов.
Современные данные подтверждают, что мультимодальный
подход, сочетающий фармакотерапию, нутритивную поддержку и
психосоциальные вмешательства, позволяет достичь устойчивой
ремиссии у пациентов с коморбидной НА и ДР.

























 medicine
medicine psychology
psychology








