Similar presentations:
Основы лучевой терапии в онкологии
1.
ОСНОВЫ ЛУЧЕВОЙТЕРАПИИ В ОНКОЛОГИИ
Доцент кафедры онкологии, к.м.н. Ткачук Ольга Анатольевна
Ассистент кафедры онкологии Ефанова Екатерина Владимировна
2. ВВЕДЕНИЕ
Медицинская радиология — областьмедицины, разрабатывающая теорию и
практику
применения
излучений
в
медицинских целях. Медицинская радиология
включает в себя две основные научные
дисциплины: диагностическую радиологию
(лучевую диагностику) и терапевтическую
радиологию (лучевую терапию).
Лучевая терапия- это метод лечения с
использованием ионизирующих излучений
3. АКТУАЛЬНОСТЬ ТЕМЫ:
Лучевая терапия в клинической онкологии занимаетодно из ведущих мест. В настоящее время около 2/3
онкологических больных нуждаются в лучевой
терапии.
4. ЦЕЛЬ ЛЕКЦИИ
Познакомить слушателей с основами лучевойтерапии
Обозначить алгоритмы назначения лучевой
терапии онкологическим пациентам
5.
ПЛАН ЛЕКЦИИ1. Международные требования к облучению
2. История развития лучевой терапии
3. Физические основы радиотерапии
4. Радиочувствительность
5. Алгоритм назначения лучевой терапии
6. Методы лучевой терапии
7. Варианты лучевой терапии
8. Фракционирование
9. Лучевые повреждения
10.Выводы
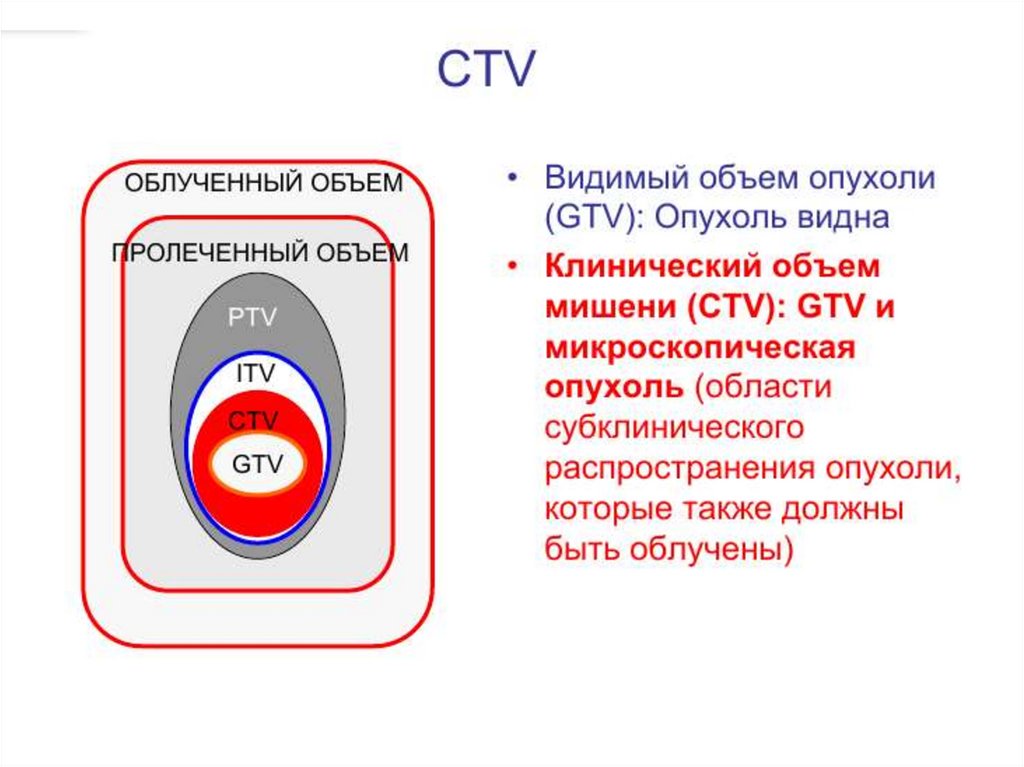
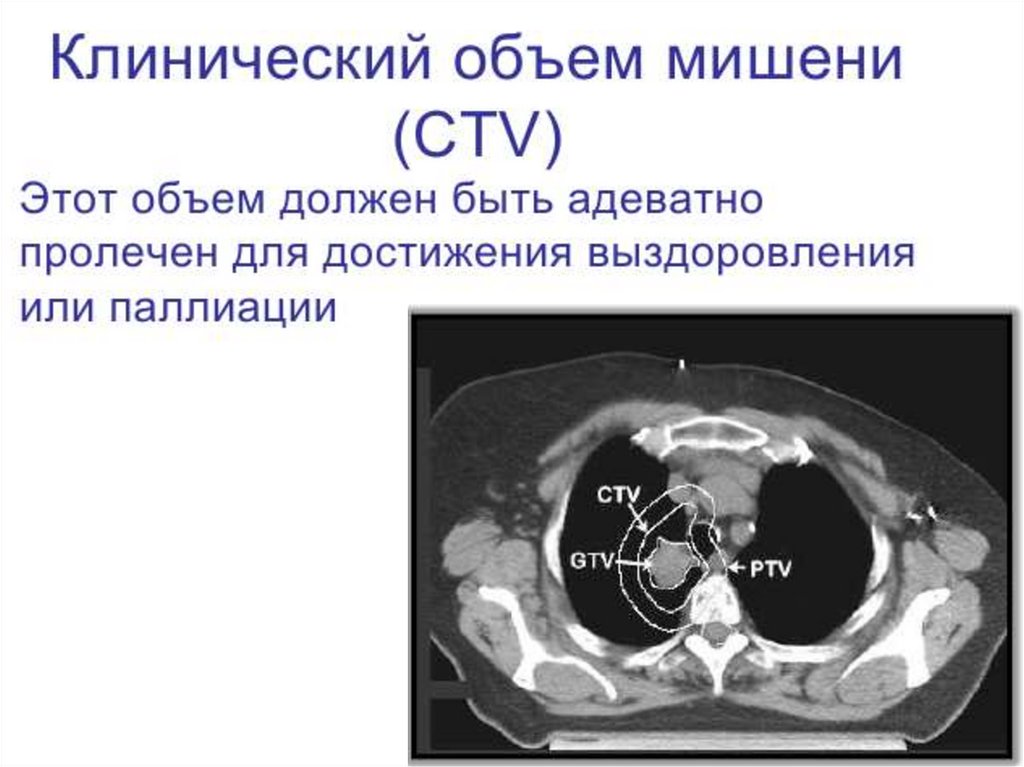
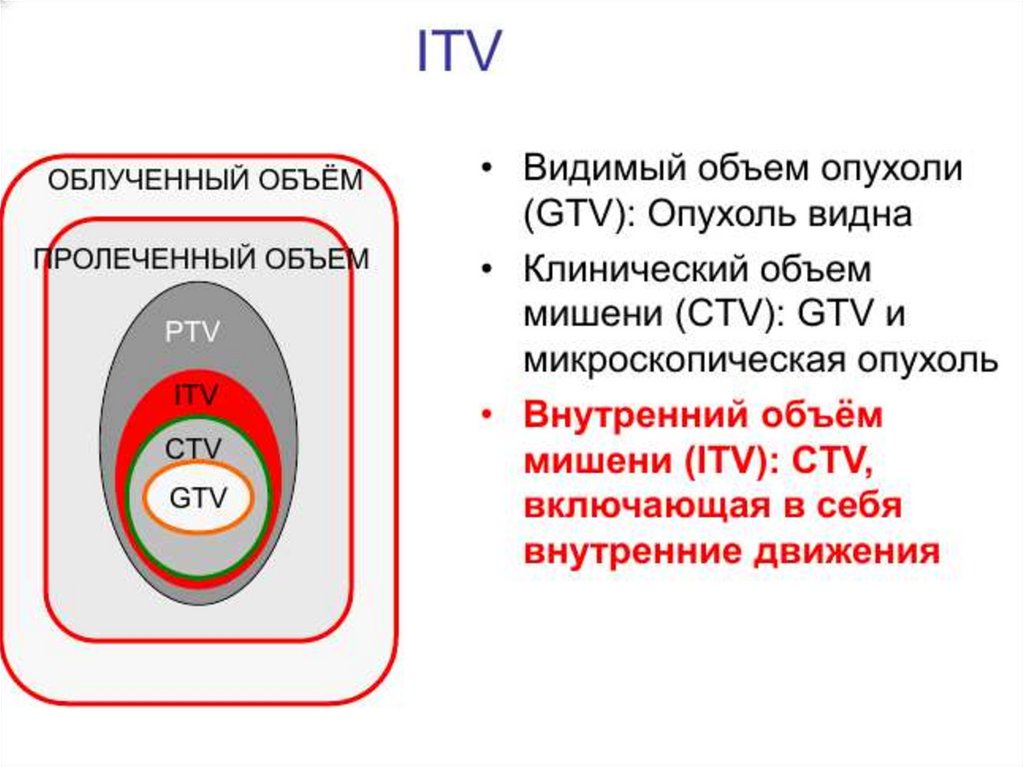
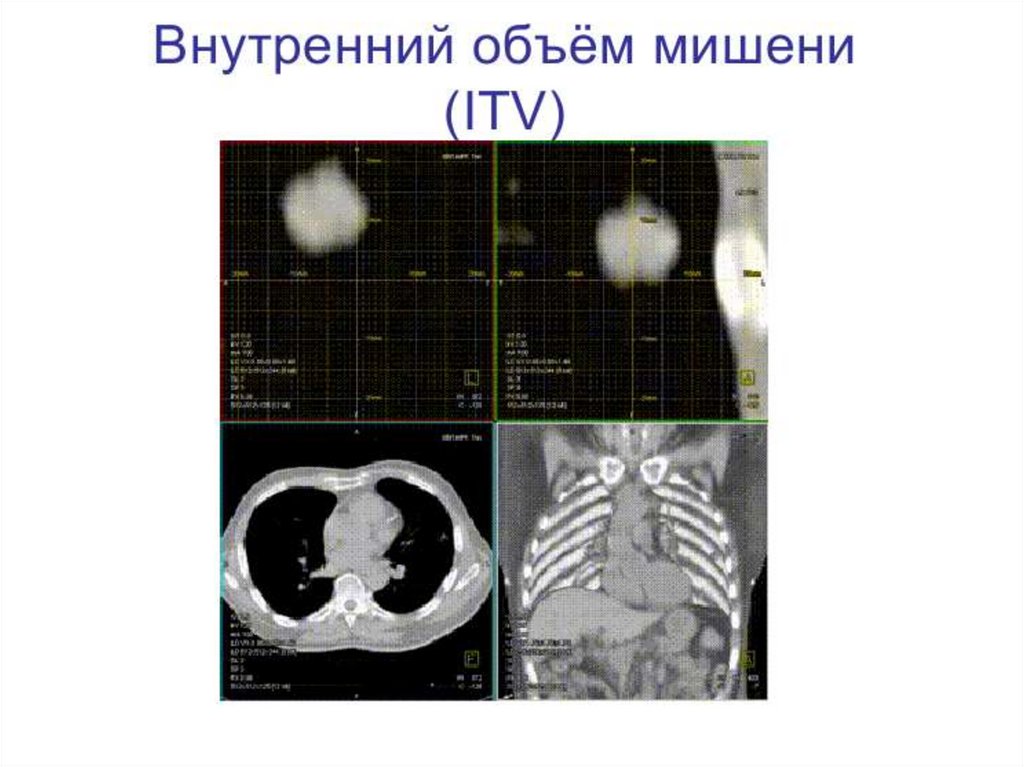
6. Международные требования к облучению
Международная комиссия по радиационным
единицам и измерениям (МКРЕ / ICRU).
Год создания 1928 г.
Основные требования к облучению изложены в
докладах МКРЕ.
Цель МКРЕ - разработка концепций, определений и
рекомендаций для использования величин и их
единиц для ионизирующего излучения и его
взаимодействия с веществом, в частности, в
от
ношении биологических эффектов, вызываемых
излучением.
7.
Международные требования коблучению
• Состоит из Главной Комиссии и четырёх
Комитетов:
по Радиационной защите,
по Дозам радиационного воздействия,
по Защите в медицине,
по Применению рекомендаций МКРЗ.
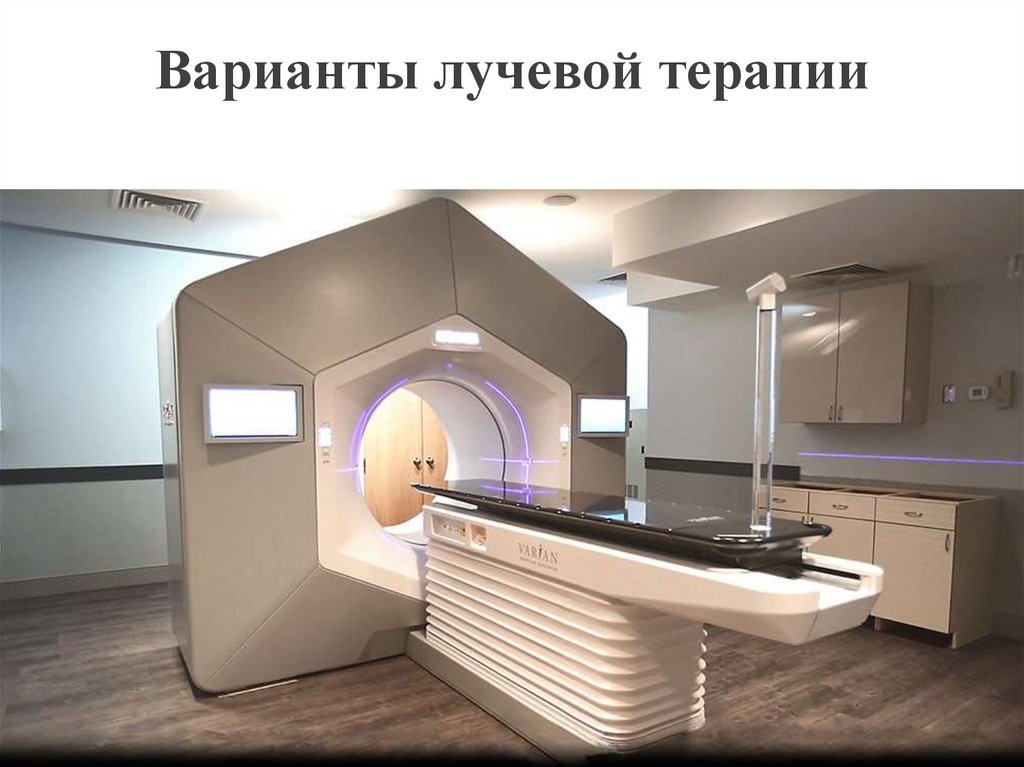
Ранее существовал комитет по Защите окружающей
среды.
• МКРЗ
предлагает
свои
рекомендации
организациям по нормированию и научному
сопровождению в качестве помощи в руководстве и
реализации мер радиационной защиты.
8. Международные требования к облучению
Целью лучевого лечения является уничтожениезлокачественных клеток в месте их возникновения
и на путях метастазирования, повышения качества
и продолжительности жизни.
Метод лучевой терапии заключается в подведении
точно измеренной дозы излучения к обозначенном
у объёму опухоли и как можно меньшим поврежде
нием нормальных тканей.
9. Совершенствование лучевой терапии направлено на
Обеспечение максимальной разницы в воздействииизлучения на опухоль и близлежащие здоровые
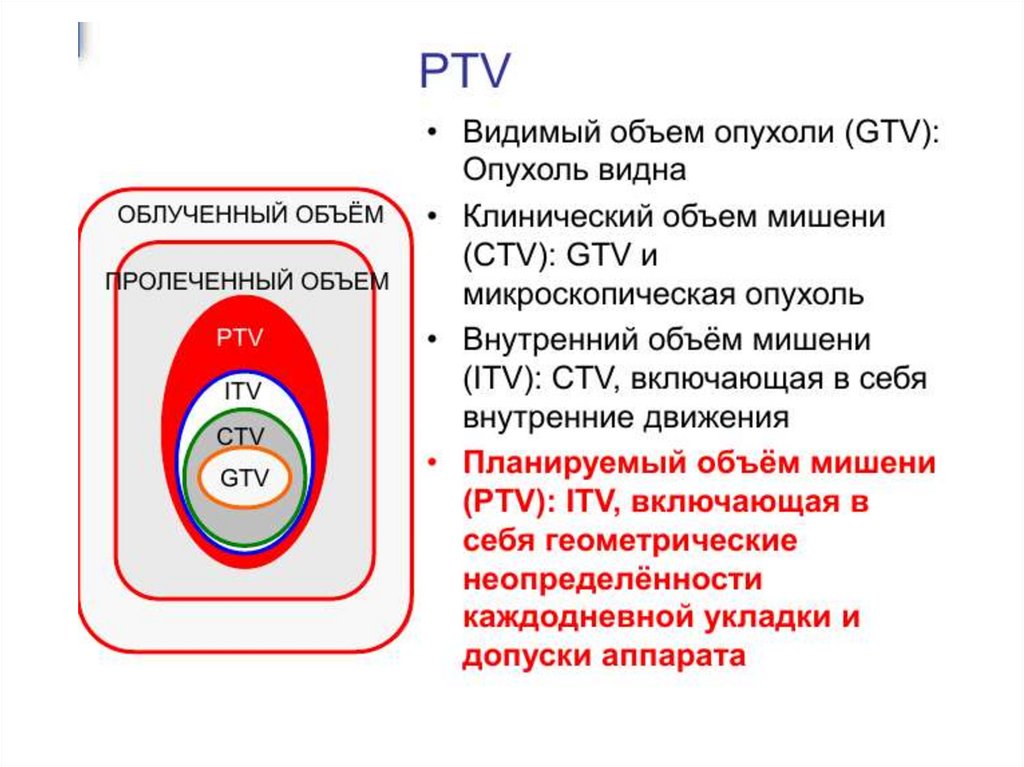
ткани:
• Повышение уровня физического фокусирования
(направление энергии излучения только на раковую
опухоль)
• Повышение уровня биологического фокусирования
(модулируемое фракционирование и химиолучевая
терапия)
10.
История развития лучевой терапии8 ноября 1895 года открытие X лучей
1901 год - Нобелевская
премия по физике за
открытие Х- лучей.
Вильгельм Конрад Рентген
(1845–1923)
11.
История развития лучевой терапии29 января 1896 года – первый
сеанс лучевой терапии у
больной с неоперабельным
раком левой молочной железы
Эмиль Генрих Груббе
(1875–1960)
12.
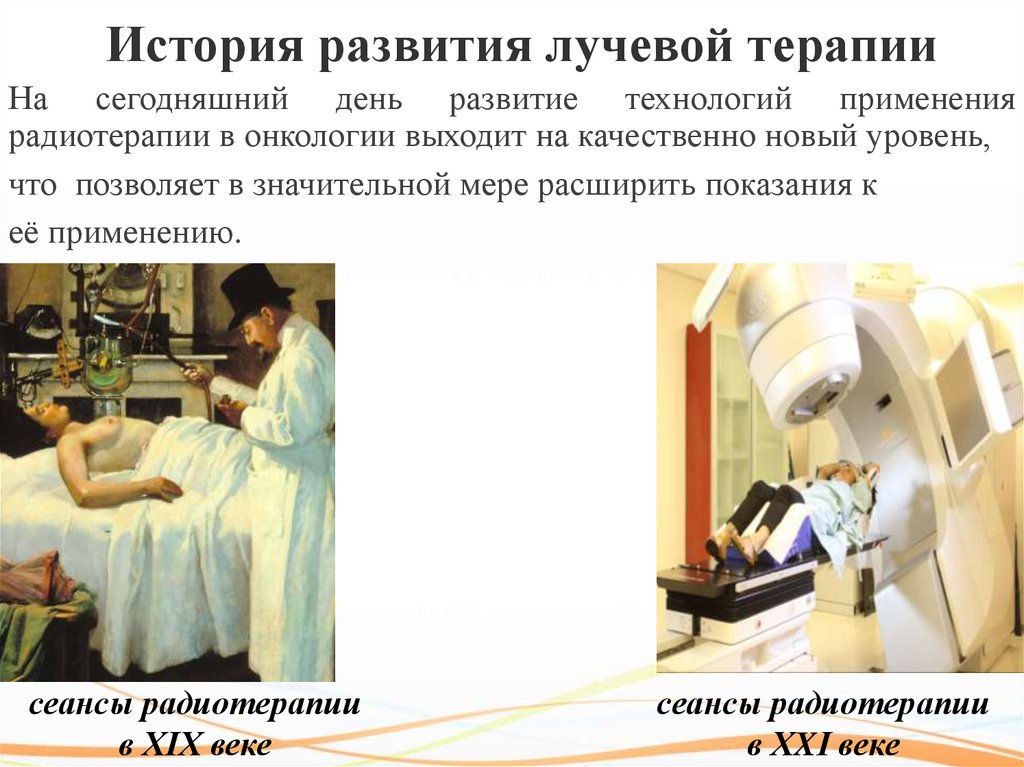
История развития лучевой терапии13.
История развития лучевой терапииНа сегодняшний день развитие технологий применения
радиотерапии в онкологии выходит на качественно новый уровень,
что позволяет в значительной мере расширить показания к
её применению.
сеансы радиотерапии
в XIX веке
сеансы радиотерапии
в XXI веке
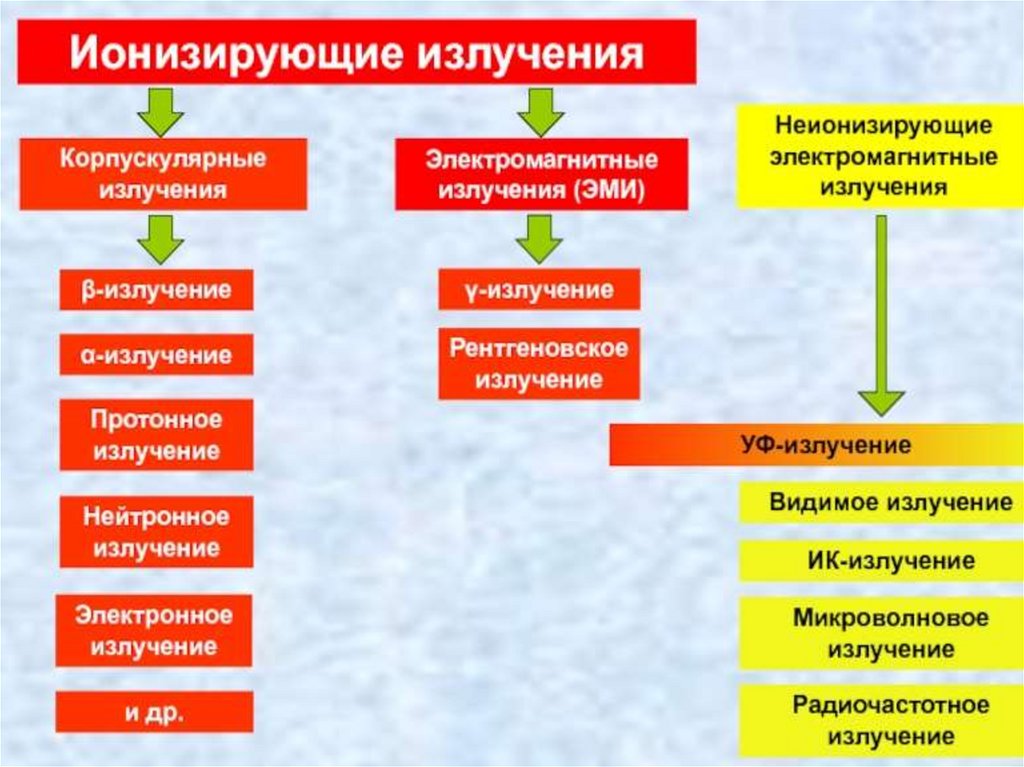
14. Физические основы радиотерапии
Ионизирующее излучение- любоеизлучение, взаимодействие которого с
облучаемым веществом приводит к
образованию электронных зарядов
различных знаков.
15.
16. Действие ионизирующего излучения
Прямое действие ионизирующего излучения(1/3) происходит в результате
непосредственного повреждения ДНК
Непрямое действие или косвенное (2/3)
происходит в результате появления свободных
радикалов, образующихся в результате
ионизации молекул H2O.
17.
18. Стадии морфологических лучевых изменений в опухолевых тканях:
• Повреждение опухоли• Разрушение опухоли (некроз)
• Замещение погибшей ткани
Чувствительность любой злокачественной опухоли к
излучению зависит от специфических особенностей
составляющих ее клеток, и в первую очередь, от
радиочувствительности ткани, из которой опухоль
произошла. Гистологическое строение опухоли является
ориентировочным
признаком
прогнозирования
радиочувствительности.
19.
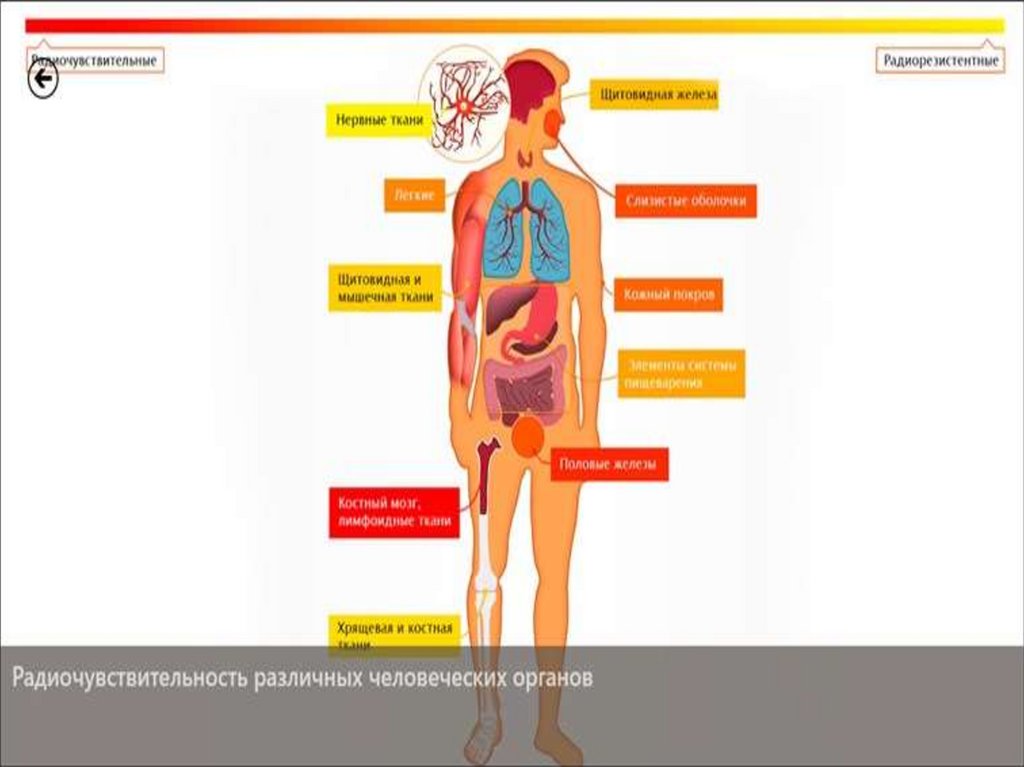
Радиочувствительность зависит от:1. Характера роста опухоли (экзофитные)
2. Размера опухоли (минимальные)
3. Длительности ее существования / не длительно существующие
1. Фазы клеточного цикла (митоз)
2. Степени дифференцировки (низкодифференцированные)
3. Оксигенации (хорошо оксигенированные)
Радиочувствительные
Радиорезистентные
Семиномы
Фибросаркома
Лимфомы
Остеогенные саркомы
Опухоли Юинга
Аденокарцинома желудка
Мелкоклеточный рак легкого
Гипернефромы
20.
21. Таким образом,
благодарязнанию
основных
радиобиологических законов и положений,
появилась
возможность
прогнозировать
вероятность резорбции опухоли
после
воздействия
ионизирующего
излучения,
возникновения лучевых реакций и лучевых
осложнений,
оценить биологическую
эффективность дозы излучения с помощью
различных математических моделей.
22.
Алгоритмы назначения лучевойтерапии онкологическим пациентам
23. Этапы проведения лучевой терапии (ЛТ)
1. Принятие решения о проведении лучевой терапиимеждисциплинарном консилиуме.
2. Консультация пациента в отделении и определение
объемов, разовых и суммарных доз облучения.
3. Иммобилизация пациента.
4. КТ - топометрия – разметочная КТ
5. Оконтуривание мишеней и органов риска.
6. Планирование лечения
7. Проверка лечебного плана на фантомах.
8. Лечение пациента.
на
24. Решение о назначении ЛТ устанавливается консилиумом врачей
ПРИКАЗ МЗ РФ 116 Н от 19 февраля 2021 года:Приказ МЗ России от 19.02.2021 N 116н (ред. от 24.01.2022)
"Об утверждении Порядка оказания медицинской помощи
взрослому населению при онкологических заболеваниях"
Консилиум:
онколог-хирург, врач- химиотерапевт, врач- радиотерапевт.
Решение онкологического консилиума, оформленное
протоколом, вносится в медицинскую документацию
пациента.
25.
1. КонсилиумНазначается лучевая терапия (ЛТ) только
при морфологической верификации диагноза
При назначении ЛТ учитывается:
1. Стадия онкологического процесса
2. Радиочувствительность опухоли
3. Общее состояние пациента (ECOG)
4. ЛТ радикальная, паллиативная, как компонент
комплексного или комбинированного лечения
26.
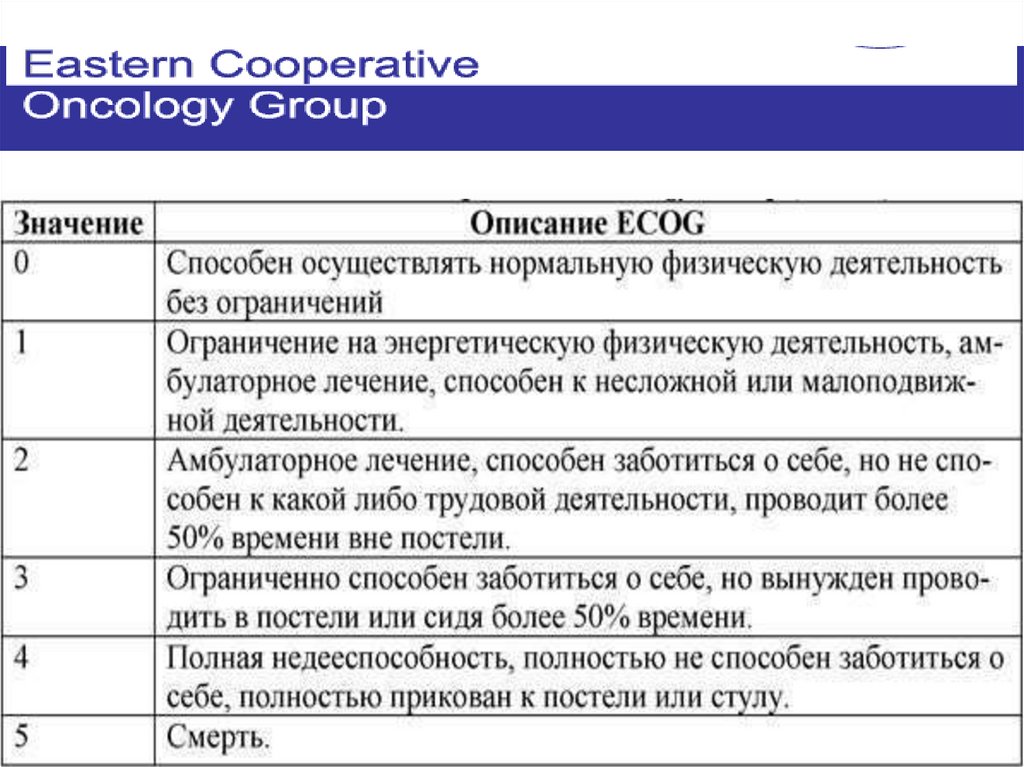
Перед назначением ЛТ необходимо оценить статуспациента по шкале ECOG
Шкала ECOG
(Eastern Cooperative Oncology Group) была
разработана Восточной Кооперативной Группой
Исследования Рака в 1955 году.
С целью более точной
оценки эффективности
различных способов лечения
ученые этой группы разработали Шкалу ECOG,
основываясь
в
основном
на
свободу
деятельности
пациента.
27.
28.
2. Консультация пациентаврачом- радиотерапевтом
для выбора ЛТ, объёма
облучения и т.д.
29. Классификация методов лучевой терапии
I. Дистанционная лучевая терапия1. Рентгенотерапия
2. Дистанционная гамма терапия (γ-терапия) с традиционным двумерным
облучением
3. Лучевая терапия тормозным рентгеновским излучением высокой энергии
3.1 Двухмерная лучевая терапия (конвенциальная)
3.2 Трехмерная лучевая терапия
3.2.1 3D CRT (конформная лучевая терапия)
3.2.2 IMRT (лучевая терапия с модуляцией интенсивности)
3.2.3 IGRT (Лучевая терапия под визуальным контролем)
3.3.3. VMAT (объемно-модулированная терапия )
3.3 (4-мерная лучевая терапия, с контролем дыхания)
3.4 SBRT/SABR (стереотаксическая лучевая терапия )
3.5 SRT стереотаксическая радиохирургия
4. Лучевая терапия заряженными частичками (β-, α-, протоны, нейтроны, ионы и
т.д.)
30. Рентгенотерапия
Аппаратрентгенотерапевтический
Wolf T-200
при терапии
поверхностных
заболеваний кожи
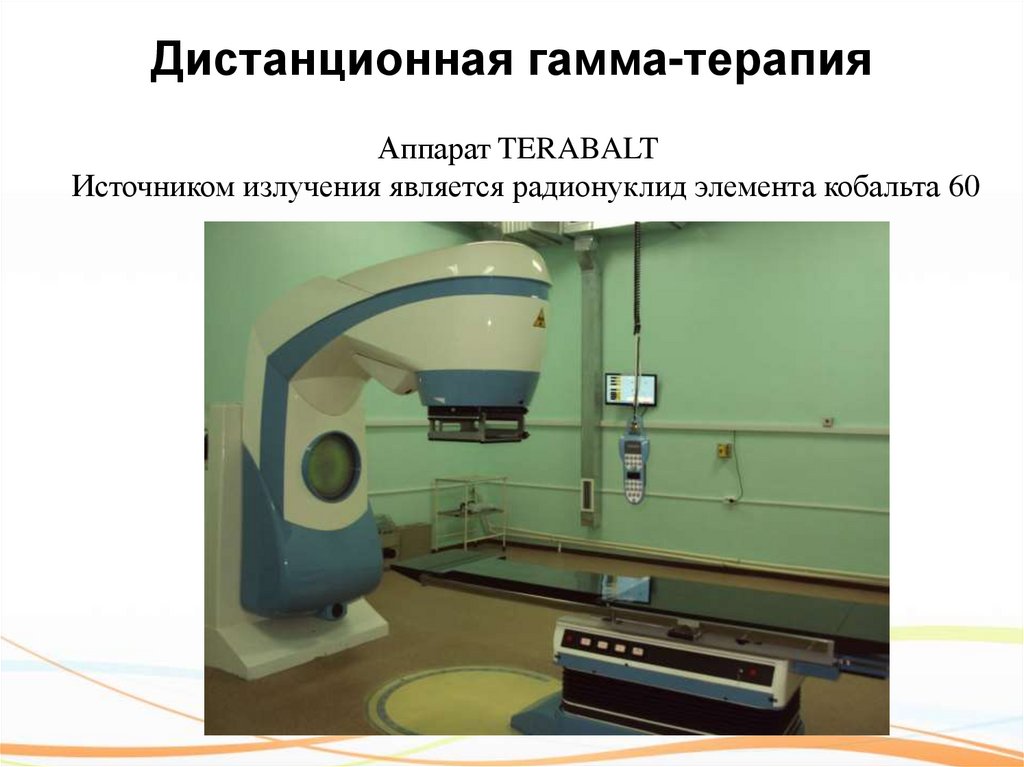
31. Дистанционная гамма-терапия
Аппарат TERABALTИсточником излучения является радионуклид элемента кобальта 60
32. 3D конформная лучевая терапия
Линейный ускорительArtiste
с многолепестковым
коллиматором.
33. IGRT технология
Лучевая терапия с наведением изображения.Данная методика заключается в том, что перед
тем как начать облучение, выполняется
сравнение текущего положения пациента, с тем
положением, для которого осуществлялся
теоретический расчет алгоритма облучения.
Это осуществляется при
помощи
специализированной системы визуализации,
встроенной в аппарат лучевой терапии.
Перед лечением пациент сканируется, а затем
программа сравнивает текущее положение
пациента с изначальным, и при необходимости
осуществляется корректировка столом аппарата.
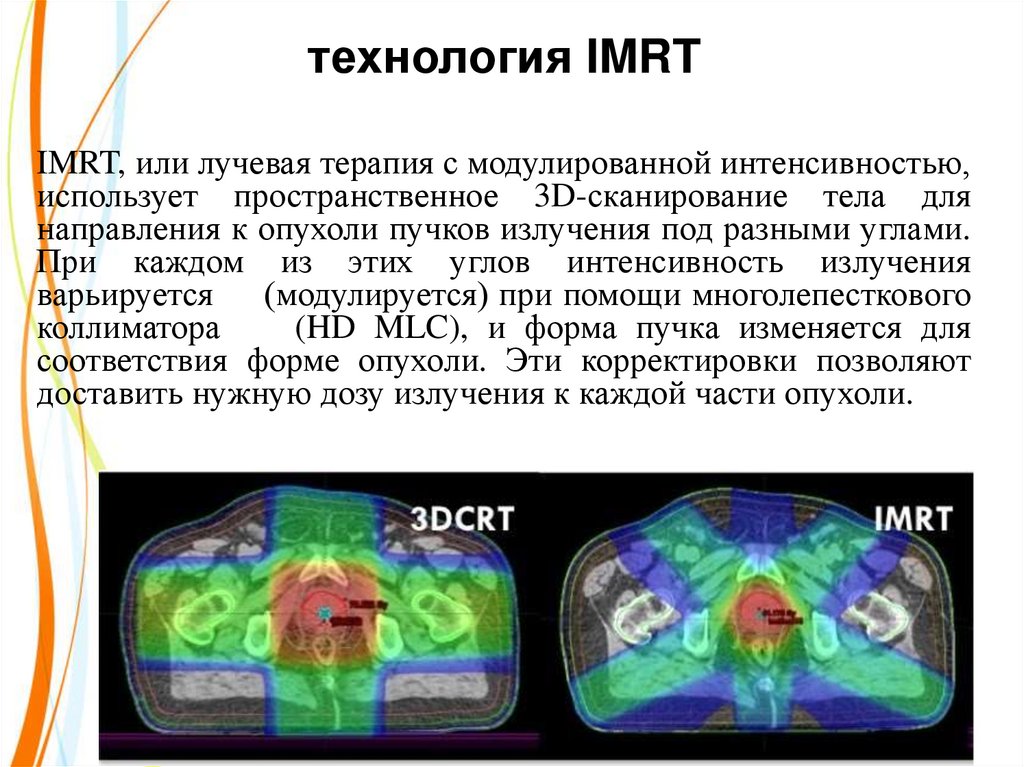
34. технология IMRT
IMRT, или лучевая терапия с модулированной интенсивностью,использует пространственное 3D-сканирование тела для
направления к опухоли пучков излучения под разными углами.
При каждом из этих углов интенсивность излучения
варьируется (модулируется) при помощи многолепесткового
коллиматора
(HD MLC), и форма пучка изменяется для
соответствия форме опухоли. Эти корректировки позволяют
доставить нужную дозу излучения к каждой части опухоли.
35.
Томотерапия – инновационный радиотерапевтический метод, позволяющий одновременно использовать возможности IMRT и IGRT. Прибор ]
томотерапии – самая новая разработка в области радиотерапии опухолей,
аппарат последнего поколения для проведения современных видов лучевой тера
пии. Метод основан на послойном облучении веерным пучком фотонов с модуля
цией интенсивности и реализуется при помощи установки,
комбинирующей в себе функциональные возможности линейного
ускорителя и спирального компьютерного томографа. Преимуществом
является возможность облучения множества «мишеней-опухолей» за один
сеанс. Это применяется для опухолей, обладающими тенденцией к
распространению на большие пространства и имеющими неровные формы.
Для таких обширных зон облучения томотерапия является оптимальным
решением, так как она позволяет произвести облучение поражённых
метастазами органов, соблюдая высокую точность дозировки, и,
одновременно, не затрагивая при этом область сердца и лёгких. Можно
проводить без рисков для пациента облучение пространств длиной до 1,6 м.
36. Технология VMAT или RapidArc
С помощью VMAT доза излучения воздействует на опухольпутем непрерывного вращения гантри ускорителя до 360°.
Во время сеанса в ускорителе, по заданной программе,
непрерывно двигаются тончайшие металлические пластины
(многолепестковый коллиматор - HD MLC), которые
обеспечивают защиту здоровых тканей.
37.
Стереотаксическая радиохирургия (СР)СР является не оперативным вмешательством, а одним из современных
методов лучевой терапии, использующим стереотаксические техники. Для
проведения процедуры используется уникальная аппаратура: Гамма-Нож,
радиохирургический робот Кибер-Нож.
Гамма-Нож – стационарная радиохирургическая установка, в которой
источники
излучения располагаются по диаметру полусферы. С помощью
Гамма-Ножа в нужную точку подается мощнейшая доза излучения,
Образующаяся за счет подачи с разных полей небольших доз и пересечения
лучей в одной точке, что обеспечивает концентрацию в ней энергии,
необходимой для уничтожения клеток новообразования.
При этом окружающие здоровые ткани мозга и организма в целом не
подвергаются облучению. С помощью таких лучей можно как бы обвести
раковую опухоль, аккуратно выделив ей из здоровых тканей.
38.
Кибер-нож – это мобильная радиохирургическая система, применяемая при лечениидоброкачественных и злокачественных опухолей по всему телу с субмиллиметровой
точностью. Эта система состоит из линейного ускорителя, обеспечивающего
перемещение и наведение линейного ускорителя с высочайшей точностью. Это
позволяет минимизировать риск лучевого поражения здоровых тканей рядом с
новообразованием.
Кибер-Нож является универсальной установкой, а Гамма-Нож
предназначен исключительно для лечения заболеваний головы, шеи, мозга.
Стереотаксическая радиохирургия является высокоэффективной альтернативой
инвазивной хирургии, особенно при опухолях и аномалиях кровеносных сосудов,
расположенных глубоко в мозге или вблизи жизненно важных его областей.
Радиохирургическое лечение хорошо переносится больными, может проводиться в
амбулаторных условиях. В большинстве случаев требуется всего один сеанс облучения.
39.
Стереотаксическая радиохирургия – это методточного подведения больших разовых
очаговых доз от 7-20 Гр.
Используется для лечения опухолей головного
мозга, в т.ч. метастатического поражения
(меланомы,
легких,
молочной
железы).
По данным НИИ онкологии им. Петрова
выживаемость пациентов с MTS в легкие
после проведенного стереотаксиса составляет
около 2-х лет.
40.
Показания к проведению SRS- Наличие от 1 до 4 метастазов
- Хорошая визуализация опухоли при МРТ и
при совмещении с КТ исследованием
- Размер очага не более 3,0 см
- Ожидаемая продолжительность жизни
больного не менее 3-х месяцев
- Хороший или промежуточный прогноз
41.
Ионная терапия, новейший метод ЛТ, для лечении тяжелых форм рака.Наиболее часто применяются ядра водорода – протоны, что и явилось причиной
для названия метода – протонная терапия.
При протонной терапии применяется другой физический фактор – заряженные
частицы (ионы). Они ведут себя совершенно по-иному, когда проходят ткани
человеческого организма. Протонный пучок высвобождает энергию,
губительную для раковых клеток, только в момент торможения при контакте с
опухолью.
Здоровые ткани протоны проходят на высокой скорости (близкой к скорости
света) и практически не воздействуют на них. В этом и состоит главное
преимущество нового метода: он позволяет, невзирая на более высокую
интенсивность пучка ионов, существенно понизить дозу облучения,
приходящуюся на долю здоровых тканей. Специальная система точно локализует
пространство, где протонный пучок должен быть заторможен, отклонение
составляет не более 0,5 мм.
42.
Именно поэтому радиологи говорят, что у них «наконецпоявилась возможность облучать опухоль, а не пациента».
Эффективность лечения протонной терапией при неметастазирующих
опухолях достигает почти 100%.
Преимуществом лучевой терапии с применением протонной энергии также
является снижение риска побочных реакций со стороны здоровых тканей,
этот вид лечения лучше переносится пациентами и не требует обязательной
госпитализации, что позволяет провести лечение амбулаторно и в более
короткие сроки.
Кроме того, снижается риск вторичных опухолей, как следствия лучевой
терапии, что позволяет применять протонную терапию в детской онкологии.
Протонная терапия уже начала постепенно вытеснять традиционное
гамма – и рентгеновское облучение.
43.
Медики возлагают большие надежды на облучение ионамивысоких энергий в основном, ионами углерода.
Считается облучение тяжелыми ионами еще более
эффективным, нежели облучение протонами. В результате
облучения ускоренными ионами углерода-12 молекула ДНК
вещества опухоли буквально перерезается в нескольких местах
и полностью теряет способность к восстановлению. При
применении ускоренных ионов углерода возможно лечение
даже резистентных видов рака. Разработка немецких ученых
дает надежду тем пациентам, у которых традиционная терапия
не приносит результата.
Новая технология - облучение ионами высоких энергий – по
эффективности превосходит все существующие методики.
44.
Нейтронная и нейтрон-захватная терапии.Многие злокачественные опухоли, например, глиобластомы мозга,
поддаются излечению только нейтронами.
Метод нейтрон - захватной терапии состоит в облучении пациента
тепловыми нейтронами (тепловые нейтроны весьма мало взаимодействуют
с биологическими тканями) с предварительным введением в зону опухоли
соединений с атомами, ядра которых имеют большое сечение захвата
тепловых нейтронов. Обычно используют химические соединения,
содержащие атомы бора или гадолиния.
В результате захвата нейтрона атомом бора происходит ядерная реакция с
испусканием ядер гелия (альфа-частица) и ядер лития. Они вызывают
гибель раковых клеток.
45.
Радиоиммунотерапия – это доставка излучения непосредственно взлокачественное новообразование посредством антител, меченных
радиоактивными метками. Антитела – это высокоспецифичные белки,
которые образуются в организме в ответ на возникновение антигенов. У
ряда опухолевых клеток имеются специфические антигены, запускающие
производство опухоль-специфических антител. Есть возможность
выращивания большого количества таких антител в лаборатории, к которым в
дальнейшем присоединяют радиоактивные метки. Попадая в организм,
антитела соединяются с раковыми клетками и разрушают их излучением.
Подобный подход позволяет минимизировать риск повреждения соседних
здоровых тканей. Уже существуют препараты, применяемые в лечении
распространенной неходжкинской лимфомы у взрослых. В клинических
испытаниях изучается лечение такими препаратами рака легкого, печени,
простаты, мозга, молочной железы, щитовидной железы, поджелудочной
железы, яичников, рака кишечника и лейкемии.
46. Классификация методов лучевой терапии
II. Контактная лучевая терапия:Аппликационный – размещение источников на
поверхности тела в специальных аппликаторах;
Внутриполостной – введение источника внутрь
полости тела (полость рта, матки, влагалища,
прямой кишки и т.д.);
Внутритканевой – внутриопухолевое введение
радиоактивных препаратов (иглы, цилиндры,
шарики, короткие стерженьки).
47.
Аппарат Гамма-Мед для внутриполостной ЛТ48.
Манипуляционная для проведения внутриполостной ЛТ49.
Сеанс внутриполостной ЛТ онкогинекологической больной50. Контактный метод ЛТ:
Характеризуется резким падением величины дозы наближайших от источника расстояниях, поэтому
используется лишь для поверхностных, небольших по
объему
опухолях. В самостоятельном плане часто
сочетается с дистанционными методами.
Закрытые радиоактивные препараты –это радионуклиды
заключенные
в
оболочку
–фильтр.
Введение
осуществляется в ручную или при помощи эндостатов –
система after-loading, которые вводятся вручную или
автоматизированно.
51.
Современные методики контактной ЛТ:Брахитерапия, SIRT, Afterloading терапия.
Брахиотерапия или Seed-имплантация заключаются в ведении
мельчайших капсул с радиоактивным препаратом
непосредственно в пораженный болезнью орган. Брахиотерапия
дает возможность провести интенсивное облучение опухоли с
минимальным воздействием на здоровые ткани. Такой метод
лучевой терапии применяется при лечении рака влагалища, матки,
прямой кишки и на начальных стадиях рака предстательной
железы. Имплантация радиоактивных зерен является
малоинвазивным вмешательством и чаще всего проводится в
амбулаторных условиях.
52.
Afterloading-терапия – метод краткосрочного высокодозисногооблучения. Метод заключается во внутриполостном и
внутритканевом введения эндостатов или полых проводников с
последующим введением в них радиоактивных источников.
Пораженные ткани облучаются в течение короткого времени
импульсными дозами излучения. Таким образом, в желаемой
области доза облучения может быть увеличена, не оказывая при
этом значительного воздействия на прилегающие ткани.
Существует специальная радиотерапевтическая техника для
обеспечения автоматизированной подачи радиоактивного
источника в эндостаты и их автоматический возврат в
специальный контейнер-хранилище по окончании сеанса
облучения. Курс лечения включает 2–3 сеанса.
53.
SIRT (селективная внутренняя радиотерапия) – это один изинновационных методов лечения как первичных, так и
метастатических злокачественных опухолей печени.
SIRT-терапия применяется в случае резистентных к
химиотерапии и неоперабельных опухолей. Этот метод ЛТ
основан на введении радиоактивных «микросфер» в опухолевую
ткань печени. Миллионы таких «микросфер» поступают через
катетер в печеночную артерию. Вместе с током крови они
попадают в опухоль и задерживаются в мелких сосудах, которые
снабжают новообразование артериальной кровью. В течение
нескольких дней находящийся в «микросферах» радиоактивный
элемент Иттруим-90 подает излучение, которое уничтожает
раковые клетки.
54.
Тубусы для контактной ЛТ55. Радиационная терапевтическая техника (РТТ)
РТТ –это совокупность технических устройств для получения излучения иих применения в ЛТ.
Для дистанционного облучения, когда источник находится на
расстоянии от пациента используется гамма- и рентгеновские лучи, быстрые
электроны, протоны и др. (Гамма- и рентгеновские установки, бетатроны,
линейные ускорители, ядерные реакторы и др.)
При контактном облучении, когда идет соприкосновение с опухолью,
используют внутриполостное, внутритканевое, аппликационное введение
радиоактивных изотопов.
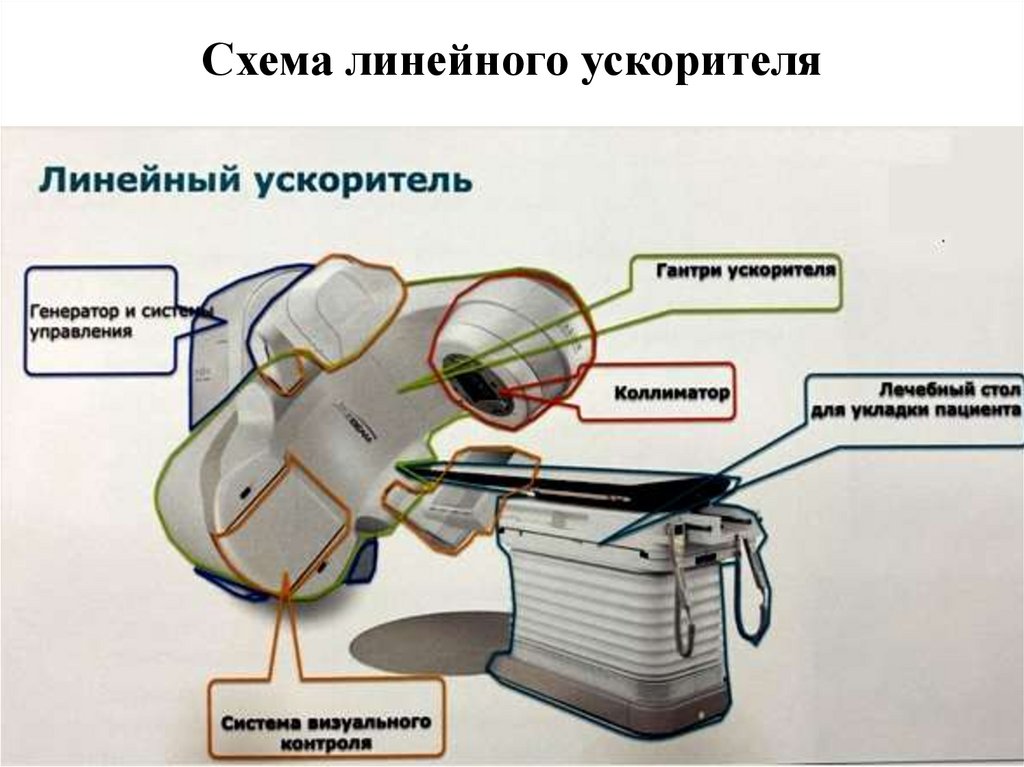
56. Схема линейного ускорителя
57. Линейные ускорители
Varian Truebeam
58. Линейные ускорители
Electa VersaHD
59. Варианты лучевой терапии
60. Радикальная ЛТ
Это лечебное лучевое воздействие на зонуклинического распространения опухоли и
профилактическом облучении зон
возможного субклинического поражения
(регионального метастазирования).
Целью радикальной ЛТ является полная
эрадикация опухоли.
61. Паллиативная ЛТ
Это лечебное лучевое воздействие на зону клиническогораспространения или метастазирования опухоли для
уменьшения тяжелых
клинических симптомов (компрессии,
боли, воспалительной реакции).
Целью паллиативной ЛТ является максимльное
снижение биологической активности, торможение
роста, уменьшение размеров опухоли.
62.
Лучевая терапия может сочетаться с химиотерапией и тогда лечениеназывается химиолучевое.
При гормонзависимых опухолях (рак молочной железы, эндометрия
, предстательной железы) ЛТ проводят в сочетании с гормональным
лечением.
Широко ЛТ применяется в комбинации с
ем.
хирургическим лечени
63.
64.
Предоперационная ЛТЦель - уменьшение опухоли для возможности
хирургического
лечения,
особенно
при
опухолях больших размеров,
подавление
пролиферативной
активности
опухолевых
клеток,
уменьшение сопутствующего
воспаления, воздействие на пути регионарного
метастазирования. уменьшение числа
рецидивов и возникновения метастазов.
65.
Послеоперационная ЛТпроводится в качестве дополнительного
воздействия на остатки опухоли после
нерадикальных
операций
для
уничтожения сублинических очагов и
возможных метастазов в регионарных
лимфатических узлах.
66.
Интраоперационная ЛТ (IORT)подведение высокодозного ионизирующего излучения в процессе
хирургического лечения именно на место, где находилась опухоль, а
также на зоны риска развития рецидива. Преимущество IORT –
возможность с максимальной точностью, узконаправленно подвести
необходимую дозу радиационного излучения к опухоли, при этом
прилежащие органы и ткани не входят в поле воздействия радиации,
поэтому снижается возможность развития лучевых реакций.
Цель IORT –
минимизация риска рецидива
за счет уничтожения
опухолевых клеток,
которые могут быть оставлены
по краям операционной раны.
67. Противопоказания к ЛТ
• Лейкопения• Тромбоцитопения
• Анемия, крвотечение из опухоли
• Кахексия
• Интеркуррентные заболевания с лихорадкой
• Активные формы туберкулеза
• Сердечно-сосудистые заболевания
• Дыхательная недостаточность
• Воспалительные заболевания легких
• Заболевания почек
• ЦНС
• Распад опухоли, перфорации и предперфорации
пораженных опухолью органов
68. пациента
3. Укладка ииммобилизация
пациента
Укладка пациента это создание определенных условий
положения пациента во время КТ-разметки и всего
последующего курса ЛТ.
Цель иммобилизации (лат. immobilis — неподвижный)
- уменьшения погрешностей укладки пациента при
помощи специальных устройств.
.
69. Классификация устройств для иммобилизации пациента:
1. Стандартные - приспособленныедля
облучения мишени в
определенной части
человеческого тела (маммоборд,
подставка под ноги и др.),
маммоборд
подставка под ноги
70. Классификация устройств для иммобилизации пациента:
2. Индивидуальные (термопластичнаямаска, вакуумный матрац).
71. Классификация устройств для иммобилизации пациента:
Вакуумныйматрац
состоит
из
наполнителя
(полистироловые шарики), оболочки синего либо светлоголубого цвета (нейлон, покрытый
с внутренней
стороны полиуретаном), соединительного воздушного
разъема-клапана для накачки/откачки воздуха, а также
пластикового
кольца для подвешивания и хранения.
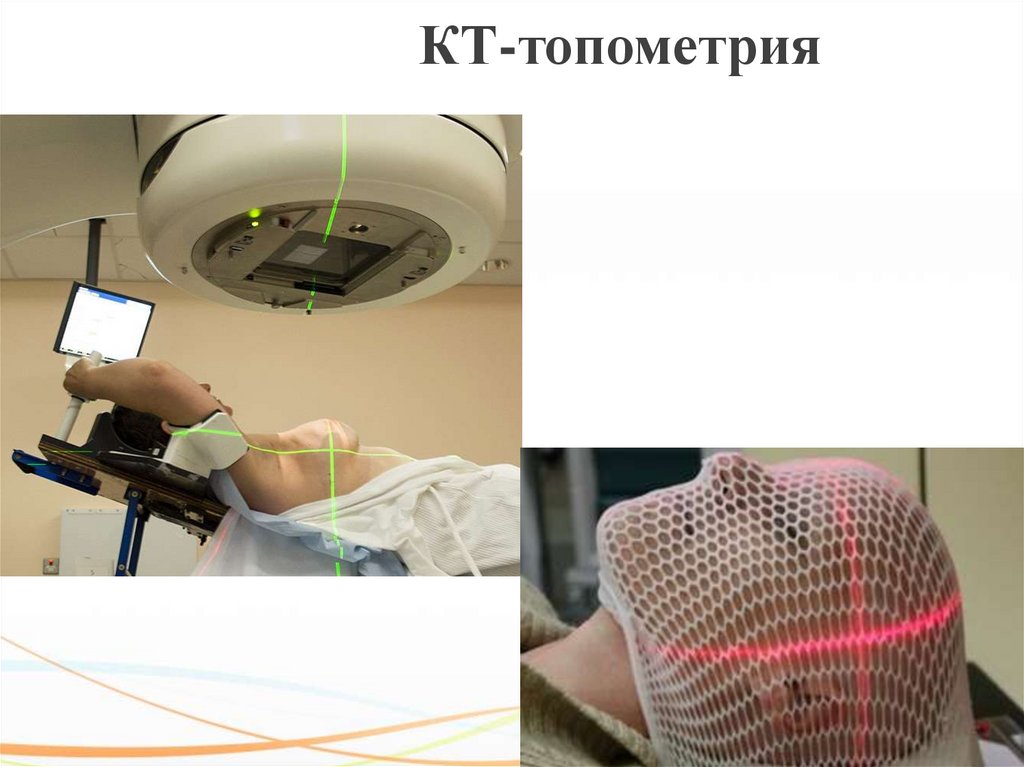
72. 4. КТ – топометрия
КТ-топометрияРазметка на КТ выполняется в положении
последующего лечения с
использованием
фиксирующих приспособлений. Положение и
размеры мишени
(опухоли) и прилегающих
структур определяют на КТ- или МРТизображениях. По данным снимков и при помощи
стационарно установленной
лазерной системы
центрации на теле пациента отмечают опорные
точки (метки), по которым в будущем будет
воспроизводиться укладка для проведения сеансов
ЛТ.
73. КТ-топометрия
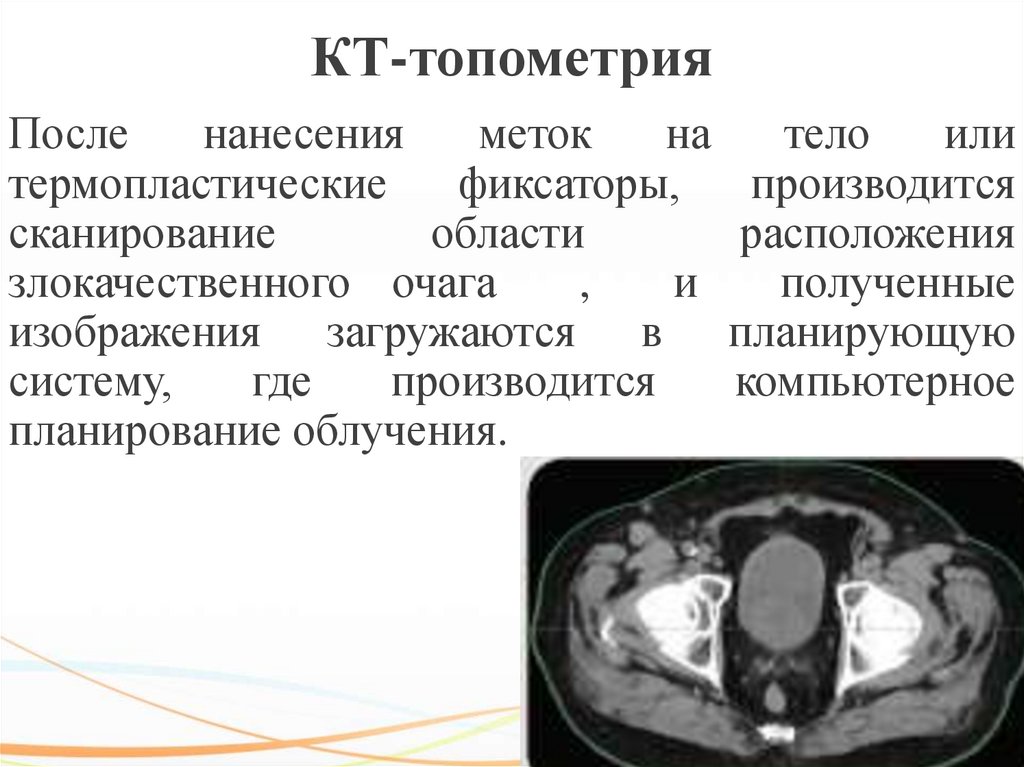
74. КТ-топометрия
Посленанесения
меток
на
тело
или
термопластические
фиксаторы,
производится
сканирование
области
расположения
злокачественного очага
,
и
полученные
изображения загружаются в планирующую
систему,
где
производится
компьютерное
планирование облучения.
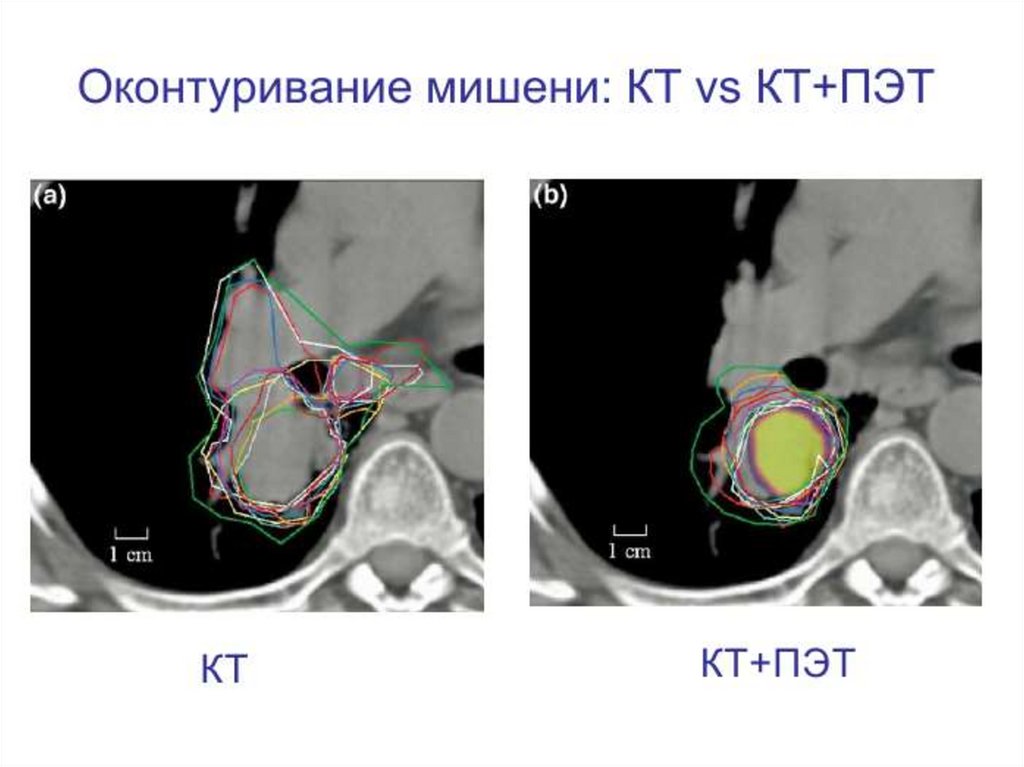
75. Fusion
Fusion - это методикасовмещения
КТ и МРТ
(ПЭТ-КТ) срезов , которая
позволяет
более
точно
визуализировать опухоли и
соответственно
более
качество их оконтуривать.
76.
77.
78.
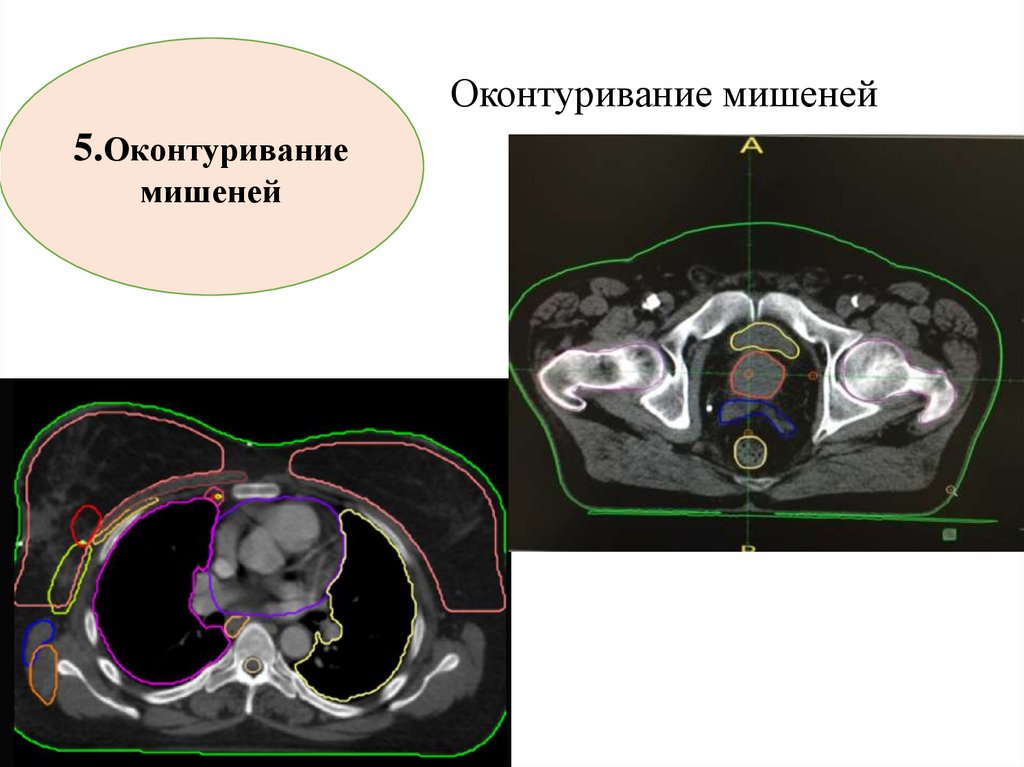
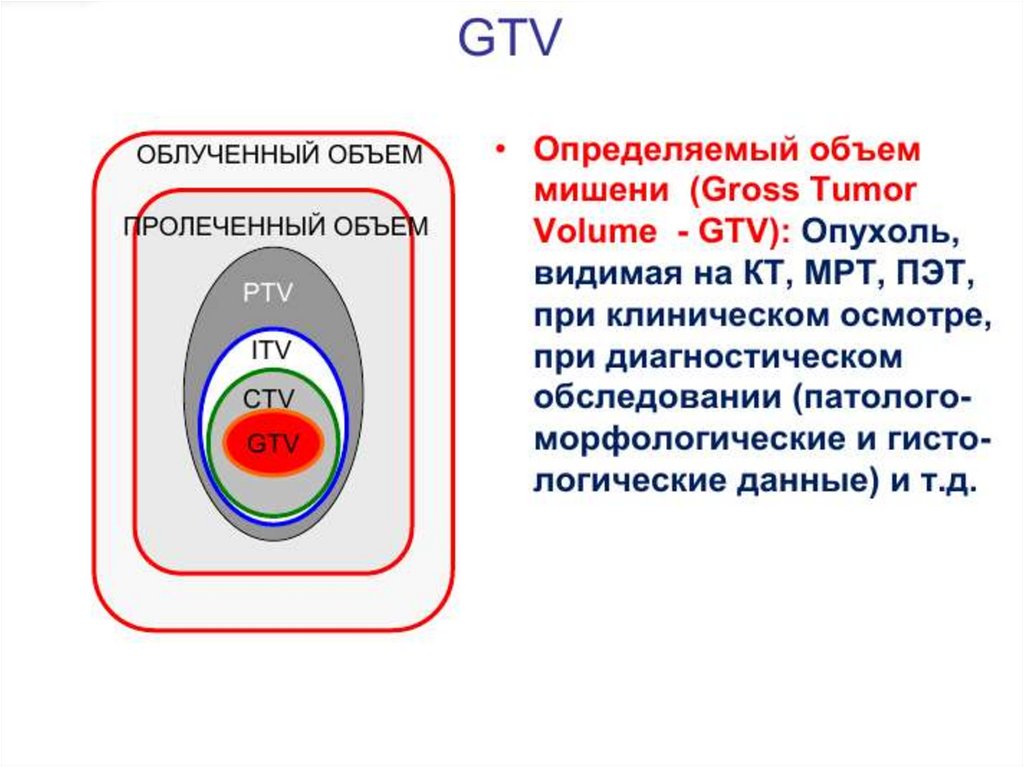
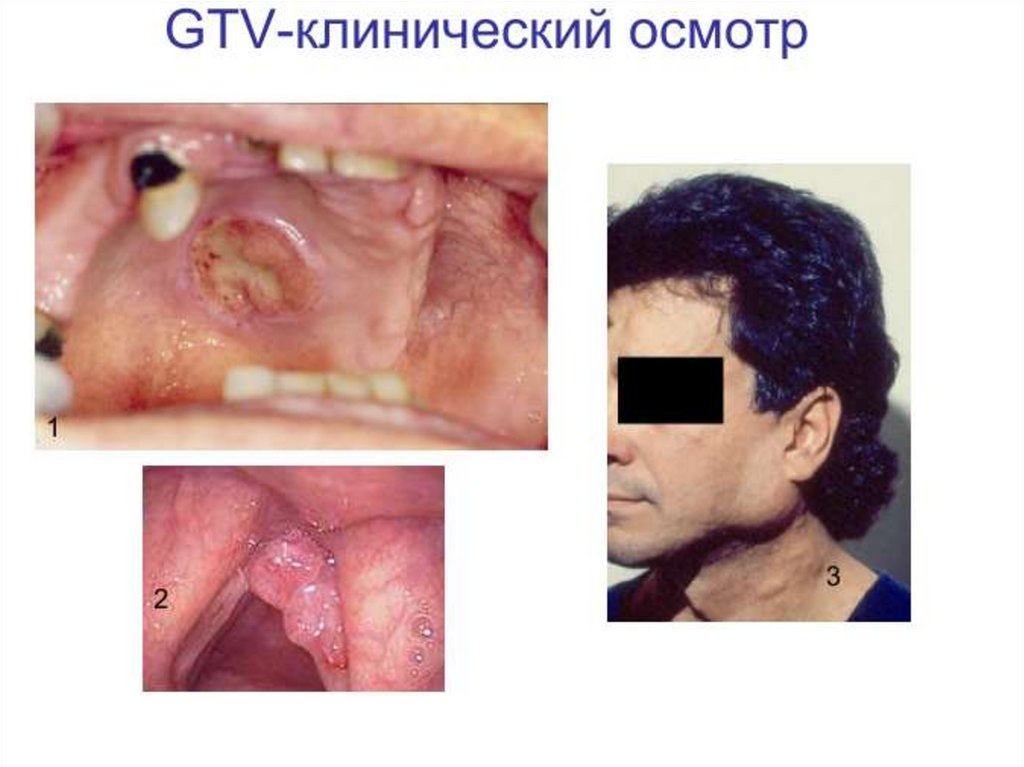
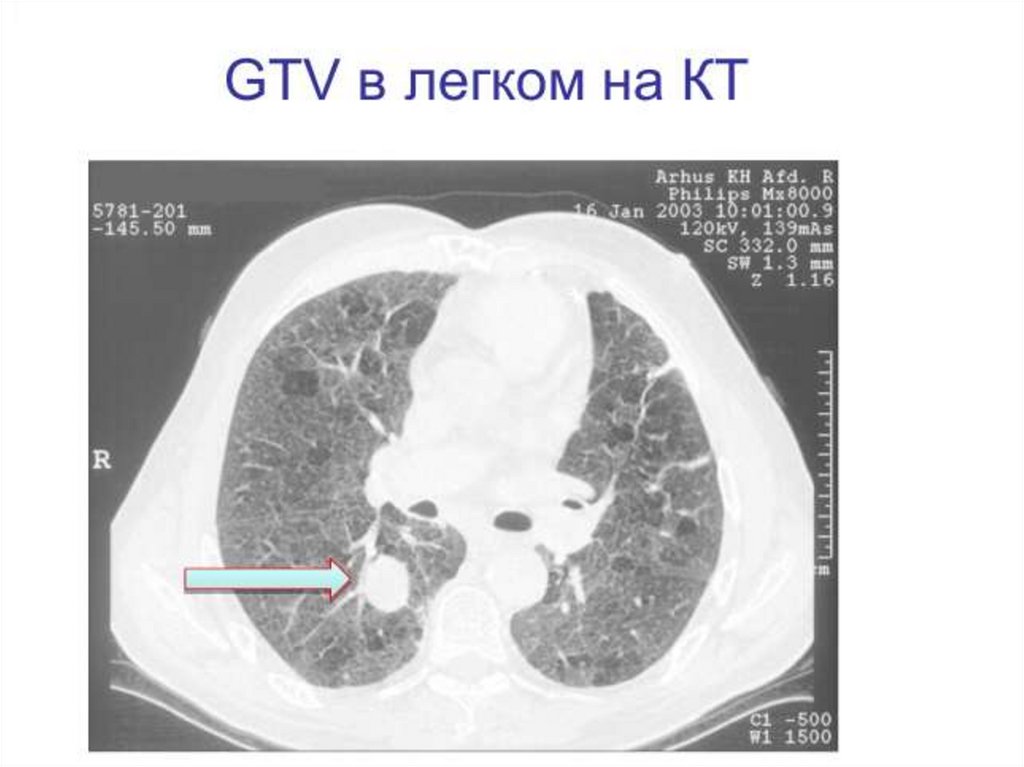
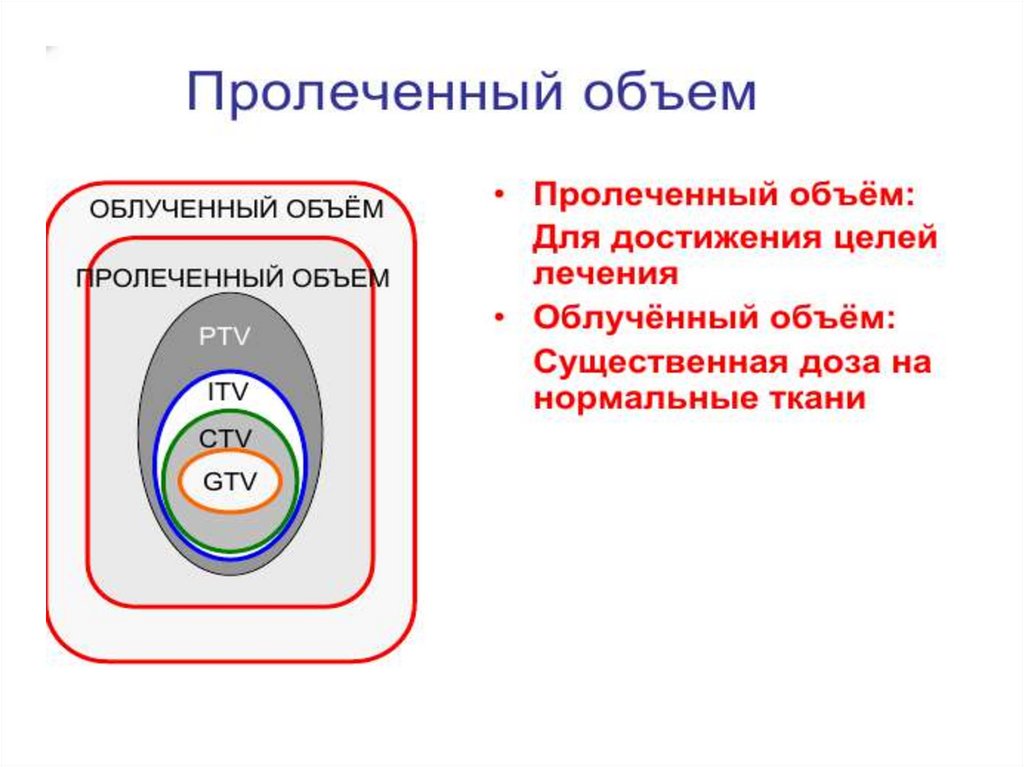
Оконтуривание мишеней5.Оконтуривание
мишеней
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
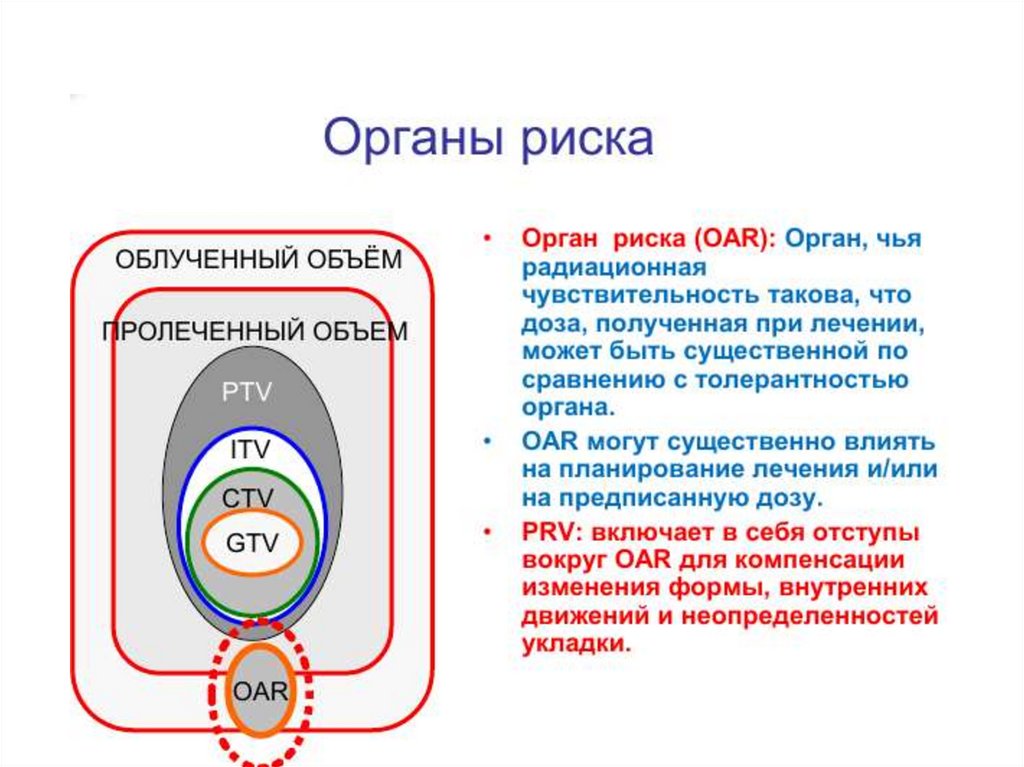
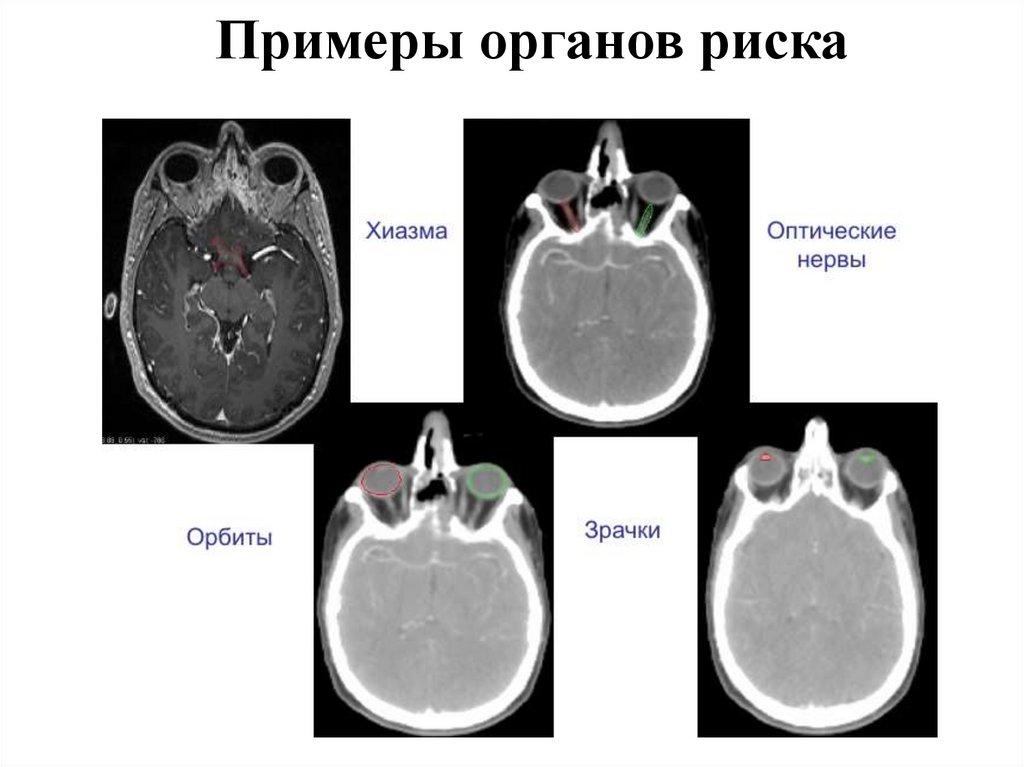
Примеры органов риска90.
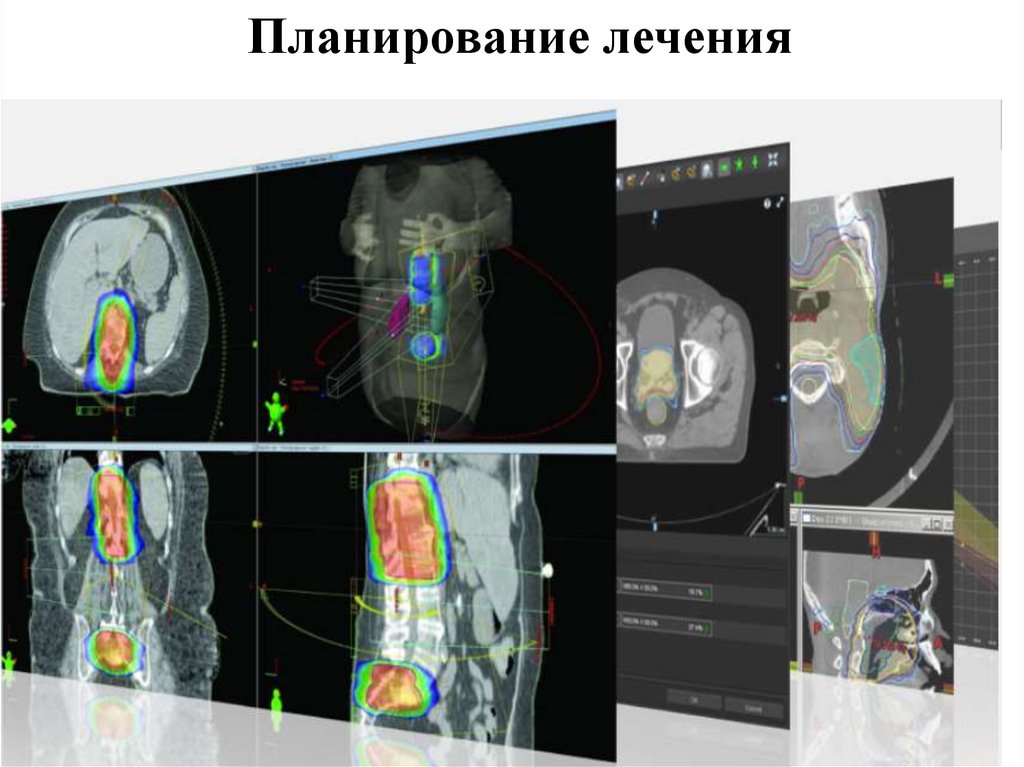
6.Планирование
лечения
Планирование
лечения
Под планированием лучевого лечения понимается
процесс определения лечебных параметров,
считающихся наилучшими для ведения данного больного
. В лучевой терапии они включают объем мишени,
критические
органы, режим фракционирования,
предписанную дозу, положение больного, установки
радиотерапевтического аппарата и сопроводительное
лечение.
91.
ФракционированиеФракционирвание – распределение суммарной дозы
(СОД) в течение всего времени лечения, в течение недели,
в течение дня.
Наиболее часто применяемые режимы фракционирования:
Традиционное фракционирование – облучение в
разовой дозе (РОД) 1,8-2,0 Гр в сутки в течение 5 дней
в неделю.
Гипофракционирование
- а) укрупненное РОД 3-5 Гр
- б) крупное РОД 6-10 Гр
Гиперфракционирование – применение «небольших»
по сравненению с традиционным фракционированием
РОД, например 1-1,2 Гр.Число фракций увеличено.
92.
Суммарная очаговая дозаСуммарная очаговая доза (СОД) - это доза облучения,
полученная пациентом за весь курс лучевой терапии.
СОД зависит от особенностей:
- Морфологических
- - биологических
- - клинических
93. Пример режимов фракционирования дозы лучевой терапии при раке молочной железы
После органосохраняющих операций при облучении только оставшейсячасти молочной железы используются режимы:
2 Гр/46-50 Гр или 2,67 Гр/50изоГр (16 фр.)
«Буст» (локально) 2 Гр / 12-16 Гр ли 2,5 Гр/10-12,5 Гр
При облучении передней грудной стенки (включая вариант реконструированной
молочной железы) и зон лимфооттока
2 Гр/ 46-50 Гр (23-25 фр.)
При невозможности выполнения операции/отказе пациентки от операции
проводится радикальная ДЛТ.
2 Гр/ 60–66 Гр
В зависимости от конктретной клинической ситуации разовая доза может
быть увеличена до 2,5 Гр
Показания к проведению «буста»: молодой возраст <50 лет,
в возрасте старше 50 лет: G3, при опухолевых клетках в краях резекции.
94.
6.Планирование
лечения
Планирование
лечения
Планирование лучевой терапии осуществляется с
помощью различных систем систем- 3D планирования
PROWESS PANTHER, Eclipse, Monaco и др.
95.
Планирование леченияСистемы планирования используются для планирования внешн
его облучения фотонными, электронными и протонными пучкам
и, а также для контактного облучения (брахитерапии).
Система представляет собой комплексное решение с открытой а
рхитектурой и позволяет создавать планы лечения для различны
х линейных ускорителей, подключаться к нескольким системам
визуализации и импортировать планы лечения.
96.
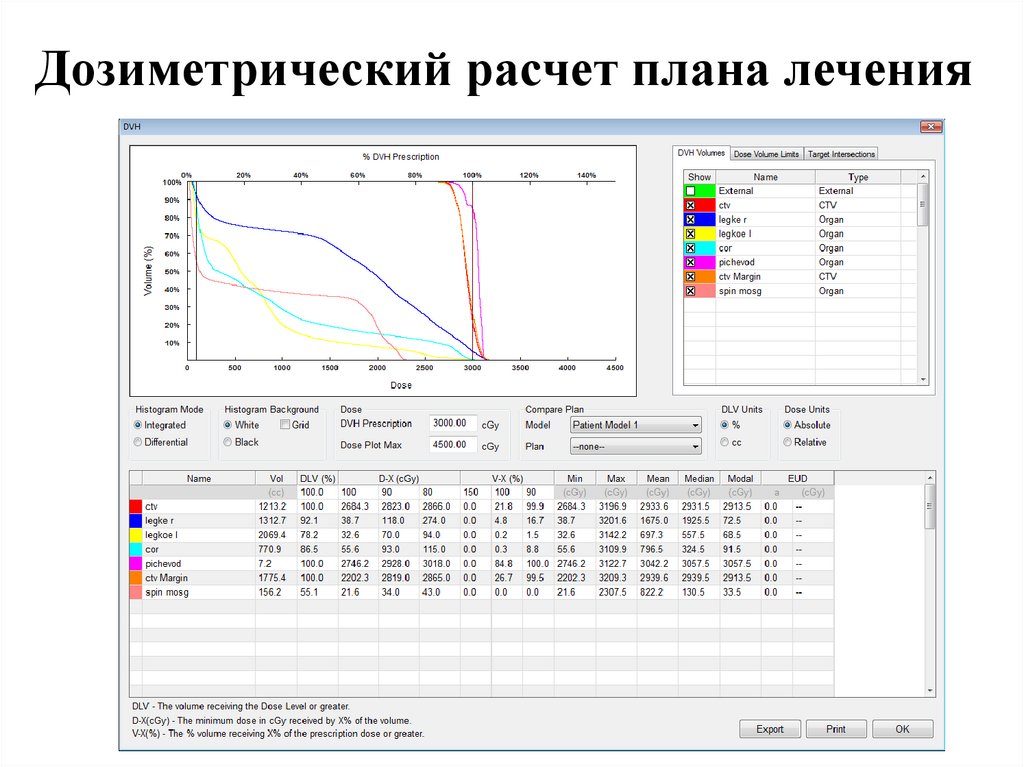
Планирование лечения97.
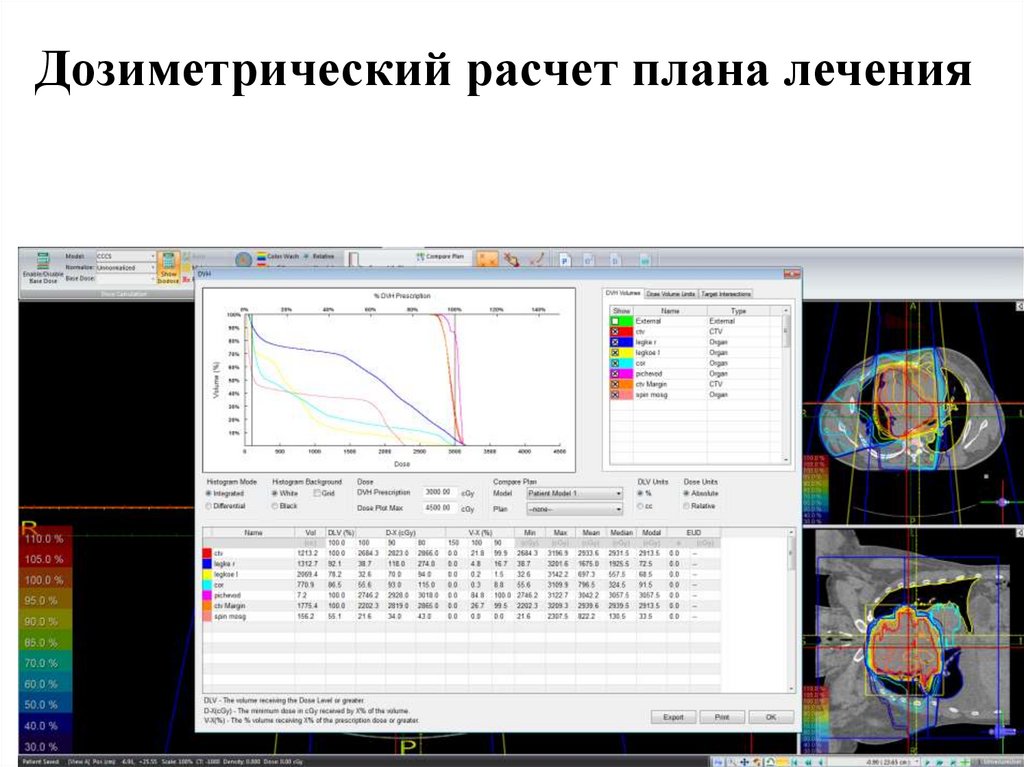
Дозиметрический расчет плана лечения98.
Дозиметрический расчет плана лечения99.
7. Проверкаплана на
фантомах
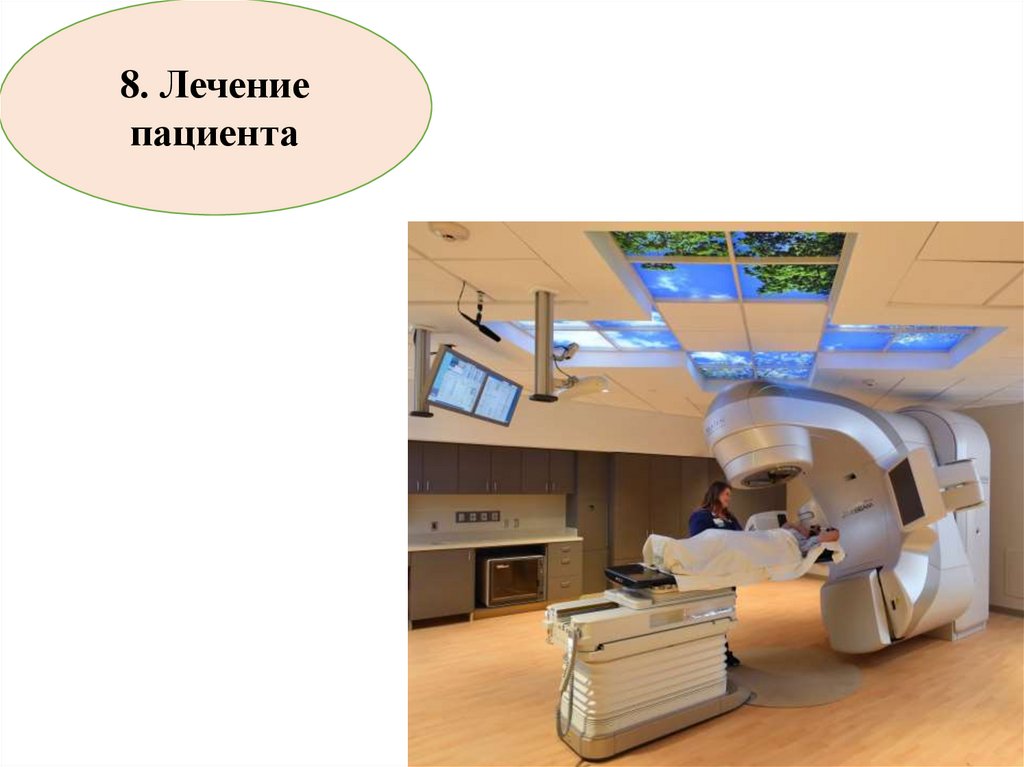
100.
8. Лечениепациента
101.
Классификации лучевых повреждении:• в рекомендациях ВОЗ (1981) акцент ставится на ранних реакциях и
•повреждениях и игнорируются поздние.
• франко-итальянская школа (1993) вообще не предусматривает разделение
•лучевых повреждении на ранние и поздние, при этом она содержит множество
•параметров для оценки состояния каждого органа, что в условиях практического
здравоохранения невыполнимо.
• европейская система (Diche S. et al., 1989) базируется на ретроспективном
•анализе данных и при этом предусматривает весьма точную (в процентах,
•квадратных сантиметрах и т.д.) оценку возникших изменении.
• в настоящее время в большинстве радиологических центров используется
•классификация радиотерапевтической онкологической группы совместно с
•Европеиской организацией по исследованию и лечению рака (RTOG/EORC, 1995
), дополненная критериями кооперативной группы исследователей для более
•точной характеристики преимущественно ранних токсических эффектов.
102.
К ранним относят лучевые повреждения, развивающиеся в процесселучевой терапии или в ближайшие 3 месяца (100 дней) после нее. Такое
ограничение установлено в соответствии с результатами
радиобиологических исследований, показавших, что это крайний срок
восстановления сублетально поврежденных клеток.
Поздними считают местные лучевые повреждения, развившиеся после
указанного срока. При этом поздние лучевые повреждения могут быть
бинарными, т.е. реакция тканей происходит по типу «да-нет»,
градационными (имеющими различную степень выраженности) и
непрерывными. Все эти повреждения оцениваются по шестибальной шкале
(от 0 до 5) с учетом степени тяжести их проявлений, при этом символу «0»
соответствует отсутствие изменений, а «5» - смерть пациента в результате
лучевого повреждения. (Шкала оценки поздних лучевых повреждений
RTOG/EORTC).
103. Осложнения ЛТ
Лучевые реакции (ЛР)– это изменения,возникшие в органах и тканях в конце курса
ЛТ
и,
как
правило,
проходящие
самостоятельно
или
под
влиянием
соответствующего лечения.
ЛР бывают местные –на коже, слизистых
оболочках прилегающих к опухоли.
ЛР общие – это функциональные нарушения
со стороны ЦНС, кроветворения, желудочнокишечного тракта.
104. Осложнения ЛТ
Лучевые повреждения (ЛП) – это стойкие органическиеизменения в органах и тканях, прилегающих к опухоли и
подвергшихся лучевому воздействию и требующие
длительного специального лечения.
Пример: атрофический или гипертрофическаий дерматит,
индуративный отек, фиброз, лучевая язва, ректит, цистит,
пневмосклероз, перикардит.
105.
Команда специалистов отделения радиотерапии1.
2.
3.
4.
Врач-радиотерапевт – врач который назначает радиотерапию и
наблюдает пациента в процессе лечения
Медицинский физик – осуществляет и проверяет оборудование и
гарантии качества лечебных планов.
Техник-дозиметрист занимается созданием дозиметрических
лечебных планов совместно с медицинским физиком и врачомрадиотерапевтом
Медицинская сестра процедурной линейных ускорителей (RTTRadiation Therapy Technolosist ) проводит сеасны лечения пациента
на линейном ускорителе совместно с врачом-радиотерапевтом и
техником-дозиметристом.
106. ВЫВОДЫ
Достижение в развитии радиотерапевтическойтехники, клинической радиобиологии позволяет
считать лучевую терапию высокотехнологичной
лечебной практикой в онкологии. Использование
современных линейных ускорителей представляет
новые возможности для широкого внедрения новых
схем
фракционирования,
рационального
соотношения
пространственновременного
распределения
дозы,
стереотаксического
облучения. По-прежнему остается актуальным
поиск эффективных способов индивидуального
прогнозирования реакции опухоли, прилежащих
органов и тканей на лучевое, лекарственное и
комплексное воздействие.















































































 medicine
medicine








