Similar presentations:
Общая и неорганическая химия. Металлы и неметаллы
1. Раздел 1. Общая и неорганическая химия Металлы и неметаллы
РАЗДЕЛ 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯХИМИЯ
МЕТАЛЛЫ И НЕМЕТАЛЛЫ
2.
ЛАБОРАТОРНО-ПРАКТИЧЕСКАЯРАБОТА
«Свойства металлов и неметаллов
КОРРОЗИЯ СТАЛИ
ЗАЩИТА СТАЛИ ОТ КОРРОЗИИ (ФОСФАТИРОВАНИЕ)
ИСПОЛЬЗОВАНИЕ ДАННОЙ ЗАЩИТЫ ЖЕЛЕЗА ОТ
КОРРОЗИИ В ПРОИЗВОДСТВЕ МУФТ НА
ПРЕДПРИЯТИИ ПНТЗ.
3. Цель: изучить свойства металлов, коррозию металлов (железа) и основных способов защиты стали от коррозииот воздействия
ЦЕЛЬ: изучить свойства металлов, коррозиюметаллов (железа) и основных способов
защиты СТАЛИ ОТ КОРРОЗИИОТ ВОЗДЕЙСТВИЯ
АГРЕССИВНОЙ
СРЕДЫ.
• УЧЕБНАЯ ЦЕЛЬ
5/17/2016
adasdfsdzfvzx
3
4. Задачи:
ЗАДАЧИ:• Развить умения наблюдать, самостоятельно анализировать
условие задачи, формулировать вопросы, разрабатывать
план решения и осуществлять его, соблюдать нормы ТБ,
оценивать полученные результаты;
Реактивы и оборудование:
Растворы H2SO4, HCl, NaOH, NaCl; Fe, Na3PO4,
H2O, K3[Fe(CN)6] штатив c химическими
пробирками.
5/17/2016
adasdfsdzfvzx
4
5.
Информационное обеспечение:Учебно-методическая литература:
1.
Ерохин Ю.М. Химия. Учебник для студ.
образовательных
учреждений
сред.
проф.
образования. М.: Издательский центр «Академия»,
2017.
2.Габриелян О.С., Остроумов И.Г.
Химия: учебник для студентов профессиональных
образовательных организаций,
осваивающих профессии и
специальности СПО. – М., 2017.
6. Критерии оценки лабораторно-практической работы:
КРИТЕРИИ ОЦЕНКИ ЛАБОРАТОРНОПРАКТИЧЕСКОЙ РАБОТЫ:Панируемый результат
Незачёт
Знать и уметь определять Сделал 4 и
возможности
протекания более ошибок
химических превращений в при выполнении
лабораторной
различных
условиях
и
работы
оценки их последствий.
Оценка
3
Сделал 3
ошибки при
выполнении
лабораторно
й работы
Оценка
4
Оценка
5
Сделал 2 и
Без ошибок
более
выполнил
ошибок при
лабораторну
выполнении ю работу
лабораторно
й работы
7.
Порядок выполнения лабораторной работы:1.Прочитайте основные теоретические сведения
2.Ответьте на вопросы
3. Внимательно прочитайте ход выполнения работы
4. Просмотрите видео демонстрационных опытов
5. Оформите отчёт.
В отчёте запишите:
- название опыта
- наблюдения
- химические реакции
6. Ход выполнения работы писать не надо
7.Сделайте вывод по лабораторной работе
8. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
• Коррозия - это процесс самопроизвольногоразрушения (окисления) металлов под химическим и
электрохимическим воздействием окружающей среды.
По механическому протеканию
коррозионные процессы делятся
на две группы:
химические и электрохимические.
(видео №1)
9. Химическая коррозия
ХИМИЧЕСКАЯ КОРРОЗИЯ• протекает в сухих газах, жидкостях, не
обладающих заметной электропроводностью.
• Это обычная химическая, гетерогенная,
окислительно-восстановительная реакция.
• Например, при высокой температуре в
закалочной печи, происходит коррозия Fе:
5/17/2016
4Fe+3O2=2Fe2O3
9
10.
5/17/2016adasdfsdzfvzx
10
11. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
• происходит в электролитах и сопроваждаетсяобразованием электрического тока.
5/17/2016
adasdfsdzfvzx
11
12.
• Электрохимическое растворение металла- сложный процесс, состоящий из трех основных:
• 1. Анодного процесса -процесса перехода ионов
металла в раствор
n+
Me - ne = Ме
• 2. процесса перетекания электронов по металлу от
анодных участков к катодным и соответствующего
перемещения катионов и анионов в растворе;
• 3. Катодного процесса
5/17/2016
adasdfsdzfvzx
12
13.
•Катодный процесс происходит на болееэлектроположительных участках поверхности.
•В зависимости от характера среды катодные
процессы протекают следующим образом:
•В кислой среде:
•2Н++2е=Н2↑
•в нейтральной среде:
•О2+2Н2О+4е→4ОН-
14.
•Коррозия железа сопровождаетсяобразованием ионов Fe2+, присутствие которых
можно установить с помощью реакции с
гексацианоферратом (III) калия – K3[Fe(CN)6]
по уравнению реакции:
•FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6] + K2SO4
турнбулева синь
•Вещество KFe[Fe(CN)6] имеет синюю окраску. (видео№ 1)
•По окраске раствора можно установить интенсивность
протекания коррозии стали.
15. ОСНОВНЫЕ СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
• 1. Нанесение на поверхность металловзащитных пленок: лака, краски, эмали, других
металлов.
(видео №2)
16.
5/17/2016adasdfsdzfvzx
16
17.
• 2. Легирование металлов, т.е. получениесплавов.
• Например, в настоящее время создано
большое число нержавеющих сталей путем
присадок к железу никеля, хрома, кобальта и др.
Такие стали, действительно, не покрываются
ржавчиной
18.
Нержавеющая сталь(коррозионно-стойкие стали, в
просторечье «нержавейка») —
легированная сталь, устойчивая
к коррозии в атмосфере и
агрессивных средах
5/17/2016
adasdfsdzfvzx
18
19.
3. Введение ингибиторов(замедлителей коррозии)
Ингибиторы – это вещества, способные в
малых
количествах
замедлять
протекание
химических процессов или останавливать их.
Название ингибитор происходит от лат. «inhibere»,
что означает сдерживать, останавливать. Они не
позволяют
агрессивной
среде
действовать
на металл.
5/17/2016
adasdfsdzfvzx
19
20.
• 4. Протекторный метод защиты металла• Листовое железо, покрытое цинком, называют
оцинкованным железом, а покрытое оловом – белой жестью
(луженое железо).
• Первое в больших количествах идет на кровли домов, а из
второго изготавливают консервные банки. И то и другое
получают главным образом протягиванием листа железа через
расплав соответствующего металла.
• Покрытия из цинка и олова (так же, как и других металлов)
защищают железо от коррозии при сохранении сплошности.
При нарушении покрывающего слоя (трещины, царапины)
коррозия изделия протекает даже более интенсивно, чем без
покрытия.
5/17/2016
adasdfsdzfvzx
20
21.
Цинк электрохимически защищает железо откоррозии и является протектором
На этом принципе основан протекторный метод
защиты от коррозии металлических конструкций и
аппаратов.
Английское слово «protect» – означает защищать,
предохранять.
5/17/2016
adasdfsdzfvzx
21
22.
оцинкование5/17/2016
adasdfsdzfvzx
22
23.
• Хромирование5/17/2016
adasdfsdzfvzx
23
24.
• 5. ФосфатированиеФосфатирование используют для дополнительной
защиты от коррозии, улучшения твердости, износостойкости,
повышения электроизоляционных свойств основного покрытия
на черных и цветных металлах.
5/17/2016
adasdfsdzfvzx
24
25.
Суть процесса фосфатирования состоит всоздании на поверхности защищаемого изделия
слоя малорастворимых фосфатов железа (Fe),
цинка или марганца.
Фосфатированию подвергаются: чугун,
низколегированные, углеродистые стали, кадмий,
цинк, медь, сплавы меди, алюминий.
5/17/2016
adasdfsdzfvzx
25
26. Экологические последствия, вызванные коррозией и мерами защиты
ЭКОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ,ВЫЗВАННЫЕ КОРРОЗИЕЙ И МЕРАМИ
ЗАЩИТЫ
• Коррозия металлов имеет немаловажное значение в ряду
причин, усугубляющих решение экологических проблем.
Коррозионное разрушение трубопроводов, резервуаров,
реакторов, цистерн и т.д. может вызвать непредвиденный излив
агрессивных и биологически опасных жидкостей и газов, что
приведет к местному усилению загрязнения окружающей среды.
• При коррозии металлов, особенно при утечке газа и нефти, может
значительно пострадать окружающая среда.
5/17/2016
adasdfsdzfvzx
26
27.
Промышленность Российской Федерации имеет более 20000предприятий с разнообразными технологиями производства.
Оборудование и трубы для них изготавливают на основе
сплавов черных и цветных металлов, а также из природных или
искусственных химически стойких материалов. Со временем оно
стареет или разрушается вследствие коррозии.
Это приносит не только большие экономические потери, но и
приводит к глобальным катастрофам
Например, авария на магистральном газопроводе под Уфой,
произошедшая в 1989 году в ночь с 3 на 4 июня, в месте взрыва
газа, вытекшего из трубопровода и скопившегося в лощине,
унесла, по разным данным, 537 и 780 человеческих жизней –
пассажиров двух поездов «Новосибирск-Адлер» и «АдлерНовосибирск».
5/17/2016
adasdfsdzfvzx
27
28.
Вопросы для закрепления теоретическогоматериала:
1.Что называется коррозией металлов?
2.Объясните механизм коррозии
3. Какая среда самая агрессивная для железоуглеродистых
сплавов?
4. Что является ингибитором для железа?
5. Что такое протектор?
6. Какой металл по своей активности будет выполнять роль
протектора в защите железа?
29. Выполнение лабораторной работы
ВЫПОЛНЕНИЕЛАБОРАТОРНОЙ РАБОТЫ
• Опыт№1
Качественная реакция на катион Fe2+.
(видео №3)
• Для проведения эксперимента нужно взять 2 стакана.
• В 1ый стакан поместите с помощью шпателя соль Мора,
содержащая FeSO4, и прилейте 1 мл H2O, затем добавьте
комплексную соль K3[Fe(CN)6]
• Наблюдения
• Химическая реакция (в молекулярном и ионном виде)
30.
•Во 2ой стакан налейте 1М раствор H2SO4 И поместитес помощью шпателя K3[Fe(CN)6] затем в стакан
опустите железный стержень
• Наблюдения
• Химическая реакция (в молекулярном и ионном виде)
31.
•Опыт№2 Влияние различных коррозионныхагрессивных сред: воды, кислоты, щелочи, растворов
солей на порошок железа
(видео №4)
•Для проведения эксперимента взять 5 пробирок, в каждую
пробирку с помощью шпателя поместить стружку (порошок)
железа :
•А) В 1ую пробирку налить 2мл раствора соляной кислоты (HCl)
•Наблюдение
•Химическая реакция (в молекулярном и ионном виде)
32.
• Б)во 2-ую пробирку налить 2мл щелочи NaOH (KOH)• Наблюдение
• В)в 3-тью пробирку налить 2мл – раствора NaCl
• Наблюдение
• Г)в
4-ую
пробирку
(фосфатирование)
• Наблюдение
налить
2мл
раствора
Na3РО4
• Д)в 5-ую пробирку налить 2мл дистиллированную воду Н2О
Наблюдение
• Химическая реакция (в молекулярном и ионном виде)
33.
2. Во все пробирки добавить 1-2 каплигексацианоферрата (III) калия K3[Fe(CN)6]
3. через 5 минут отметить изменения (сравнить интенсивность
окраски растворов) в пробирках с раствором пробирки из 1-го
опыта
4. После добавления раствора K3[Fe(CN)6] в каждую пробирку
запишите в таблицу наблюдения
34.
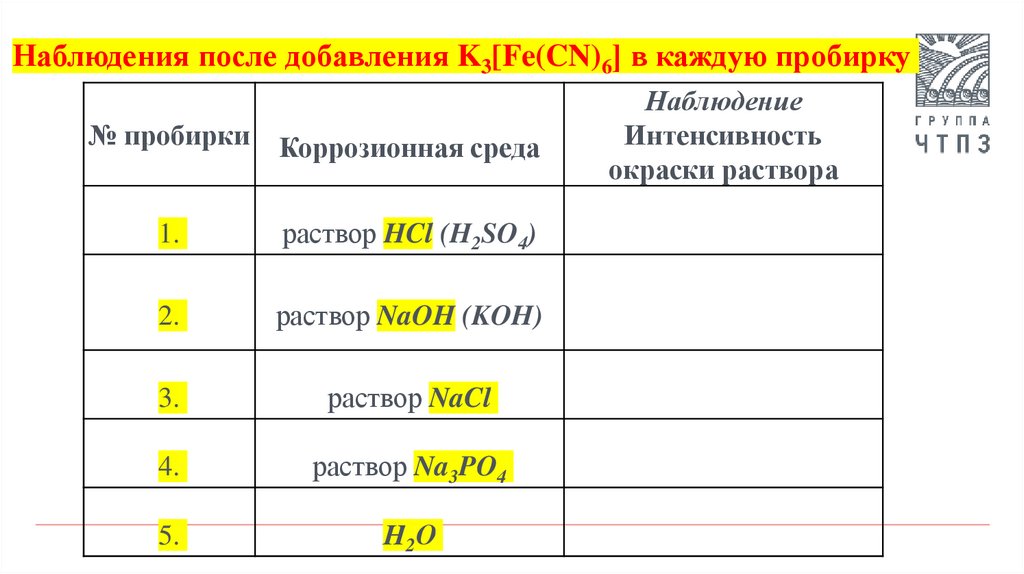
Наблюдения после добавления K3[Fe(CN)6] в каждую пробирку№ пробирки Коррозионная среда
1.
раствор HCl (H2SO4)
2.
раствор NaOH (KOH)
3.
раствор NaCl
4.
раствор Na3PO4
5.
Н2О
Наблюдение
Интенсивность
окраски раствора
35.
Опыт 3Протекторная защита металлов
(ВИДЕО №5)
Наблюдения
Для проведения эксперимента взять 2 пробирки и налить
по 3 мл раствора соляной кислоты (HCl)
В обе пробирки добавьте 1-2 капли раствора K3[Fe(CN)6]
Поместите: в 1-ую пробирку зачищенный стальной стержень;
во 2-ую пробирку – образец вырезанный из оцинкованного
железа.
Запишите наблюдения
Через 3-5 минут отметьте окраску растворов.
36.
Вывод• 1. В результате проведения эксперимента, наиболее интенсивно
коррозия железа протекает в ____________________ среде.
(кислая,нейтральная,щелочная)
• 2. В нейтральной среде интенсивнее коррозия протекает в
присутствии _____
(NaCl, Na3PO4, H2O)
• 3. Роль активатора (ускорителя) коррозии выполняют ионы _____
• 4. Наименее интенсивно в нейтральной среде коррозия протекает
в присутствии_______________
(NaCl, Na PO4, H2O).
3
• 5. Роль ингибитора коррозии выполняют ионы _______
37.
6. Железо в растворе соляной кислоты_________________________________ коррозии
(подвергается, не подвергается)
7. При контакте с цинком железо подвергается коррозии
___________________________________________степени,
(в большей, в меньшей)
о чем свидетельствует ______________ интенсивная окраска
раствора.
(более, менее)
8. Цинк выполняет роль __________________________
38.
5/17/2016adasdfsdzfvzx
38
39.
5/17/2016adasdfsdzfvzx
39
40. Благодарим за внимание!
БЛАГОДАРИМ ЗАВНИМАНИЕ!







































 chemistry
chemistry








