Similar presentations:
Радиоактивность и её виды
1. РАДИОАКТИВНОСТЬ Урок физики 9 класс
12. «Науки делятся на две группы – на физику и собирание марок». Эрнест Резерфорд
(1871-1937)2
3.
Французский физик. Основныеработы посвящены изучению
явлений люминесценции и
радиоактивности. Открыл (1896)
и изучил явление
самопроизвольного излучения
солями урана и металлическим
ураном лучей особой природы,
названное М. Кюри в 1898
радиоактивностью.
В честь Беккереля названа
единица измерения активности
радиоактивных изотопов – 1Бк.
А.Беккерель
4. Открытие радиоактивности В 1896 году французский физик Антуан Анри Беккерель случайно обнаружил, что химический элемент уран
(1852-1908)4
5. . Исследование радиоактивности В 1898 году французские ученые Мария Склодовская-Кюри и Пьер Кюри выделили из уранового минерала
Мария КюриПьер Кюри
5
6. Исследование радиоактивности
67. Урок 81. Радиоактивность
78.
Склодовская-Кюри (SklodowskaCurie). Химик и физик. Является одним изосновоположников учения о радиоактивности.
Совместно с П. Кюри открыла (1898)
химические элементы полоний и радий.
Впервые употребила термин
«радиоактивность». Получила (1902) вместе с
П. Кюри 0,1 г соли радия и определила его
атомный вес. Совместно с А. Л. Дебьеном
получила (1910) радий в металлическом виде.
Они же изготовили (1911) первый эталон радия.
Нобелевская премия по физике (1903, совместно
с П. Кюри). Нобелевская премия по химии
(1911).
М.Складовская-Кюри
9.
Кюри (Curie) Пьер(15.V.1859–19.IV.1906)
Французский физик и химик. Один из
основателей
учения
о радиоактивности.
Научные
работы
посвящены
также
исследованию
кристаллических
тел,
магнетизму. Изучал (до 1896) парамагнитные и
диамагнитные тела и установил (1895) закон,
согласно
которому
сущестует
обратная
пропорциональность
между
магнитной
восприимчивастью
парамагнетиков
и
абсолютной температурой (закон Кюри).
Обнаружил, что для железа существует особая
температура, выше которой исчезают его
ферромагнитные свойства (точка Кюри).
Совместно с женой М. Склодовской-Кюри
открыл (1898) полоний и радий. Одним из
первых
использовал
понятие
«период
полураспада». Предложил (1904) идею метода
определения
абсолютного
возраста
ураносодержащих минералов. Нобелевская
премия по физике (1903, совместно с
М. Склодовской-Кюри).
П.Кюри
10.
Резерфорд (Rutherford) Эрнст(30.VIII.1871–19.X.1937)
Английский физик. Один из основателей
учения о радиоактивности, ядерной физики и
представлений о строении атомов. Совместно
с Ф. Содди дал четкую формулировку (1903)
закона радиоактивных превращений, выразив
его в математической форме, и ввел понятие
«период полураспада». Изучил рассеяние αчастиц атомами различных элементов и
предложил (1911) планетарную (ядерную)
модель атома. Бомбардировал (1919) αчастицами атомы азота, осуществив первое
искусственное превращение элементов (азота
в кислород). Предложил называть ядро атома
водорода протоном. Нобелевская премия по
физике (1908).
Э.Резерфорд
11. Опыты Резерфорда
После открытия радиоактивных элементовначалось исследование физической природы их
излучения.
В 1899 году Резерфорд, изучая ионизирующую
способность радиоактивного излучения, обнаружил,
что оно неоднородно.
После проявления фотопластинки на ней
обнаруживалось одно темное пятно – как раз в том
месте, куда попадал пучок.
Фотопластинка
Пучок радиоактивного излучения радия,
выходящий через узкое отверстие в сосуде
Толстостенный свинцовый сосуд с
крупицей радия на дне
11
12. Опыты Резерфорда
В сильном магнитном поле нана проявленной пластинке
возникало три пятна: одно
центральное было на том же
месте что и раньше, а два других по разные стороны от
центрального. Резерфорд назвал
их α- и β-лучами.
В том же году (1899г.)
А.Беккерель доказал, что β-лучи
являются потоком электронов.
В 1900 году французский физик
П.Виллард установил, что в
состав радиоактивного излучения
входит и третья составляющая,
которую он назвал γ-лучами.
12
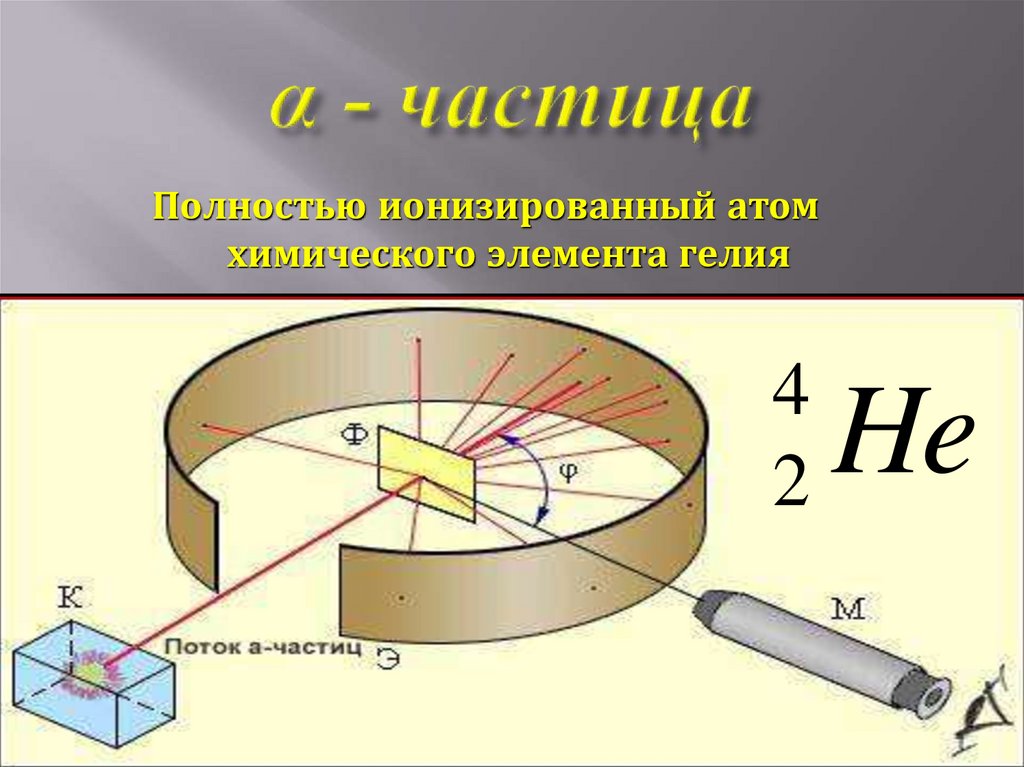
13. α - частица
Полностью ионизированный атомхимического элемента гелия
4
2
He
14.
β – частицы представляют собой0
1
электроны, движущиеся со скоростями, очень
близкими к скорости света. Они сильно
отклоняются как в магнитном, так и в
электрическом поле.
β – лучи гораздо меньше поглощаются при
прохождении через вещество. Алюминиевая
пластинка полностью их задерживает только
при толщине в несколько миллиметров.
e
15. β - частица
Представляетсобой - электрон
0
1
e
16. γ - частицы
Вид электромагнитного излучения17. Виды радиоактивного излучения
1718. Виды радиоактивного излучения
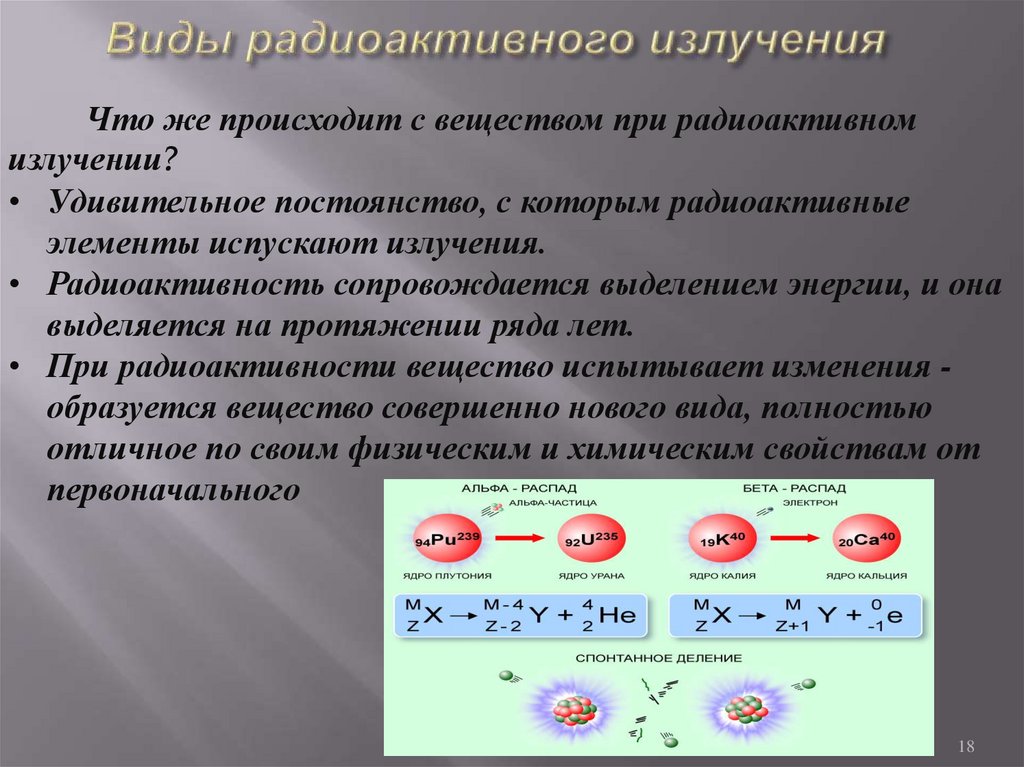
Что же происходит с веществом при радиоактивномизлучении?
• Удивительное постоянство, с которым радиоактивные
элементы испускают излучения.
• Радиоактивность сопровождается выделением энергии, и она
выделяется на протяжении ряда лет.
• При радиоактивности вещество испытывает изменения образуется вещество совершенно нового вида, полностью
отличное по своим физическим и химическим свойствам от
первоначального
18
19. Виды радиоактивного излучения
a - лучи- лучи
b - лучи
19
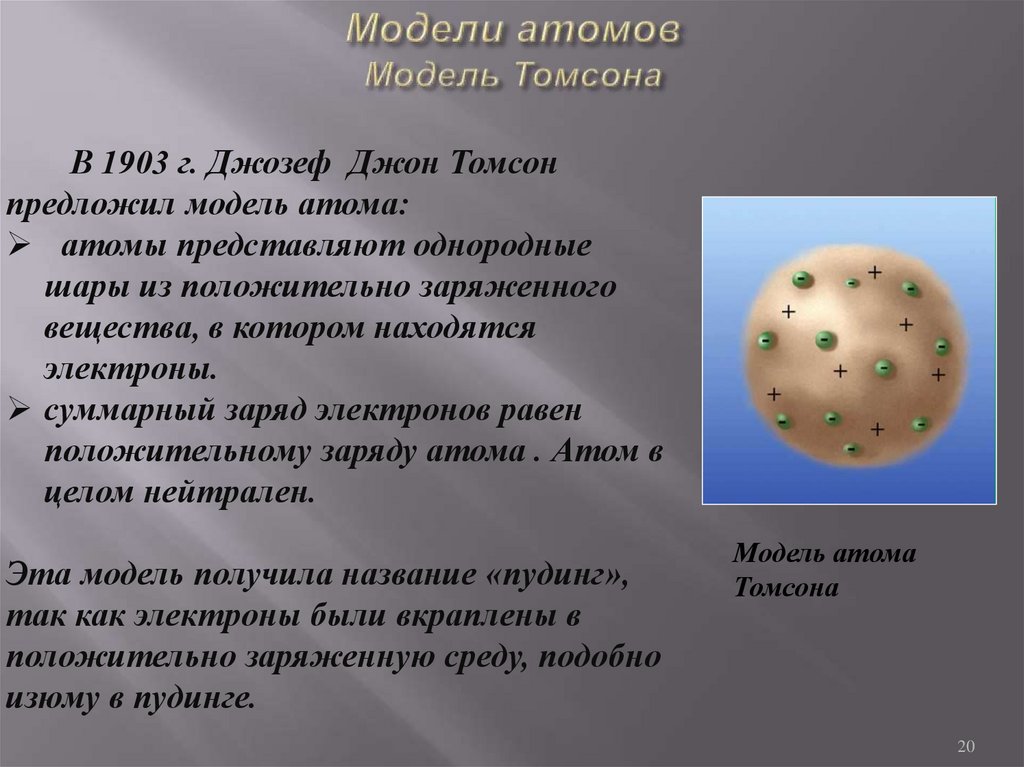
20. Модели атомов Модель Томсона
В 1903 г. Джозеф Джон Томсонпредложил модель атома:
атомы представляют однородные
шары из положительно заряженного
вещества, в котором находятся
электроны.
суммарный заряд электронов равен
положительному заряду атома . Атом в
целом нейтрален.
Эта модель получила название «пудинг»,
так как электроны были вкраплены в
положительно заряженную среду, подобно
изюму в пудинге.
Модель атома
Томсона
20
21.
Томсон (Thomson) Джозеф Джон(18.XII.1856–30.VIII.1940)
Английский физик, член Лондонского королевского
общества (с 1884, в 1915–20 – президент). В 1884–19
профессор
Кембриджского
университета
и
руководитель
Кавендишской
лаборатории;
одновременно в 1905–18 профессор Королевского
института в Лондоне. Ранние работы Томсона
посвящены вычислению электромагнитного поля
движущегося заряженного шара, теории вихрей,
прецизионному измерению отношения абсолютных
электрических единиц к электромагнитным. Занимаясь
изучением газового разряда, Томсон совместно с
сотрудниками выполнил серию классических работ,
приведших к открытию электрона (впервые измерил
отношение заряда электрона к массе, 1897;
Нобелевская премия, 1906). Томсон дал объяснение
непрерывного спектра рентгеновского излучения,
установил природу положительных ионов, предложил
первую модель строения атома. В 1911 Томсон
разработал так называемый метод парабол для
измерения отношения заряда частицы к ее массе,
который сыграл большую роль в исследовании
изотопов.
Большое значение имела научно-организационная
деятельность
Томсона.
Возглавляемая
им
Кавендишская лаборатория превратилась в ведущий
научно-исследовательский физический центр, в
котором под его руководством работали крупнейшие
английские физики (Э. Резерфорд, Ч. Вильсон, Ф. У.
Астон, У. Ричардсон и др.). Будучи убежденным
сторонником
классической
физики,
Томсон
придерживался гипотезы эфира.
Д.Д.Томсон
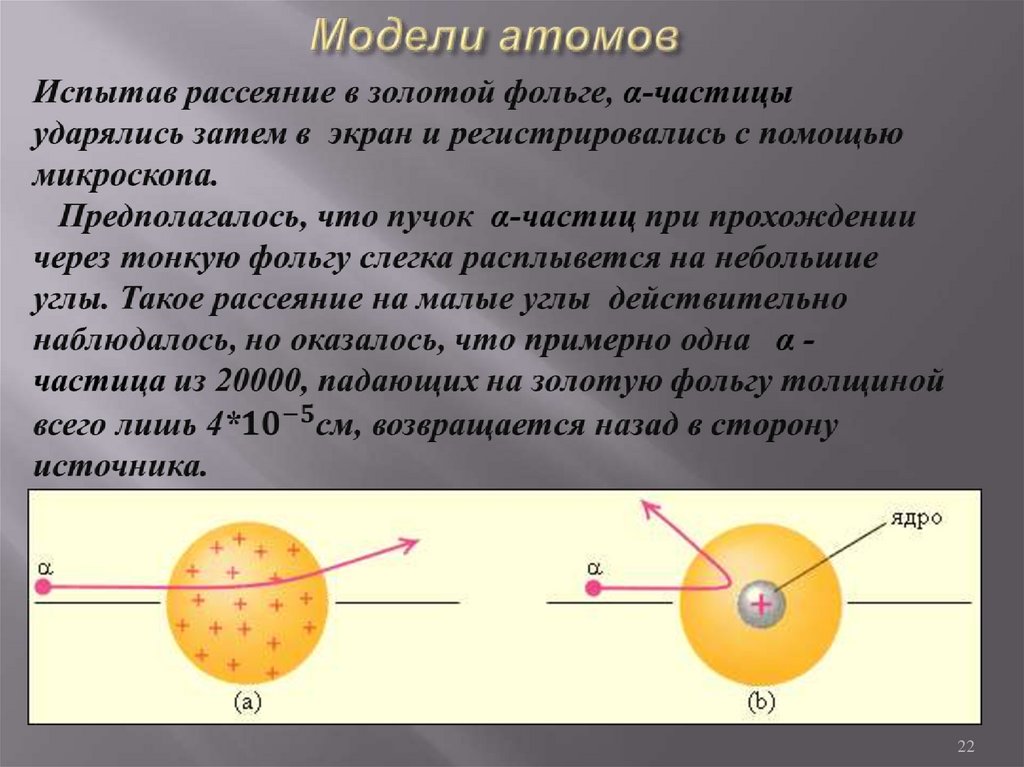
22. Модели атомов
2223. Модели атомов
В 1911 г. Резерфорд предложил своим сотрудникамэкспериментально проверить состоятельность модели атома
Томсона Если модель атома Томсона соответствует
действительности, то, пропуская через очень тонкую
металлическую пленку узкий пучок быстрых α-частиц,
экспериментаторы не должны обнаружить сколько-нибудь
заметного отклонения этих частиц.
23
24. Опыт Резерфорда
25. Модели атомов
Резерфорд пришел к выводу- положительный заряд
атома сосредоточен в очень
малом объеме в центре
атома, а не распределен по
всему атому, как в модели
Томсона. Резерфорд
предложил ядерную
(«планетарную») модель
атома
25
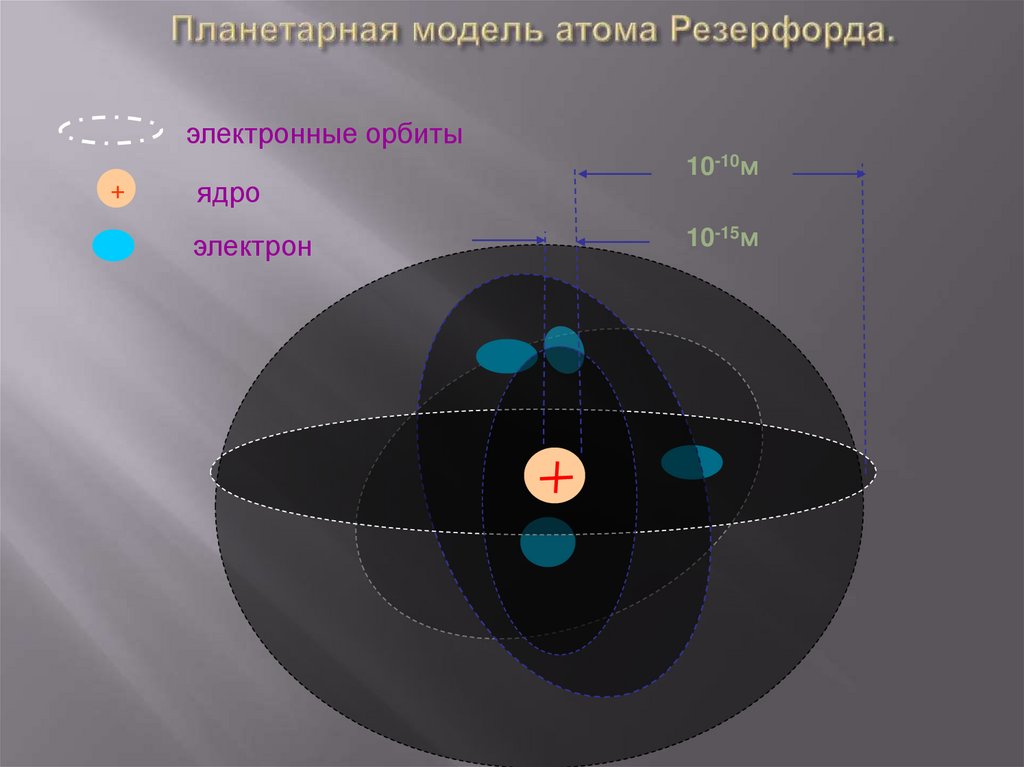
26. Планетарная модель атома Резерфорда.
электронные орбиты+
ядро
электрон
10-10м
10-15м
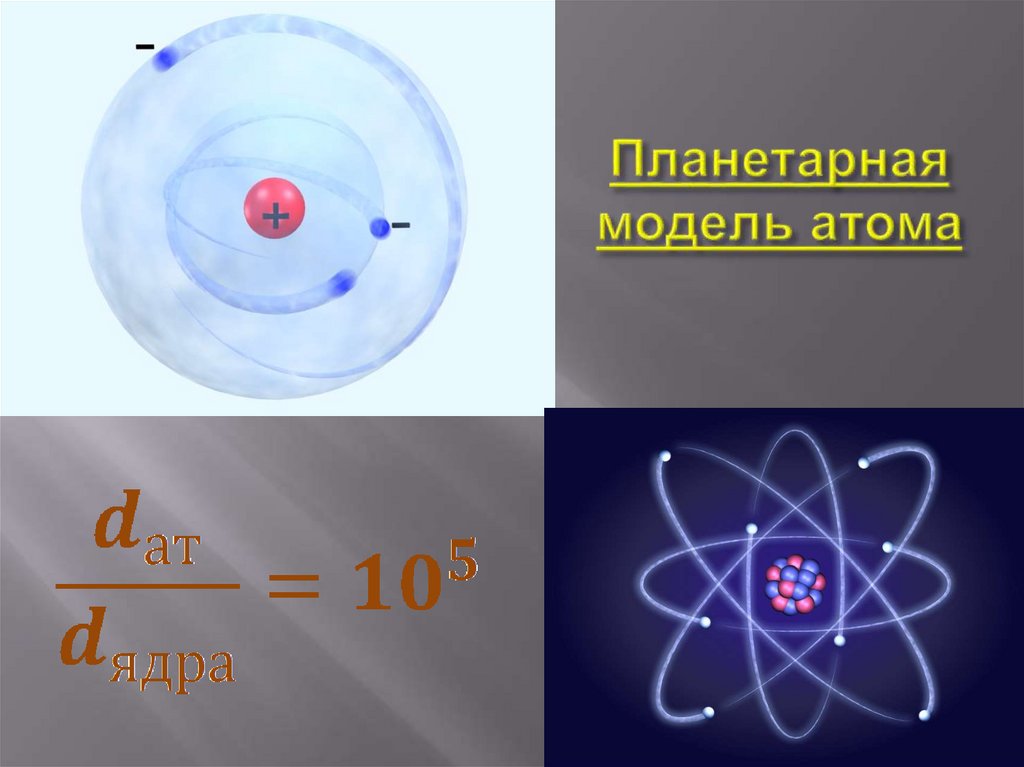
27. Модели атомов Модель Резерфорда
Атомы любого элемента состоят изположительно заряженной части ядра. Размеры ядра малы, п сравнению
с размерами самого атома.
Модель атома
Резерфорда
В состав ядра входят положительно
заряженные частицы – протоны (
позднее было установлено, что и
нейтральные нейтроны).В ядре
сконцентрирована вся масса атома.
Вокруг ядра вращаются электроны,
образующие так называемую
электронную оболочку.
27
28. Планетарная модель атома
29. Строение атома
АтомЯдро
+Z·e
Протоны
+Z·e
Электроны
-Z·e
Нейтроны
N
Атом не несет заряда, он
электрически нейтрален.
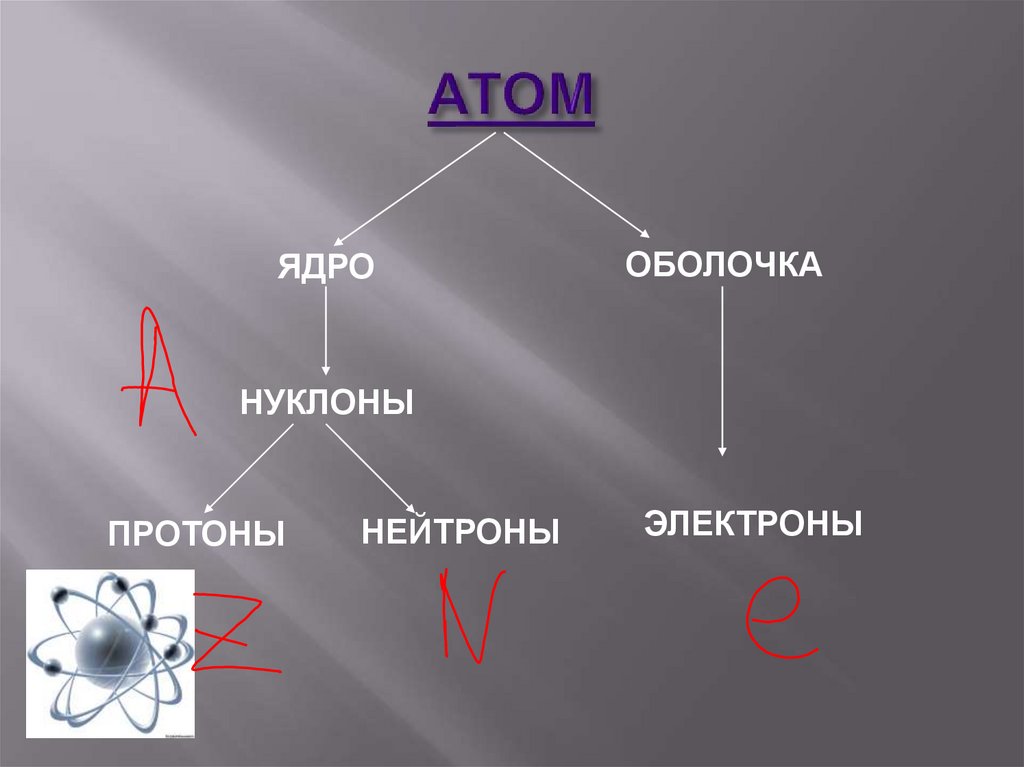
30. АТОМ
ЯДРООБОЛОЧКА
НУКЛОНЫ
ПРОТОНЫ
НЕЙТРОНЫ
ЭЛЕКТРОНЫ
31. Строение атома
Химический элементA – массовое число (масса атома)
Z – зарядовое число (заряд ядра атома)
A=N+Z
N - количество нейтронов
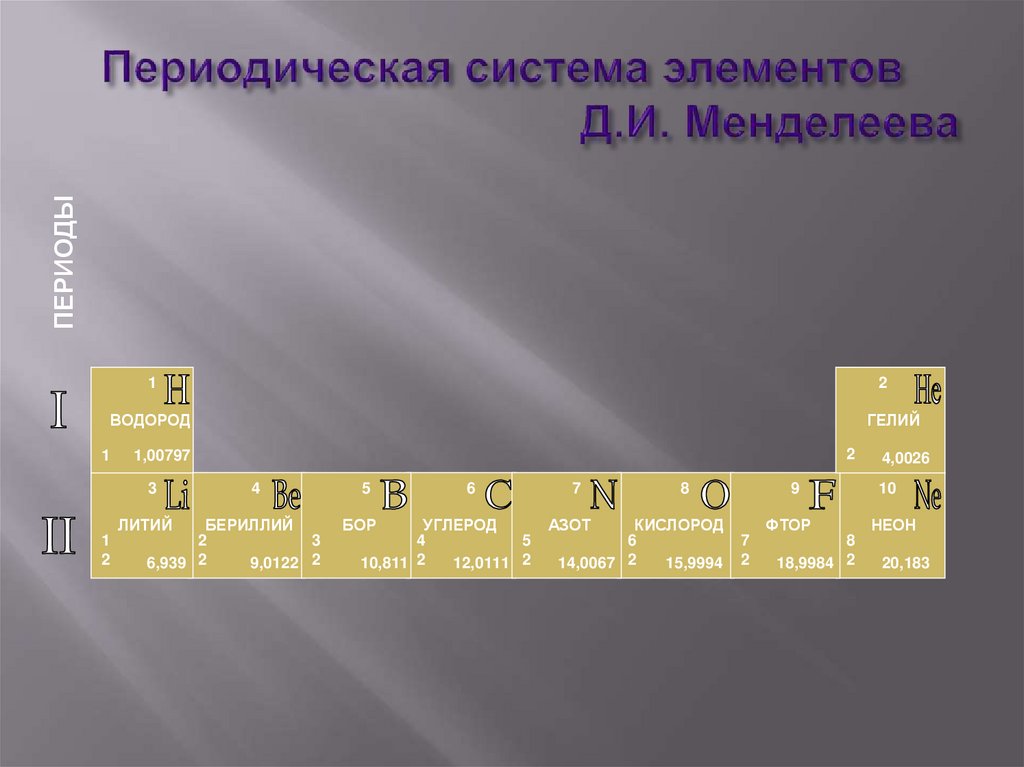
32. Периодическая система элементов Д.И. Менделеева
ПЕРИОДЫ1
2
ВОДОРОД
ГЕЛИЙ
1
3
ЛИТИЙ
1
2
2
1,00797
4
БЕРИЛЛИЙ
2
3
6,939 2
9,0122 2
5
БОР
6
УГЛЕРОД
4
5
10,811 2
12,0111 2
7
8
АЗОТ
КИСЛОРОД
6
14,0067 2
15,9994
7
2
4,0026
9
10
ФТОР
НЕОН
8
18,9984 2
20,183
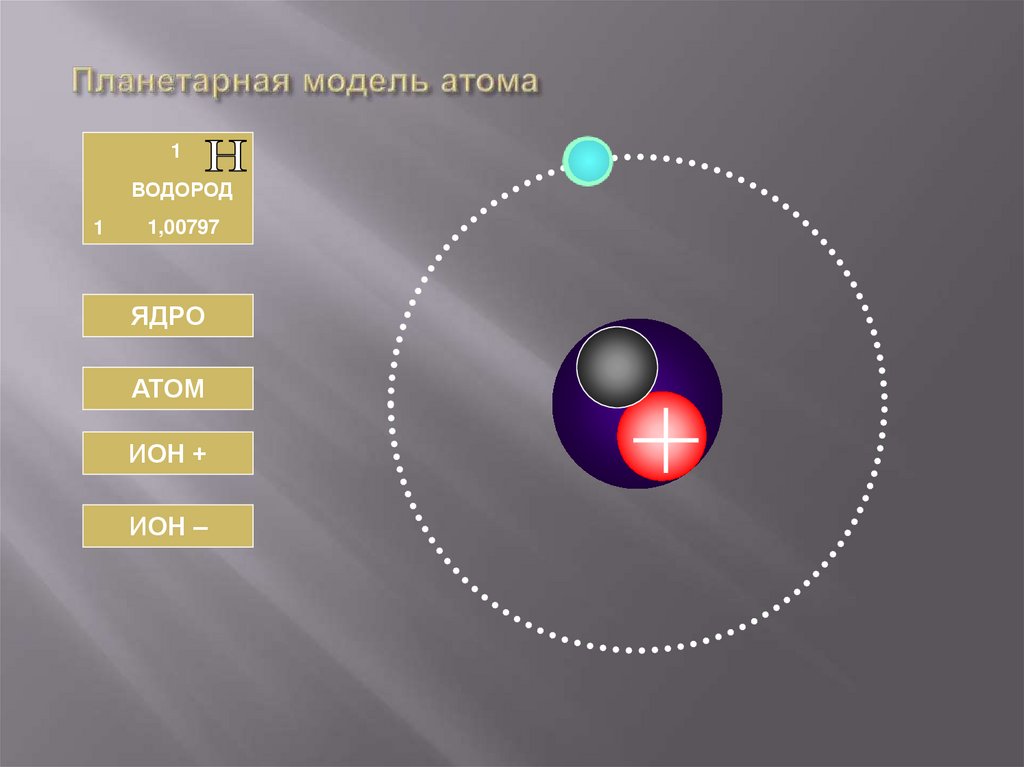
33. Планетарная модель атома
1ВОДОРОД
1
1,00797
ЯДРО
АТОМ
ИОН +
ИОН –
34. ВОДОРОД
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 1
Nn = 1
Z = +e1
A=1
Мя = 1Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов =1
Заряд атома
0
Заряд электронов = -е1
Заряд ядра
= +е1
ИОН –
Н+
0
+1
0
+1
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Н2
-1
-2
+1
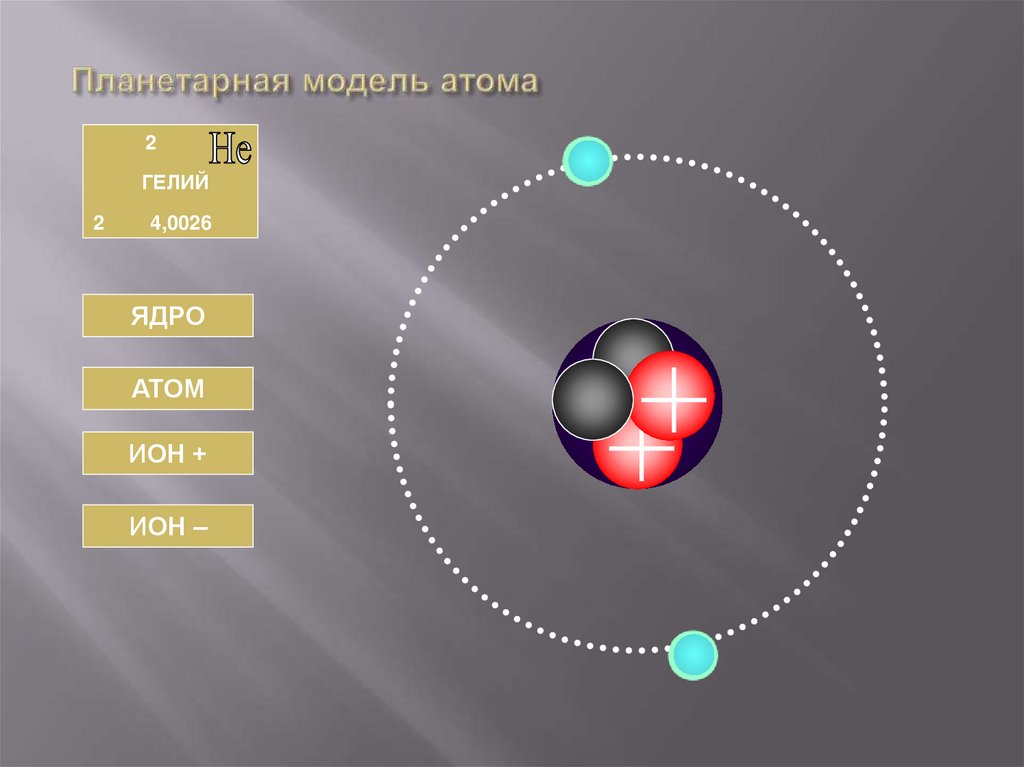
35. Планетарная модель атома
2ГЕЛИЙ
2
4,0026
ЯДРО
АТОМ
ИОН +
ИОН –
36. ГЕЛИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 2
Nn = 2
Z = +e2
A=4
Мя = 4Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов =2
Заряд атома
0
Заряд электронов = -е2
Заряд ядра
= +е2
ИОН –
Не+
1
+1
-1
+e2
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Нe3
-1
-3
+e2
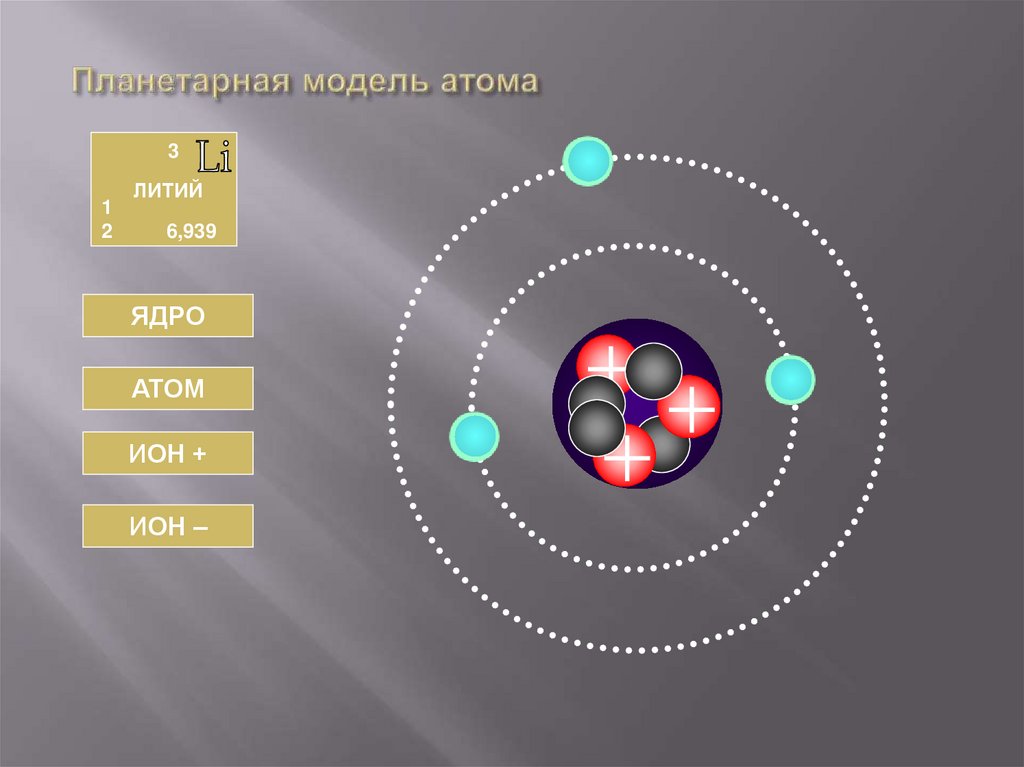
37. Планетарная модель атома
31
2
ЛИТИЙ
6,939
ЯДРО
АТОМ
ИОН +
ИОН –
38. ЛИТИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 3
Nn = 4
Z = +e3
A=7
Мя = 7Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов = 3
Заряд атома
0
Заряд электронов = -е3
Заряд ядра
= +е3
ИОН –
Li+
2
+1
- e·2
+e·3
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Li4
-1
- e·4
+e·3
39. Планетарная модель атома
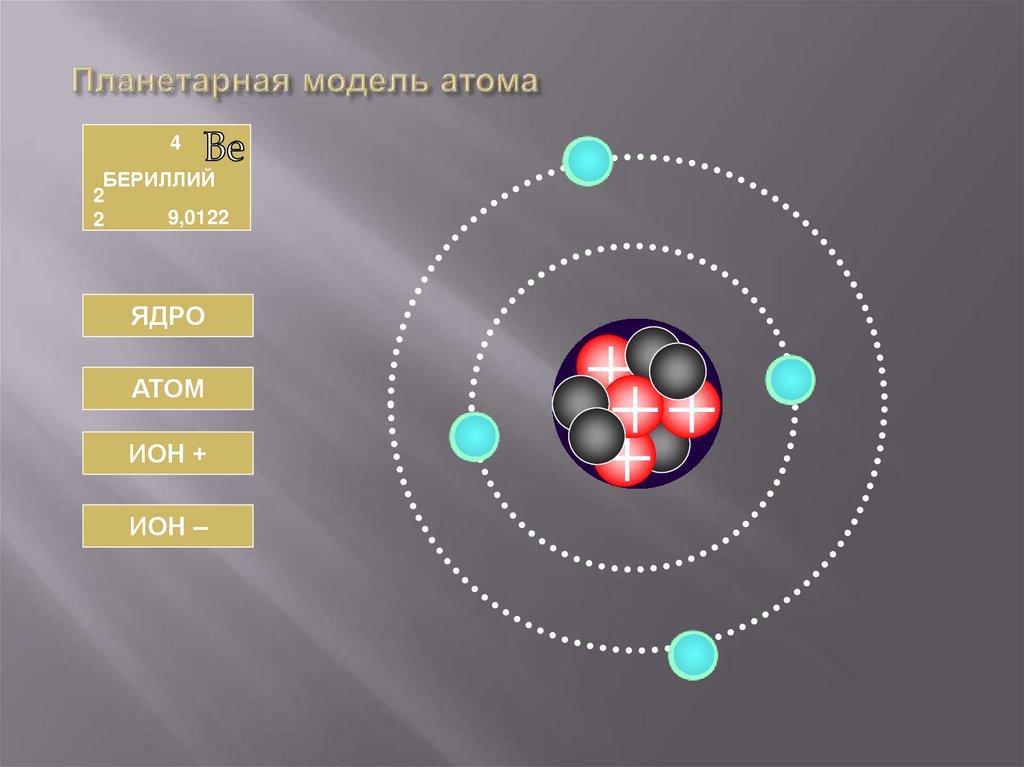
4БЕРИЛЛИЙ
2
9,0122
2
ЯДРО
АТОМ
ИОН +
ИОН –
40. БЕРИЛЛИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 4
Nn = 5
Z = +e4
A=9
Мя = 9Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов = 4
Заряд атома
0
Заряд электронов = -е4
Заряд ядра
= +е4
ИОН –
Ве+
3
+1
- e3
+e4
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Ве5
-1
- e·5
+e·4
41.
A=Z=
A=
Z=
238
92
U
A=
Z=
42. 1. Выберите один правильный ответ из предложенных вариантов
Что представляют собой α -частицы?А
Поток ядер водорода.
Б
Поток нейтронов.
В
Поток быстрых электронов.
Г
Поток ядер гелия.
42
43. 2. Выберите один правильный ответ из предложенных вариантов
Чему равно число протонов (Z) и числонейтронов (N) в изотопе бора
?
А
Z = 5, N = 11.
Б
Z = 11, N = 5.
В Z = 5 , N = 6.
43
44. А. Эйнштейн:
«Обнаруженная силаурана угрожает
цивилизации и людям не
больше, чем когда мы
зажигаем спичку.
Дальнейшее развитие
человечества зависит не
от уровня технических
достижений, а от его
моральных принципов».
(1879 – 1955)
44
45. Домашнее задание
§57 (старый учебник)§56 (новый учебник)
Конспект слайдов 26 - 44
45
































 physics
physics








