Similar presentations:
Открытие радиоактивности. Опыты резерфорда и планетарная модель атома
1.
26.03.20252.
3.
А.БеккерельФранцузский физик.
Основные работы
посвящены изучению
явлений люминесценции и
радиоактивности. Открыл
(1896) и изучил явление
самопроизвольного
излучения солями урана и
металлическим ураном
лучей особой природы,
названное М. Кюри в 1898
радиоактивностью.
В честь Беккереля
названа единица измерения
активности радиоактивных
изотопов – 1Бк.
4.
Склодовская-Кюри (SklodowskaCurie). Химик и физик. Является одним изосновоположников учения о
радиоактивности. Совместно с П. Кюри
открыла (1898) химические элементы
полоний и радий. Впервые употребила
термин «радиоактивность». Получила
(1902) вместе с П. Кюри 0,1 г соли радия и
определила его атомный вес. Совместно с
А. Л. Дебьеном получила (1910) радий в
металлическом виде. Они же изготовили
(1911) первый эталон радия. Нобелевская
премия по физике (1903, совместно с
П. Кюри). Нобелевская премия по химии
(1911).
М.Складовская-Кюри
5.
Кюри (Curie) Пьер(15.V.1859–19.IV.1906)
П.Кюри
Французский физик и химик. Один из
основателей учения о радиоактивности.
Научные
работы
посвящены
также
исследованию
кристаллических
тел,
магнетизму. Изучал (до 1896) парамагнитные
и диамагнитные тела и установил (1895)
закон, согласно которому сущестует обратная
пропорциональность
между
магнитной
восприимчивастью
парамагнетиков
и
абсолютной температурой (закон Кюри).
Обнаружил, что для железа существует
особая температура, выше которой исчезают
его ферромагнитные свойства (точка Кюри).
Совместно с женой М. Склодовской-Кюри
открыл (1898) полоний и радий. Одним из
первых
использовал
понятие
«период
полураспада». Предложил (1904) идею
метода определения абсолютного возраста
ураносодержащих минералов. Нобелевская
премия по физике (1903, совместно с
М. Склодовской-Кюри).
6.
Резерфорд (Rutherford)Эрнст
(30.VIII.1871–19.X.1937)
Э.Резерфорд
Английский
физик.
Один
из
основателей учения о радиоактивности,
ядерной физики и представлений о
строении атомов. Совместно с Ф. Содди
дал четкую формулировку (1903) закона
радиоактивных превращений, выразив
его в математической форме, и ввел
понятие «период полураспада». Изучил
рассеяние α-частиц атомами различных
элементов
и
предложил
(1911)
планетарную (ядерную) модель атома.
Бомбардировал
(1919)
α-частицами
атомы
азота,
осуществив
первое
искусственное превращение элементов
(азота в кислород). Предложил называть
ядро
атома
водорода
протоном.
Нобелевская премия по физике (1908).
7.
Томсон (Thomson) Джозеф Джон(18.XII.1856–30.VIII.1940)
Д.Д.Томсон
Английский физик, член Лондонского королевского
общества (с 1884, в 1915–20 – президент). В 1884–19
профессор
Кембриджского
университета
и
руководитель
Кавендишской
лаборатории;
одновременно в 1905–18 профессор Королевского
института в Лондоне. Ранние работы Томсона
посвящены вычислению электромагнитного поля
движущегося заряженного шара, теории вихрей,
прецизионному измерению отношения абсолютных
электрических
единиц
к
электромагнитным.
Занимаясь изучением газового разряда, Томсон
совместно с сотрудниками выполнил серию
классических работ, приведших
к открытию
электрона (впервые измерил отношение заряда
электрона к массе, 1897; Нобелевская премия, 1906).
Томсон дал объяснение непрерывного спектра
рентгеновского излучения, установил природу
положительных ионов, предложил первую модель
строения атома. В 1911 Томсон разработал так
называемый метод парабол для измерения
отношения заряда частицы к ее массе, который
сыграл большую роль в исследовании изотопов.
Большое значение имела научно-организационная
деятельность
Томсона.
Возглавляемая
им
Кавендишская лаборатория превратилась в ведущий
научно-исследовательский физический центр, в
котором под его руководством работали крупнейшие
английские физики (Э. Резерфорд, Ч. Вильсон, Ф. У.
Астон, У. Ричардсон и др.). Будучи убежденным
сторонником
классической
физики,
Томсон
придерживался гипотезы эфира.
8. Катодные лучи
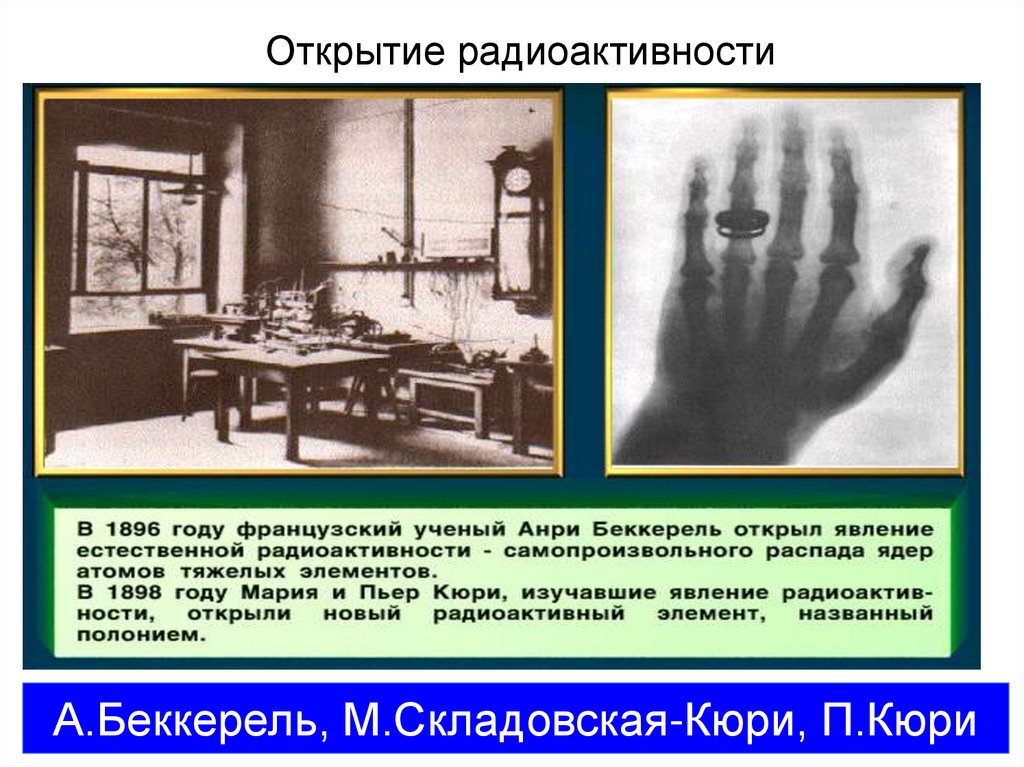
У.Крукс, Д.Стонэй9. Открытие радиоактивности
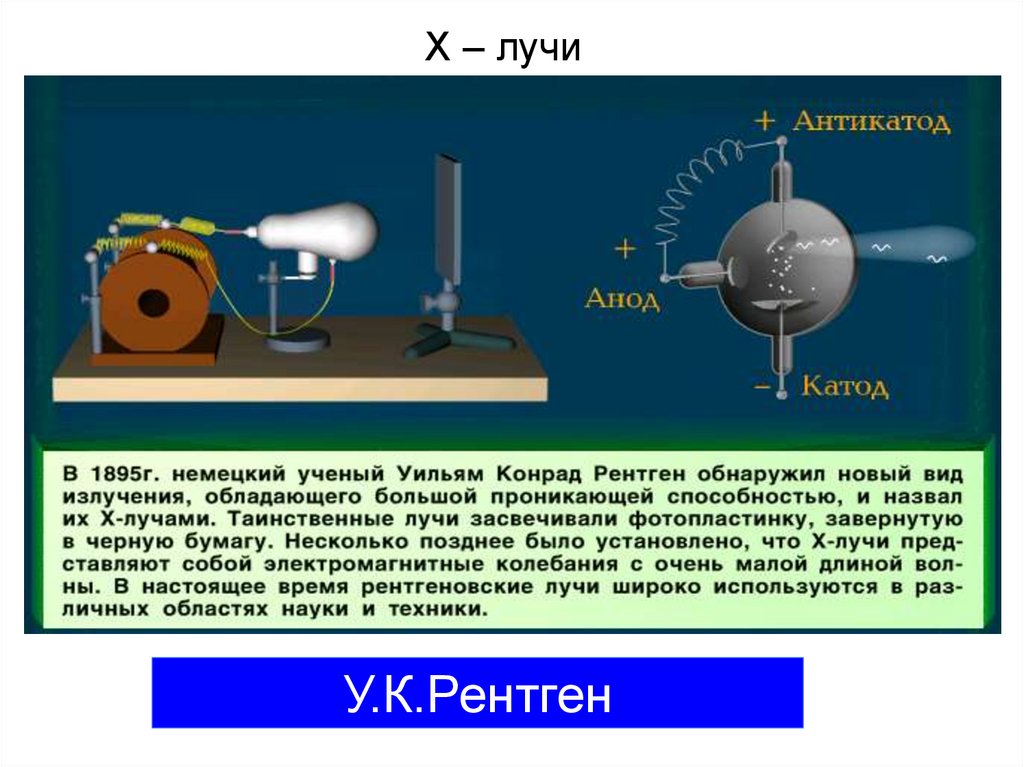
А.Беккерель, М.Складовская-Кюри, П.Кюри10. Х – лучи
У.К.Рентген11.
1896г. - открыл явлениерадиоактивности
(способность атомов
некоторых
химических
элементов к
самопроизвольному
излучению)
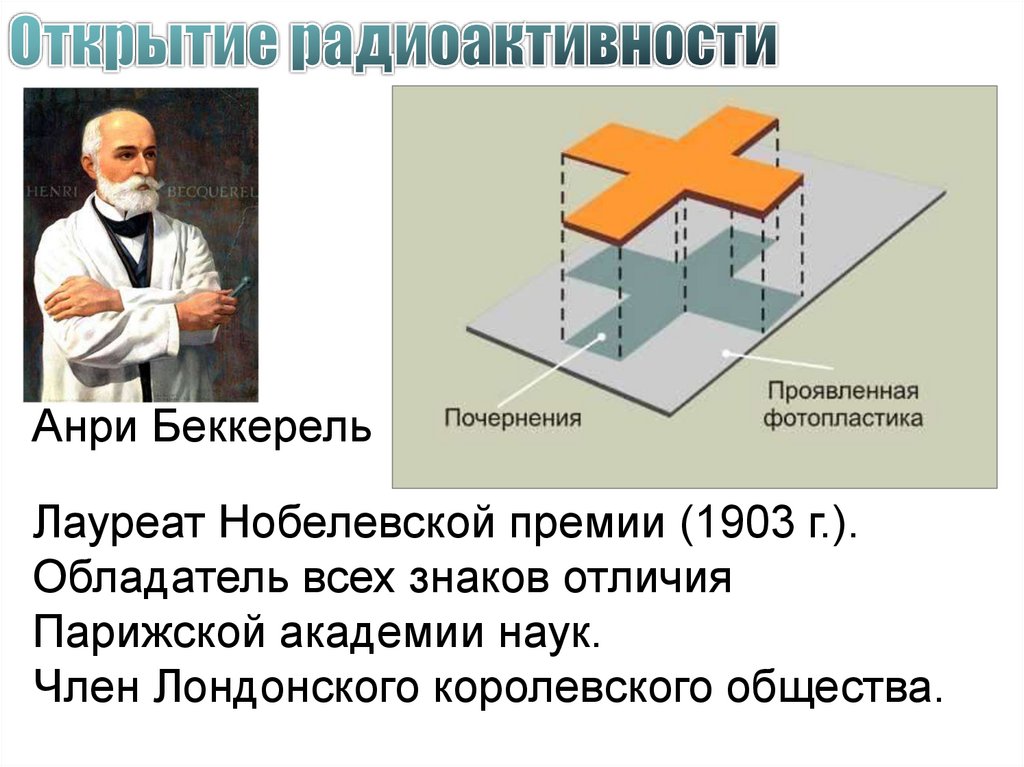
12.
Анри БеккерельЛауреат Нобелевской премии (1903 г.).
Обладатель всех знаков отличия
Парижской академии наук.
Член Лондонского королевского общества.
13.
1899г.14.
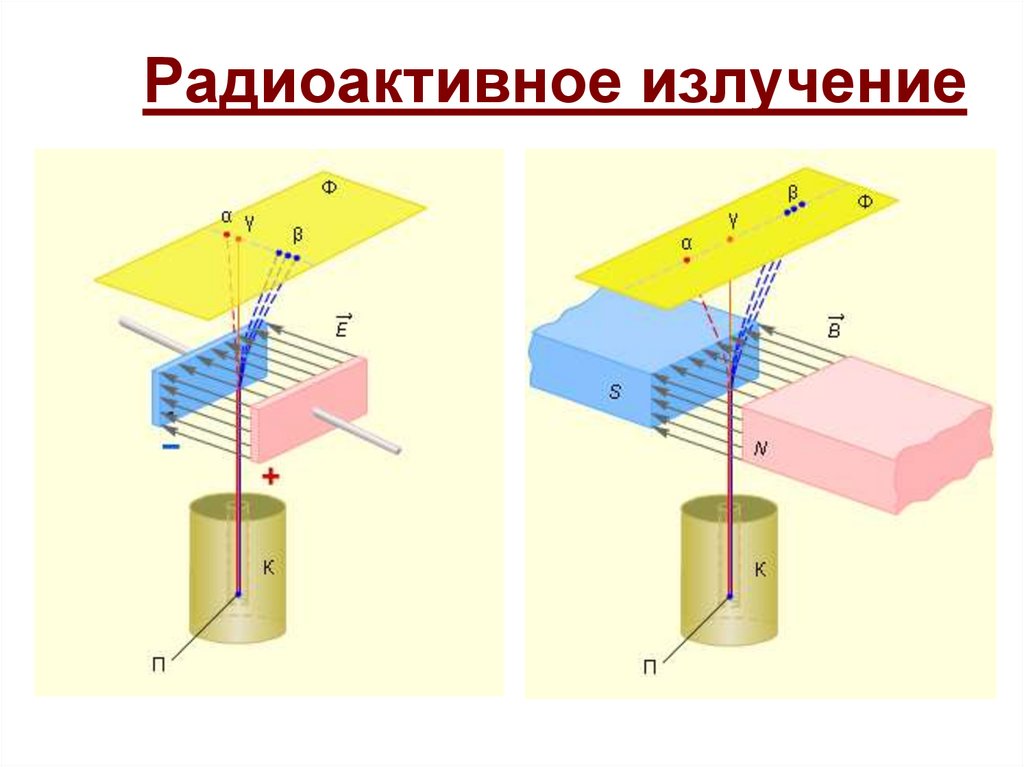
Урок 77. Атомная физика Опыты Резерфорда Планетарная модель атома.15. Радиоактивное излучение
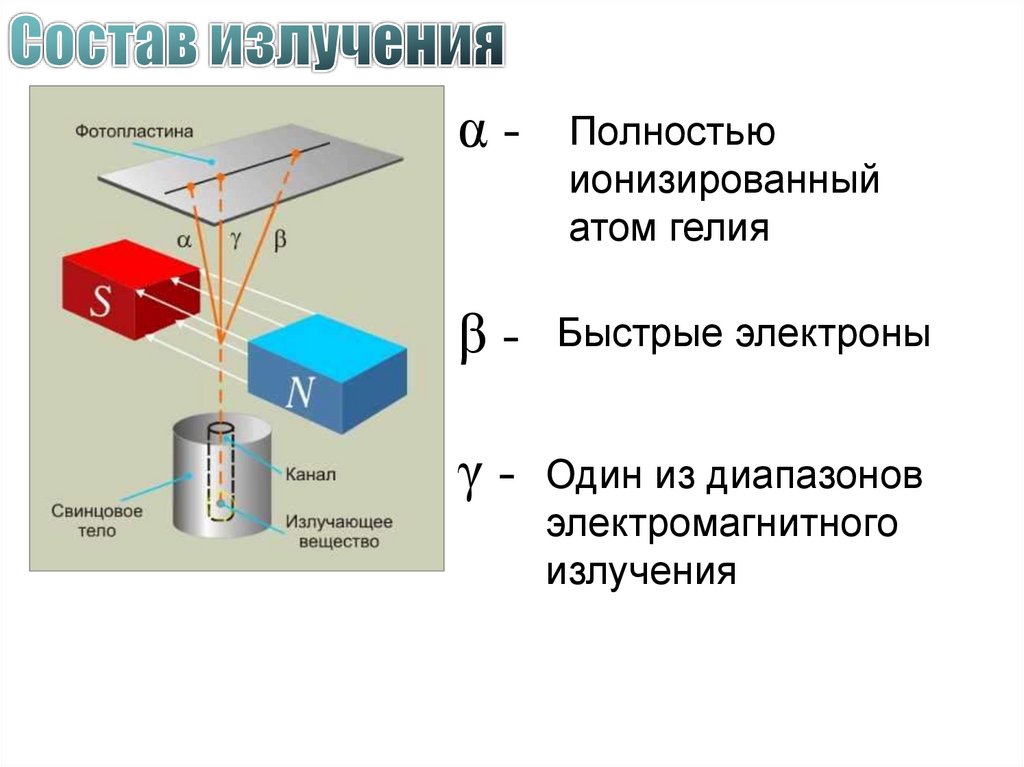
16.
α-Полностью
ионизированный
атом гелия
β - Быстрые электроны
γ - Один из диапазонов
электромагнитного
излучения
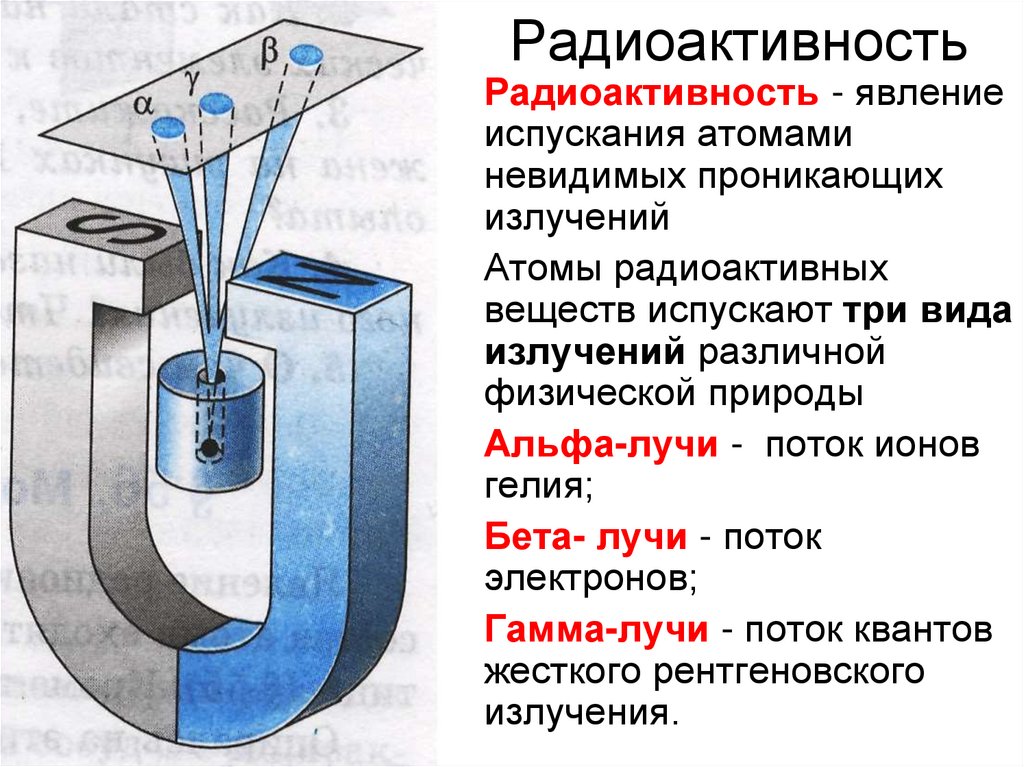
17. Радиоактивность
• Радиоактивность - явлениеиспускания атомами
невидимых проникающих
излучений
• Атомы радиоактивных
веществ испускают три вида
излучений различной
физической природы
• Альфа-лучи - поток ионов
гелия;
• Бета- лучи - поток
электронов;
• Гамма-лучи - поток квантов
жесткого рентгеновского
излучения.
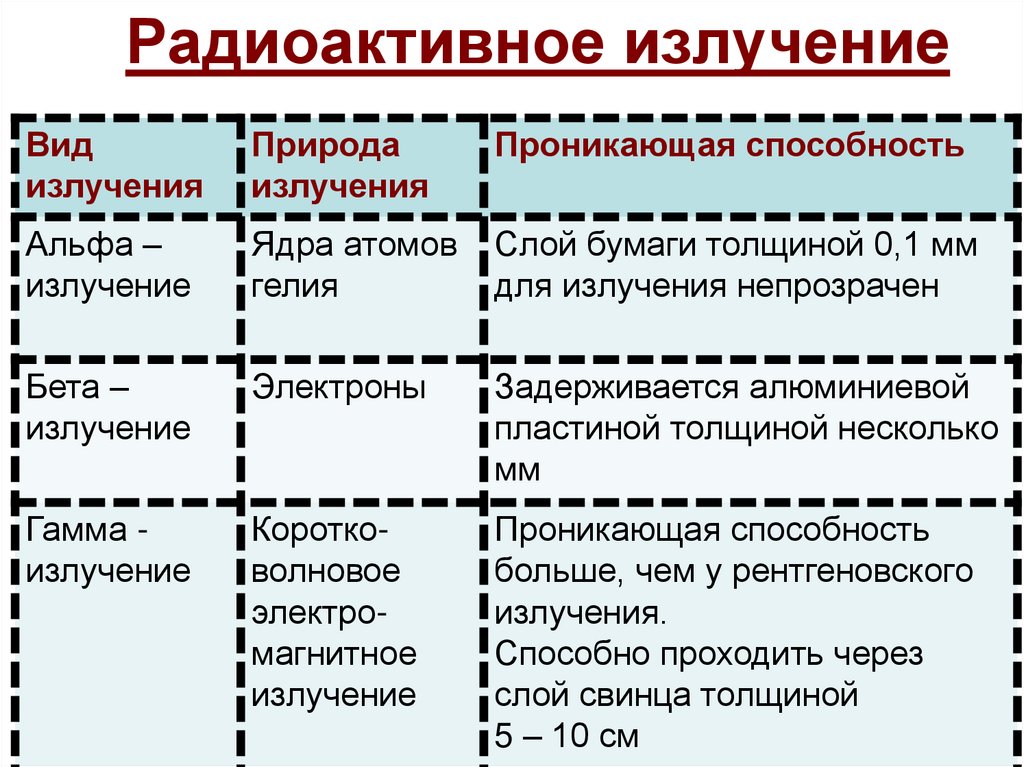
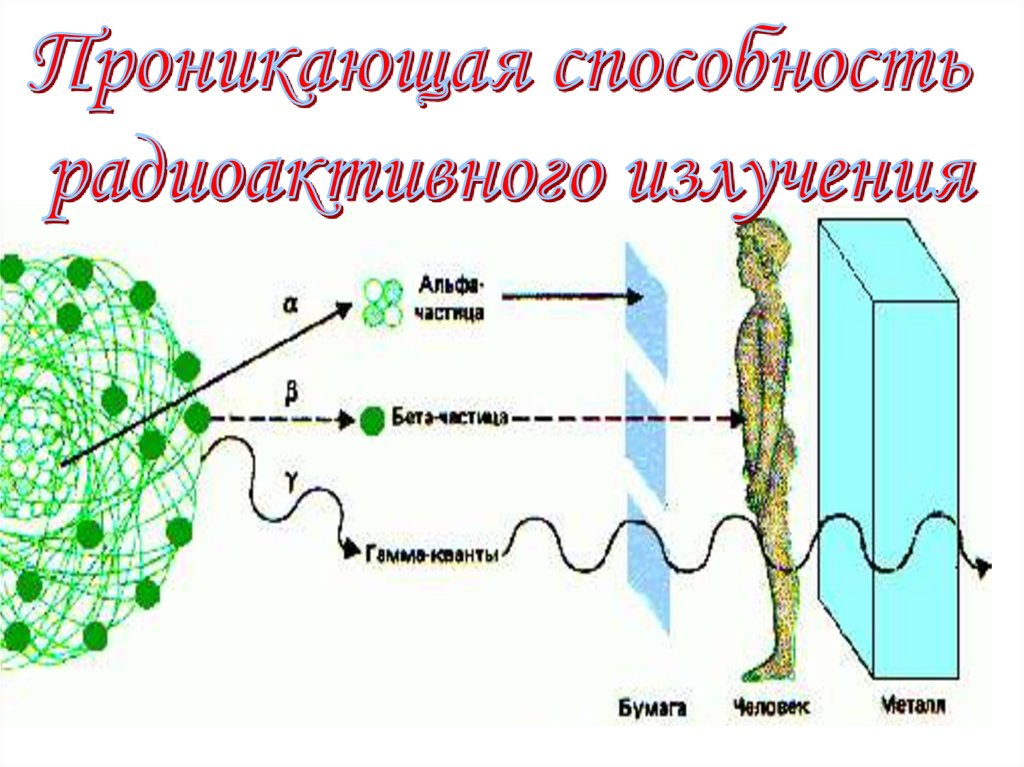
18. Радиоактивное излучение
Видизлучения
Природа
излучения
Проникающая способность
Альфа –
излучение
Ядра атомов
гелия
Слой бумаги толщиной 0,1 мм
для излучения непрозрачен
Бета –
излучение
Электроны
Задерживается алюминиевой
пластиной толщиной несколько
мм
Гамма излучение
Коротковолновое
электромагнитное
излучение
Проникающая способность
больше, чем у рентгеновского
излучения.
Способно проходить через
слой свинца толщиной
5 – 10 см
19.
Радиоактивность.Альфа-, бета- и гамма-излучения
- частица – ядро атома гелия.
4
2
He
- лучи обладают наименьшей проникающей
способностью. Слой бумаги толщиной около 0,1 мм для
них уже не прозрачен. Слабо отклоняются в магнитном
поле.
У - частицы на каждый из двух элементарных зарядов
приходится две атомные единицы массы. Резерфорд
доказал, что при радиоактивном - распаде образуется
гелий.
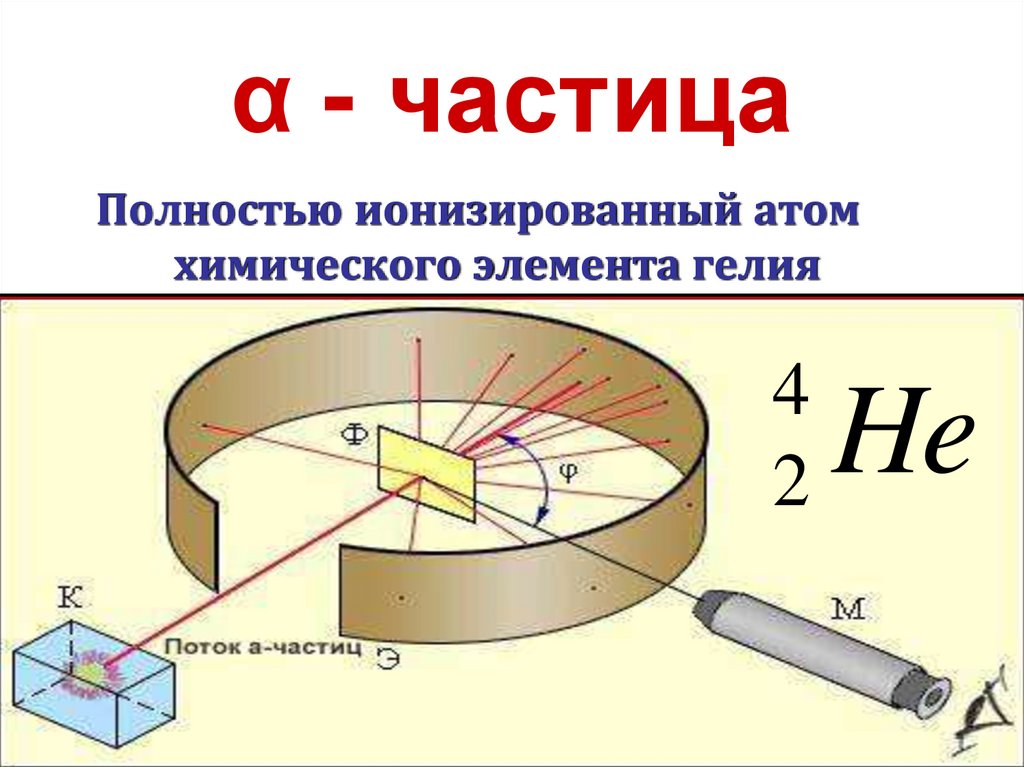
20. α - частица
Полностью ионизированный атомхимического элемента гелия
4
2
He
21.
01
β - частицы представляют собой
e
электроны, движущиеся со скоростями,
очень близкими к скорости света. Они
сильно отклоняются как в магнитном, так и
в электрическом поле.
β – лучи гораздо меньше поглощаются
при прохождении через вещество.
Алюминиевая пластинка полностью их
задерживает только при толщине в
несколько миллиметров.
22. β - частица
Представляет собой- электрон
0
1
e
23. γ - частицы
Видэлектромагнитного
излучения
24.
-лучи
представляют
собой
электромагнитные
волны.
По
своим
свойствам
очень
сильно
напоминают
рентгеновские, но только их проникающая
способность гораздо больше, чем у
рентгеновских
лучей.
Не
отклоняются
магнитным полем. Обладают наибольшей
проникающей способностью. Слой свинца
толщиной в 1 см не является для них
непреодолимой преградой. При прохождении
– лучей через такой слой свинца их
интенсивность убывает лишь вдвое.
25.
Урок 77. Строение атомов. Опыты Резерфорда (9 класс)26.
27.
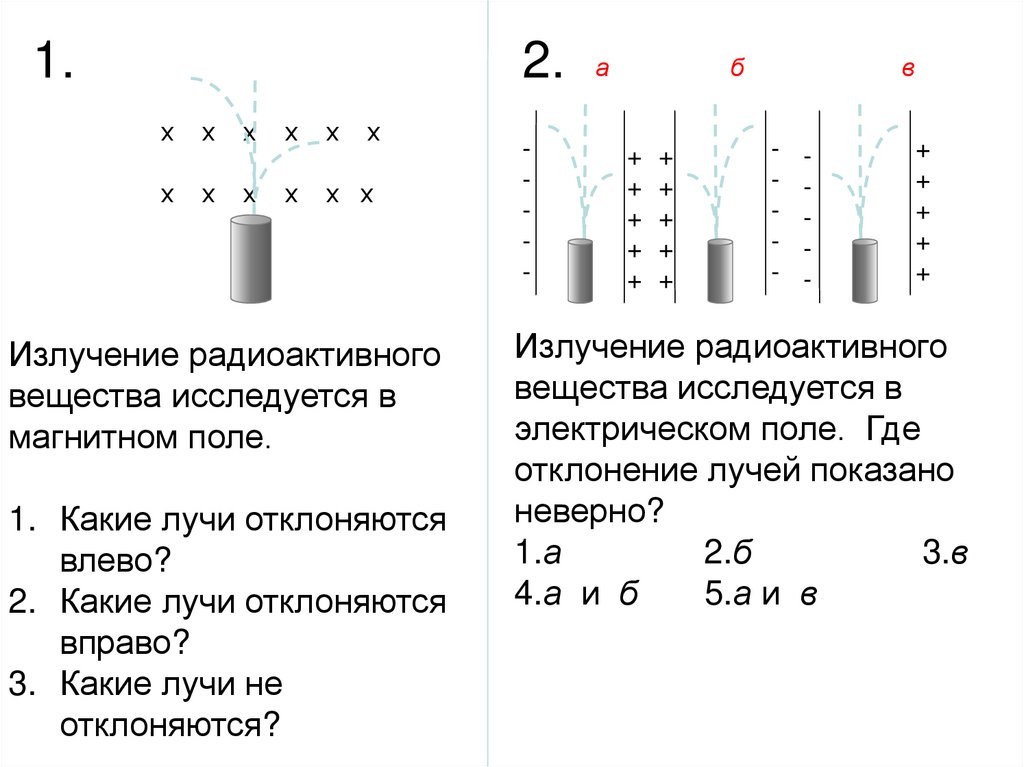
1.2. а
х
х
х
х
х
х
х
х
х
х
х х
Излучение радиоактивного
вещества исследуется в
магнитном поле.
1. Какие лучи отклоняются
влево?
2. Какие лучи отклоняются
вправо?
3. Какие лучи не
отклоняются?
-
б
+ +
+ +
+ +
+ +
+ +
в
-
-
+
+
+
+
+
Излучение радиоактивного
вещества исследуется в
электрическом поле. Где
отклонение лучей показано
неверно?
1.а
2.б
3.в
4.а и б
5.а и в
28.
Строениеатома
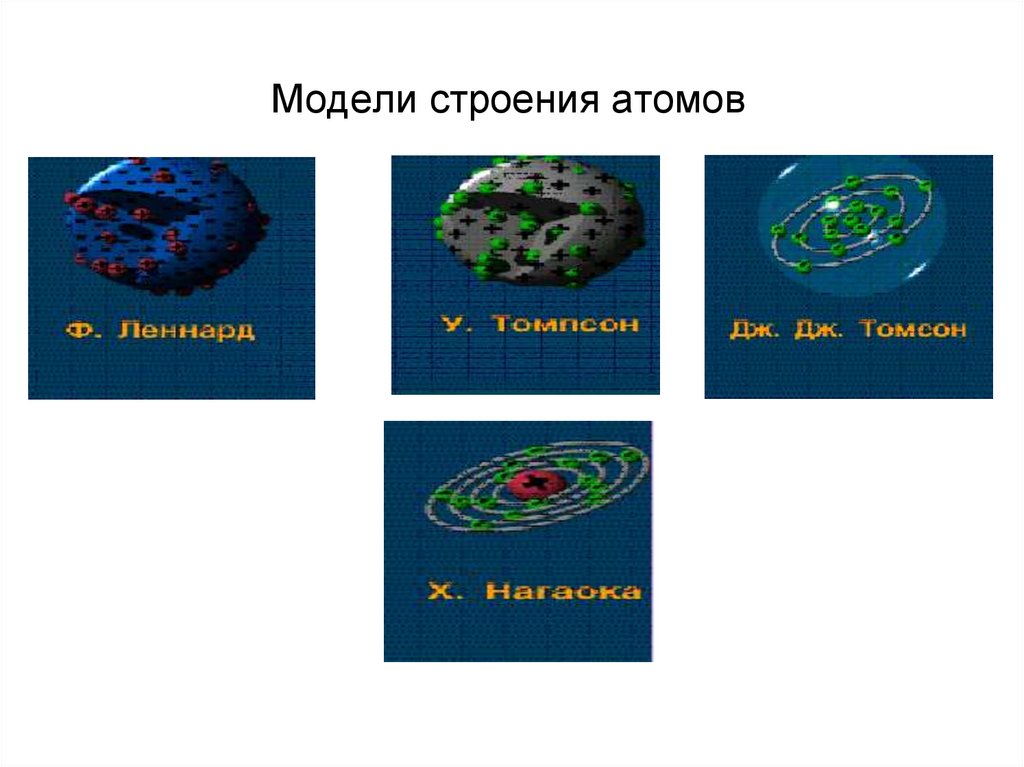
29. Модели строения атомов
30.
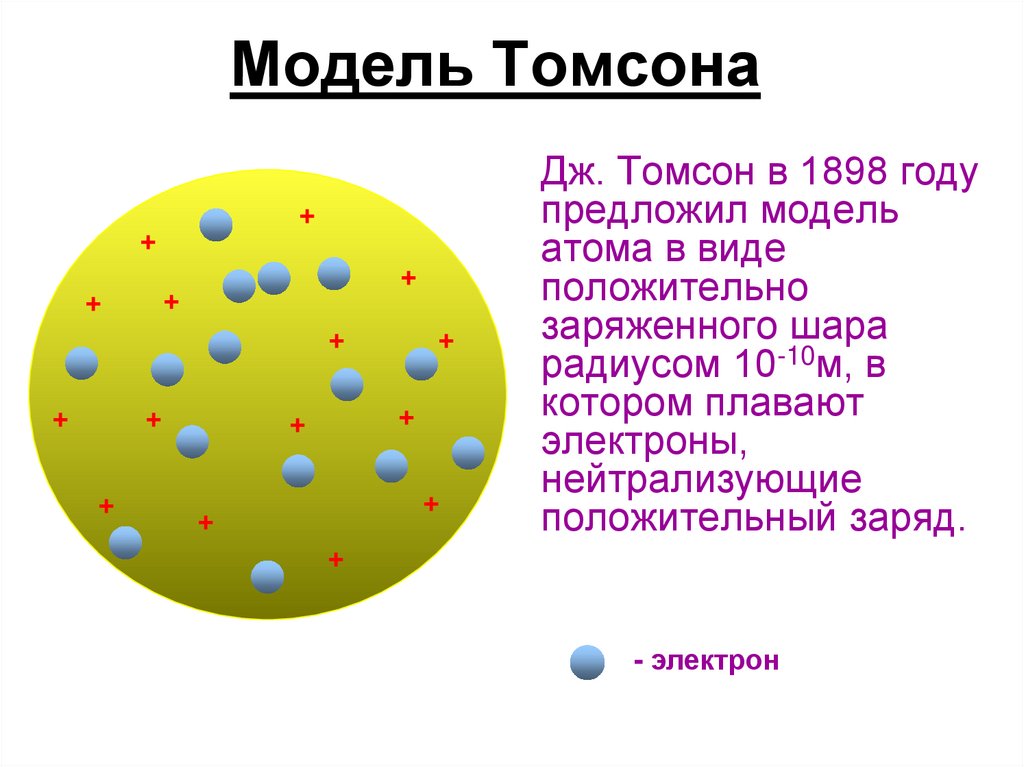
Атом Томсона31. Модель Томсона
++
+
+
+
+
+
+
+
+
+
+
+
+
Дж. Томсон в 1898 году
предложил модель
атома в виде
положительно
заряженного шара
радиусом 10-10м, в
котором плавают
электроны,
нейтрализующие
положительный заряд.
+
- электрон
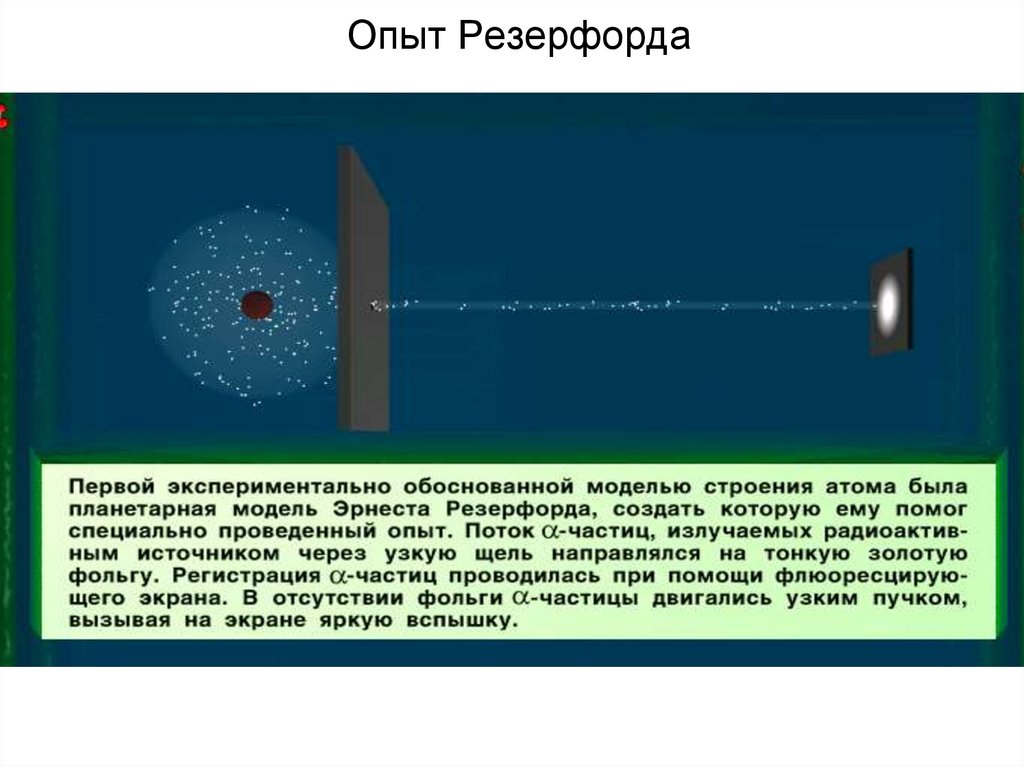
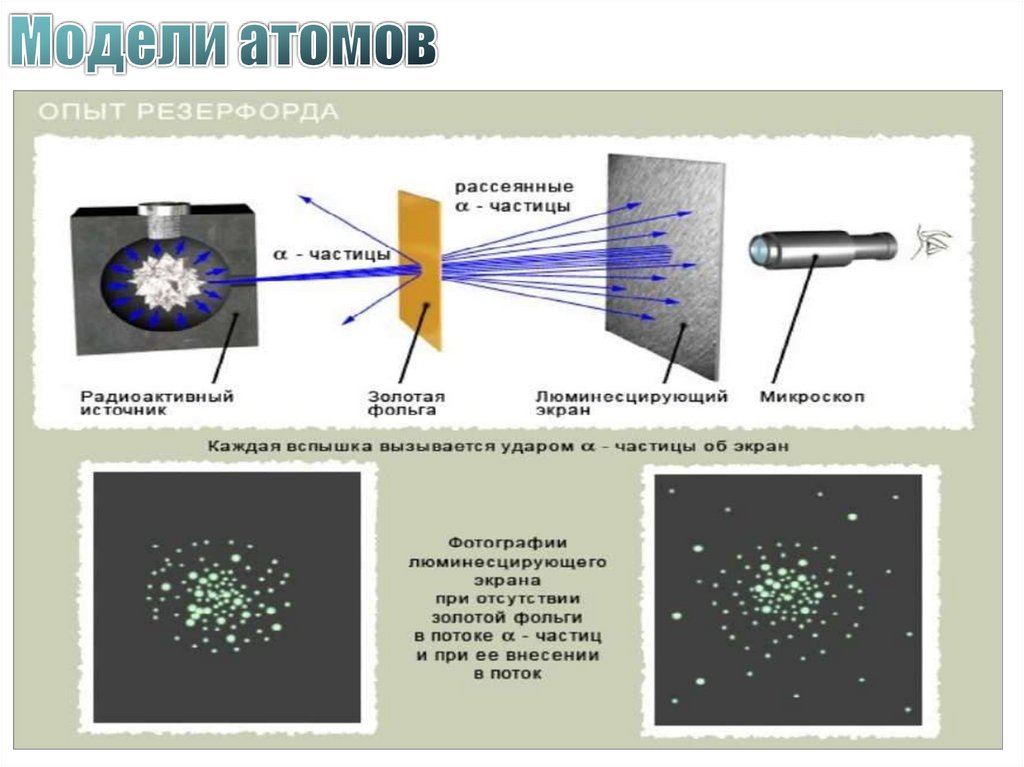
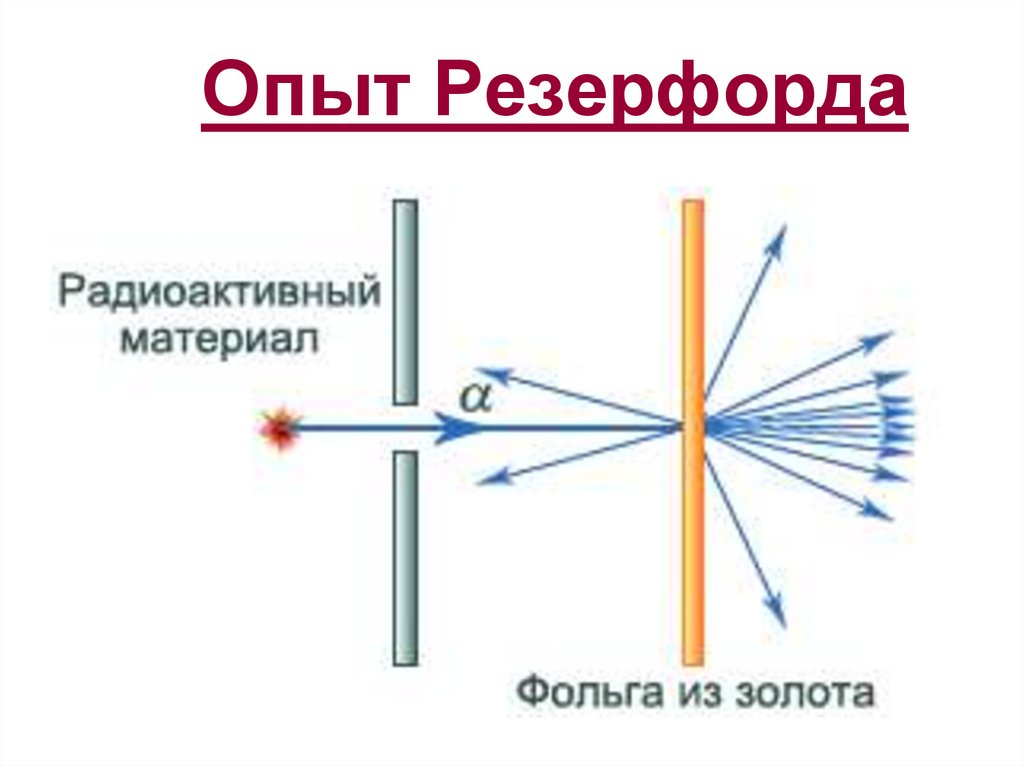
32. Опыт Резерфорда
33.
34. Опыт Резерфорда
35. Опыт Резерфорда
36.
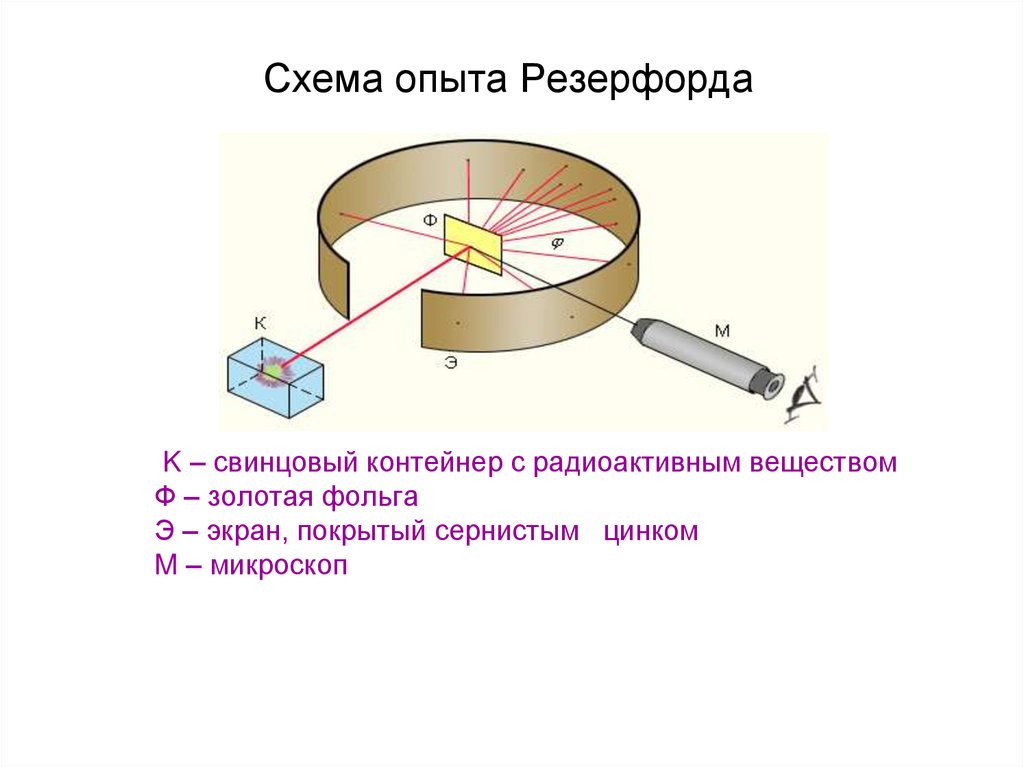
37. Схема опыта Резерфорда
K – свинцовый контейнер с радиоактивным веществомФ – золотая фольга
Э – экран, покрытый сернистым цинком
M – микроскоп
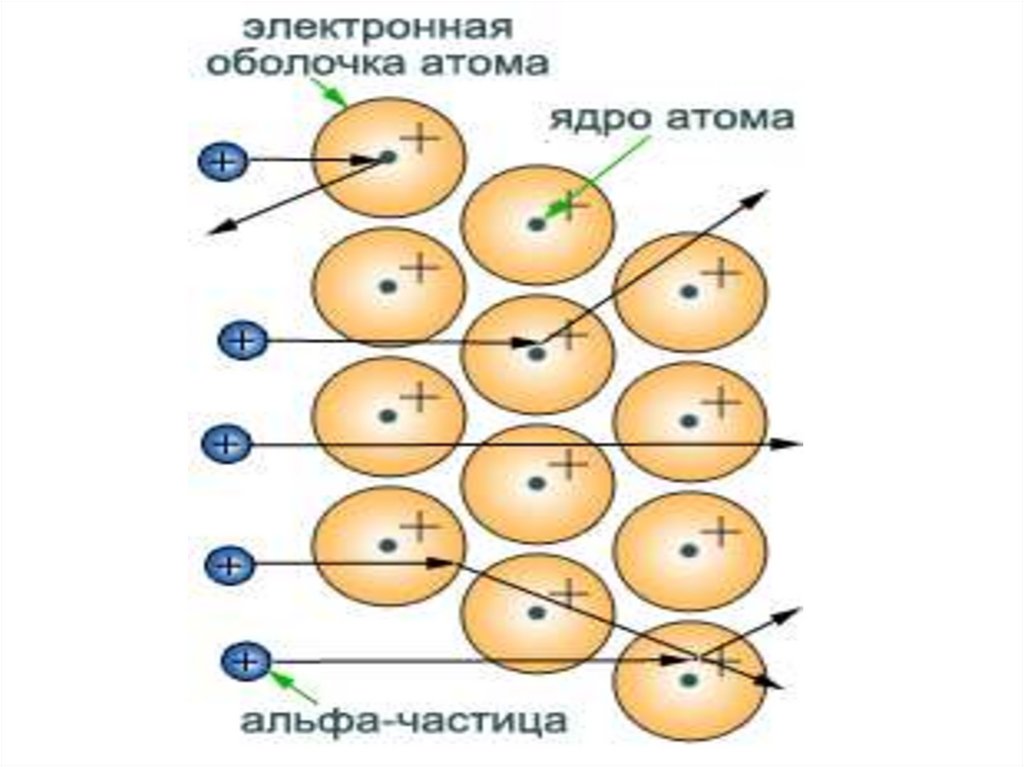
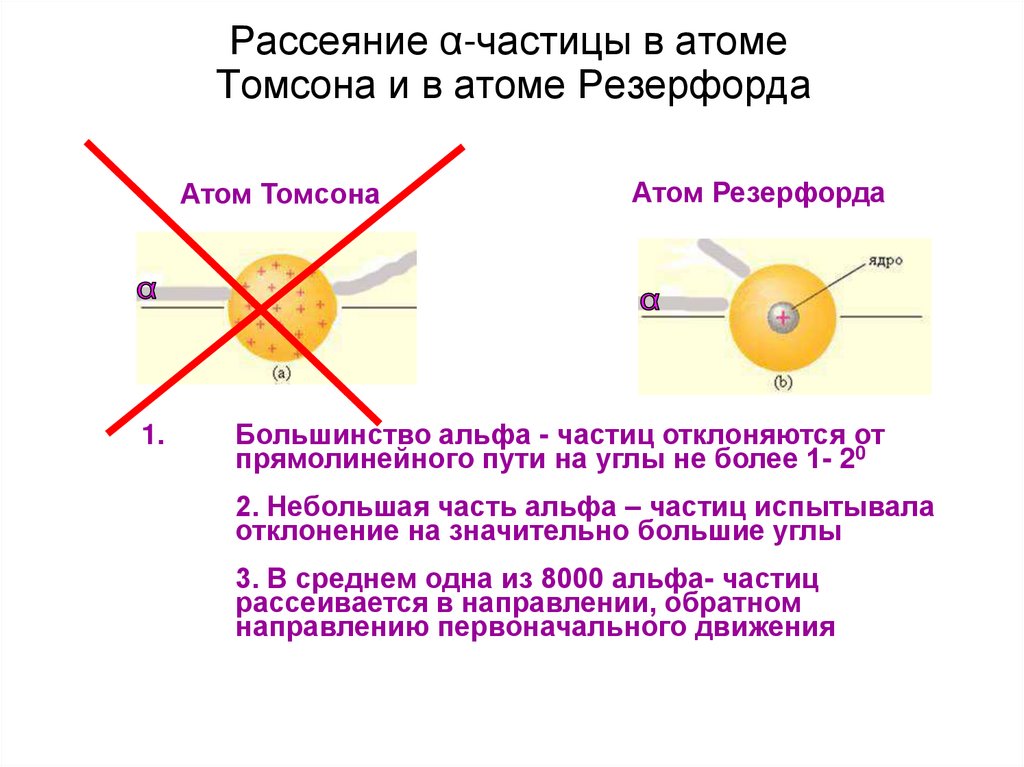
38. Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда
Атом Томсона1.
Атом Резерфорда
Большинство альфа - частиц отклоняются от
прямолинейного пути на углы не более 1- 20
2. Небольшая часть альфа – частиц испытывала
отклонение на значительно большие углы
3. В среднем одна из 8000 альфа- частиц
рассеивается в направлении, обратном
направлению первоначального движения
39.
Атом РезерфордаПланетарная
модель
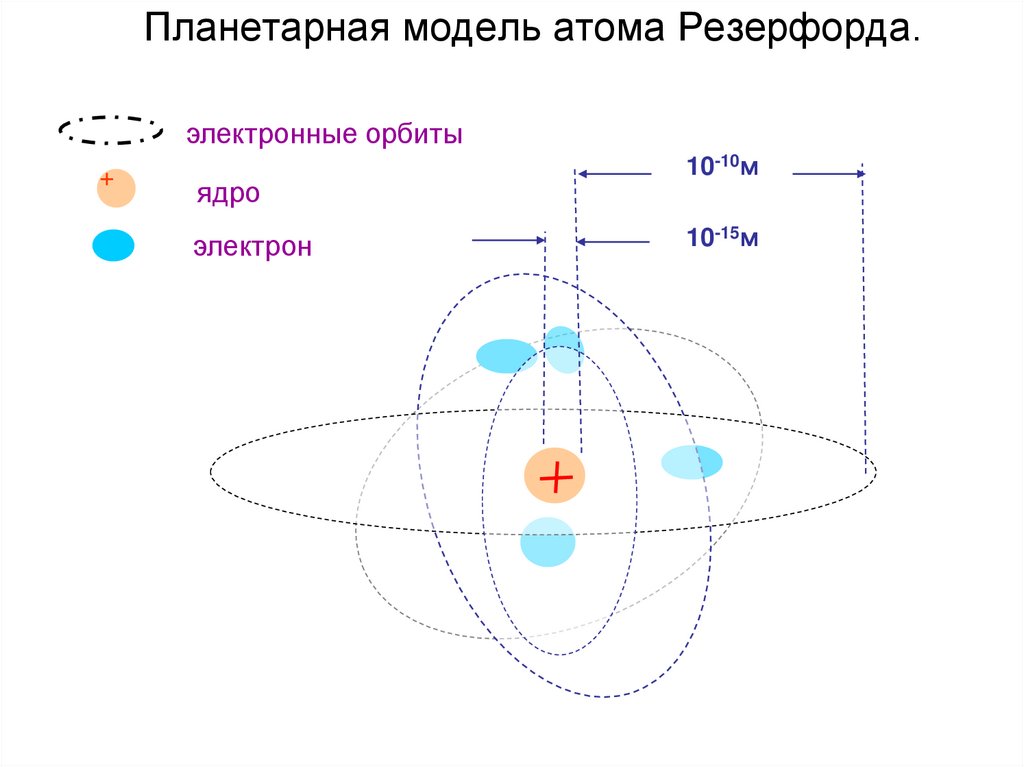
40. Планетарная модель атома Резерфорда.
электронные орбиты+
ядро
электрон
10-10м
10-15м
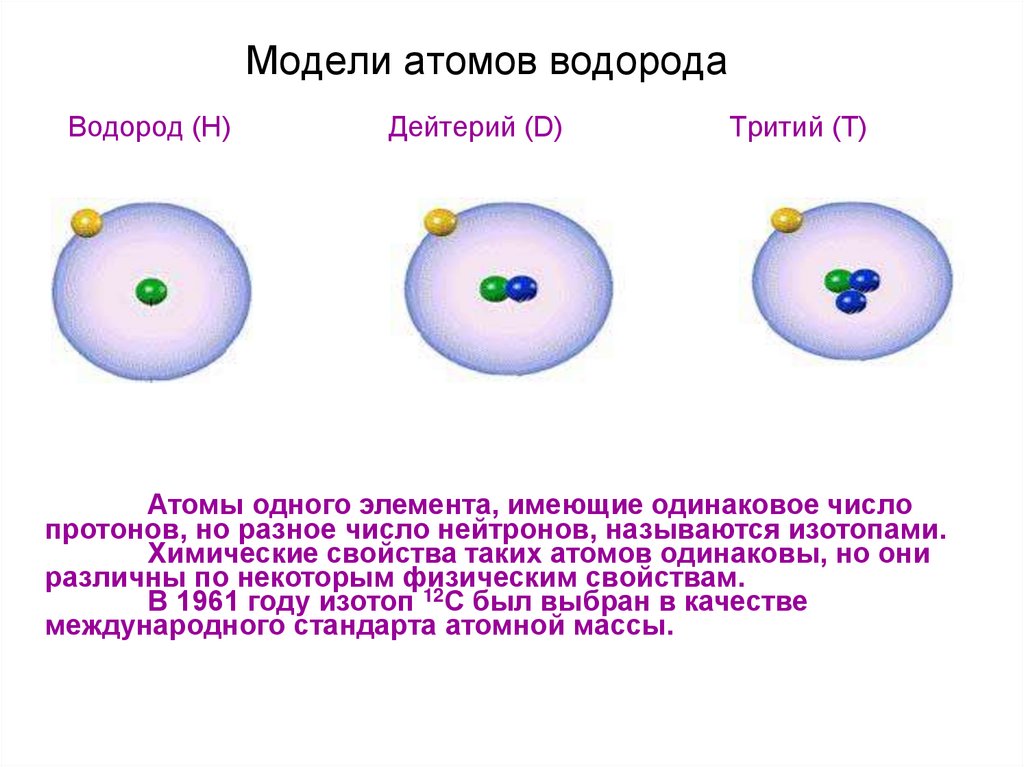
41. Модели атомов водорода
Водород (H)Дейтерий (D)
Тритий (T)
Атомы одного элемента, имеющие одинаковое число
протонов, но разное число нейтронов, называются изотопами.
Химические свойства таких атомов одинаковы, но они
различны по некоторым физическим свойствам.
В 1961 году изотоп 12С был выбран в качестве
международного стандарта атомной массы.
42. Планетарная модель атома
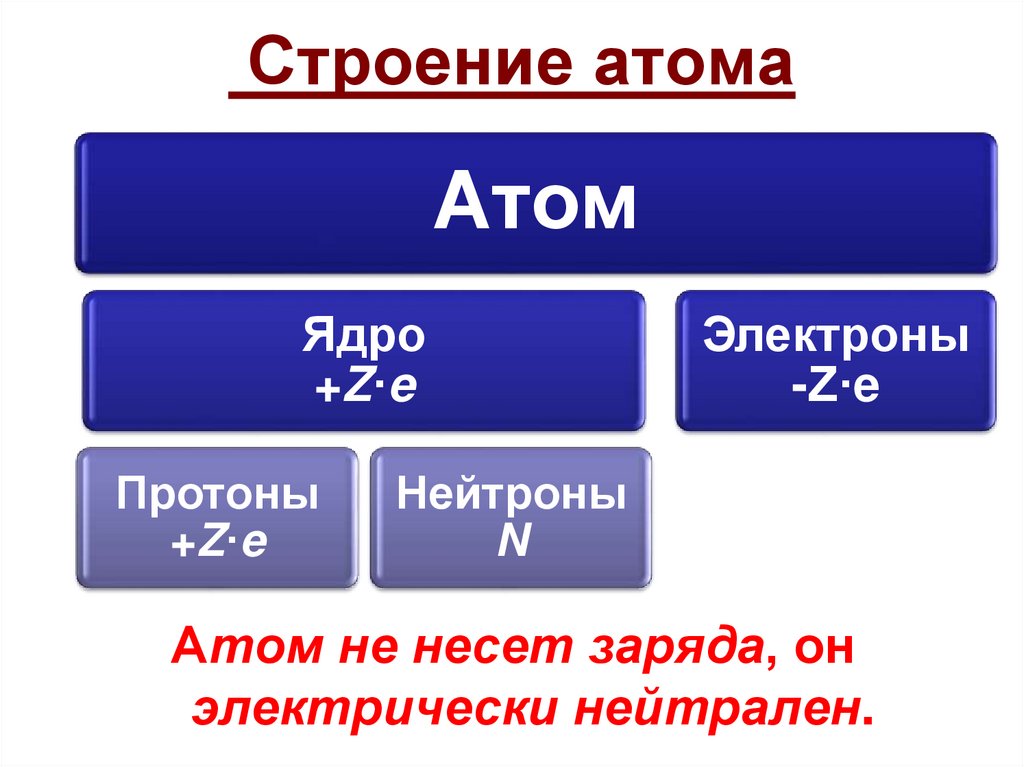
43. Строение атома
АтомЯдро
+Z·e
Протоны
+Z·e
Электроны
-Z·e
Нейтроны
N
Атом не несет заряда, он
электрически нейтрален.
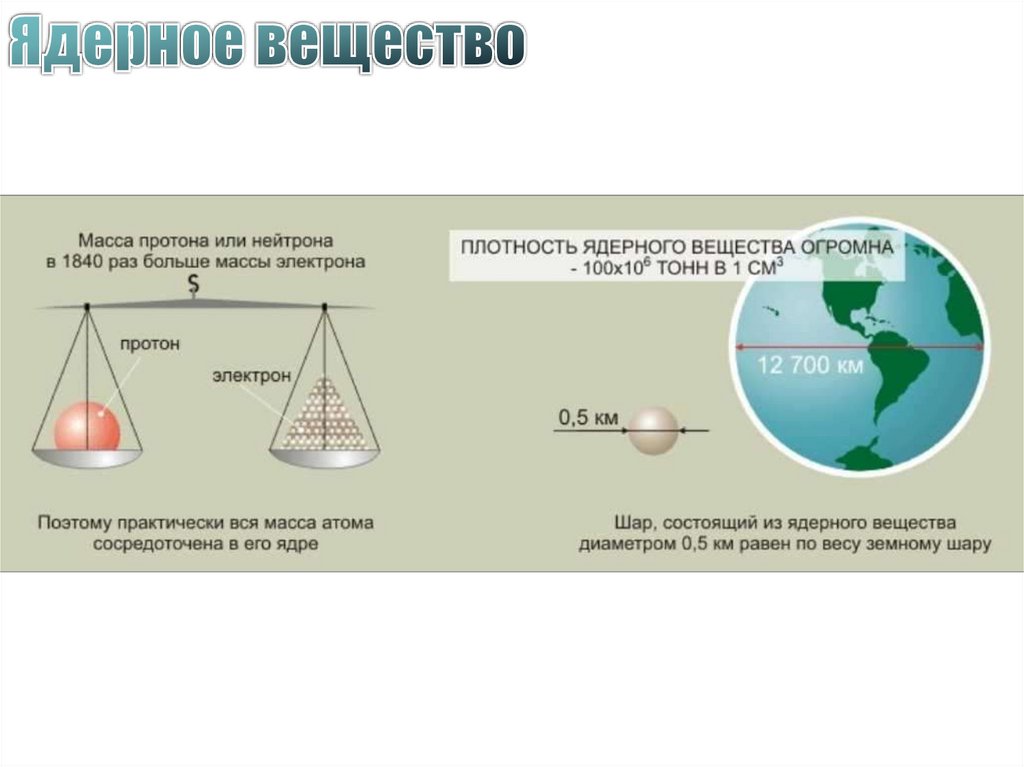
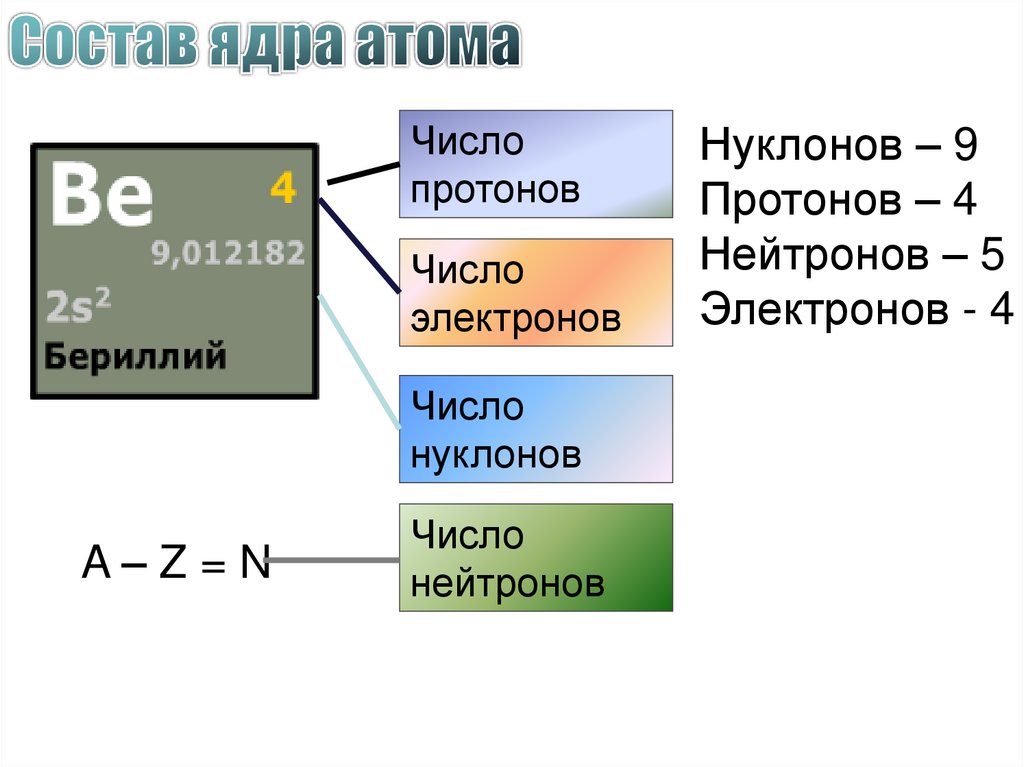
44. Состав ядра атома
протоныmp= 1, 6726·10-27 кг ≈ 1 а.е.м.
qp= +1,6·10-19 Кл = │e│
нейтроны
mn= 1,6749·10-27 кг ≈ 1 а.е.м.
q n= 0
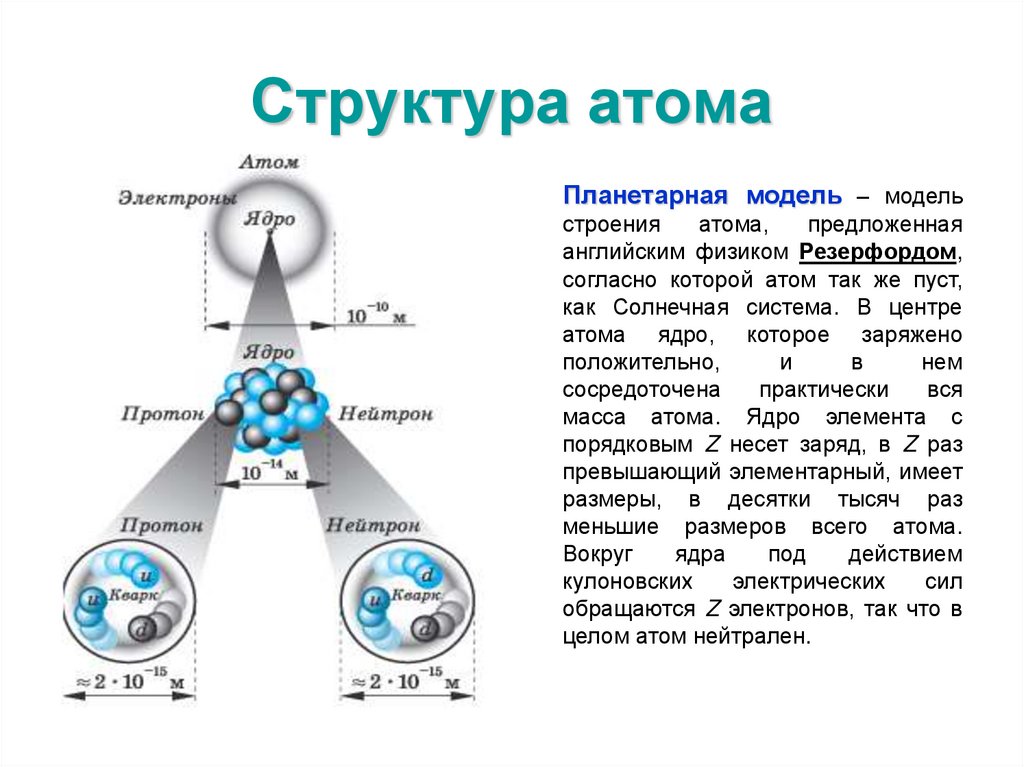
45. Структура атома
Планетарная модель – модельстроения
атома,
предложенная
английским физиком Резерфордом,
согласно которой атом так же пуст,
как Солнечная система. В центре
атома ядро, которое заряжено
положительно,
и
в
нем
сосредоточена
практически
вся
масса атома. Ядро элемента с
порядковым Z несет заряд, в Z раз
превышающий элементарный, имеет
размеры, в десятки тысяч раз
меньшие размеров всего атома.
Вокруг
ядра
под
действием
кулоновских
электрических
сил
обращаются Z электронов, так что в
целом атом нейтрален.
46. Строение атома
Химический элементA – массовое число (масса атома)
Z – зарядовое число (заряд ядра
атома)
A=N+Z
N - количество нейтронов
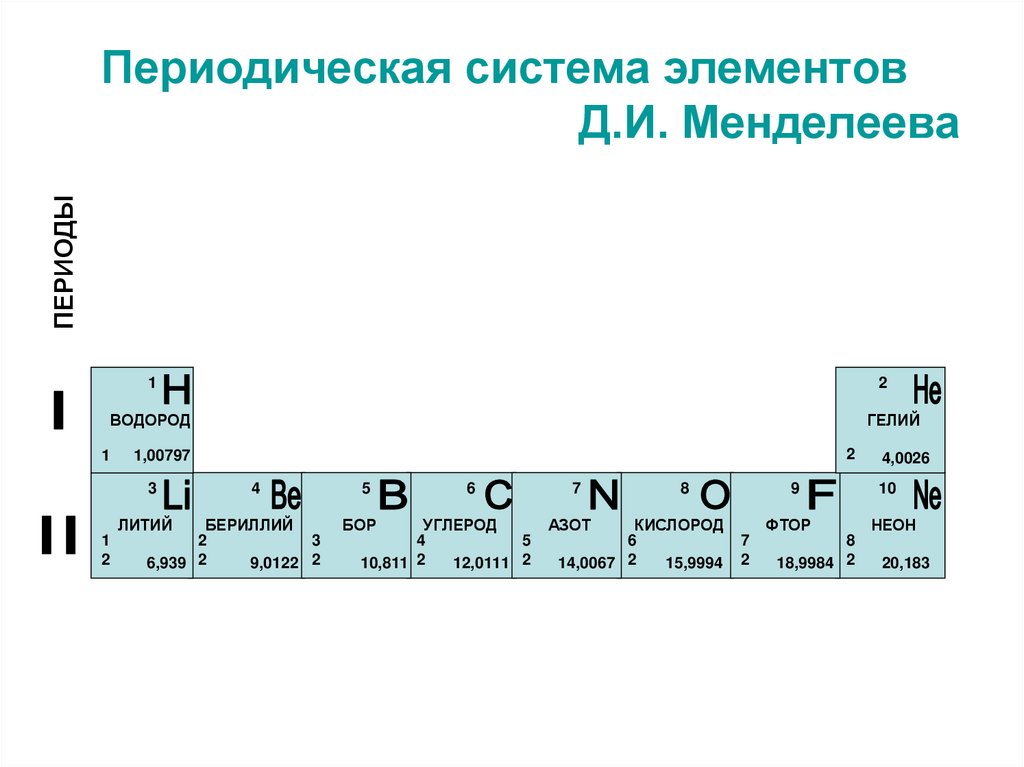
47. Периодическая система элементов Д.И. Менделеева
ПЕРИОДЫПериодическая система элементов
Д.И. Менделеева
1
2
ВОДОРОД
ГЕЛИЙ
1
3
ЛИТИЙ
1
2
2
1,00797
4
БЕРИЛЛИЙ
2
3
6,939 2
9,0122 2
5
БОР
6
УГЛЕРОД
4
5
10,811 2
12,0111 2
7
8
АЗОТ
КИСЛОРОД
6
14,0067 2
15,9994
7
2
4,0026
9
10
ФТОР
НЕОН
8
18,9984 2
20,183
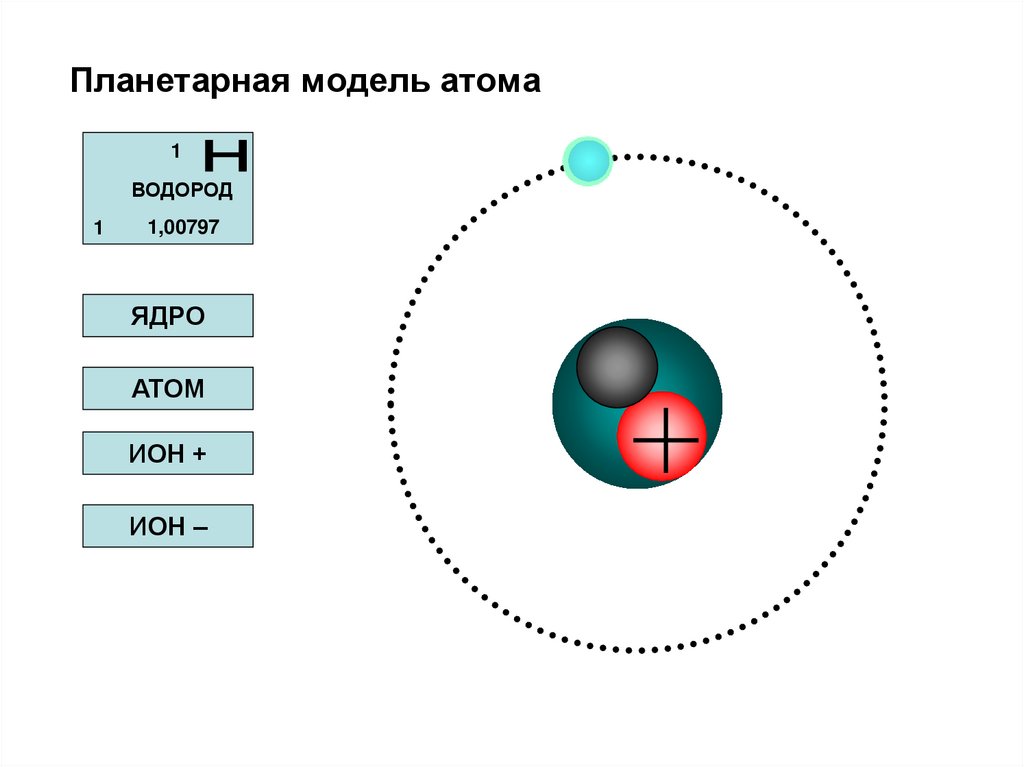
48. Планетарная модель атома
1ВОДОРОД
1
1,00797
ЯДРО
АТОМ
ИОН +
ИОН –
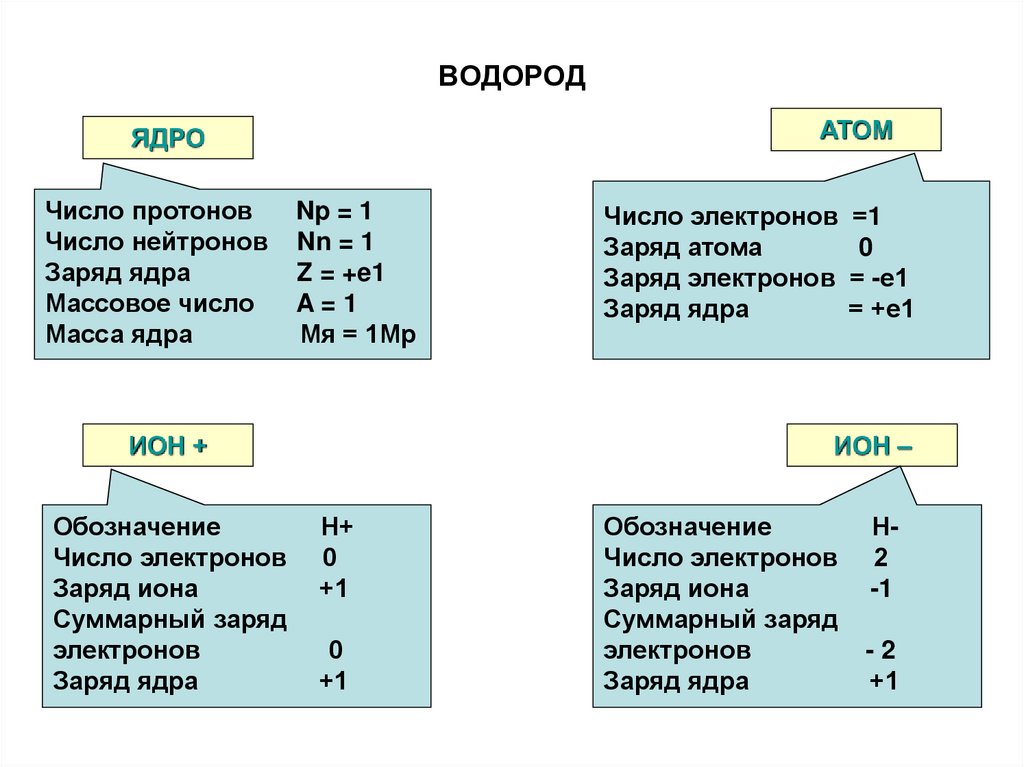
49. ВОДОРОД
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 1
Nn = 1
Z = +e1
A=1
Мя = 1Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов =1
Заряд атома
0
Заряд электронов = -е1
Заряд ядра
= +е1
ИОН –
Н+
0
+1
0
+1
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Н2
-1
-2
+1
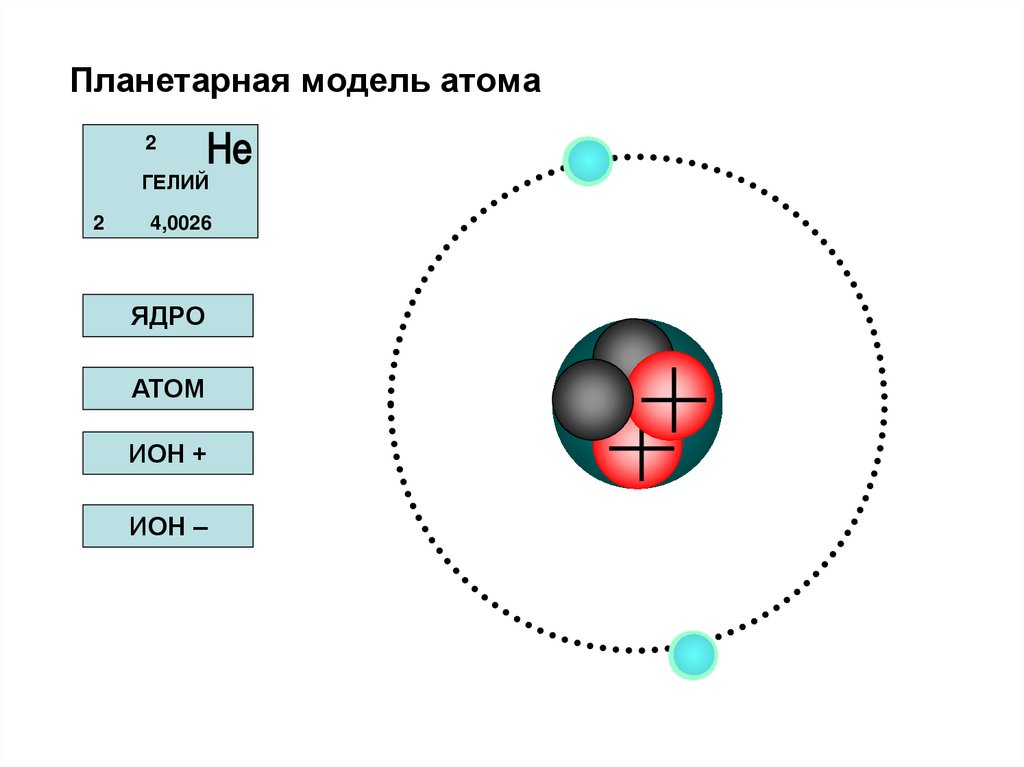
50. Планетарная модель атома
2ГЕЛИЙ
2
4,0026
ЯДРО
АТОМ
ИОН +
ИОН –
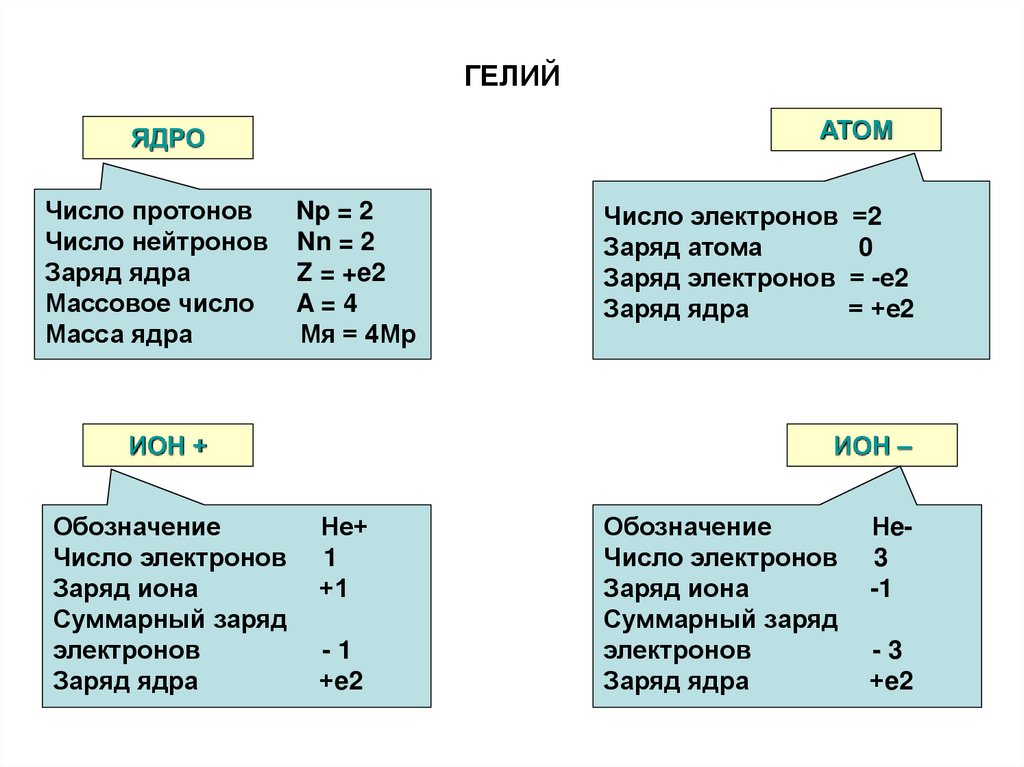
51. ГЕЛИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 2
Nn = 2
Z = +e2
A=4
Мя = 4Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов =2
Заряд атома
0
Заряд электронов = -е2
Заряд ядра
= +е2
ИОН –
Не+
1
+1
-1
+e2
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Нe3
-1
-3
+e2
52. Планетарная модель атома
31
2
ЛИТИЙ
6,939
ЯДРО
АТОМ
ИОН +
ИОН –
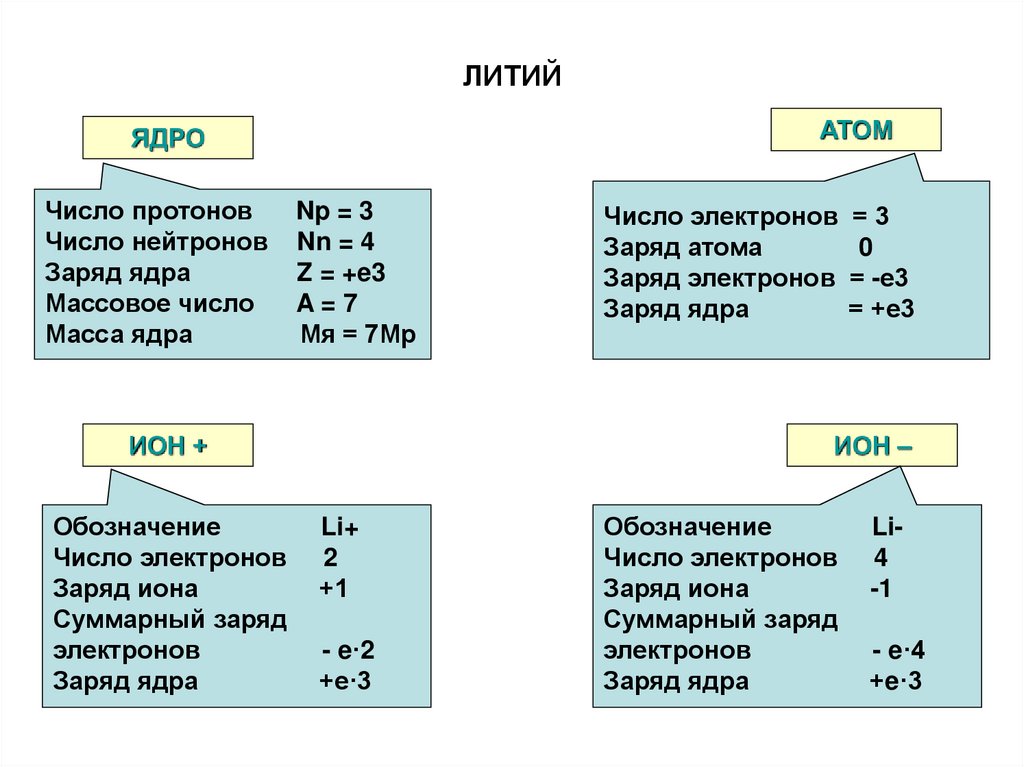
53. ЛИТИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 3
Nn = 4
Z = +e3
A=7
Мя = 7Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов = 3
Заряд атома
0
Заряд электронов = -е3
Заряд ядра
= +е3
ИОН –
Li+
2
+1
- e·2
+e·3
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Li4
-1
- e·4
+e·3
54. Планетарная модель атома
4БЕРИЛЛИЙ
2
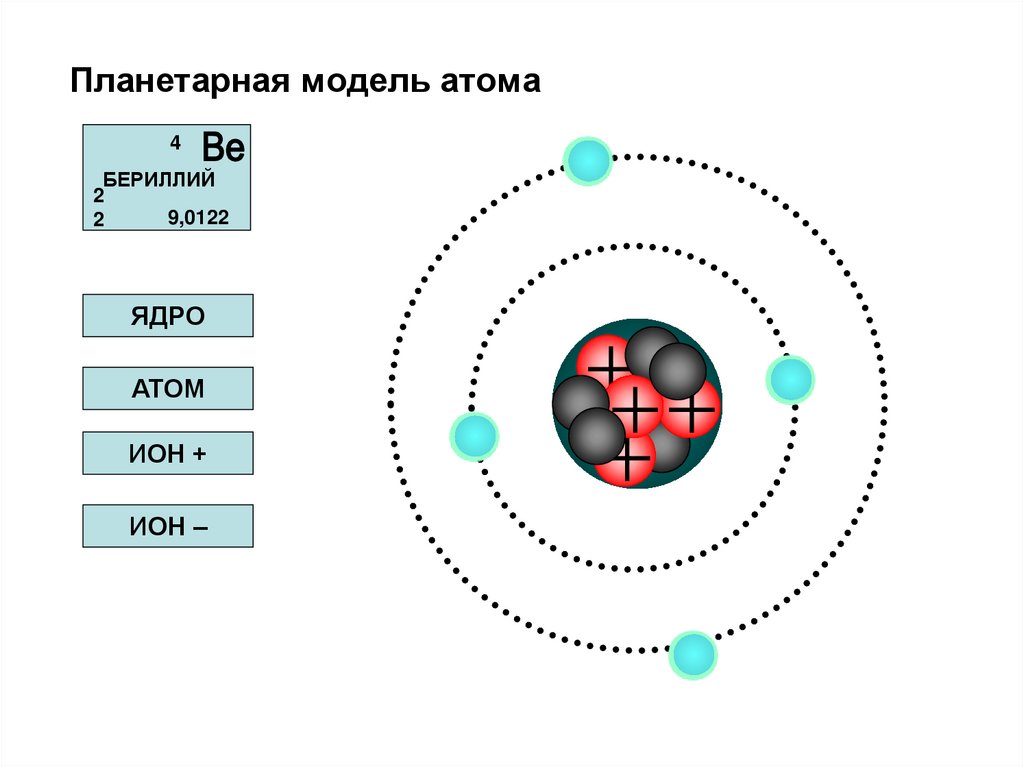
9,0122
2
ЯДРО
АТОМ
ИОН +
ИОН –
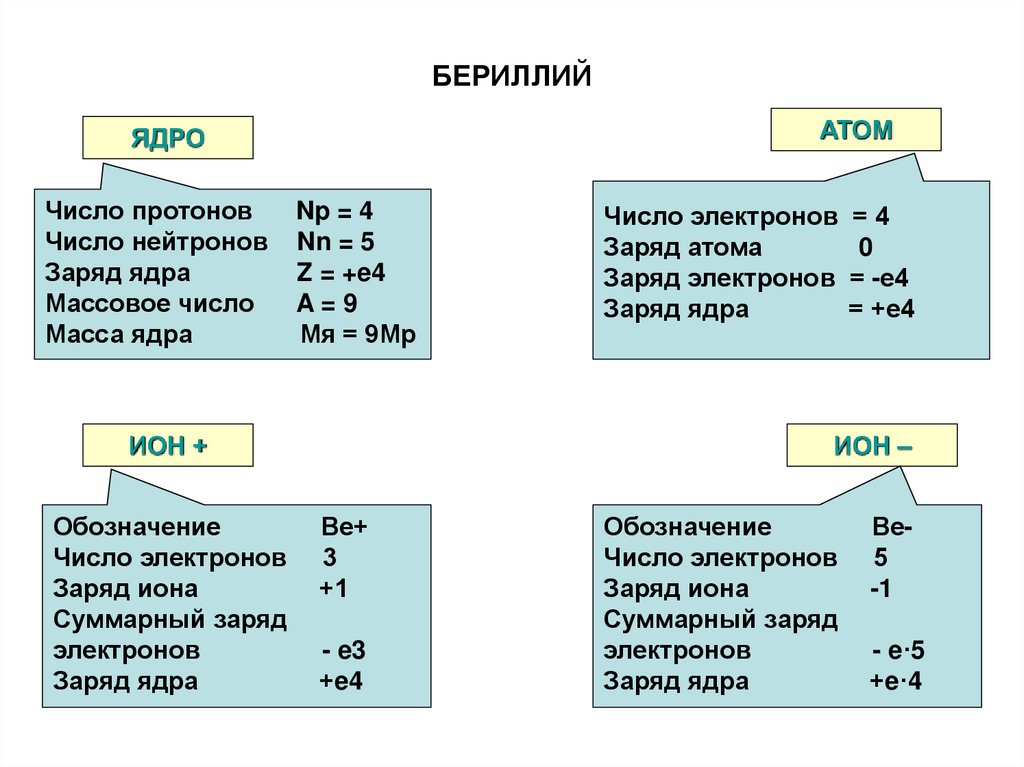
55. БЕРИЛЛИЙ
АТОМЯДРО
Число протонов
Число нейтронов
Заряд ядра
Массовое число
Масса ядра
Np = 4
Nn = 5
Z = +e4
A=9
Мя = 9Мр
ИОН +
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Число электронов = 4
Заряд атома
0
Заряд электронов = -е4
Заряд ядра
= +е4
ИОН –
Ве+
3
+1
- e3
+e4
Обозначение
Число электронов
Заряд иона
Суммарный заряд
электронов
Заряд ядра
Ве5
-1
- e·5
+e·4
56.
57.
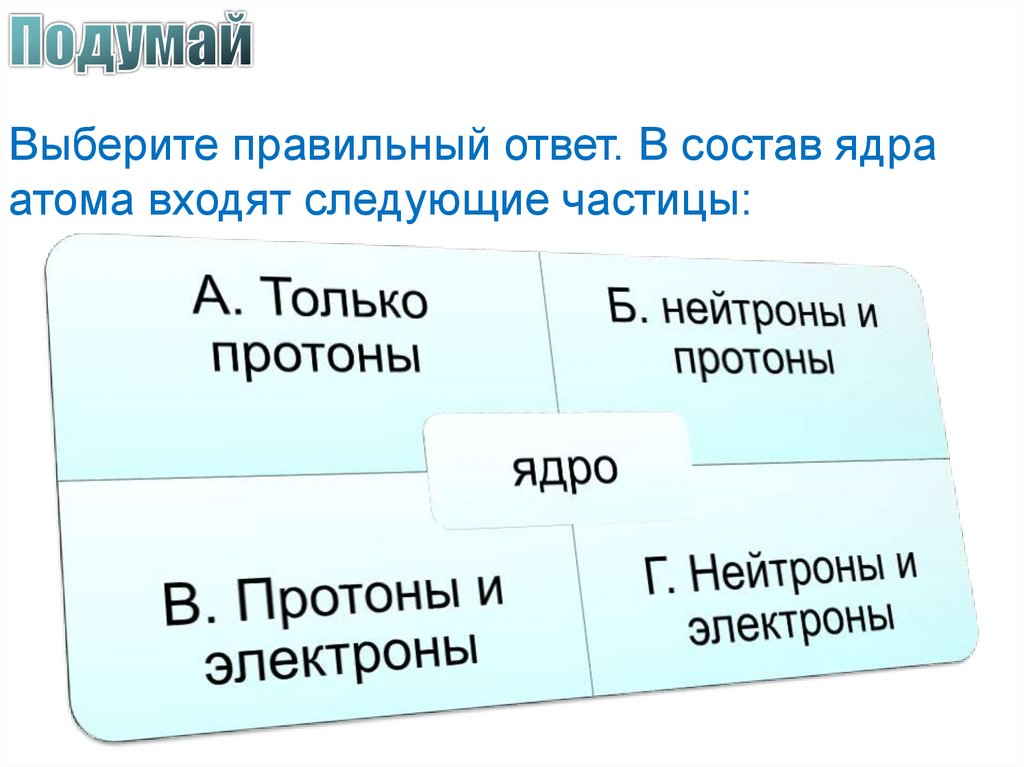
Выберите правильный ответ. В состав ядраатома входят следующие частицы:
58.
Числопротонов
Число
электронов
Число
нуклонов
A–Z=N
Число
нейтронов
Нуклонов – 9
Протонов – 4
Нейтронов – 5
Электронов - 4
59.
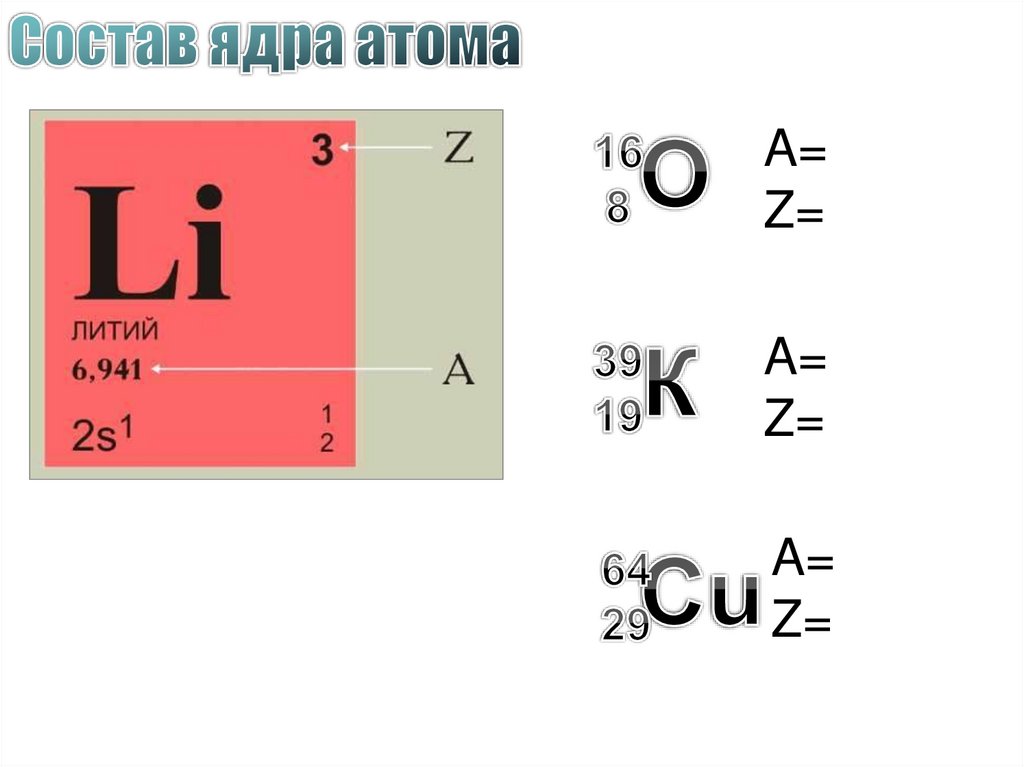
A=Z=
A=
Z=
A=
Z=
60.
Сколько нуклонов, протонов, нейтронов,электронов ?
Что объединяет эти атомы?
61.
62. Домашнее задание
§57 (старый учебник), Упражнение 50 (1-4)§56 (новый учебник), Упражнение 46 (1-4)
Задания из презентации



























 physics
physics








