Similar presentations:
Бензол
1.
БЕНЗОЛ2.
С6Н6 открыт м. Фарадеем в светильномгазе в 1825 году. Жидкость, бесцветная, с
характерным запахом, не растворим в воде,
хороший растворитель, ядовит.
Противоречие: Бензол – сильно
ненасыщенный углеводород, но
устойчив к действию окислителей,
не обесцвечивает р-р КМnO4 и Вr2воду.
Выход: строение бензола
3.
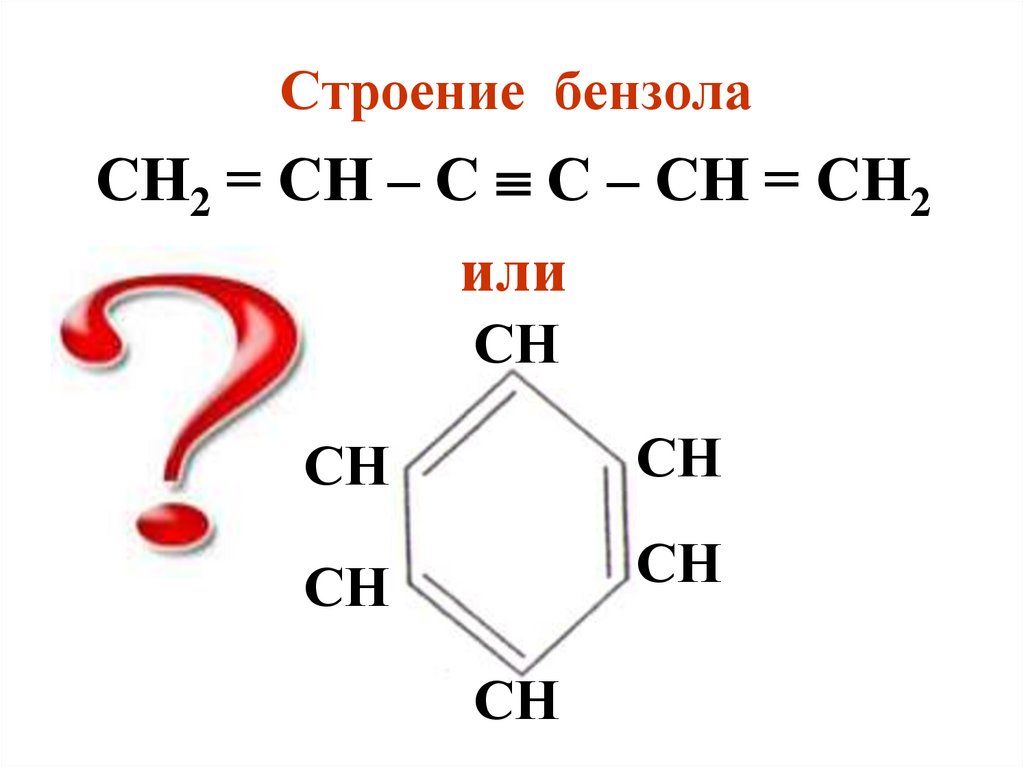
Строение бензолаСН2 = СН – С С – СН = СН2
или
СН
СН
СН
СН
СН
СН
4.
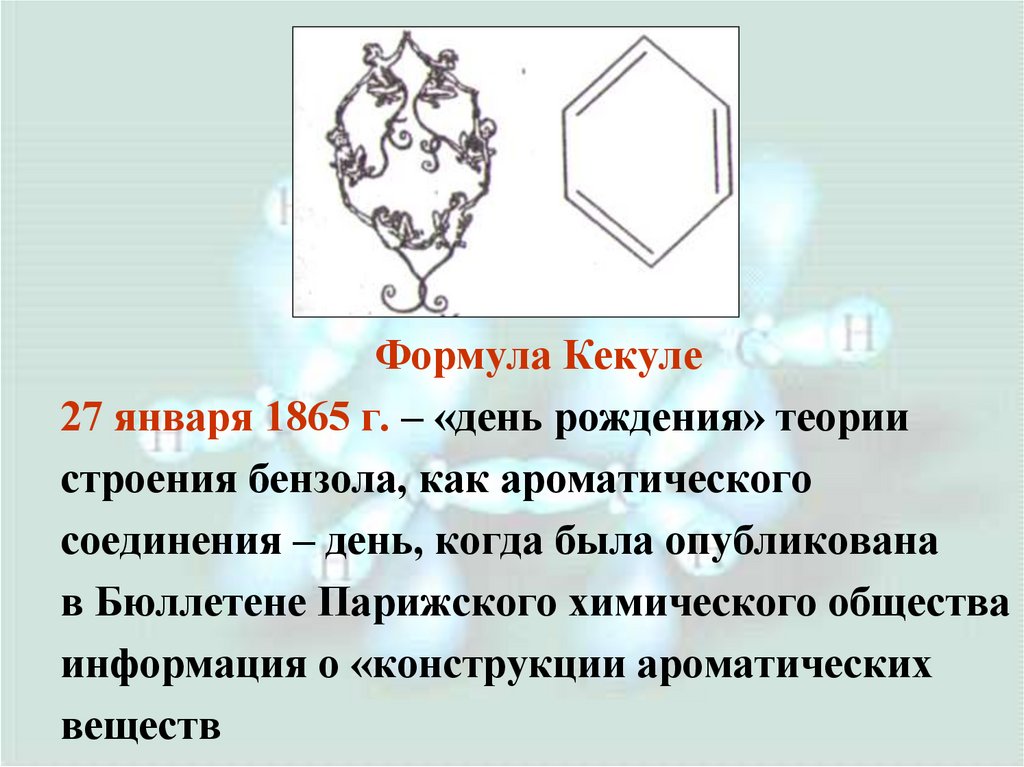
Формула Кекуле27 января 1865 г. – «день рождения» теории
строения бензола, как ароматического
соединения – день, когда была опубликована
в Бюллетене Парижского химического общества
информация о «конструкции ароматических
веществ
5.
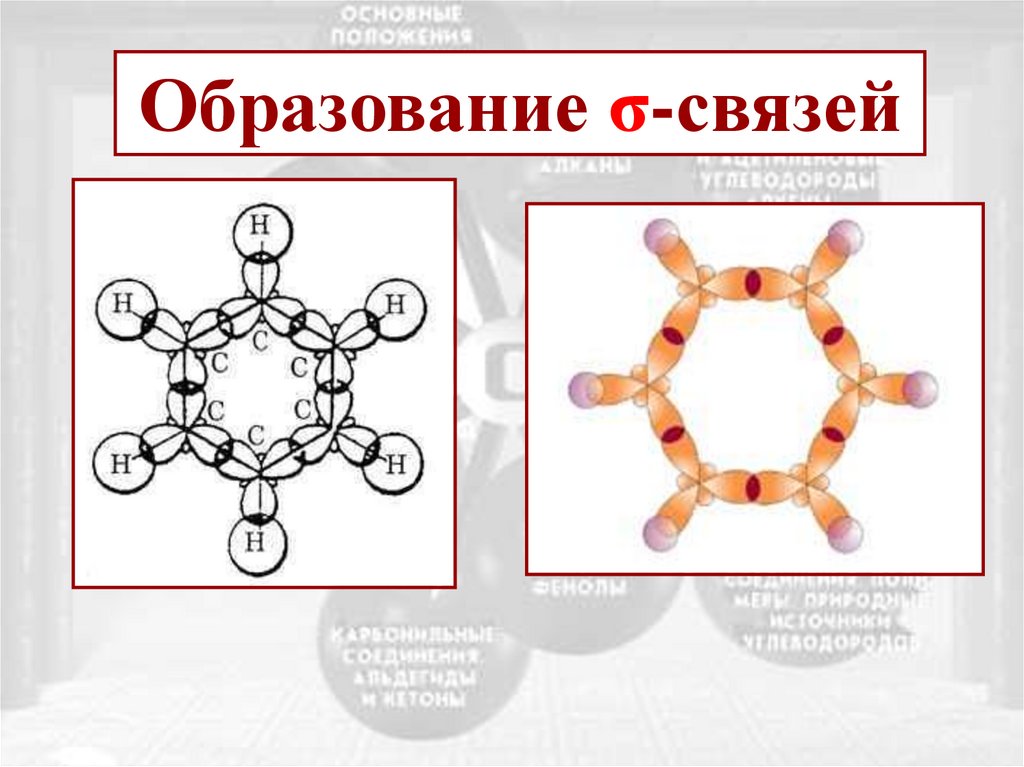
Образование -связейС
s-
С
p-
sp2 1200
6.
Образование σ-связей7.
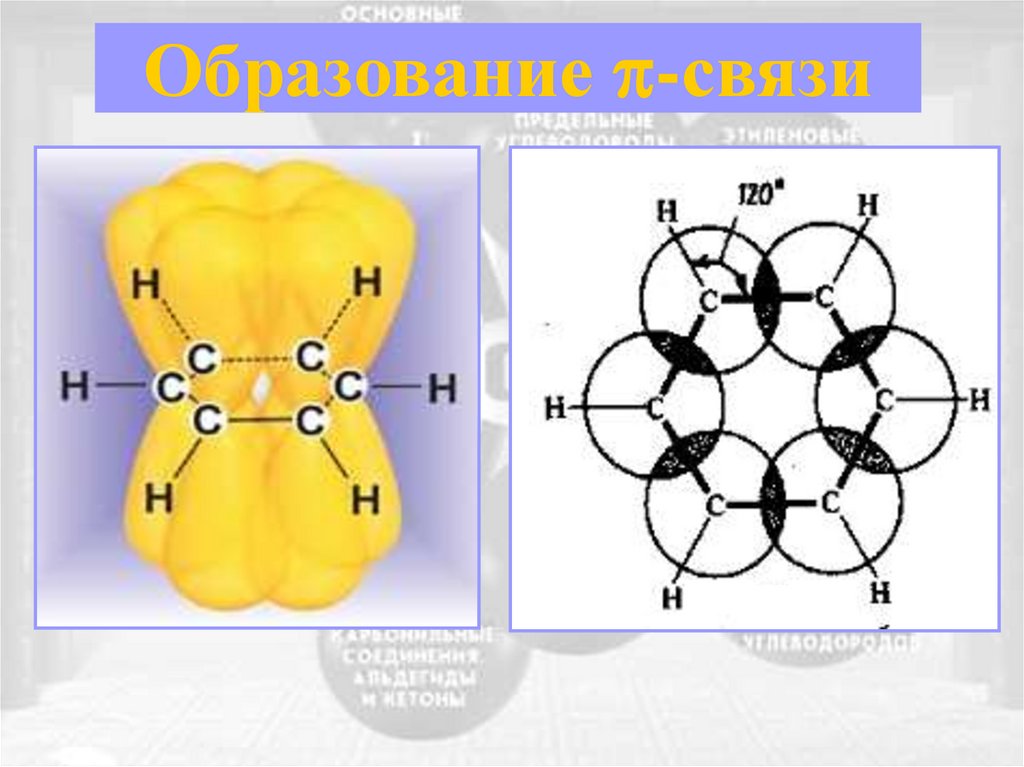
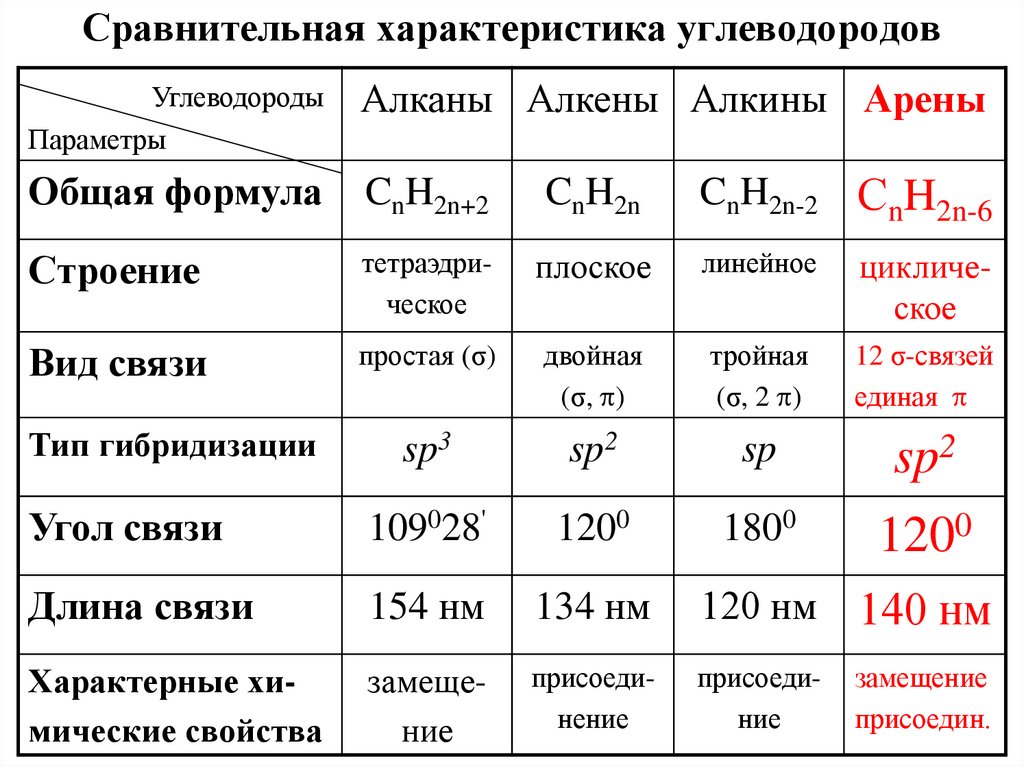
Образование -связи8. Сравнительная характеристика углеводородов
УглеводородыПараметры
Алканы Алкены Алкины Арены
Общая формула
CnH2n+2
CnH2n
CnH2n-2 СnH2n-6
Строение
тетраэдрическое
плоское
линейное
циклическое
Вид связи
простая (σ)
двойная
(σ, )
тройная
(σ, 2 )
12 σ-связей
единая
sp3
sp2
sp
sp2
Угол связи
109028'
1200
1800
1200
Длина связи
154 нм
134 нм
120 нм
140 нм
Характерные химические свойства
замещение
присоединение
присоединие
замещение
присоедин.
Тип гибридизации
9.
Химические свойстваСходство с предельными углеводородами
I. Устойчивость к действию окислителей
При обычных условиях не обесцвечивает
р-р KMnO4 и Br2 вода.
II. Реакции замещения
1.Реакция галогенирования
FeBr
С6Н6 + Br2 С6Н5Br + HBr
3
бромбензол
2. Реакция нитрования
H SO
С6Н6 + НО-NO2 С6Н5NO2 + H2O
2
4
нитробензол
10.
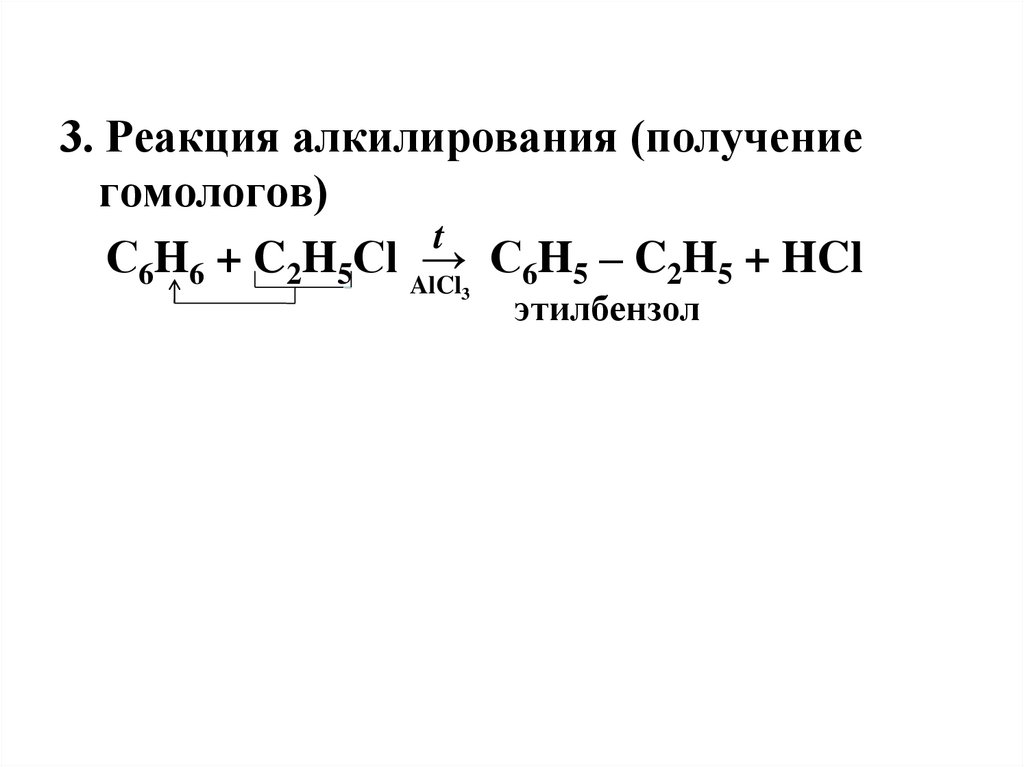
3. Реакция алкилирования (получениегомологов)
t
С6H6 + C2H5Cl AlCl
→ C6H5 – C2H5 + HCl
3
этилбензол
11.
Сходство с непредельными углеводородамиIII. Реакции присоединения (идут с большим
трудом из-за разрушения устойчивой
ароматической системы)
1. Реакция гидрирования
СН2
СН
СН
СН
СН
СН
СН
СН2
СН2
Ni СН2
СН2
t
+ 3H2
СН2
циклогексан
12.
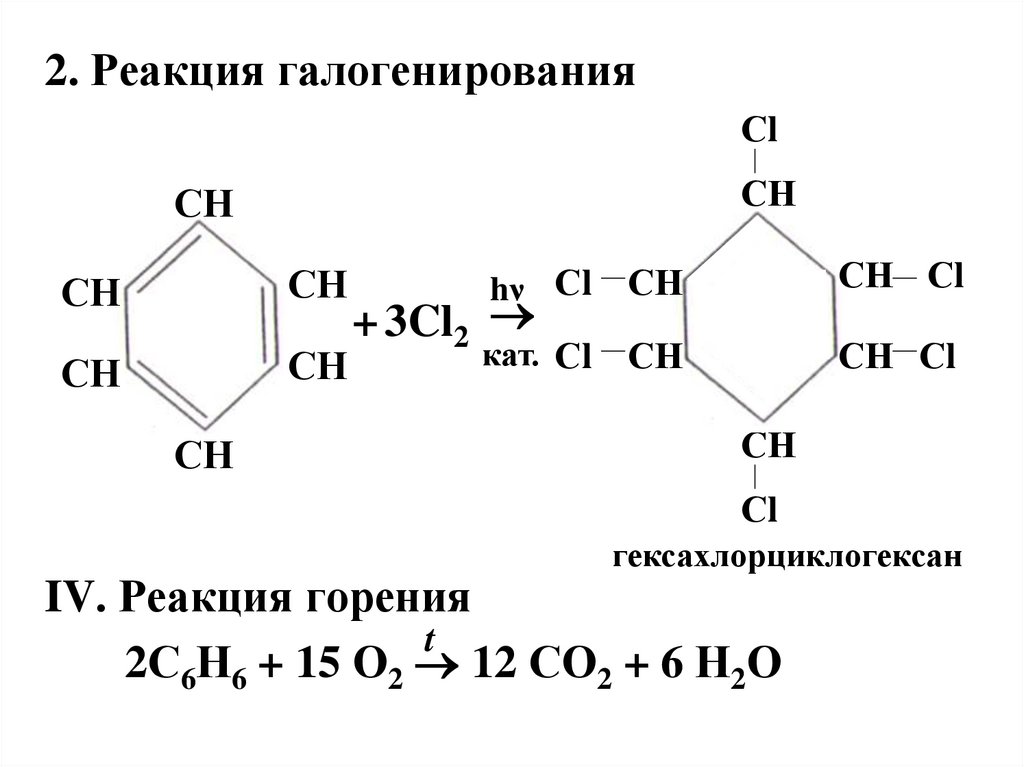
2. Реакция галогенированияСl
СН
СН
СН
СН
СН
СН
СН
hν Сl
СН
СН Сl
кат. Сl
СН
СН Сl
+ 3Cl2
СН
Сl
гексахлорциклогексан
IV. Реакция горения
t
2С6Н6 + 15 О2 12 СО2 + 6 Н2О
13.
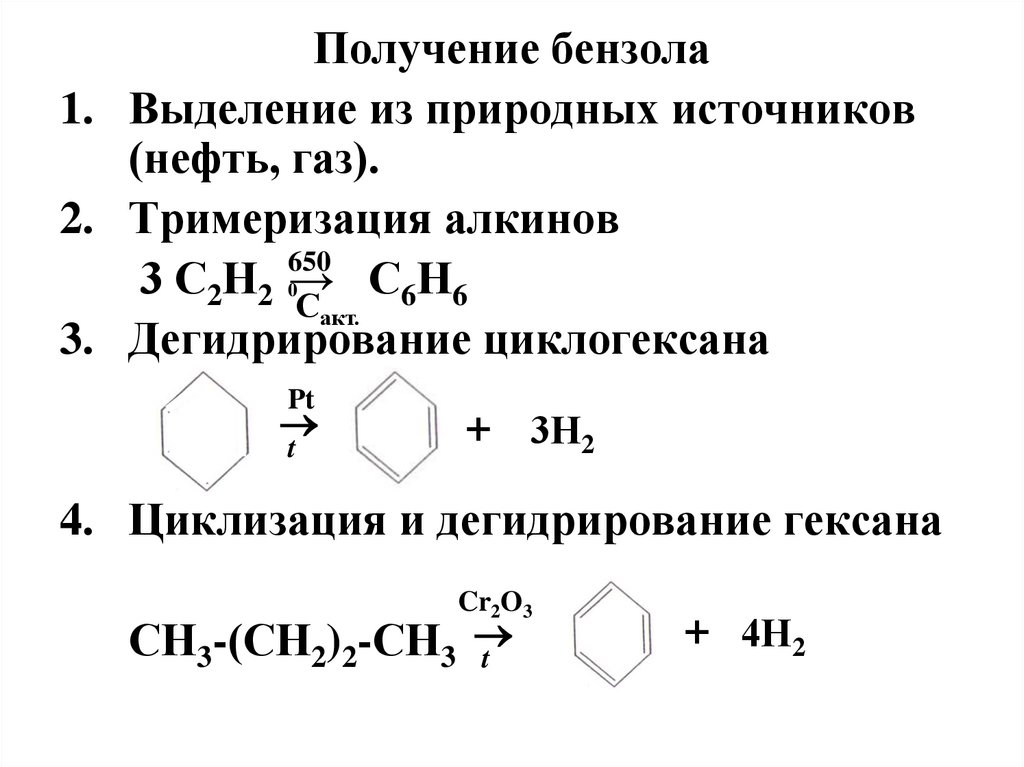
Получение бензола1. Выделение из природных источников
(нефть, газ).
2. Тримеризация алкинов
650
3 С2Н2 0→ С6Н6
Сакт.
3. Дегидрирование циклогексана
Pt
t
+ 3Н2
4. Циклизация и дегидрирование гексана
Cr2O3
СН3-(СН2)2-СН3
t
+ 4Н2
14.
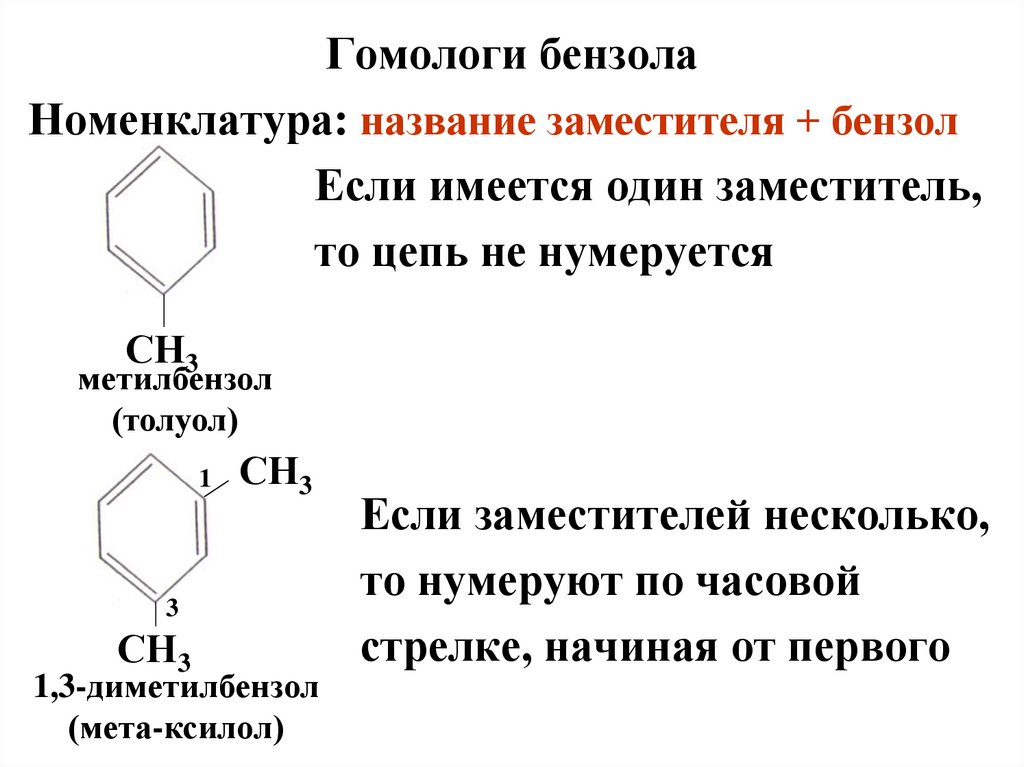
Гомологи бензолаНоменклатура: название заместителя + бензол
Если имеется один заместитель,
то цепь не нумеруется
СН3
метилбензол
(толуол)
1
СН3
3
СН3
1,3-диметилбензол
(мета-ксилол)
Если заместителей несколько,
то нумеруют по часовой
стрелке, начиная от первого
15.
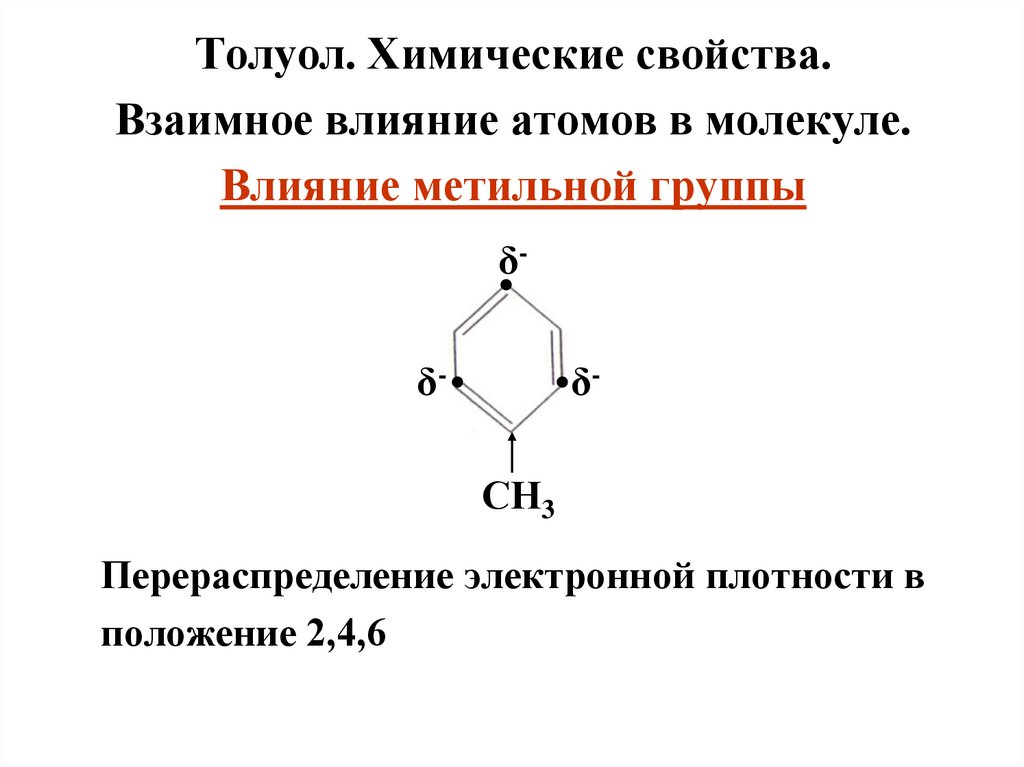
Толуол. Химические свойства.Взаимное влияние атомов в молекуле.
Влияние метильной группы
δ
δ-
● δ-
СН3
Перераспределение электронной плотности в
положение 2,4,6
16.
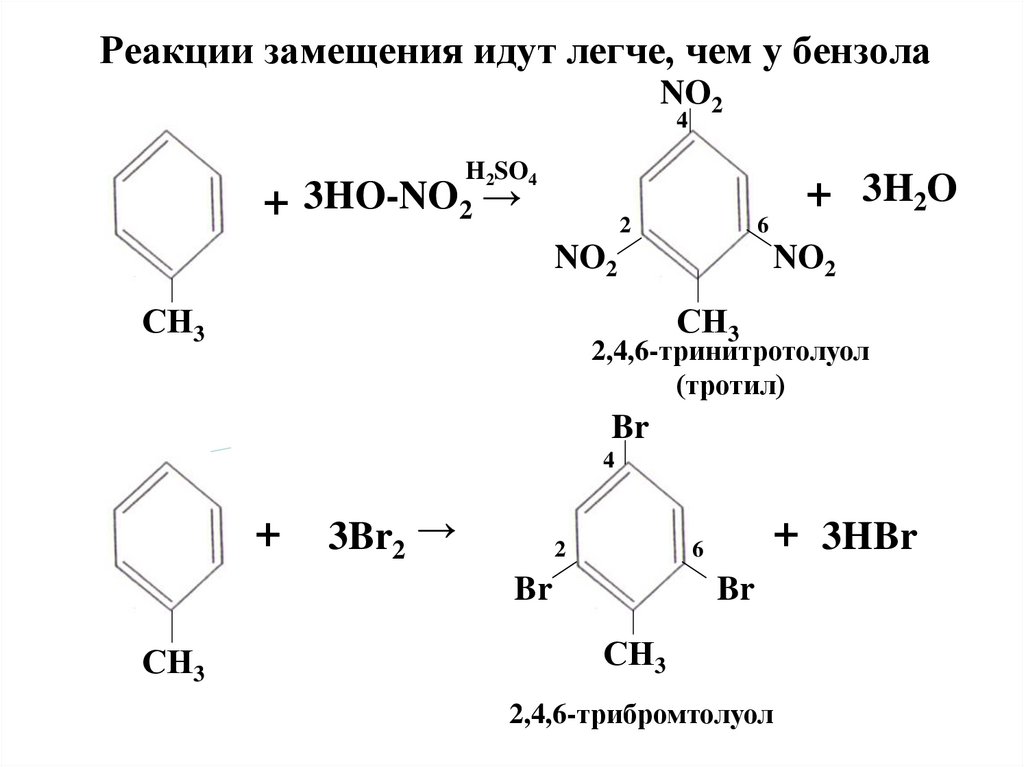
Реакции замещения идут легче, чем у бензолаNO2
4
H2SO4
+ 3HO-NO2 →
+ 3H2O
2
6
NO2
СН3
NO2
СН3
2,4,6-тринитротолуол
(тротил)
Br
4
+
3Br2 →
2
Br
СН3
+ 3HBr
6
Br
СН3
2,4,6-трибромтолуол
17.
Влияние бензольного кольцаДействие подкисленного раствора KMnO4 при
нагревании – обесцвечивание, группа СН3 –
подвергается окислению.
Н
ОН
С Н + 3[О] →
Н
С
→
ОН
О
С
бензойная кислота
ОН
+ Н2 О
ОН
→






 chemistry
chemistry








