Similar presentations:
Общая химия (лекция 7)
1.
ОБЩАЯ ХИМИЯ(лекция 7)
2.
д.х.н.,профессор
кафедры
общей химии
Конюхов
Валерий
Юрьевич
VK
id2476227
3.
Химическое равновесие(продолжение)
4. План лекций
1 неделя (13.02)Введение, строение атома
2 неделя (20.02)
Строение атома. Периодическая Система Элементов
3 неделя (27.02)
Химическая связь
4 неделя (6.03)
Химическая связь (продолжение).
Химическая термодинамика
5 неделя (13.03)
Химическая термодинамика (продолжение)
6 неделя (20.03)
Химическое равновесие. Равновесие в растворах
7 неделя (27.03)
Химическое равновесие в растворах (продолжение)
8 неделя (3.04)
Комплексные соединения
9 неделя (10.04)
Химическая кинетика
10 неделя (17.04)
Растворы
11 неделя (24.04)
Коллигативные свойства растворов
12 неделя (8.05)
Дисперсные системы
13 неделя (15.05)
Электрохимия. Системы. ХИТ
14 неделя (22.05)
Электролиз
15 неделя (29.05)
Коррозия
16 неделя
Заключительная лекция
5. Из программы курса: Основные закономерности химических процессов
6. Химическое равновесие
Основные закономерности химических процессовОбратимые и необратимые реакции. Химический потенциал и его свойства.
Химический потенциал компонентов идеальных и реальных систем.
Активность и коэффициент активности. Признаки истинного химического
равновесия. Термодинамическое условие химического равновесия. Закон
действующих масс. Термодинамическая и концентрационная константы
равновесия. Расчет химического равновесия: равновесные концентрации,
степень превращения. Принцип Ле Шателье.
Химическое равновесие в растворах. Сильные и слабые электролиты.
Константа и степень диссоциации слабых электролитов. Закон разбавления
В.Оствальда.
Гидролиз. Смещение равновесия диссоциации воды в растворах
электролитов. Гидролиз по катиону и аниону: изменение характера среды.
Константа и степень гидролиза.
Химическое равновесие в гетерогенных системах. Константа и коэффициент
распределения. Закон Бертло-Нернста. Произведение растворимости.
7. Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО КУРСУ ХИМИИ (для подготовки к экзамену и выполнения итогового домашнего задания)
Химическое равновесие. Химический потенциал и его свойства.Активность. Коэффициент активности неэлектролита и
электролита. Закон действующих масс для равновесия.
Термодинамическая и концентрационная константы равновесия.
2. Химическое равновесие в гетерогенных системах. Закон Бертло–
Нернста. Равновесие в растворах малорастворимых соединений.
Произведение растворимости.
3. Сильные и слабые электролиты. Равновесие диссоциации слабых
электролитов: воды, слабых кислот, слабых оснований.
константа и степень диссоциации слабых электролитов. Закон
разбавления В.Оствальда. Смещение равновесия диссоциации
слабых электролитов.
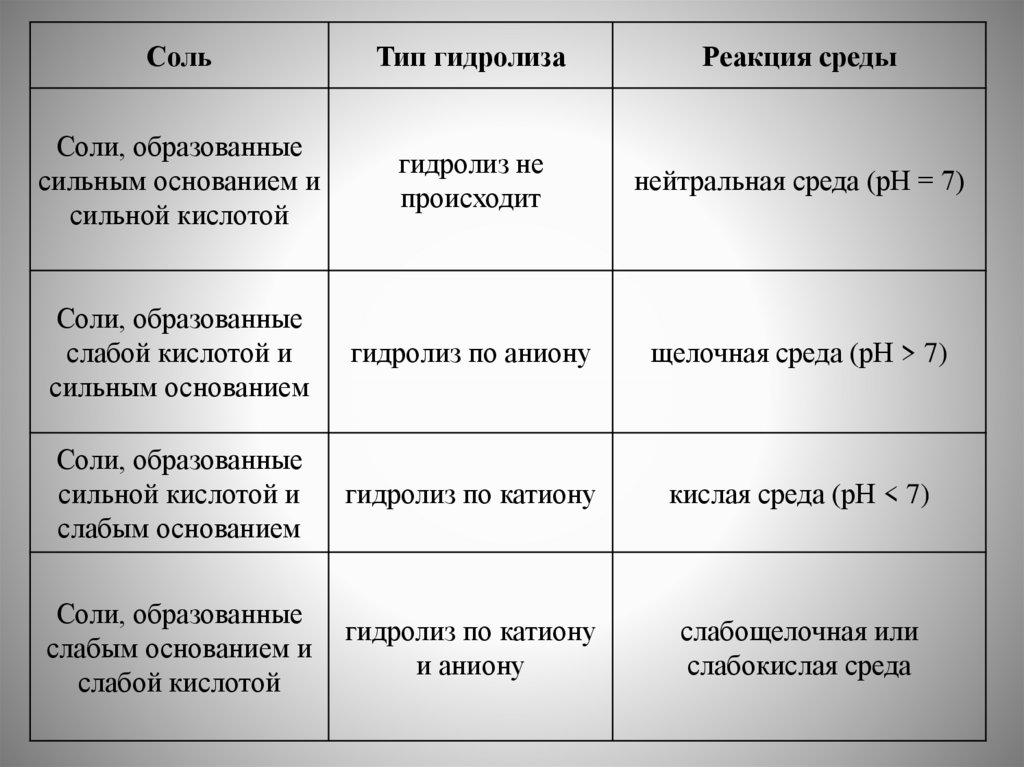
4. Гидролиз. Гидролиз по катиону и аниону (изменение рН среды).
Константа и степень гидролиза. Принцип Ле Шателье.
1.
8. ИТОГОВЫЙ КОНТРОЛЬ ПО ОСНОВАМ ТЕОРИИ ХИМИИ
1.2.
3.
4.
5.
6.
7.
Обратимые
реакции.
Химическое
равновесие.
Закон
действующих масс в химической термодинамике.
Смещение химического равновесия. Принцип Ле Шателье.
Диссоциация слабых электролитов. Константа и степень
электролитической диссоциации. Расчет рН раствора слабой
кислоты или слабого основания.
Произведение растворимости (ПР). Растворимость вещества и
её расчет по ПР.
Гидролиз. Гидролиз по катиону и аниону (изменение рН
среды). Константа и степень гидролиза.
Химический потенциал, активность, коэффициент активности.
Дайте определение химического потенциала и поясните его
физический смысл.
9. Список литературы
1. Н.В. Коровин. Общая химия. М.: Высшая школа.2014.
2. Н.С.Ахметов. Общая и неорганическая химия –
М.:ВШ, 2012.
3. Н.Л. Глинка «Общая химия» М.: Изд. «Химия»,
2002.
4. Жукова Т.В., Глаголева М.А., Липанова Н.В.,
Сергиевский В.В., Сорока И.В. Общая химия
(основные понятия, примеры, задачи). М.: МИФИ,
2008.
5. Сергиевский В.В., Ананьева Е.А., Жукова Т.В.,
Звончевская М.Ф., Кучук Ж.С., Котыхова О.А.
Неорганическая химия: учебное пособие для
внеаудиторной работы. М.: МИФИ, 2007.
10. Литература
Общая химия лабораторные работы(под редакцией Е.А. Ананьевой) М.:
МИФИ, 2010.
Сборник тестов и задач по курсу
химии. НИЯУ МИФИ. М.: 2014.
Общая и неорганическая химия (под
редакцией А.Ф. Воробьева).
Т. 1 и 2. М.: Академкнига. 2004.
11. Химическое равновесие
12.
13. Разберем задачу 5
Вопрос 5.Для равновесных химического процессов:
Mg(OH)2(кр) MgO(кр) + Н2О(г)
СО2(г) + 3Н2(г) СН3ОН(г) + Н2О(г)
а) напишите уравнения закона действующих масс (Ка, а также
КС или Кp);
б) укажите, изменение каких факторов (концентрации
реагентов, давления, температуры) приведет к изменению
значения термодинамической константы равновесия;
в)
укажите направление смещения равновесия при
увеличении давления в системе:
14. Разберем решение задачи 9
Вопрос 9.Для
гомогенной реакции по известным
равновесным
концентрациям
компонентов
рассчитайте: а) неизвестную равновесную
концентрацию
компонента;
б)
константу
равновесия реакции; в) начальные концентрации
исходных веществ, если начальные концентрации
продуктов были равны нулю.
Уравнение реакции
Равновесные концентрации
компонентов, моль/л
4HCl + O2 2Cl 2 + 2H2O
0,2
0,1
0,6
х
15. Равновесия в растворах электролитах
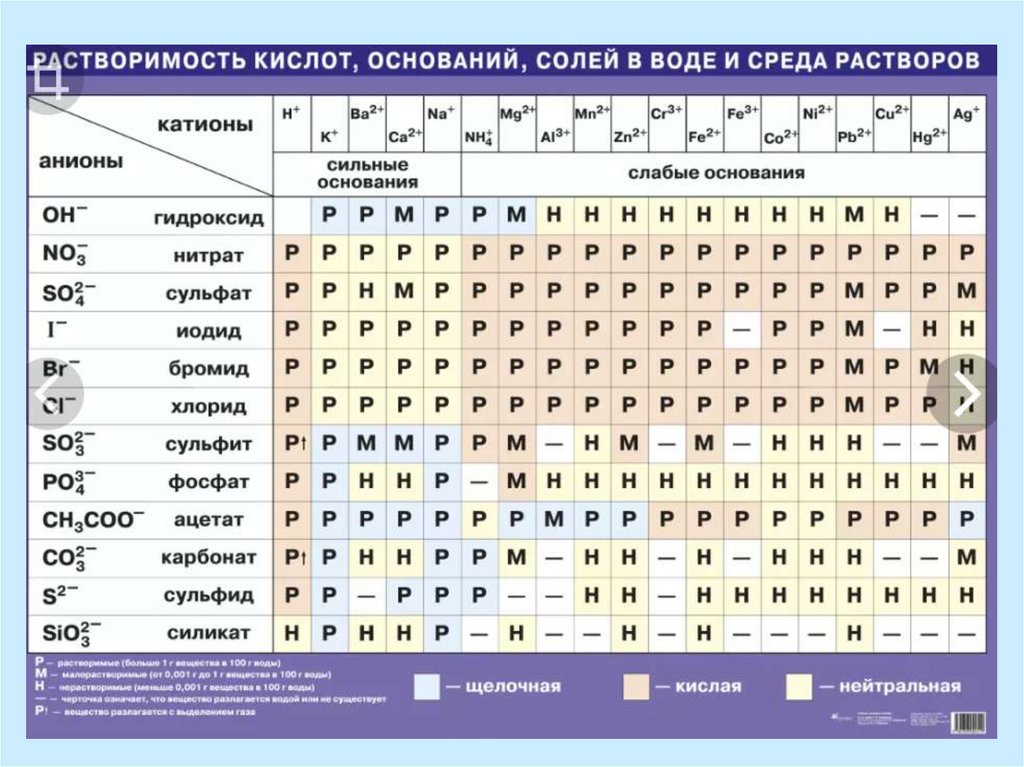
16. Особенности реакций и равновесия в растворах электролитов
Химические свойства раствора электролитаскладываются из свойств образующих его ионов.
Группа электролитов, содержащая один и тот же вид
ионов, обладает сходными химическими свойствами.
Так, все растворы, содержащие хлорид-ионы Сl , при
добавлении к ним раствора нитрата серебра AgNO3
дают белый осадок хлорида серебра AgCl .
Подобные качественные реакции на данный вид
ионов широко используются в аналитической химии
при определении состава растворов.
17.
Основным фактором, влияющим на смещениеравновесия в растворах электролитов, является
изменение концентрации ионов. Поэтому обменные
реакции в растворах идут в сторону малорастворимых
веществ или слабых электролитов.
Это правило легко объяснимо, так как в результате
протекания таких процессов один или несколько
видов ионов выводятся из сферы взаимодействия, что
в соответствии с принципом Ле Шателье должно
привести к более полному протеканию реакции.
Малорастворимые вещества могут выводится из
раствора или в виде осадка, или в виде газа. Слабыми
электролитами могут быть кислоты и основания, вода
и комплексы.
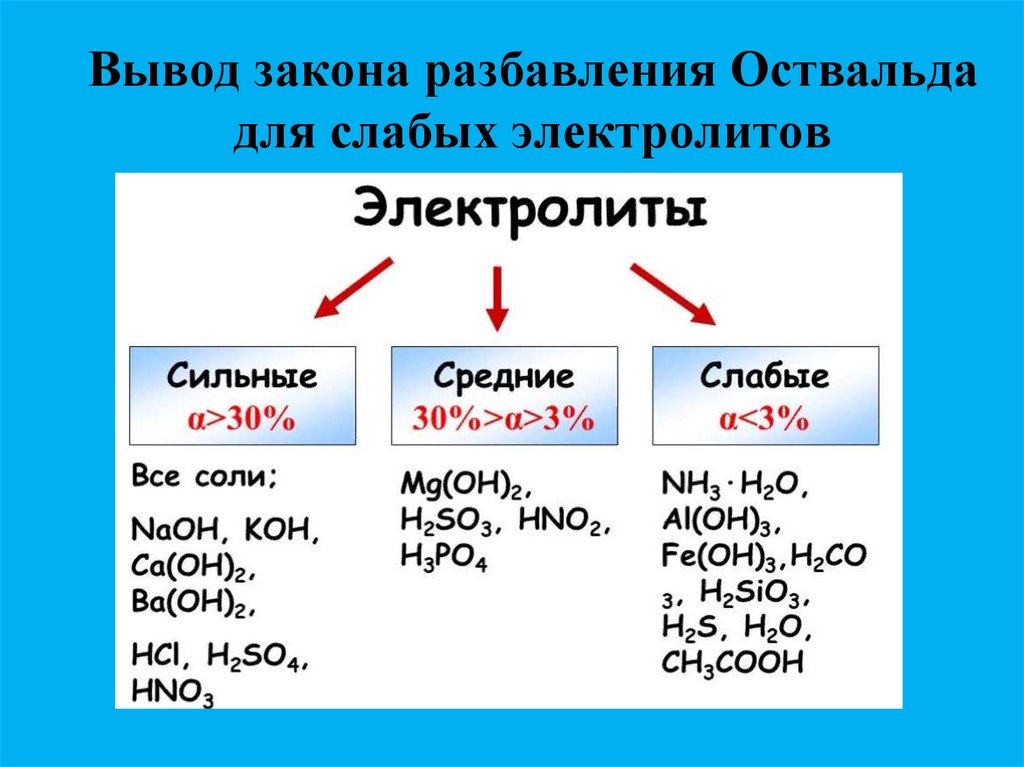
18. Электролиты бывают сильными и слабыми.
Сильные электролиты диссоциируютполностью ( = 1) при любой
концентрации.
Слабые электролиты диссоциируют
лишь незначительно и степень их
диссоциации увеличивается при
разбавлении. При бесконечном
разбавлении, когда С 0 1.
19.
20. Вывод закона разбавления Оствальда для слабых электролитов
21.
Пусть слабый электролит (бинарный) АBдиссоциирует в согласии с уравнением:
АB AZ+ + BZ К процессу электролитической
диссоциации применим закон
действующих масс.
Константа равновесия (константа
электролитической диссоциации),
выраженная через концентрации:
C C
KC
Co
22.
Концентрации ионов и молекул врастворе равны:
С+ = С,
С- = С,
Следовательно:
Со = С(1 )
С С С
КC
;
С (1 ) 1
2
V 1/ C
KC
2
V (1 )
(1)
Здесь V – разбавление раствора, это такой объем
раствора, который содержит 1 моль растворенного
вещества.
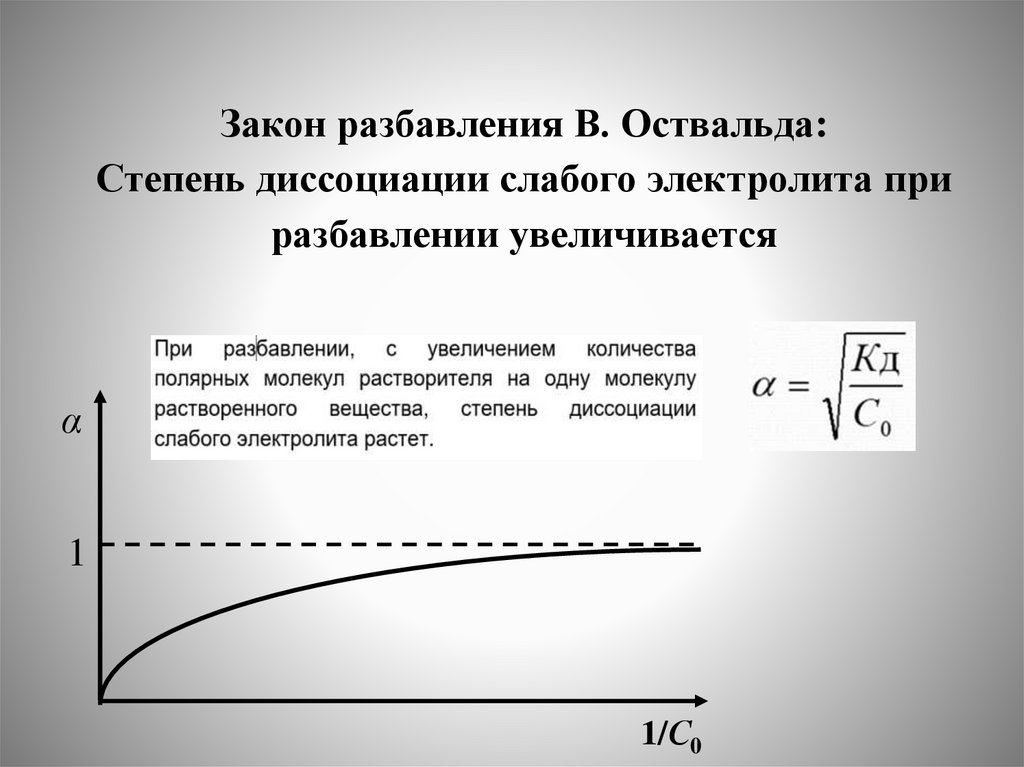
Закон разбавления В. Оствальда
23.
( К 4КC С КC );
2С
При α 1, (тт.е при малых К C
2
C
и достаточно больших С ) :
КC
С
Степень диссоциации уменьшается с ростом
концентрации.
24.
Закон разбавления В. Оствальда:Степень диссоциации слабого электролита при
разбавлении увеличивается
α
1
1/С0
25.
Константа диссоциации КС в отличие отстепени диссоциации не зависит от
концентрации раствора (в определенном
интервале С) и определяется в первую
очередь природой электролита и
растворителя.
26. Константы диссоциации слабых кислот и оснований в водных растворах при 25°С
КислотаКС
pK
(I) 3,71 10-5
4,430
(II) 3.87 10-6
5,412
5,56·10-5
4,255
(I) 1,29·10-2
1,990
(II) 1,26·10-4
3,900
6,3 10-5
4,201
(I) 5,83 10-10
9,234
(II) 1,8 10-13
12,745
(III) 1,6·10-14
13,80
m-Бромбензойная С7Н5О2Вг
1,54 10-4
3,812
о-Бромбензойная С7Н5О2Вг
1,40·10-3
2,854
Адипиновая С6Н10О4
Акриловая С3Н402
Аспарагиновая C4H704N
Бензойная С7Н602
Борная Н2В03
27.
Примеры слабых электролитовСлабые кислоты:
Органические
(СН3СООН)
HF
H2 S
HCN
HnЭOm , m-n
2
Слабые основания:
NH4OH
Амины(C6H5NH3OH)
Me(OH)n , где Ме любой, кроме
щелочных и щелочноземельных
металлов
Для уксусной кислоты
Н
СН
СОО
;
СН 3 СООН
3
C (H ) C (CH 3COO )
5
0
KD
2 10 (25 C)
C (CH 3COOH)
28.
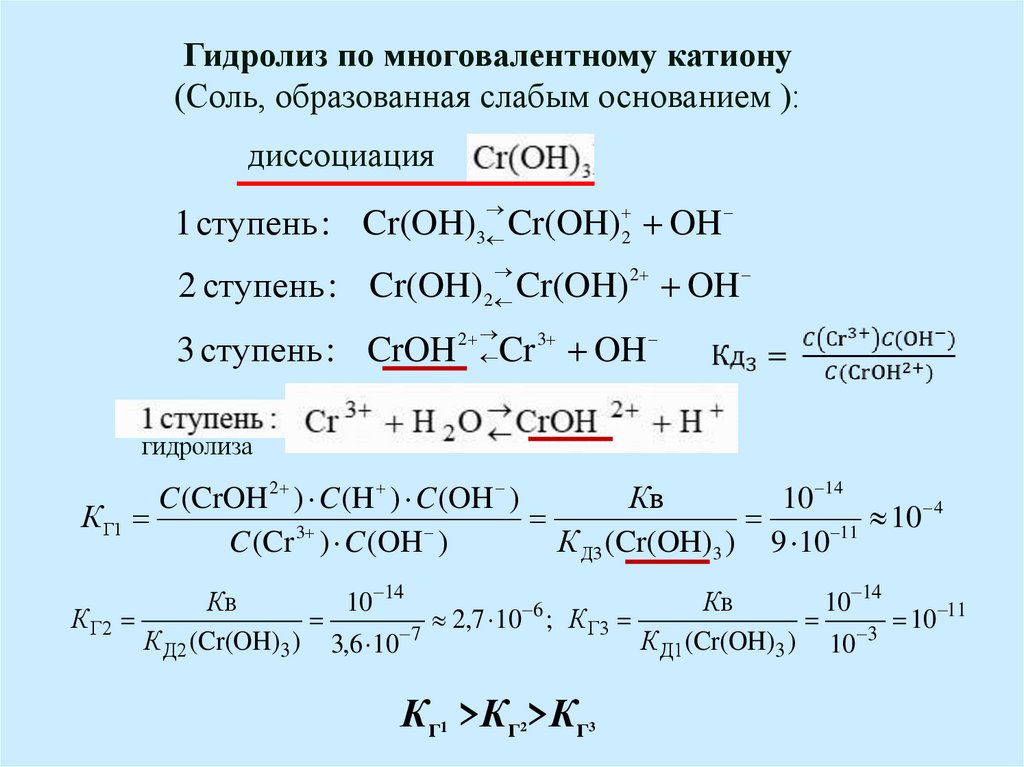
!!!Слабые
многоосновные кислоты и
многовалентные
основания диссоциируют
по ступеням.
Каждая следующая
ступень
слабее предыдущей
Fe(OH)2
1 ст. Fe(OH) 2
FeOH OH
К д1 1,2 10 2
2 ст. FeOH
Fe 2 OH
К д2 5,5 10 8
Kд2 << Kд1
H 2S
1 ступень:
H 2S
H HS
С Н С HS
К д1
1,7 10 7
C H 2S
1
K д1
С0
4 10 4
HS
H S2
2 ступень
СН СS
14
К д2
10
C HS
2
K д2
1С 0
5 10 6
Kд << Kд
2
1
29. Многоступенчатая диссоциация кислоты
H 3 A H 2 A HH 2 A HA2 H
H H A
K
2
H 3 A
I
H HA
K
H A
H A
K
HA
H A
K
K K K
2
2
2
2
3
HA A H
H 3 A A3 3 H
3
3
2
3
D
3
H 3 A
I
Константы ступенчатой диссоциации обычно
различаются на несколько порядков, причем
КI > K2 > K3
2
3
30.
Экспериментальная проверка теорииАррениуса показала, что для слабых
электролитов (уксусная кислота и т.п.),
теория справедлива, например, константа
КС (1) остается постоянной в достаточно
широком интервале концентраций.
Для сильных электролитов (минеральные
кислоты, соли и т.п.) КС изменяется с
концентрацией раствора.
31.
Для сильных электролитов даже в областинебольших концентраций константа
диссоциации сильно изменяется при
изменении концентрации.
Ниже в качестве примера приведены
значения констант диссоциации для
водных растворов КСl и СН3СООН при
298 К.
32. Константы диссоциации для водных растворов КСl и СН3СООН при 298 К
СКС1 (моль/л)КС (моль/л)
0,0001
0,0128
0,0010
0,0456
0,0100
0,1510
0.100
0,5349
CСН3СООН(моль/л)
KС 105(моль/л)
0,001
1,751
0,002
1,740
0,100
1,700
0,200
1,653
На эту слабость своей теории указывал ещё
сам С. Аррениус
33. Воспоминания об активностях
34.
35.
Американский физик Дж. Льюис ввелпонятие активности как некоторой
формальной эффективной концентрации,
подстановка которой в термодинамические
уравнения для идеальных растворов делают
их справедливыми и для реальных
растворов.
В таком виде уравнения согласуются с
экспериментом. Для константы равновесия
диссоциации:
Ка
а H a A
a HA
36.
Экспериментально найденныеактивности (эффективные
концентрации) отличаются от
соответствующих аналитических
концентраций из-за взаимодействия
между ионами в растворах сильных
электролитов.
В растворах слабых электролитов
можно использовать концентрации,
а не активности.
37. Активность связана с концентрацией (с мольной долей) через коэффициент активности:
ai = i xiВ случае моляльной концентрации mi:
ai = i mi
38.
Коэффициент активности компонентаявляется мерой отклонения свойств
раствора от свойств идеального раствора
той же концентрации:
ai
γi
xi
И чем сильнее активность отличается от
концентрации, тем сильнее коэффициент
активности отличается от единицы, тем
более неидеален раствор.
39.
В растворах электролитов, как правило,наблюдаются более значительные
отклонения от идеальности, чем в
растворах неэлектролитов.
Это объясняется наличием
электростатических межионных
взаимодействий, которые существенно
сильнее межмолекулярных (ван-дерваальсовских) взаимодействий.
40.
Существуют разные способы выражениякоэффициентов активности, которые отвечают
разным способам выражения состава растворов
Концентрация
раствора
Единицы
измерения
Обозначения
Молярность
моль в 1 л
раствора
С
молярный
Моляльность
Молярная доля
С
моль в
1 кг
растворителя
m
m
практический
-
x
рациональный
41.
При введении активностей в уравнениедля константы электролитической
диссоциации получаем:
a a γ C γ C
Ka
a0
γ 0 C0
C C γ γ
γ γ
KC
C0
γ0
γ0
42.
Первый множительКС = С+·С-/Со
является функцией концентрации при её
изменении в широком интервале.
Величину КС называют кажущейся или
концентрационной константой
диссоциации.
43.
Ка называют термодинамической (истинной)константой диссоциации
Она не зависит от концентрации раствора.
В разбавленных растворах концентрационная
и термодинамическая константы практически
совпадают, так как i 1 и второй множитель
равен единице.
В общем случае Ка ≠ КД, поскольку ≠ 1 для
более или менее концентрированных
растворов.
44.
Константа диссоциации Ка зависит отприроды электролита, природы
растворителя и температуры.
Зависимость константы диссоциации от
температуры выражается уравнением
изобары Вант-Гоффа:
d ln K a D H
2
dT
RT
o
где DHo – тепловой эффект процесса
диссоциации (теплота диссоциации).
45. Средние ионные величины
46.
Нельзя приготовить раствор содержащийтолько катионы или анионы, т.е. нельзя
экспериментально определить
коэффициент активности для каждой из
этих заряженных частиц.
По этой причине вводится понятие о
среднем ионном коэффициенте
активности ионов, который
обозначается как и представляет собой
среднюю геометрическую величину от +
и отдельных ионов.
47.
Средний ионный коэффициент активности:γ γ γ
1/
Аналогично определяют и среднюю ионную
моляльность раствора т :
Активности ионов:
а γ m
а γ m
48. Для вычисления средних ионных коэффициентов активности выведено уравнение первого приближения теории Дебая-Хюккеля, называемое
также предельным законом ДебаяХюккеля для среднего коэффициентаактивности:
lg γ A | z z | I
при m < 0,01
где z+ и z_ заряды катиона и аниона, I ионная
сила раствора. Для отдельных ионов:
lg γ+ = −















































































































 chemistry
chemistry








