Similar presentations:
Строение атома. Состав атомных ядер. Изотопы
1. Строение атома. Состав атомных ядер. Изотопы
2. Основные этапы познания атома
1. Демокрит – ввёл понятие «атом –неделимый»2. Стони (ирландский физик) – доказал, что
электричество переносится электронами(ē). Они
входят в состав атома.
3. Томсон и Перрен – доказали, что катодные лучи
это ē и они имеют отрицательный заряд
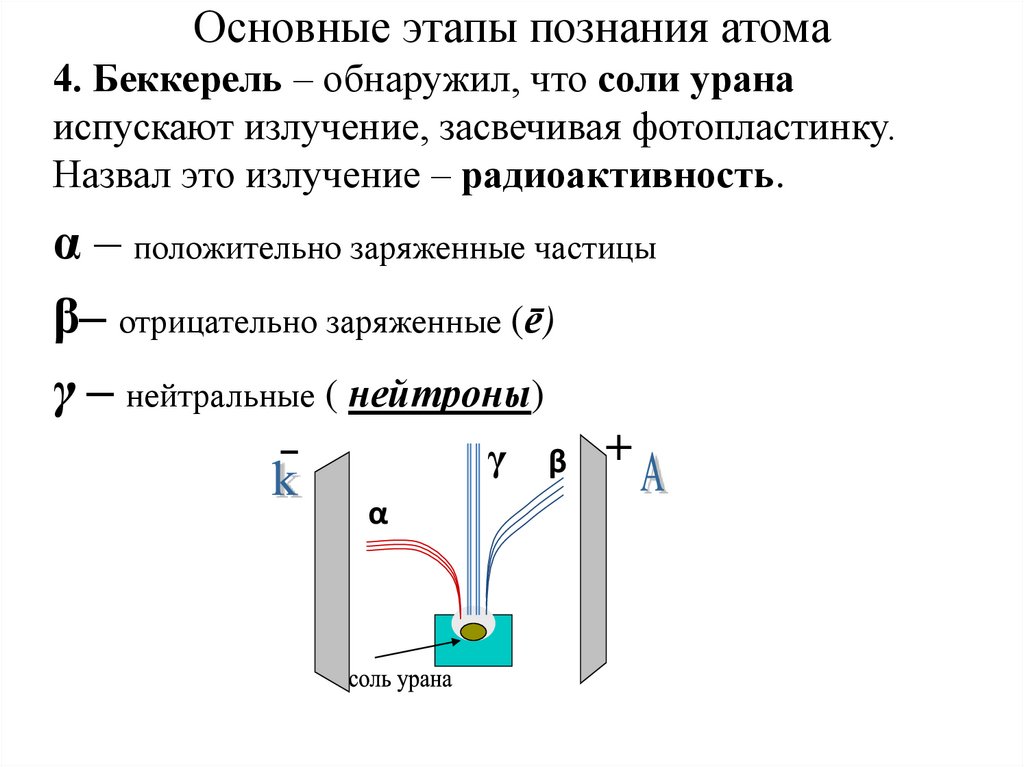
3. Основные этапы познания атома
4. Беккерель – обнаружил, что соли уранаиспускают излучение, засвечивая фотопластинку.
Назвал это излучение – радиоактивность.
α – положительно заряженные частицы
β– отрицательно заряженные (ē)
γ – нейтральные ( нейтроны)
γ
α
β
4. Модель Томсона
Джозеф ДжонТомсон
(18 декабря 185630 августа 1940)
английский физик,
лауреат
Нобелевской премии
по физике
1906 года
Дж. Дж. Томсон в
1898 году предложил
модель атома в виде
положительно
заряженного шара
радиусом 10-10м, в
котором плавают
электроны,
нейтрализующие
положительный
заряд.
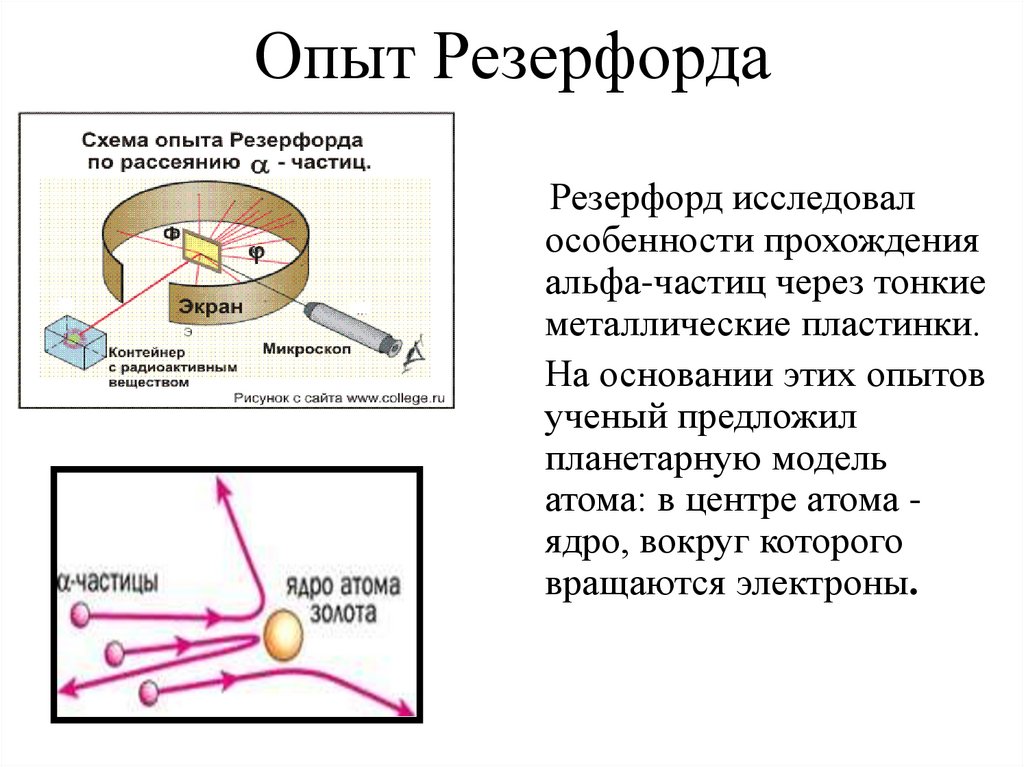
5. Опыт Резерфорда
Резерфорд исследовалособенности прохождения
альфа-частиц через тонкие
металлические пластинки.
На основании этих опытов
ученый предложил
планетарную модель
атома: в центре атома ядро, вокруг которого
вращаются электроны.
6.
Модель Резерфордаядерная (планетарная) модель1. Атом имеет ядро, размеры
Эрнест Резерфорд
(30 августа 1871 г. –
19 октября 1937 г.)
Нобелевская
премия по химии,
1908 год
которого
малы
по
сравнению с размерами
самого атома.
2. В ядре сконцентрирована
почти вся масса атома.
3. Отрицательный
заряд
всех
электронов
распределен
по
всему
объему атома.
7. Модели атомов
Модель атомаТомпсона
-++-+
Модель атома Резерфорда
(планетарная)
-
+
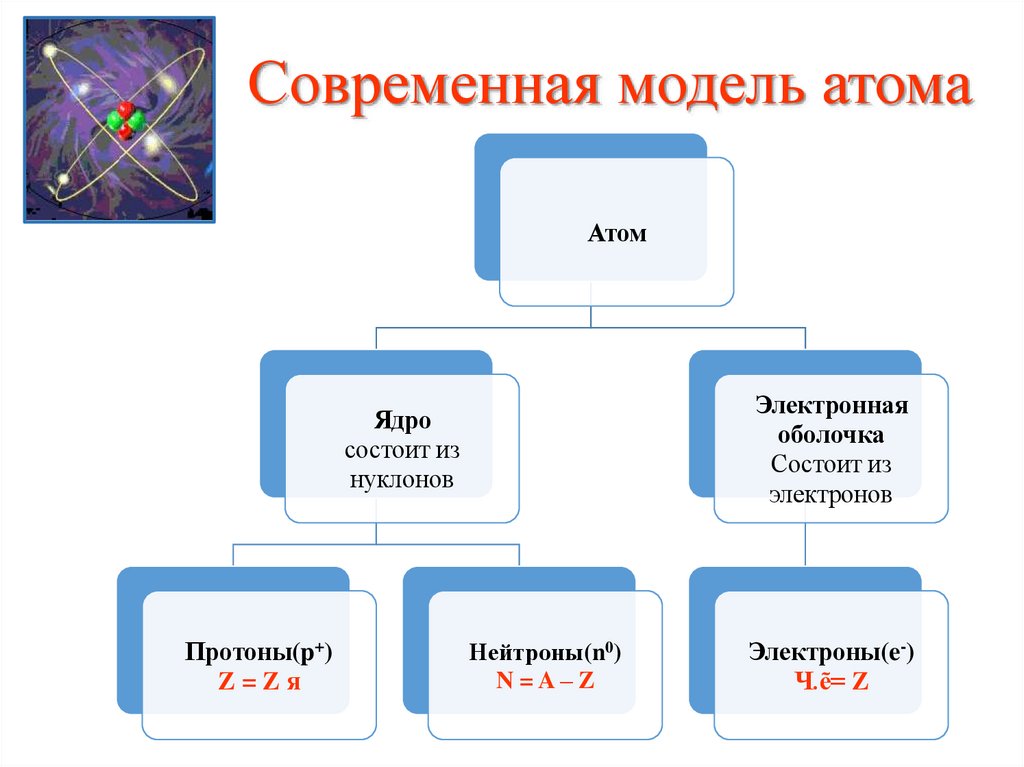
8. Современная модель атома
АтомЭлектронная
оболочка
Состоит из
электронов
Ядро
состоит из
нуклонов
Протоны(p+)
Z=Zя
Нейтроны(n0)
N=A–Z
Электроны(e-)
Ч.ẽ= Z
9.
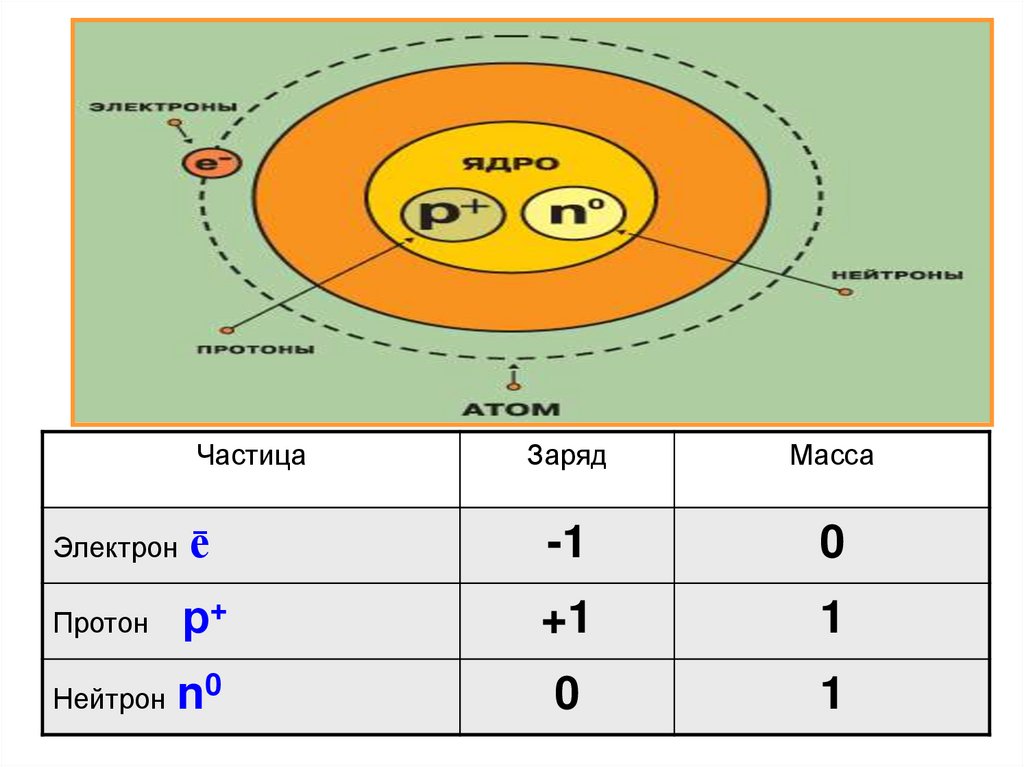
ЧастицаЗаряд
Масса
Электрон ē
-1
0
р+
+1
1
Нейтрон n0
0
1
Протон
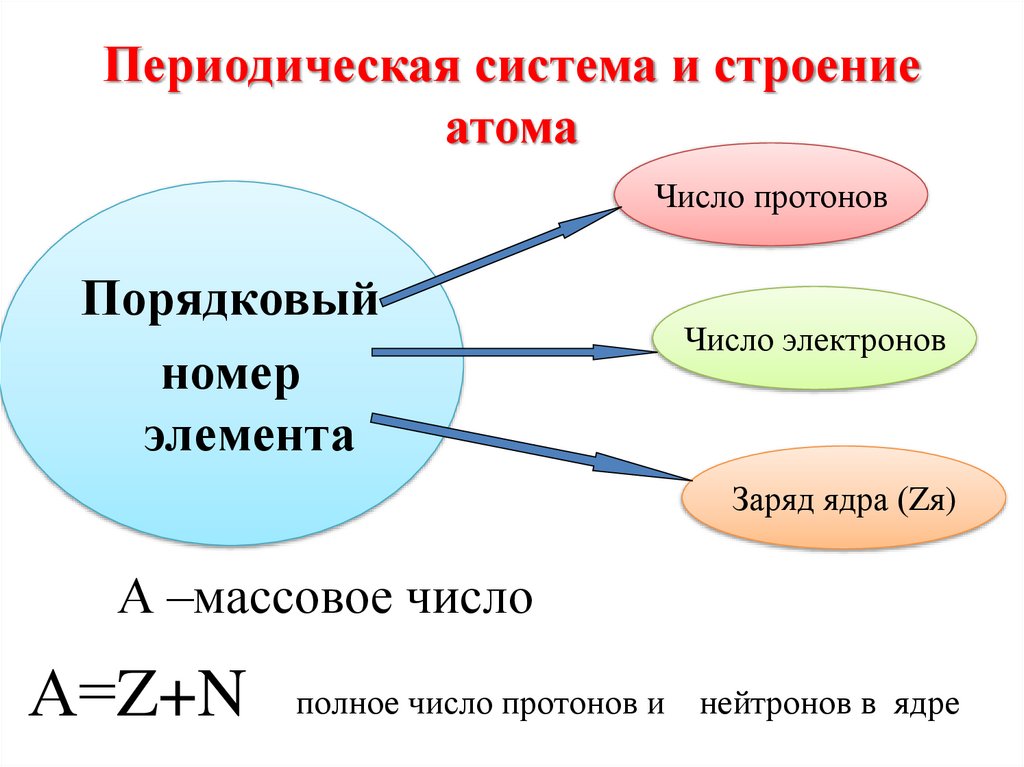
10. Периодическая система и строение атома
Число протоновПорядковый
номер
элемента
Число электронов
Заряд ядра (Zя)
А –массовое число
А=Z+N
полное число протонов и
нейтронов в ядре
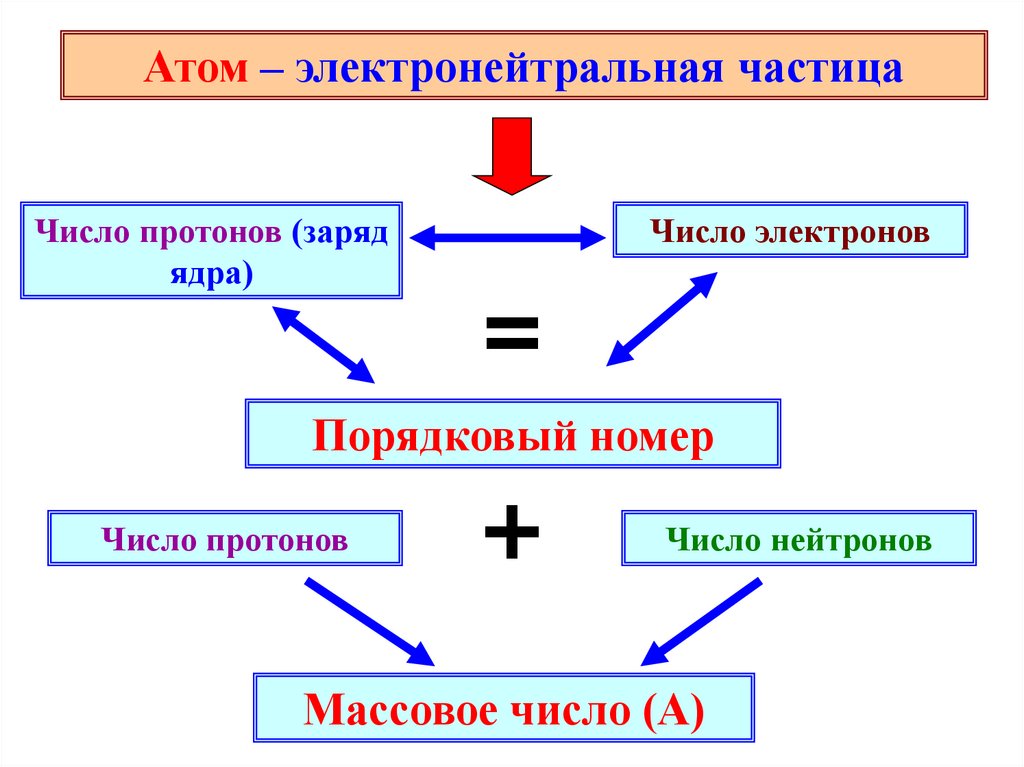
11.
Атом – электронейтральная частицаЧисло протонов (заряд
ядра)
Число электронов
=
Порядковый номер
Число протонов
+
Число нейтронов
Массовое число (А)
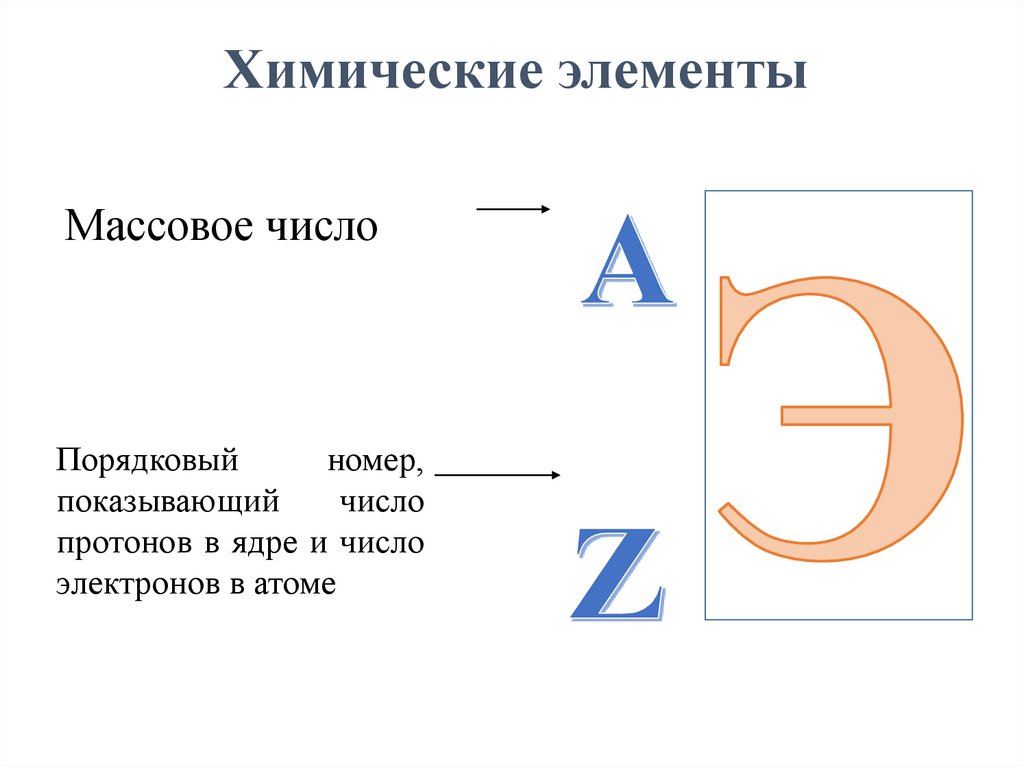
12.
Химические элементыМассовое число
Порядковый
номер,
показывающий
число
протонов в ядре и число
электронов в атоме
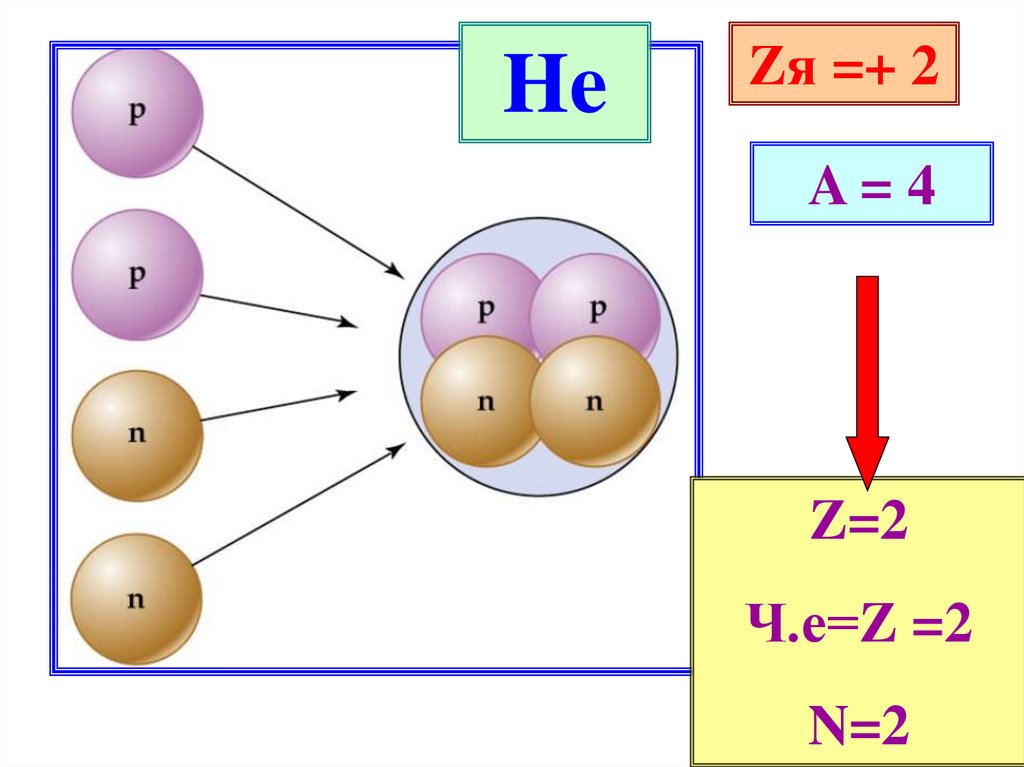
13.
HeZя =+ 2
A=4
Z=2
Ч.е=Z =2
N=2
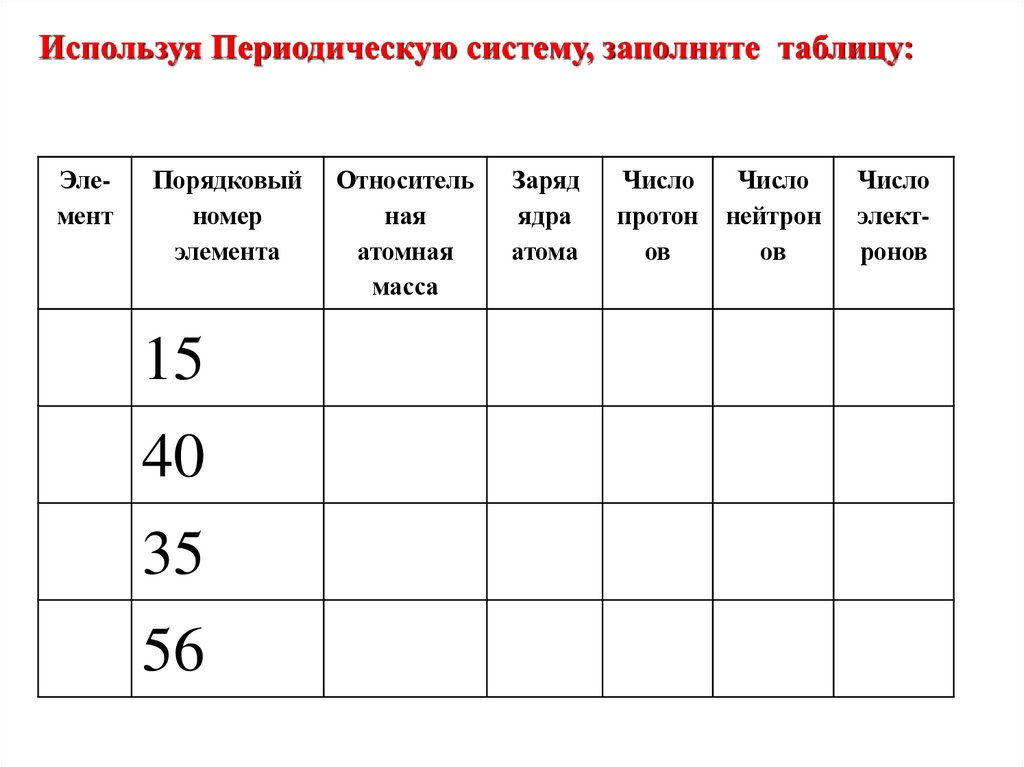
14.
Используя Периодическую систему, заполните таблицу:Элемент
Порядковый
номер
элемента
15
40
35
56
Относитель
ная
атомная
масса
Заряд
ядра
атома
Число
протон
ов
Число
нейтрон
ов
Число
электронов
15.
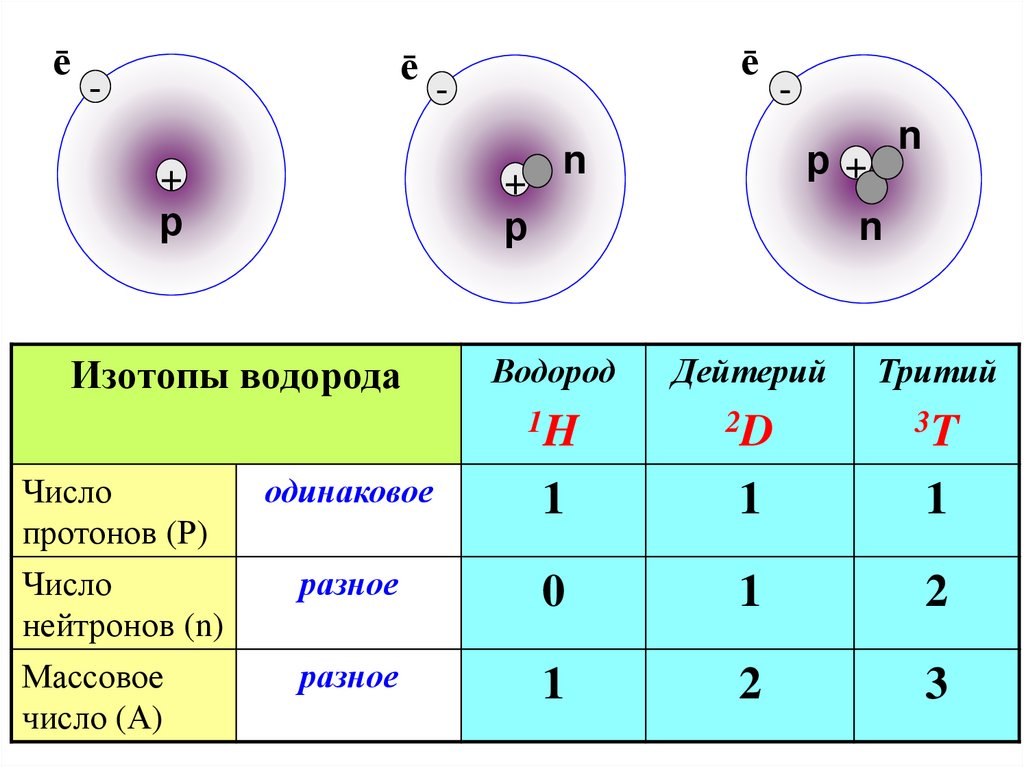
Изотопы– это РАЗНОВИДНОСТЬ АТОМОВ
одного химического элемента,
которые имеют одинаковый
порядковый номер, но разную
атомную массу.
16.
ēē
+
р
+
р
n
р+
n
n
Водород
Дейтерий
Тритий
1H
2D
3T
одинаковое
1
1
1
разное
0
1
2
разное
1
2
3
Изотопы водорода
Число
протонов (Р)
Число
нейтронов (n)
Массовое
число (А)
ē
17. Химический элемент
это совокупность атомов содинаковым зарядом ядра.
18.
Из смеси выпишите изотопы хлора имеди:
28 Si,
14
11
5 B,
16
8 O,
64
37
63
18
29Cu,
17 Cl,
27
8 O,
14 Si,
35
Cu,
29
17 Cl,
17
8 O,
23
11 Na
26
14 Si
22
11 Na
19. Тестовые задания
1) Заряд ядра атома азота равен :а) 7 б) 13 в) 4 г) 29 д) 11
2) Число протонов в ядре атома криптона :
а ) 36 б) 17 в) 4 г) 31 д) 6
3) Число нейтронов в ядре атома цинка :
а) 8
б) 35 в) 11 г) 30 д) 4
4) Число электронов в атоме железа :
а) 11 б) 8 в) 56 г) 26 д) 30
5) Изотопы водорода отличаются друг от друга :
а)числом электронов; б)числом нейтронов;
в) химическим знаком; г) числом протонов; д)массовым
числом
20. Домашнее задание
§ 30, задания впрезентации









 chemistry
chemistry