Similar presentations:
Строение атома
1. Строение атома
7 классСтроение атома
Бозаджи Н.М.
учитель химии
высшей категории
2.
В результате изучения темы ,выбудете способны:
1.
2.
3.
4.
5.
6.
Рассматривать теории открытия атома.
Описывать сложную структуру атома на
основе планетарной модели.
Знакомиться со строением атома
Устанавливать связь между понятиями:
порядковый номер элемента–заряд ядра–
общее число электронов.
Определять химический элемент как вид
атомов с одинаковым зарядом ядра.
Осуществлять рефлексию учебной
деятельности на уроке
3. “Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает…” Д.И. Менделеев “Сами трудясь, вы
сделаете все и дляблизких и для себя,а если при труде
успеха не будет, будет неудача - не беда,
пробуйте еще”.
Д.И. Менделеев
4. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле!
А каково же строение атома?!5. Демокрит
I.История открытия строения атомаДемокрит
• В основе философии Демокрита
лежит учение об атомах и пустоте
как двух принципах,
порождающих многообразие
космоса. Атом есть мельчайшее
«неделимое» тело, не
подверженное никаким
изменениям. Неделимость атома
аналогична неделимости
«бытия».
6. Модель Томсона
• В 1904 году Томсон представил свою новуюмодель атома. Она представляла собой также
равномерно заряженную положительным
электричеством сферу, внутри которой
вращались отрицательно заряженные
корпускулы, число и расположение которых
зависело от природы атома .
« Пудинг с изюмом »
7. Опыт Резерфорда
Резерфорд исследовал особенностипрохождения альфа-частиц через
тонкие металлические пластинки.
На основании этих опытов ученый
предложил планетарную модель
атома: в центре атома - ядро, вокруг
которого вращаются электроны.
8. Планетарная модель атома Резерфорда
Э. Резерфорд предложил планетарную модель атома: вцентре находится положительно заряженное ядро, которое
имеет достаточно малые размеры, но в нём заключена почти
вся масса атома; вокруг ядра по круговым орбитам движутся
отрицательно заряженные электроны, подобно движению
планет вокруг солнца.
Планетарная модель атома калия
Солнечная система
9.
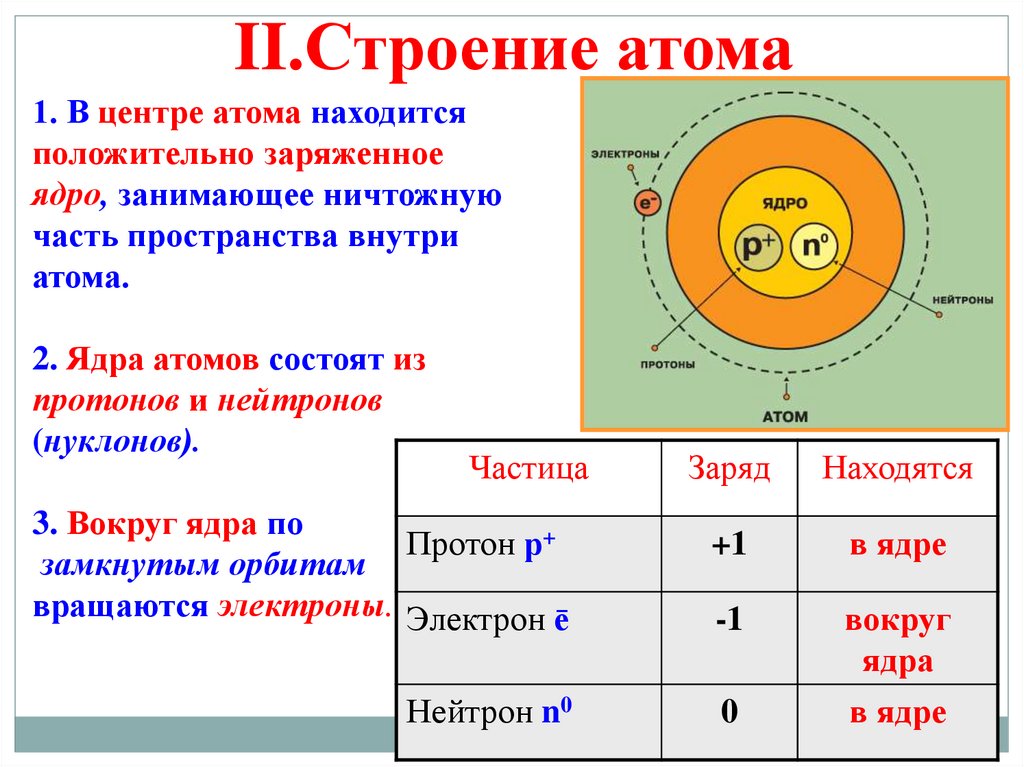
II.Строение атома1. В центре атома находится
положительно заряженное
ядро, занимающее ничтожную
часть пространства внутри
атома.
2. Ядра атомов состоят из
протонов и нейтронов
(нуклонов).
Частица
3. Вокруг ядра по
Протон р+
замкнутым орбитам
вращаются электроны. Электрон ē
Нейтрон n0
Заряд
Находятся
+1
в ядре
-1
вокруг
ядра
0
в ядре
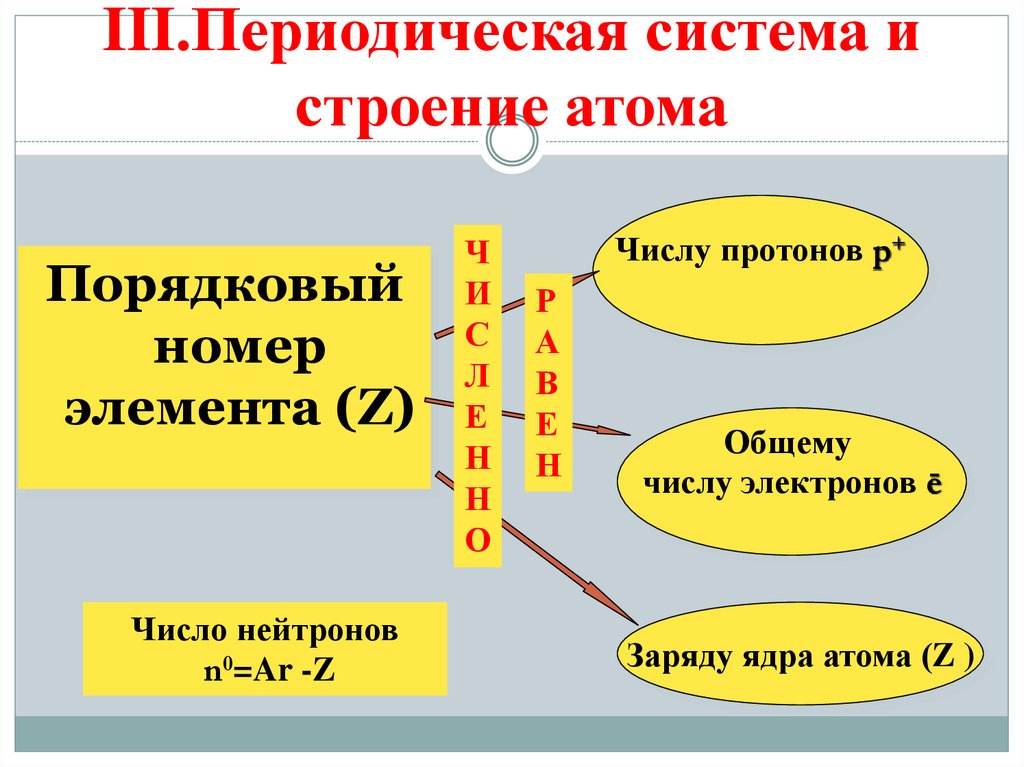
10. III.Периодическая система и строение атома
Порядковыйномер
элемента (Z)
Число нейтронов
n0=Ar -Z
Ч
И
С
Л
Е
Н
Н
О
Числу протонов р+
Р
А
В
Е
Н
Общему
числу электронов ē
Заряду ядра атома (Z )
11.
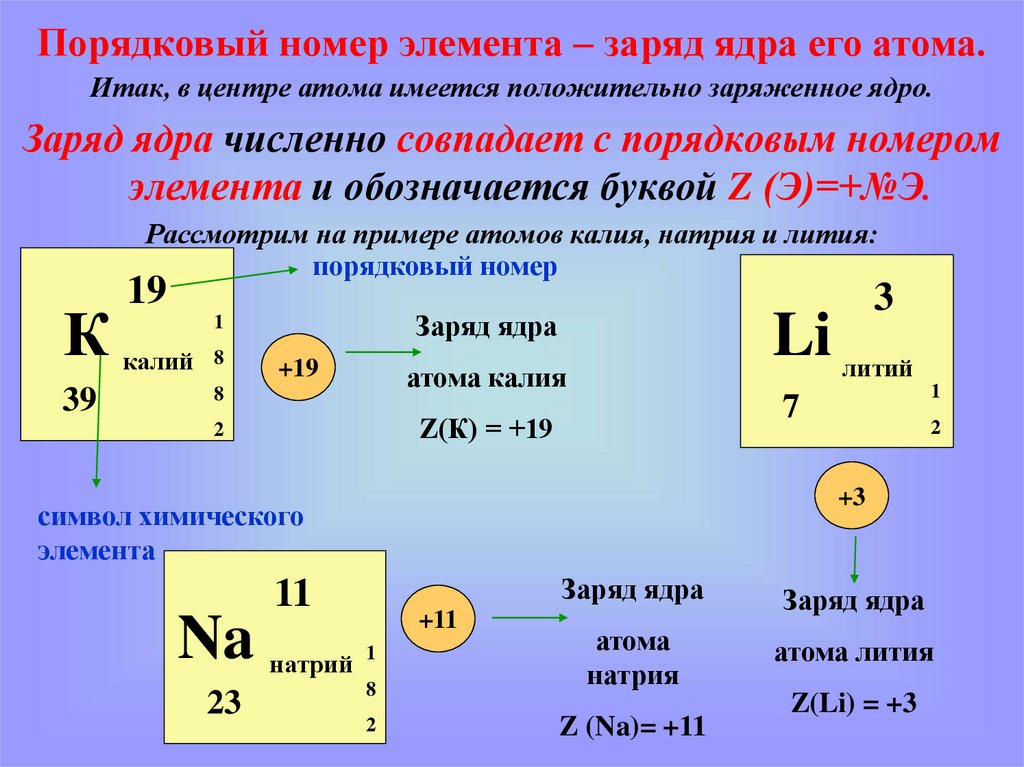
Порядковый номер элемента – заряд ядра его атома.Итак, в центре атома имеется положительно заряженное ядро.
Заряд ядра численно совпадает с порядковым номером
элемента и обозначается буквой Z (Э)=+№Э.
Рассмотрим на примере атомов калия, натрия и лития:
порядковый номер
19
К калий
39
8
3
Заряд ядра
1
+19
Li литий
атома калия
8
7
Z(К) = +19
2
Заряд ядра
Заряд ядра
атома лития
8
атома
натрия
2
Z (Na)= +11
11
23
2
+3
символ химического
элемента
Na натрий
1
+11
1
Z(Li) = +3
12. Задание 1.
А) По периодической системе химическихэлементов найдите заряды ядер атомов
Al, P, Br, Cl, записывая так Z (Э)=…
Z (Al)= +13 Z (P)= +15 Z (Br)= +35 Z (Cl)= +17
Б) Найдите неправильные ответы:
Al: Z = 13,
P: Z = + 16,
Br: Z = + 35,
Cl: Z = +18,
N: Z = + 7,
O: Z = + 9.
13. Вокруг положительно заряженного ядра атома движутся отрицательно заряженные электроны, образуя электронную оболочку. Число
электронов равнопорядковому номеру элемента (заряду ядра).
Электрон обозначается ē .
порядковый номер
19
К калий
39
1
8
8
2
число
электронов
атома калия:
ē = 19
11
Na натрий
23
1
8
2
число
электронов
атома натрия:
ē = 11
3
Li литий
7
1
2
число
электронов
атома лития:
ē=3
14. Задание 2.
А) По периодической системе химическихэлементов найдите число электронов
атомов Al, P, Br, Cl записывая так е=…
13, 15, 35, 17
Б) Найдите
неправильные ответы:
_
_
_
Al: е = +13,
P: е = 16,
Br: е = 36,
_
_
_
Cl: е = 17,
N: е = +7,
O: е = 8.
Al, P, Br, N.
15.
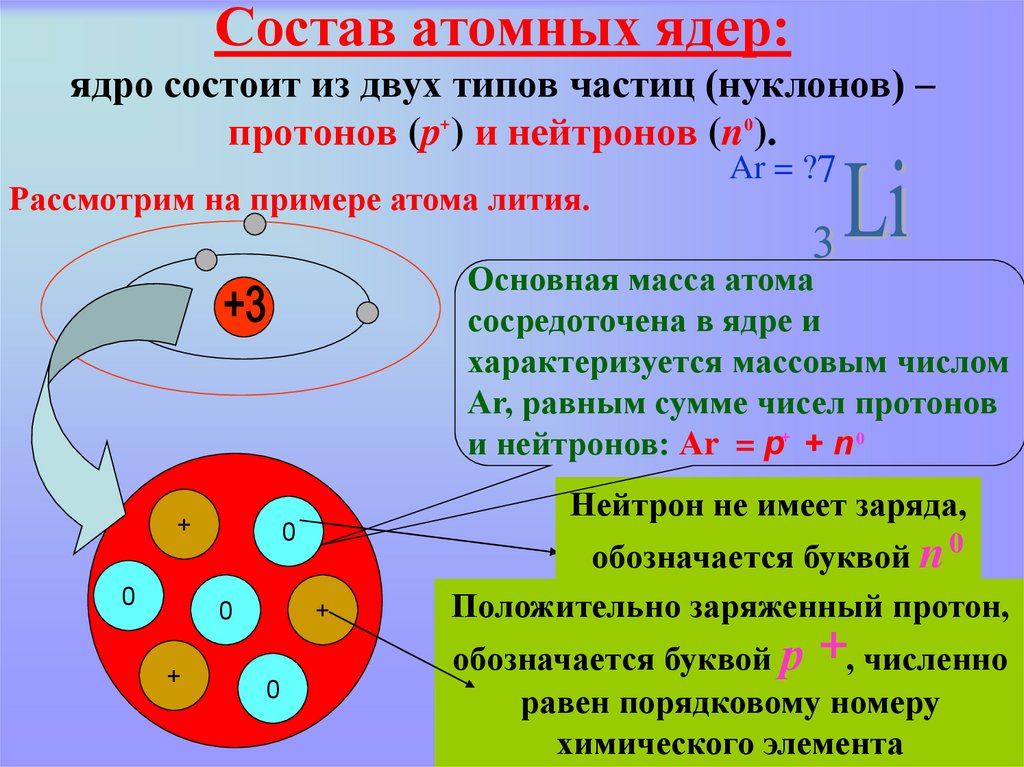
16. Состав атомных ядер: ядро состоит из двух типов частиц (нуклонов) – протонов (p ) и нейтронов (n ).
Состав атомных ядер:ядро состоит из двух типов частиц (нуклонов) –
протонов (p+ ) и нейтронов (n0).
Ar = ?7
Рассмотрим на примере атома лития.
Основная масса атома
сосредоточена в ядре и
характеризуется массовым числом
Аr, равным сумме чисел протонов
и нейтронов: Аr = p+ + n 0
+
0
0
0
+
Нейтрон не имеет заряда,
+
0
обозначается буквой n 0
Положительно заряженный протон,
обозначается буквой р +, численно
равен порядковому номеру
химического элемента
17. Атом натрия Атом калия
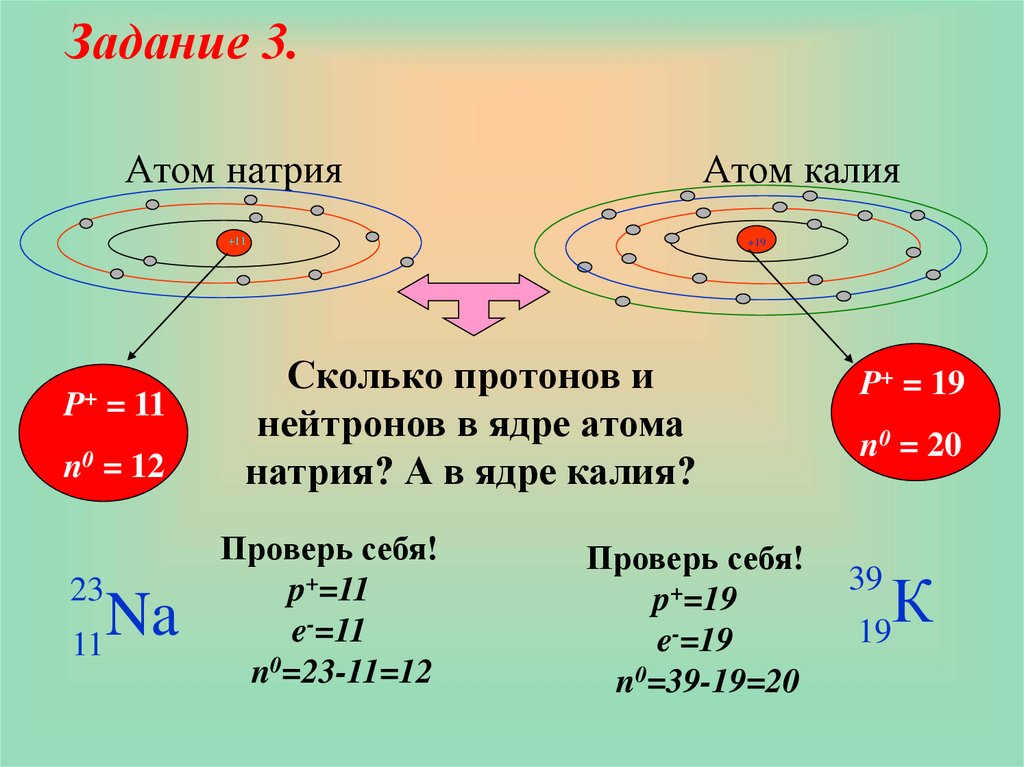
Задание 3.Атом натрия
Атом калия
+11
P+ = 11
n0 = 12
23
Na
11
+19
Сколько протонов и
нейтронов в ядре атома
натрия? А в ядре калия?
Проверь себя!
p+=11
e-=11
n0=23-11=12
Проверь себя!
p+=19
e-=19
n0=39-19=20
P+ = 19
n0 = 20
К
39
19
18.
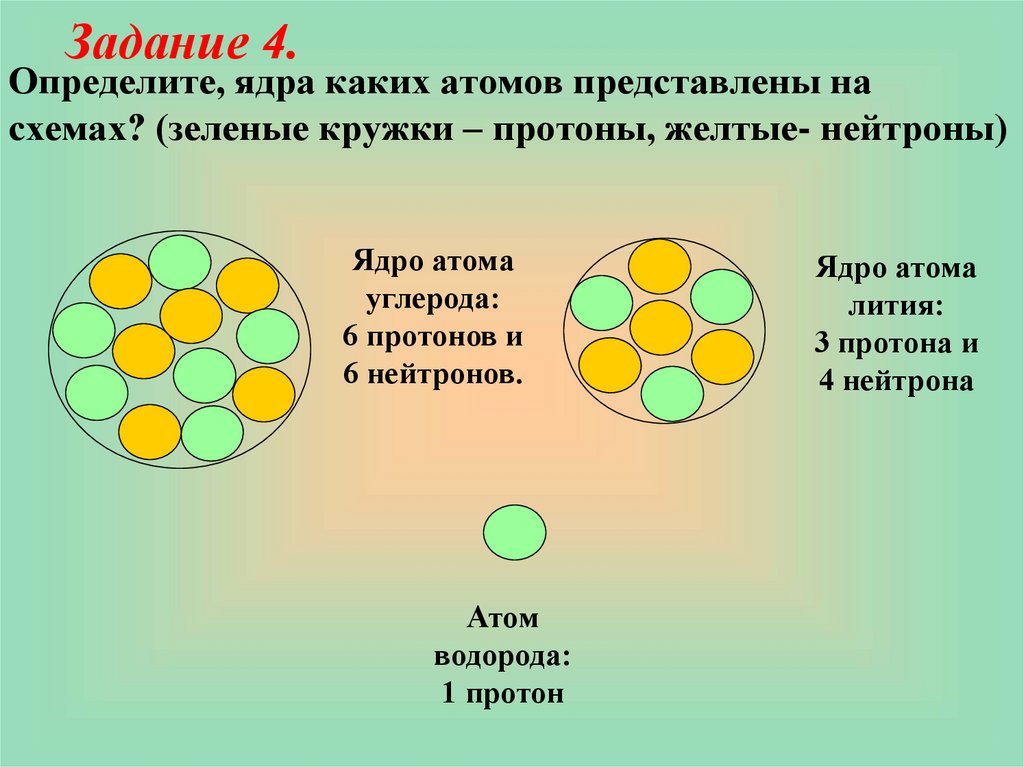
Задание 4.Определите, ядра каких атомов представлены на
схемах? (зеленые кружки – протоны, желтые- нейтроны)
Ядро атома
углерода:
6 протонов и
6 нейтронов.
Атом
водорода:
1 протон
Ядро атома
лития:
3 протона и
4 нейтрона
19. Планетарная модель атома лития по Резерфорду:
Вокруг положительно заряженного ядра атома литиядвижутся отрицательно заряженные электроны,
образуя электронную оболочку.
Строение атома лития
ядро: Z = +3
электронная оболочка 3е-
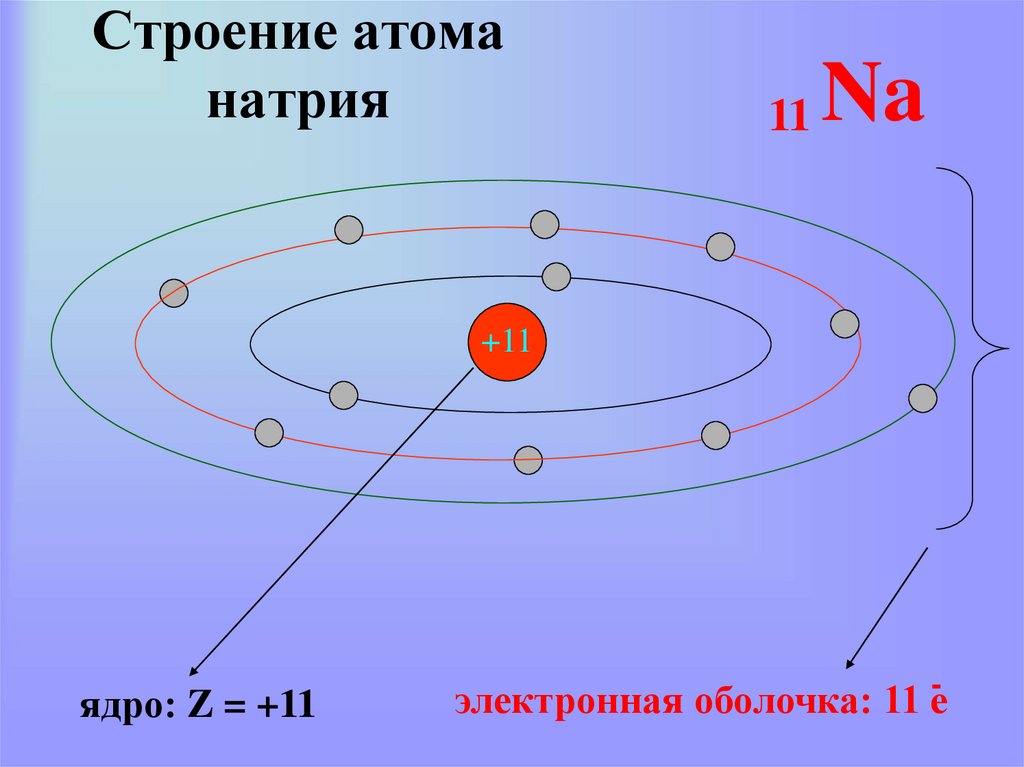
20. Строение атома натрия
11Na
+11
ядро: Z = +11
-
электронная оболочка: 11 е
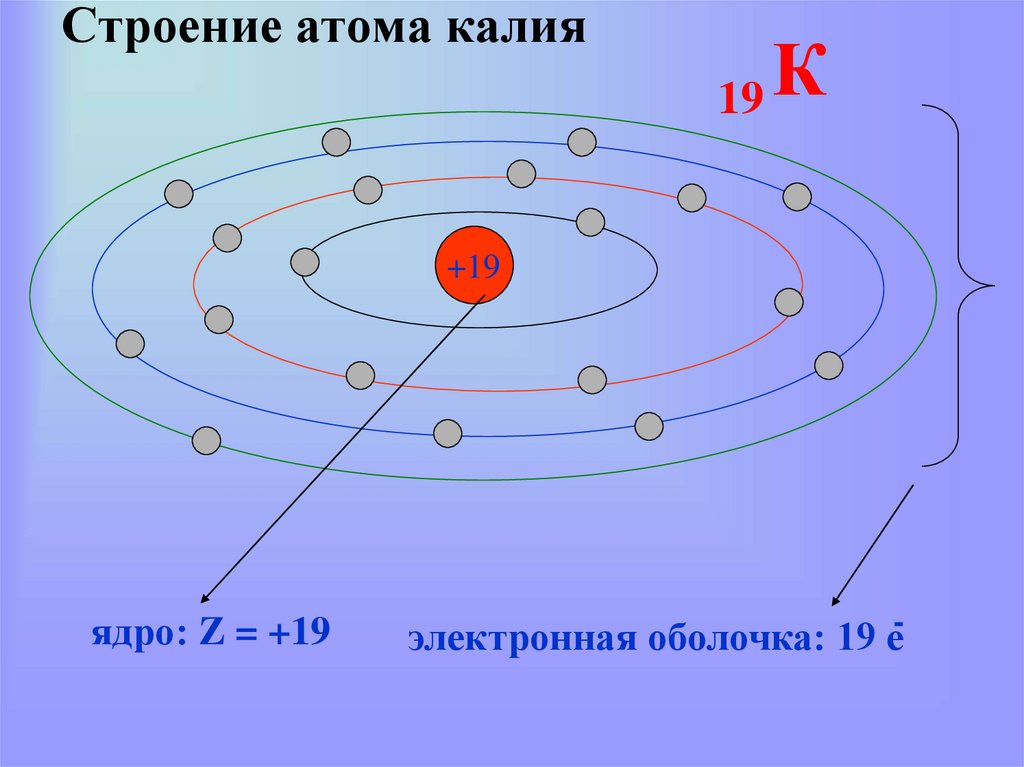
21. Строение атома калия
К19
+19
ядро: Z = +19
-
электронная оболочка: 19 е
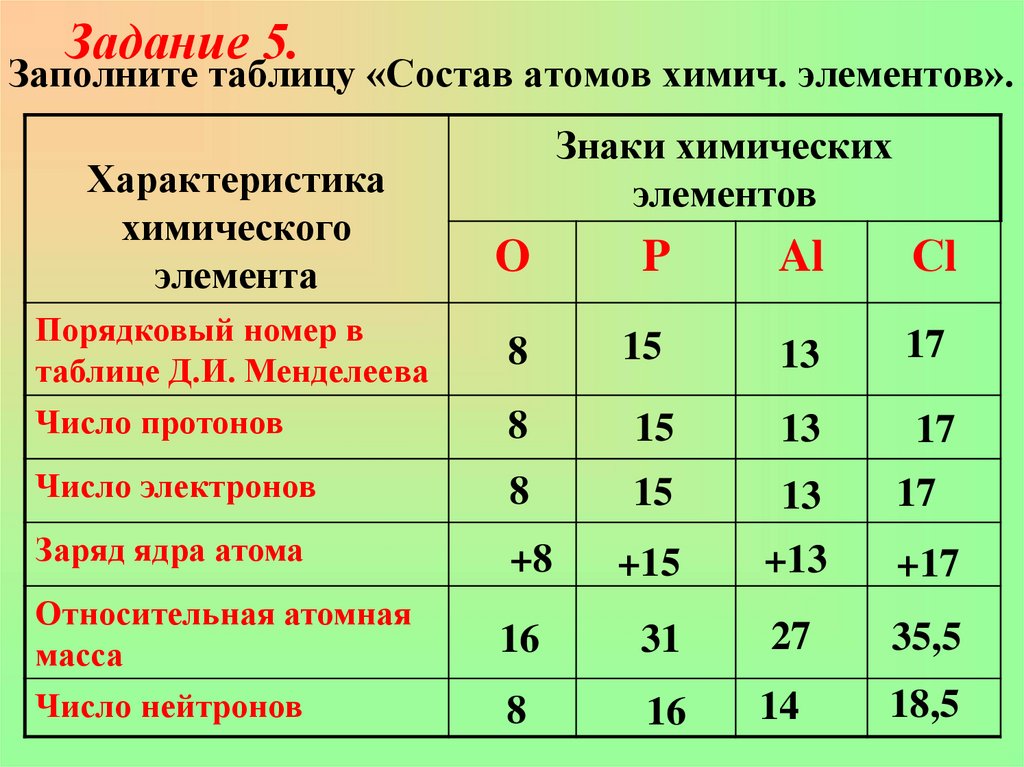
22. Заполните таблицу «Состав атомов химич. элементов».
Задание 5.Заполните таблицу «Состав атомов химич. элементов».
Характеристика
химического
элемента
Знаки химических
элементов
O
P
Al
Сl
Порядковый номер в
таблице Д.И. Менделеева
Число протонов
8
15
13
17
8
15
13
17
Число электронов
8
15
13
17
Заряд ядра атома
+8
+15
+13
+17
Относительная атомная
масса
16
31
27
35,5
Число нейтронов
8
16
14
18,5
23.
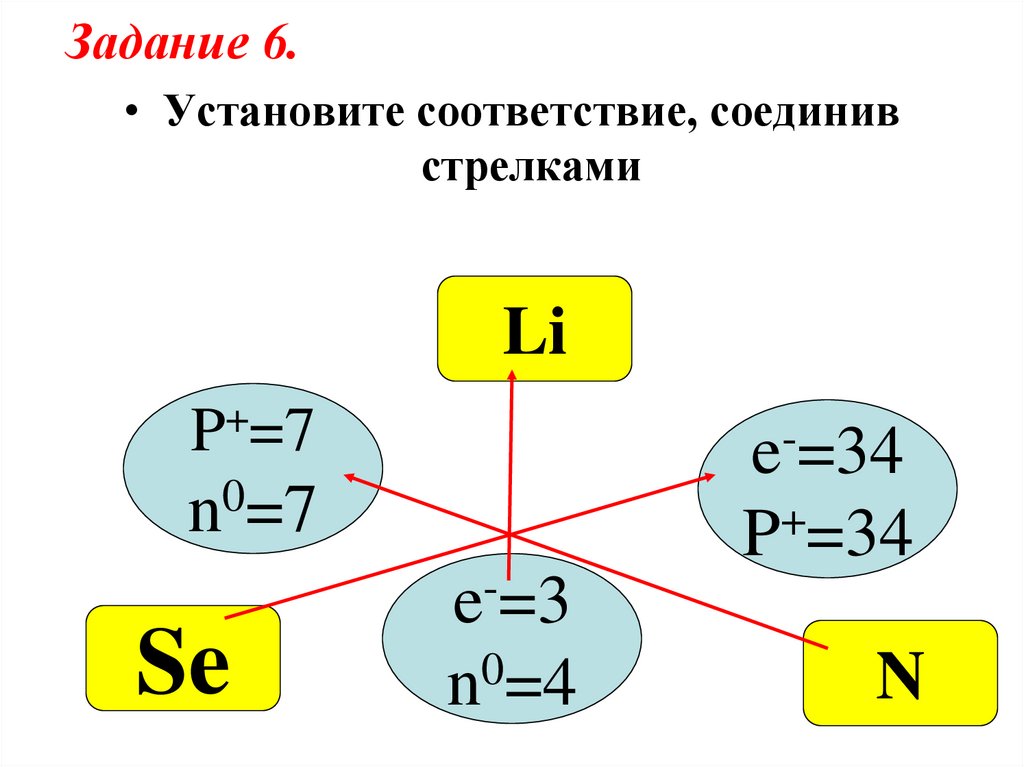
Задание 6.• Установите соответствие, соединив
стрелками
Li
+
P =7
e =34
0
n =7
Se
+
P =34
e =3
n0=4
N
24. Тест:
Задание 7.Тест:
1.Заряд ядра атома азота равен :
б) +13 в) +4 г) +29 д) +11
а)+7
2.Число протонов в ядре атома хлора :
а ) 36
б)17 в) 4 г) 31 д) 6
3.Число нейтронов в ядре атома цинка :
а) 8
б)35 в)11 г)30 д)4
4.Число электронов в атоме железа :
а) 11 б)8
в)56 г)26 д)30
МОЛОДЦЫ !
ЭТО ВАМ УДАЛОСЬ !!
25.
о. Грустио.Тревоги
о.Просветления
о.Бермудский
треугольник
26.
МОЛОДЦЫ !!!Вы справились. Желаю
дальнейших успехов в
изучении химии!
27.
Домашнее заданиеРазобрать и выучить
конспект.
Выучить параграф: § 2.4
Выполнить упр:
2, стр. 50.

















 chemistry
chemistry








