Similar presentations:
Растворы. Замерзание и кипение растворов
1. Физическая химия: практическое применение Тема 3: Растворы
КАФЕДРА Химии и экотоксикологииФизическая химия:
практическое применение
Тема 3: Растворы
Корнилов Кирилл Николаевич
Доцент,
Кандидат химических наук,
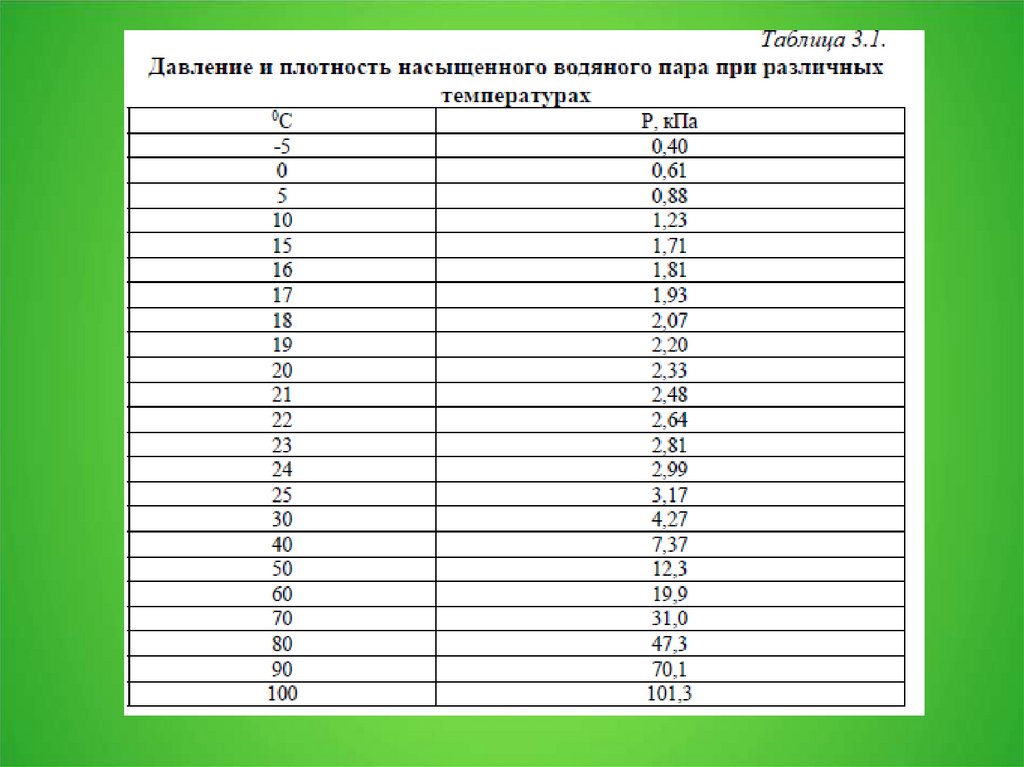
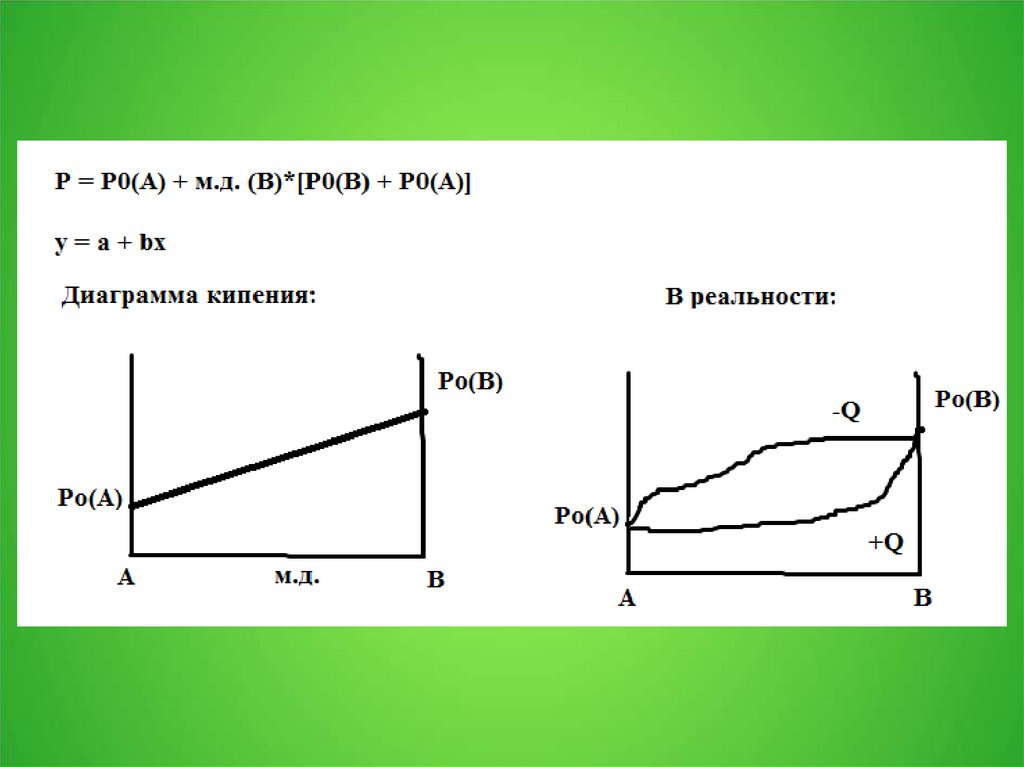
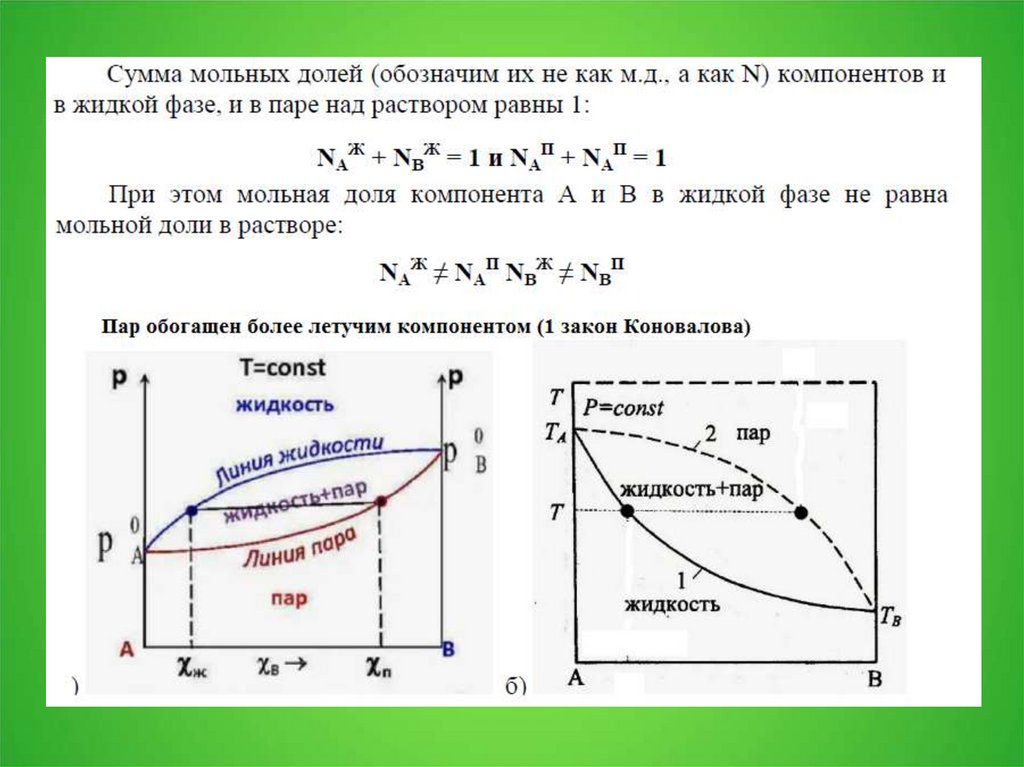
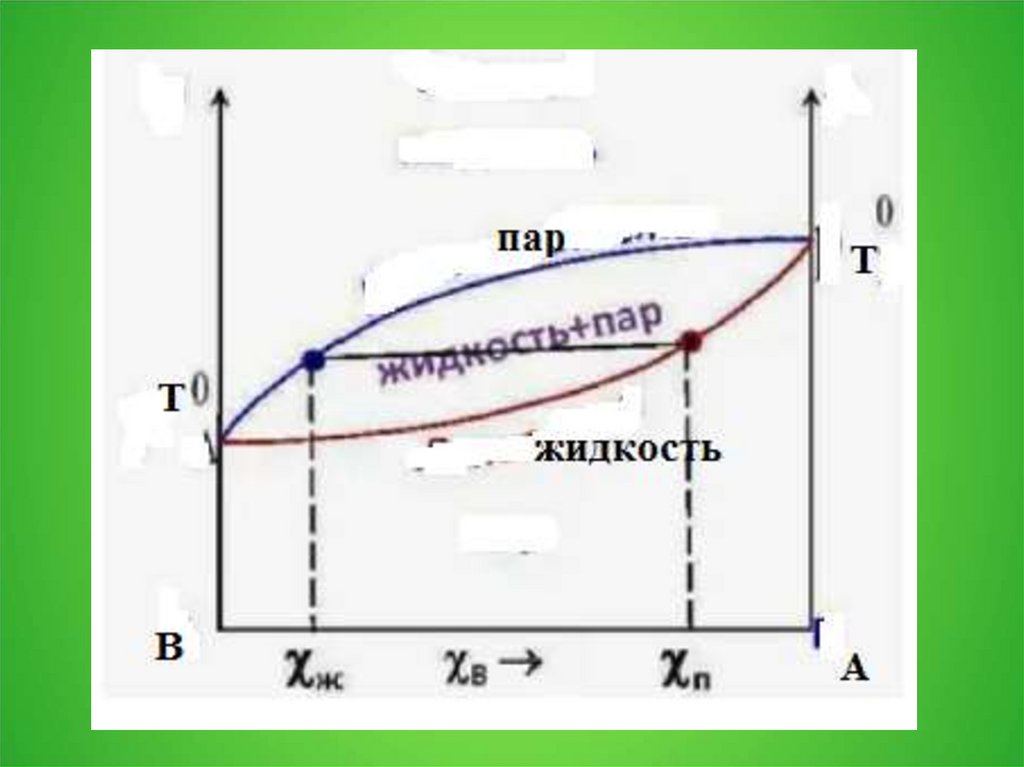
2. 3.1. Давление пара над раствором
3.
4.
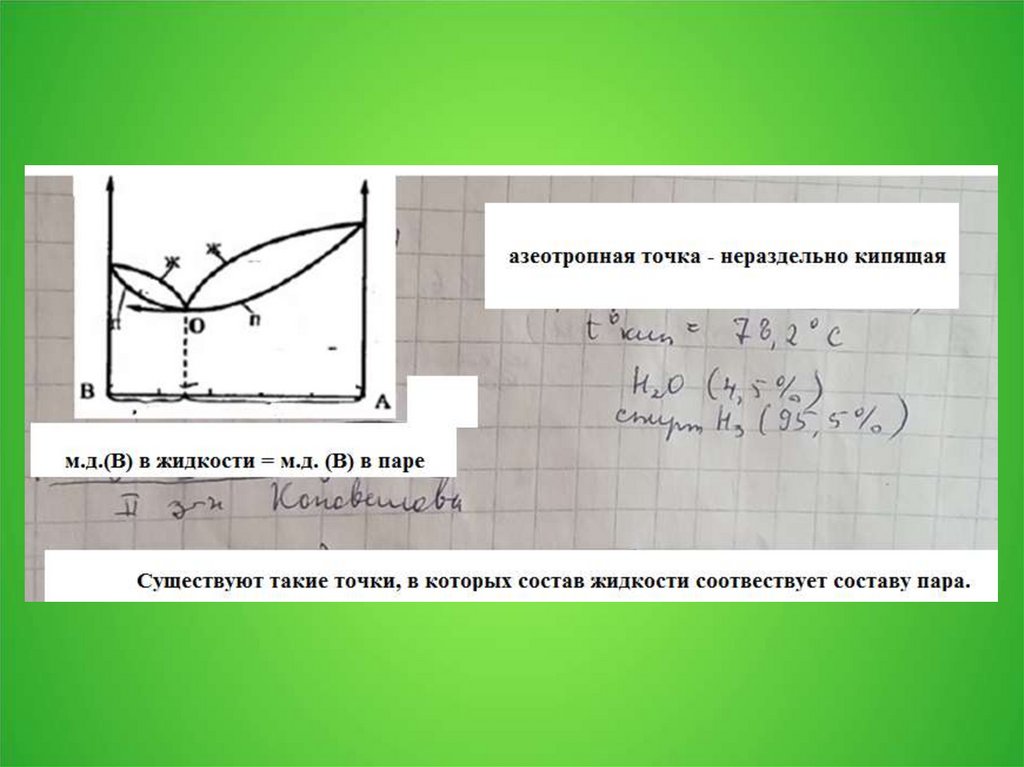
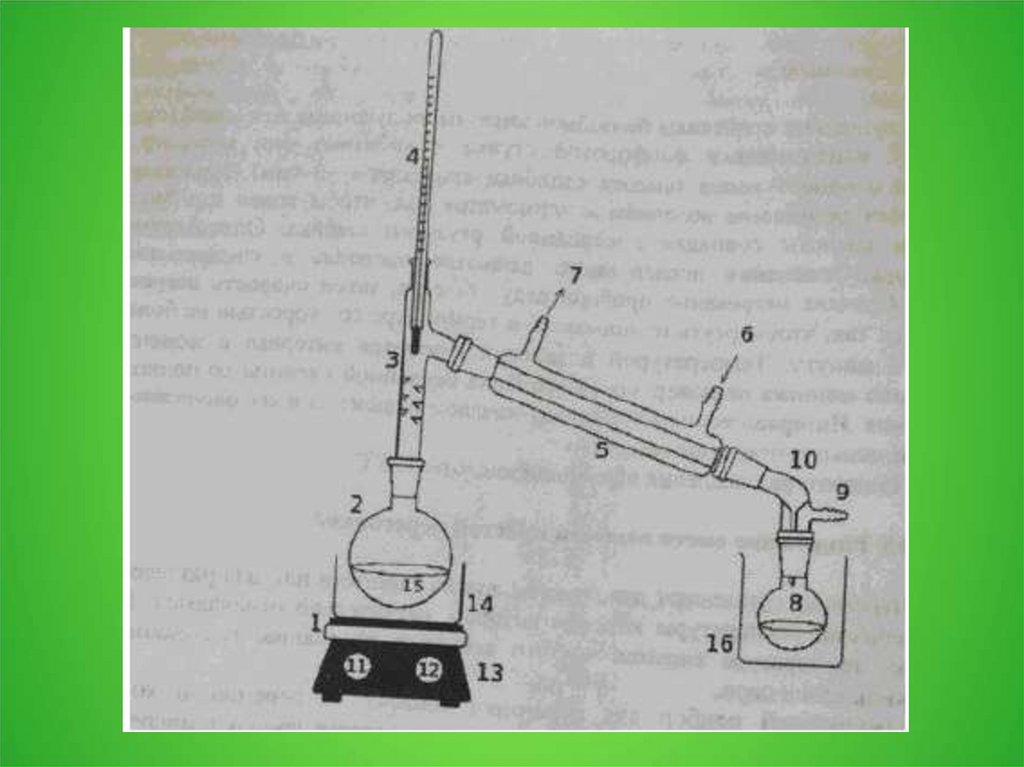
5. 3.2. Замерзание и кипение растворов
6.
7.
8.
3.3. ОСМОСОсмос (от греч. ὄσμος «толчок,
давление») — процесс
односторонней диффузии
через полупроницаемую
мембрану молекул
растворителя в сторону
большей концентрации.
9.
История.Впервые осмос
наблюдал А.
Нолле в 1748,
однако
исследование
этого явления
было начато
спустя
столетие.
10.
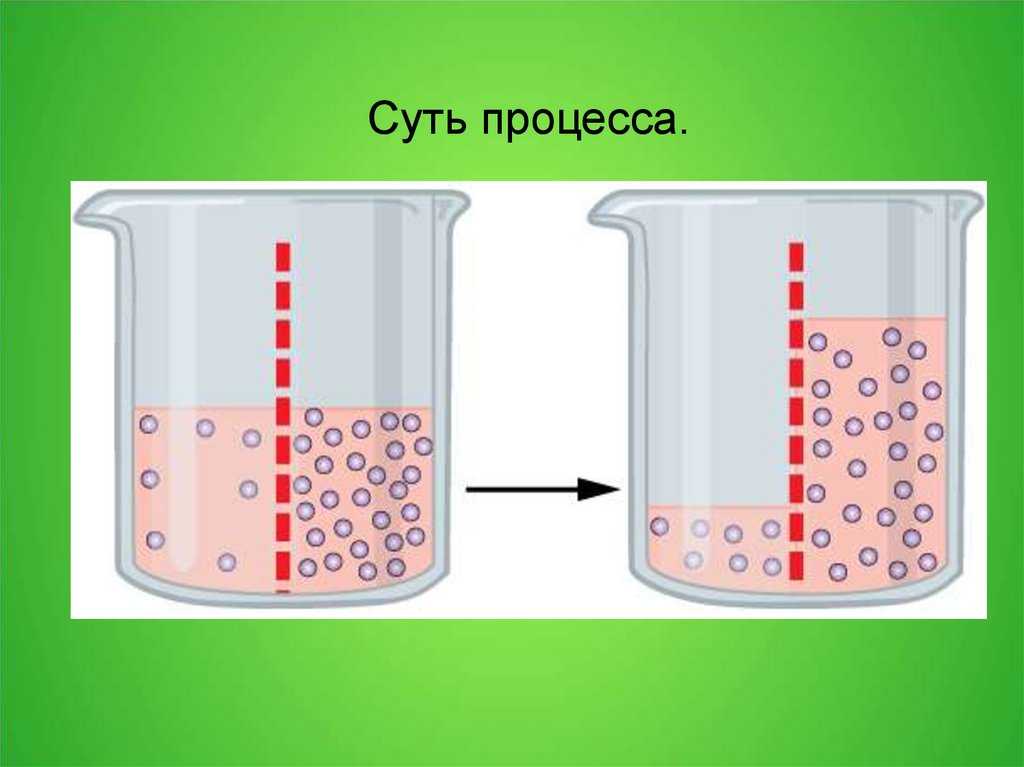
Суть процесса.11.
Осмос через полупроницаемую мембрану.Частицы растворителя (синие) способны
пересекать мембрану, частицы растворённого
вещества (красные) — нет.
12.
Осмотическое давление (обозначается Росм.) — избыточное гидростатическое
давление на раствор, отделённый от
чистого растворителя полупроницаемой
мембраной, при котором
прекращается диффузия растворителя
через мембрану.
Р = gph
13.
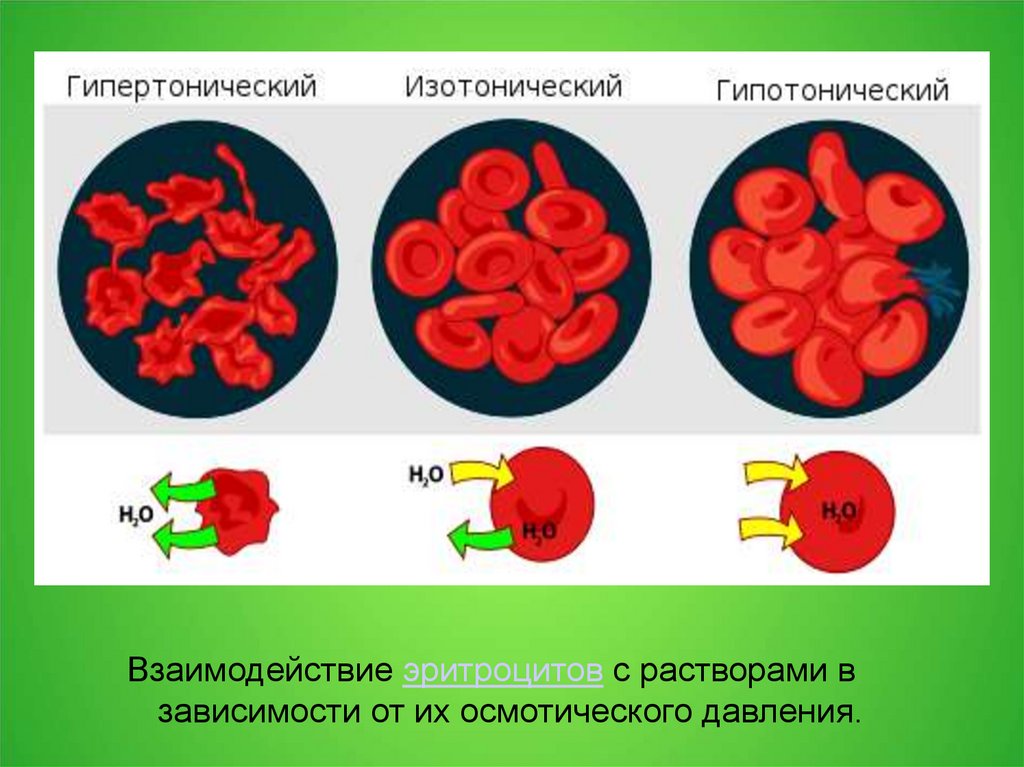
Взаимодействие эритроцитов с растворами взависимости от их осмотического давления.
14.
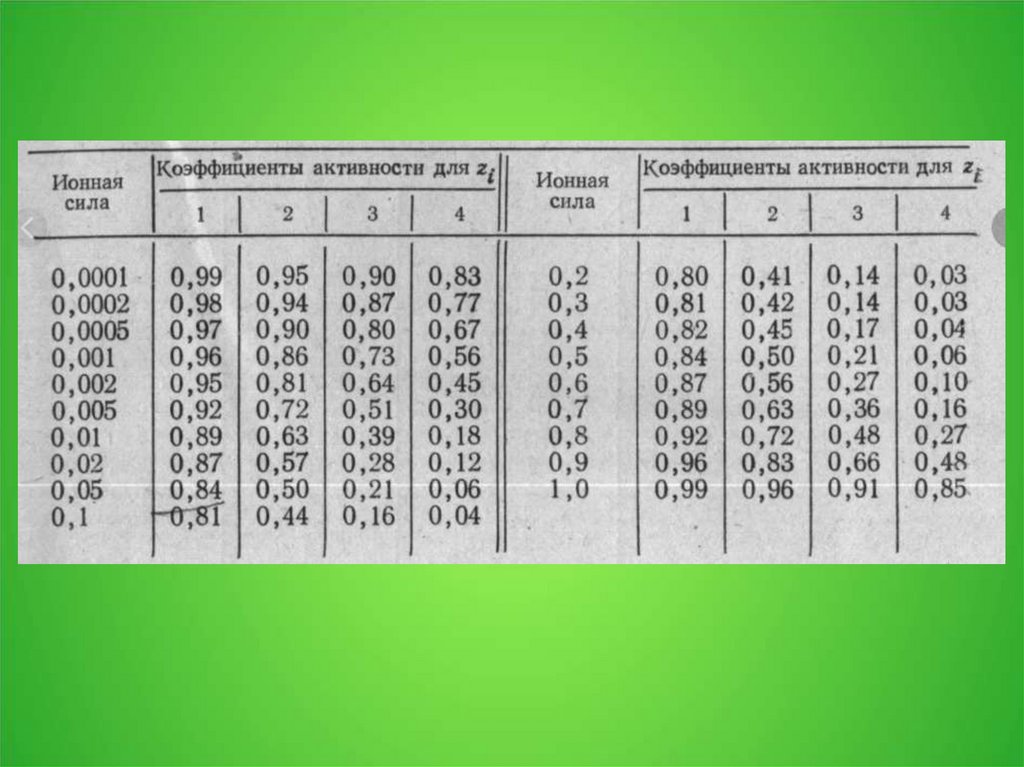
где i — изотонический коэффициент раствора (он есть только уэлектролитов); C — молярная концентрация раствора,
выраженная через комбинацию основных единиц СИ, то есть, в
моль/м3, а не в привычных моль/л; R —универсальная газовая
постоянная; T — термодинамическая температура раствора.

















 chemistry
chemistry








