Similar presentations:
Проведение преаналитического этапа лабораторного исследования
1. Проведение преаналитического этапа лабораторного исследования
2. Преаналитический этап лабораторных исследований
• Основная задача клинической лабораторнойдиагностики - это получение объективных данных о
состоянии здоровья и нездоровья отдельно взятого
пациента, выделенной группы или населения региона в
целом.
• Клинические решения, основанные на результатах
лабораторных тестов, правильны лишь при условии,
что образцы крови или других биоматериалов верно
идентифицированы и стандартизированы время и
правила их забора и транспортировки, или когда
недостаток стандартизации распознан и сделаны
необходимые допущения в отношении недостаточной
сопоставимости с результатами предшествующих
исследований
• Доля ошибок преаналитического этапа в общем числе
лабораторных ошибок составляет не менее 50%, в то
время, как на долю аналитического этапа приходится
не более 20% ошибок (Гудер В.Г. с соавт., 2003).
3. Преаналитический этап лабораторных исследований
Отсутствует стройная система квалифицированного
преаналитического этапа, которая включала бы
правильное составление заявки на исследование,
подготовку больного к исследованию по
современным нормативам и стандартам,
соблюдение условий забора, транспортировки
материала,
обязательное использование современных
расходных материалов
Стандартизация на преаналитическом этапе
обеспечивает снижение лабораторных ошибок. При
этом основной мерой для введения таких стандартов
являются современные расходные материалы для
взятия биоматериала
4. Преаналитический этап лабораторного исследования
Подготовка к составлению заявки на лабораторныеисследования
• Врач-клиницист является основным заказчиком
лабораторных анализов, а, следовательно, и
пользователем их результатов. Он инициирует
запрос на лабораторные исследования, составляя
заявку на желаемые анализы в истории болезни.
• При составлении заявки на исследования врач
должен учитывать:
• цель назначаемых лабораторных тестов :
— уточнение диагноза, предположительно
поставленного на основании других данных
— оценка течения заболевания в динамике
— скрининговые исследования
5. Преаналитический этап лабораторного исследования
• соответствие заявки на лабораторныеисследования «Стандартам лабораторных
исследований» при данной нозологической
форме или разработанной для данной
нозологической формы программы
лабораторных исследований;
• соответствие времени назначения
исследований динамике патологического
процесса;
• влияние лекарственных препаратов и
диагностических процедур на уровень
исследуемого показателя;
• диагностическую чувствительность и
специфичность теста.
6. Преаналитический этап лабораторного исследования
Согласно врачебной заявке на лабораторные
исследования средним медперсоналом
заполняется направление на исследование с
учетом системы идентификации пациентов,
принятой в данном медицинском учреждении.
для идентификации личности пациента может быть
использована следующая информация:
фамилия, имя, отчество, дата рождения;
пациенту может быть присвоен личный номер;
дополнительно могут быть использованы номер
отделения, палаты, койки;
использование для идентификации личности
пациента сово купности вышеперечисленных
сведений.
7. Преаналитический этап лабораторного исследования
• В направлении на исследование должны бытьотображены следующие данные:
— дата и время назначения исследования;
— дата в время взятия биологического материала;
— Ф.И.О. пациента;
— отделение, номер амбулаторной карты/истории
болезни, но мер палаты;
— возраст, пол;
— диагноз;
— Ф.И.О. лечащего врача;
— перечень необходим ы х исследований;
— подпись специалиста, проводившего забор
клинического материала.
8.
Когда лучше брать пробу?А. Пробы следует брать с 7 до 9 часов утра
Рис.1. Показатели крови, уровень которых существенно изменяется
в сыворотке крови в течение суток
9.
• В. Взятие проб необходимо выполнять допроведения диагностических и лечебных
процедур, способных оказать влияние на
результаты теста.
• Г. Необходимо избегать физического
напряжения в предшествующий забору
крови период.
• В случае забора крови в иное время суток в
направлении на исследование необходимо
указать период, прошедший после
последнего приема пищи.
• Кроме того, при необходимости отмечаются
также принимаемые пациентом
лекарственные препараты с указанием
времени их последнего приема.
10.
Нужно ли заполнять все графы направительногобланка?
В направлении на исследование должны быть отображены
следующие данные:
дата и время назначения исследования;
дата и время взятия крови;
Ф.И.О. пациента;
название ЛПУ, в случае, если образец транспортируется в
отдаленную лабораторию;
возраст, пол, (домашний адрес - при направлении крови на
исследование маркеров ВИЧ ?);
диагноз, при необходимости - лекарства, которые принимает
пациент;
Ф.И.О. лечащего врача;
перечень необходимых исследований;
подпись специалиста, проводившего забор клинического
материала.
Заполнение всех указанных граф существенно облегчает
сортировку проб материала при транспортировке и в
лаборатории, а также ускоряет процесс доставки результатов
обратно в отделение или ЛПУ из внешней лаборатории.
11.
Надо ли маркировать пробирку иликонтейнер с пробой пациента?
Каждая проба должна быть маркирована, с указанием
фамилии пациента и кратким перечнем необходимых
исследований.
Направления на исследования помещают в отдельные папки либо
целлофановые пакеты, запрещается вносить поправки, изменения,
зачеркивания и др. Не допускается помещение бланков
направлений или другой документации внутрь бикса, контейнера и
др.
Категорически запрещается
•помещать направления в пробирки с кровью,
•заворачивать стекла с мазками, пробирки с биоматериалом на бак.
исследования и исследования методом ПЦР в направления во
избежание инфицирования персонала
12. Сколько можно хранить забранные образцы биоматериала?
Рекомендуемое время и условия хранения проб биоматериала13.
• Содержание большинства показателей неизменяется при хранении образцов сыворотки
крови при температуре холодильника +4°С в
течение 3-4 суток.
• Гемоглобин, эритроциты стабильны в течение
1 дня при хранении в закрытой пробирке.
• Замороженные образцы плазмы и сыворотки
крови могут храниться в холодильнике при –
20°С до 4 недель и более.
• Повторное замораживание и размораживание
недопустимо.
• В случае использования вакуумных систем
забора крови могут быть свои особенности
хранения образцов в зависимости от
производителя и используемого
антикоагулянта.
14.
• Некоторые особенности хранения и транспортировкиобразцов крови в зависимости от исследуемых
показателей.
• ВНИМАНИЕ!!!!
Исследование газов крови должно производиться немедленно;
при невозможности неотложного исследования – образцы в
закрытых стеклянных контейнерах могут храниться в бане с
ледяной водой до 2 часов, образец крови, забранный в
одноразовый шприц, необходимо доставить в лабораторию в
течение 15 мин, т.к. пластик пропускает газы.
При заборе крови на исследование ионограммы, когда проба не
может быть сразу доставлена в лабораторию, рекомендуется
использовать вакуумные системы с разделительными гелями,
для изоляции клеток крови и предупреждения выхода из них
внутриклеточных ионов.
Пробы крови, отобранные для определения АКТГ и кальцитонина,
должны быть немедленно помещены на лед (но не в морозилку).
При транспортировке контейнеры с образцами крови следует
предохранять от тряски во избежание развития гемолиза и
соблюдать определенный температурный режим. Температура
<4°С и > 30°С может существенно изменить содержание в образце
многих веществ.
15. Ошибки на преаналитическом этапе анализа.
16. Ошибки, возникающие на преаналитическом этапе составляют 70 – 95% всех погрешностей, допускаемых при проведении анализа.
17. Биологические факторы, связанные с личностью пациента
18.
• Пол пациента• Возраст пациента
19.
• Сезонные ритмыпациента
• Циркадные ритмы
аналита
20.
• Индивидуальныеритмы пациентов
• Беременность и
менструальный
цикл
21.
• Физические истрессовые
нагрузки
• Положение тела
пациента
22.
• Диагностические илечебные
процедуры
• Приём
лекарственных
препаратов
23.
• Диета ипотребление
жидкости
24. Факторы, связанные с условиями отбора проб
25.
• Место отбораобразца крови
• Объем крови
26.
• Периодичностьвзятия проб
• Использование
антикоагулянтов
27.
• Температурныеусловия
28.
• Липемия проб• Гемолиз проб
29. Идентификация проб
Правильная и четкаямаркировка пробирок
является важнейшей
задачей
преаналитического
этапа
30. Транспортировка проб в лабораторию
31.
• Пробы цельной крови должны бытьдоставлены в течении 45 минут после
забора
• Для пересылки следует использовать
герметически закрывающиеся пробирки
из небьющегося материала
• Пробирки помещают в специальный
контейнер с адсорбентом
• При транспортировке охлажденных или
замороженных образцов используют
контейнер из пенопласта с сухим льдом
• Для определения лабильных аналитов
требуется температурный режим +4ºС
32. Первичная обработка проб
33.
• Центрифугирование• Отделение сыворотки (плазмы) от
осадка
• Аликвотирование сыворотки (плазмы)
• Должны быть завершены в
течении 1 часа после забора
крови!!!
34.
• Чем вакуумные системыдля забора крови лучше,
обычных стеклянных
пробирок?
Вакуумные системы для забора
крови:
гарантируют защиту персонала
от инфицирования,
экономят времени персонала на
процесс забора крови,
позволяют герметично
транспортировать пробы крови,
имеют цветовую кодировку для
различных типов анализов,
позволяют осуществить забор
крови с использованием любых
катетеров,
исключают потерю пробы крови
при транспортировке и
центрифугировании.
35.
Сопоставление цветовой кодировки вакуумных пробирокразличных производителей в зависимости от наполнителей
Пробирка
содержит
SARSTEDT
VENOSAFE цвет
пробки
VACUETTE цвет
пробки
Белая
Красная или коричневая
Красная
Цитрат Na (для
коагулоги-ческих
исследований)
Зеленая
Голубая
Голубая
К-ЭДТА
(для
гематологигеских
ис-следований)
Розовая
Сиреневая
Сиреневая
Li-гепарин
(для
иммуноло-гических
исследований)
Оранжевая
Зеленая
Зеленая
Активатор
свертывания
получения
сыворотки)
(для
36. Выбор процедуры для взятия крови.
Чаще всего для получения крови для клинических
лабораторных исследований используются:
венепункция;
взятие капиллярной крови.
Венозная кровь является лучшим материалом не
только для определения биохимических,
гормональных, серологических, иммунологических
показателей, но и для гематологических
исследований.
Это обусловлено тем, что применяемые в настоящее
время гематологические анализаторы, с помощью
которых проводят клинические исследования крови,
предназначены для работы с венозной кровью.
Выпускаемые фирмами калибровочные и
контрольные материалы предназначены для
калибровки гематологических анализаторов по
венозной крови.
37.
Рекомендуемая последовательность забора крови принеобходимости проведения различных исследований
одному больному
В зависимости от назначенного вида исследования образец крови
должен собираться в присутствии строго определенных добавок.
Для исследований системы свертывания крови применяется
только цитратная плазма.
В большинстве гематологических исследований используется
венозная кровь с ЭДТА.
Для получения сыворотки кровь собирают без антикоагулянтов.
Для исследования глюкозы кровь собирают с добавлением
ингибиторов гликолиза (фтористого натрия или йодоацетата).
При использовании вакуумных систем забора крови
обеспечивается точное соотношение антикоагулянта и крови, что
ведет к более точному результату исследования.
В случае, когда сразу должна быть набрана пробирка с цитратом
Na, первые 5 мл крови следует набрать в пустую пробирку и
выбросить, чтобы предотвратить попадание в пробу тканевого
тромбопластина из места венепункции
38. Последовательность взятия различных образцов крови
№ п/пРасходные материалы
Исследуемая
среда
Проводимые исследования
1.
Флакон с транспортной средой
для гемокультивирования
Кровь
бактериологические
2.
Пробирка без наполнителей или с
активатором свертывания
Сыворотка
биохимические,
серологические
3.
Пробирка с цитратом Na
Плазма
коагулогические
4.
Пробирка с Li-гепарином или гепарином
Кровь цельная
/плазма
Иммунологические,
электролиты,
КЩС
5.
Пробирка с ЭДТА
Кровь цельная
/плазма
Гематологические,
ПЦР
6.
Пробирка
с
гликолиза
Плазма
глюкоза, лактат
ингибитором
39. Последовательность взятия различных образцов крови
• Когда кровь набрана в пробирку сантикоагулянтом, необходимо ее
отсоединить от иглы и сразу аккуратно
перемешать, осторожно перевернув 5-6
раз, а затем уже подсоединять другую
пробирку или удалять иглу из вены.
• В противном случае в пробирке может
образоваться сгусток и проба крови будет
непригодна для дальнейшего
исследования
40. Возможные осложнения и затруднения при взятии крови
Обморок. Чтобы избежать этого осложнения и его
последствий, лучше брать кровь, когда пациент находится в
положении лежа.
Гематома. Если гематома начинает появляться, необходимо
сразу снять жгут и вынуть иглу из вены, после чего наложить
давящую повязку на место пункции.
Отек. Лучше не брать кровь там, где имеются отеки, иначе
межтканевая жидкость попадет в кровь и результаты
исследования будут искажены.
Ожирение. Те же трудности, что и при взятии крови при
отеках.
Поврежденные или склерозированные вены. При заборе
крови их следует избегать.
Гемоконцентрация. Причины: длительное наложение жгута,
массаж и сжимание места взятия крови, склерозированные
или окклюзированные вены.
Инфекционные осложнения возникают при нарушении
правил асептики и антисептики.
41. Гемолиз и причины его возникновения
• Гемолиз – высвобождение внутриклеточных компонентов изклеток крови в плазму или сыворотку. Наличие гемолиза
распознают по появлению различной выраженности красноватого
окрашивания плазмы или сыворотки крови после
центрифугирования, связанного с высвобождением гемоглобина
из эритроцитов.
• Интерференция может возникнуть даже при низких концентрациях
гемоглобина, неразличимых невооруженным глазом. Гемолиз не
всегда сопровождается высвобождением гемоглобина. Источники
интерференции могут возникнуть при лизисе тромбоцитов и
гранулоцитов.
Основные причины гемолиза:
• слишком тонкая игла для венепункции;
• при заборе крови шприцом очень быстрые движения поршня;
• неаккуратное (быстрое) переливание крови из одной емкости в
другую;
• очень интенсивное перемешивание (встряхивание);
• длительное (более 2 минут) наложение жгута;
• физиологическая ненормальность эритроцитов.
При наличии явного гемолиза проба не должна исследоваться.
• Требуется перебрать пациенту кровь с соблюдением всех мер для
предупреждения его возникновения
42. Подготовка к лабораторному обследованию
Основные требования подготовки пациента кпроцедуре сдачи крови:
• Кровь для большинства лабораторных
исследований берется строго натощак.
• Период между последним приемом пищи и
взятием крови должен составлять не менее 8
ч (желательно - не менее 12 ч). Необходимо
помнить, что сок, чай, кофе, тем более с
сахаром - тоже еда. Можно пить воду.
• Перед сдачей крови нужно исключить
физическое напряжение (бег, подъем по
лестнице), эмоциональное возбуждение.
• Перед процедурой следует отдохнуть 10-15
минут, успокоиться, что наиболее вероятно
выполнить при заборе крови на дому.
43. Подготовка к лабораторному обследованию
• При проведении биохимических исследований кровиза 1-2 дня до обследования желательно исключить
из рациона жирное, жареное и алкоголь. Если
накануне состоялось застолье лучше перенести
лабораторное исследование на 1-2 дня. За час до
взятия крови лучше воздержаться от курения.
• Перед сдачей клинического анализа крови,
последний прием пищи должен быть не ранее, чем за
3 часа до сдачи крови. Кроме того, кровь для
выполнения клинического анализа необходимо
сдавать с утра, т.к. существуют естественные
дневные циклы колебания уровня гематологических
показателей. К примеру, при сдаче крови во второй
половине могут быть диагностирован ложный
лейкоцитоз, т.к. количество данных клеток крови к
вечеру увеличивается.
44. Подготовка к лабораторному обследованию
• Содержание многих ферментов и гормонов вкрови подвержено суточным колебаниям,
поэтому кровь следует сдавать строго в
определенное время суток. Желательно до
10 часов утра.
• Для оценки динамики показателей кровь
лучше сдавать в одно и то же время суток.
• В случае постоянного приема каких-либо
лекарств необходимо перед забором крови
обязательно предупредить об этом врача и
процедурную медсестру, т.к. ряд
лекарственных средств оказывает влияние
на некоторые биохимические показатели
крови, гормоны, состав мочи.
45. Подготовка к лабораторному обследованию
• Не рекомендуется сдавать кровь на анализыпосле рентгенологического, ультразвукового
исследования, массажа, рефлексотерапии
или физиотерапевтических процедур.
• При сдаче крови на половые гормоны
женщинами репродуктивного возраста
обязательно нужно указывать фазу
менструального цикла.
• Перед сдачей крови на такие гормоны как
АКТГ и кортизол необходимо успокоиться и
расслабиться, при заборе крови на дому
лучше полежать, так как любое напряжение
вызывает увеличение уровней данных
гормонов в крови.
46. Биохимические исследования
• Биохимическое исследование крови на сегодняшнийдень - это наиболее популярный метод
лабораторной диагностики общего состояния
организма. Он используется практически во всех
областях медицины и позволяет получать наиболее
достоверные данные обо всех сложнейших
внутриорганных биохимических процессах. С его
помощью стало возможным не только определение
самих нарушений, но и многих причин их
возникновения, таких как изменение гормонального
фона или недостаток необходимых микроэлементов.
• Таким образом, обнаружение на ранних стадиях
таких тяжелых заболеваний, как сахарный диабет,
анемия, злокачественные заболевания костного
мозга, почек и других органов, может снизить риск
прогрессирования болезни или остановить ее
развитие.
47. Биохимические исследования
• Перед биохимическим исследованием крови• Дело в том, что некоторые лекарственные препараты и
процедуры могут значительно повлиять на результаты
анализа, и, если этого не учитывать, вполне возможно,
что исследование крови придется проводить повторно.
• Существуют, конечно, общие правила, и они вполне
применимы в большинстве случаев.
• Свериться с рекомендациями той лаборатории, где Вы
решили сдать анализ крови. Безусловно, исполнитель самое заинтересованное лицо, и ему важно, чтобы от
забора крови до получения результата, пациент все
инструкции выполнил максимально четко, и никаких
проблем не возникло.
48.
Биохимические исследованияПодготовка к сдаче биохимического анализа
крови
• На точность и достоверность результатов
анализа влияет, правильной ли была
подготовка к биохимическому анализу крови, и
соблюдали ли Вы рекомендации врача.
• Врачи советуют делать биохимический анализ
крови в утренние часы и СТРОГО натощак.
• Перед забором крови на анализ не
рекомендуется не только не есть, но и не пить,
не жевать жвачку и т.д.
49. Биохимические исследования
Метод забора материалаДля проведения биохимического
анализа
крови врач берет у пациента 5 - 6
мл крови из локтевой вены.
В исследуемом материале - крови
человека – определяют
показатели биохимического
анализа крови - т.е. основные
компоненты крови.
Полученные результаты вносятся
в бланк биохимического анализа
крови, и по ним врач может
оценить состояние здоровья.
50. Биохимические исследования
• Существуют определенныенормы биохимического
анализа крови - т.е. то
количество показателей,
которое должно
присутствовать в крови
человека определенного
возраста и пола.
• Это статистически
установленные показатели
здоровых людей. Отклонение
от этих показателей - симптом
разнообразных нарушений в
деятельности организма, сбой
в работе определенных
органов или систем.
51. Гематологические исследования
• Система заборакапилярной крови с КЗ
ЭДТА (для
гематологических
исследований)
Системы предназначены для
взятия, транспортировки и
последующего исследования
образцов капиллярной крови у
младенцев, детей, пожилых людей
и пациентов, находящихся в
критическом состоянии, у которых
взятие венозной крови сопряжено
с определенными трудностями.
Работа с системами для взятия
капиллярной крови EKF Diagnostic
крайне проста и необычайно
удобна.
Система состоит из пластиковых
пробирки и капилляра end-to-end с
точным объемом заполнения.
52. Гематологические исследования
• Взятие крови производится вгоризонтальном положении,
заполнение происходит под действием
капиллярного эффекта. В большинстве
случаев не требуется дополнительное
выдавливание крови из пальца, что
позволяет не вызывать боли и
неприятных ощущений у пациента.
• После заполнения капилляра пробирка
переворачивается в вертикальное
положение, кровь под собственным
весом полностью стекает в пробирку.
• После этого капилляр удаляется и
пробирка закрывается крышкой.
53. Гематологические исследования
• Пробирка помещается в миксер или производитсяручное встряхивание. Нанесенный на стенки
пробирки антикоагулянт равномерно
перемешивается с пробой.
• В системах взятия капиллярной крови EKF
Diagnostic для гематологии применяется
антикоагулянт в K3 EDTA (Ethylene Diamine
Tetraacetic Acid) виде порошка, напыленного на
стенки пробирки.
• В отличии от аналогичных систем других
производителей, применяющих жидкие
антикоагулянты, данный метод не приводит к
дополнительному неучтенному разведению крови
жидким антикоагулянтом, что исключает получение
неверных результатов анализа пробы.
54. Исследование системы гемостаза
• Кровь берут утромнатощак путём пункции
локтевой вены сухой
острой иглой с широким
просветом без шприца.
• Допускается создание
кратковременного
венозного стаза.
• Первые капли крови
выпускают на ватный
тампон, так как они могут
содержать тканевый
тромбопластин.
55. Исследование системы гемостаза
• Кровь для исследования забираютиз локтевой вены в пластиковую или
силиконированную пробирку,
содержащую 3,8%-й раствор натрия
лимоннокислого 3-х замещенного
(цитрата натрия), соотношение
* объемов крови и цитрата натрия –
9:1.
• Пробирку закрывают плотно
прилегающей пробкой и сразу
несколько раз плавными
движениями переворачивают для
перемешивания крови с
антикоагулянтом.
• Доставляют в лабораторию для
немедленного исследования.
56. Исследование системы гемостаза
• Кровь центрифугируют при 1000 об/мин (240 g) втечение 7 мин. Богатую тромбоцитами плазму
переносят в другую пробирку и повторно
центрифугируют при 3000 об/мин (1200 g) в
течение 15 мин.
• Допускается для получения бедной тромбоцитами
плазмы однократное центрифугирование крови
при 3000–4000 об/мин (1200 g) в течение 15 мин.
• Центрифугирование должно проводиться
непосредственно после взятия крови, а отбор
плазмы на исследование – сразу же после
центрифугирования.
• Не допускается анализ плазмы крови, имеющей
сгустки, гемолиз и полученной более 2 ч назад, а
также замороженной плазмы крови.
57. Исследование системы гемостаза
• Первым этапом, который осуществляетсянепосредственно в лаборатории, является
пробоподготовка.
• Основной ошибкой при центрифугировании
является применение в протоколах
пробоподготовки показателя скорости вращения
центрифуги вместо относительной
центрифужной силы, которая расчитывается по
формуле ОЦС = 1.118 x радиус (об/мин/1000)² и
зависит от радиуса используемой центрифуги.
• Таким образом, при стандартизации
преаналитического этапа следует не только
исключить ошибки, но и соблюдать ряд общих
требований:
58. Требования
• Требования к стандартизации идентификациипроб: наличие этикетки на каждой пробирке с
биоматериалом и применение лабораторной
информационной системы для идентификации проб.
Наличие ЛИС – лабораторной информационной
системы - позволяет выявить и проанализировать
ошибки преаналитического этапа и принять меры для
их устранения.
• Проведение регулярного мониторинга
преаналитического этапа для выявления неверных
действий и своевременной корректировки работы
персонала.
• Применение современных систем взятия материала,
имеющих все необходимые сертификаты качества и
использование их в строгом соответствии с
инструкциями производителей.
• Обеспечение безопасности персонала и удобства
применения систем взятия биоматериала.
59. Цитологические исследования
• Результат исследования напрямуюзависит от техники забора
материала для исследования.
• У женщин рекомендуется проводить
забор материала с поверхности
вульвы, влагалища, шейки матки
при помощи шпателя, ложечки
Фолькмана или универсального
пластикового зонда.
• Чтобы получить соскоб эпителия из
цервикального канала, существует
множество цервикальных щеток.
• Также существуют зонды, при
помощи которых можно
одновременно получить соскоб как
из эндоцервикса, так и из
экзоцервикса.
60.
Цитологические исследования• В качестве инструмента для взятия
материала из шейки матки при
профилактическом осмотре женщин
используются модифицированные
шпатели типа Эйра или щетки
Cervix-Brash, Papette. С
диагностической целью материал
получают раздельно шпателями из
эктоцервикса, щетками типа
Cytobrash из эндоцервикса.
• Материал для цитологической
диагностики получают различными
способами: аспирацией и соскобом
содержимого заднего свода
влагалища, шейки матки или
получением мазка-отпечатка.
61. Правила забора материала для цитологического исследования из шейки матки с помощью щетки «цервикс-браш»
Промаркировать предметные
стекла, написав на его крае №
исследования (или ФИО
пациентки).
С помощью зеркала обнажить
шейку матки.
Убрать слизистую пробку.
Ввести щеточку в цервикальный
канал. Под влиянием легкого
нажима щетинки принимают
форму шейки матки.
Удерживая ручку большим и
указательным пальцами и слегка
нажимая на нее, повернуть ее
дважды по направлению часовой
стрелки и дважды против
часовой стрелки.
62. Правила забора материала для цитологического исследования из шейки матки с помощью щетки «цервикс-браш»
• Сделать мазок сначала однойповерхностью щеточки на первом
предметом стекле, затем перевернув
щеточку – другой поверхностью на
втором предметном стекле. Мазок
делается легким рисующим движением
вдоль предметного стекла.
• Подсушить мазки при комнатной
температуре.
• Поместить мазки в индивидуальный,
промаркированный контейнер.
63.
Цитологические исследования• Полученный биологический материал
наносится тонким слоем на предметное
стекло и подсушивается на воздухе.
Стекло обязательно маркируется с
указанием не только фамилии/ кода, но и
места забора клеточного материала
(шейка матки, цервикальный канал).
• Маркировка на предметном стекле и в
направлении на цитологическое
исследование должны соответствовать
друг другу.
64. Правила забора материала для цитологического исследования из шейки матки
• Тщательно заполнить направление нацитологическое исследование - обязательно
указать
• ФИО;
• дату, месяц и год рождения;
• клинический диагноз;
• дату последних месячных;
• день цикла;
• данные акушерско-гинекологического анамнеза;
• результаты проводимых ранее цитологических и
гистологических исследований,
• данные о сопутствующих заболеваниях.
65. Цитологические исследования
• В направлении на исследование должныбыть отражены следующие данные:
• 1. Ф. И. О., возраст, профессия.
• 2. Возраст начала месячных, количество
абортов и родов.
• 3. Жалобы больной.
• 4. Характер менструального цикла и дата
последнего.
• 5. Применяемые противозачаточные
средства.
• 6. Дата исследования.
66. Цитологические исследования
• Исследование стоит проводить после исключениялюбых воспалительных процессов.
• Вначале марлевым тампоном удаляется слизь,
вагинальные выделения, после чего происходит
забор материала.
• Исследование можно выполнять в любой день
цикла за исключением периовуляторного периода и
менструации.
• Кроме того, цитологическое исследование нужно
проводить не ранее чем через 2-ое суток после
последнего полового акта, во время лечения
инфекционно-воспалительных заболеваний
(особенно если используются различные
антисептики, вагинальные свечи и кремы,
спермициды),
• а также не ранее 48 часов после проведения
кольпоскопии, во время которой применялись
растворы укуса и Люголя.
67.
Цитологические исследования• Техника приготовления вагинальных мазков
1. Материал для исследования нужно брать из
верхне-бокового свода влагалища.
2. Материал наносится на стекла и размазывается.
3. Перед окраской мазок должен быть подсушен или
зафиксирован в жидкости Никифорова.
4. Подсчет клеточных элементов должен
подсчитываться в нескольких полях зрения
мазка.
• Одной из наиболее информативных является
окраска препаратов по Папаниколау.
68. Цитологические исследования
• Материал наносится на предметное стеклоровным слоем, после чего происходит их
фиксация, например, смесью Никифорова.
• Окраска выполняется по Папаниколау.
• Исследование цитологических мазков,
окрашенных таким образом, считается
эталонным и получило название Pap-smear
test.
• Правильно выполненный забор материала
приводит к тому, что в исследуемом образце
должно быть не менее 8000 – 15000 клеток.
69. Цитологические исследования
• Материал для исследования:В направлении на цитологическое
исследование биологического
материала обязательно указываются
клинические данные, диагноз,
особенности и место получения
материала, данные о менструальном
цикле.
• Мазки берутся до бимануального
исследования и кольпоскопии.
• Используемые инструменты должны
быть стерильными и сухими, поскольку
вода и дезинфицирующие растворы
разрушают клеточные элементы.
• При профилактическом осмотре
(цитологический скрининг) женщин
клеточный материал целесообразно
получать с поверхности влагалищной
части шейки матки (эктоцервикса) и
стенок цервикального канала
(эндоцервикса), при наличии
патологических изменений шейки матки
прицельно.
70. Цитологические исследования
• Цитологические исследования в гинекологиизанимают особое место. Разработана целая
система цитологического анализа, позволяющая
установить ряд весьма ценных показателей:
гормональный статус, степень чистоты и характер
флоры, наличие инфицирования трихомонадами,
гарднереллами, хламидиями и, что весьма важно,
возможность диагностирования предопухолевых и
опухолевых поражений.
• Правильная оценка цитологических данных в этих
случаях зависит от правильной техники
приготовления вагинальных мазков, в оценке
которых необходимо придерживаться
определенных структуpных наименований и
классификации в соответствии с современными
данными.
71. Цитологические исследования
Особенности строения слизистой оболочки женского половоготракта:
1. Слизистая оболочка влагалищной части матки выстлана
многослойным плоским эпителием, состоящим из базального,
парабазального, промежуточного и функционального
(поверхностного) слоев.
2. Слизистая оболочка цервикального канала покрыта высоким
призматическим эпителием с базальным распространением
ядер, цитоплазма клеток содержит слизь. Под призматическим
эпителием нередко обнаруживаются резервные (камбиальные)
клеточные элементы. Два вида эпителия: многослойный,
плоский и призматический имеют стык в области наружного
маточного зева.
3. Многослойный плоский эпителий влагалищной части меняется
от фаз овариально-менструального цикла; в климактерическом
периоде в менопаузе наблюдается его атрофия.
• Все эти изменения эпителия в зависимости от фаз овариальноменструального цикла отражаются и на цитограммах.
72. Цитологические исследования
• В мазках клетки функционального слоя имеют полигональную,реже округлую или овальную форму с четкими границами.
Диаметр их от 40 до 50 мкм. Ядра маленькие, пикнотичные,
интенсивно окрашены, диаметром до 6 мкм. Структура хроматина
не определяется. Ядерно-цитоплазматическое соотношение
равно 1:10. Цитоплазма широкая, светлая, содержит зерна
гликогена. Клетки функционального слоя в мазках располагаются
в виде пластов и полей. Наличие их в большом количестве в
мазках является отражением эстрогенной активности.
• Клетки промежуточного слоя многослойного плоского эпителия
меньше по размерам клеток функционального слоя. Диаметр их
25—30 мкм. Ядра пузырьковидные, округлые или овальные с
хорошо выраженным тонко петлистым хроматином. Цитоплазма
базофильна, содержит гликоген.
• Появление значительного числа промежуточных клеток в мазках
отмечается в начале фолликулиновой и во время лютеиновой
фаз, в послеродовом периоде, менопаузе, являясь отражением
недостаточности эстрогенных гормонов.
73. Цитологические исследования
• Парабазальные клетки в мазках имеют округлую, овальную,иногда полигональную форму с четкими границами. Размеры
их разные и колеблются в пределах 12—30 мкм. Ядра как и в
клетках промежуточного слоя с нежным тонкопетлистым или
мелкозернистым хроматином, иногда видно ядрышко.
Цитоплазма резко базофильна, гликоген выявляется не всегда.
Парабазальные клетки могут обнаруживаться в мазках из
влагалища во время менструации в период менопаузы.
• Базальные клетки многослойного плоского эпителия мелкие,
ядерно-цитоплазматическое, соотношение равно 1:3. Ядра
округлые, хроматин мелкозернистый, содержит 1—2 ядрышка.
Цитоплазма в виде узкого ободка, резко базофильная, гликоген
в клетках не содержится. В мазках здоровых женщин
базальные клетки появляются только в период менопаузы.
• Появление в мазках в значительном числе парабазальных и
базальных клеток говорит о каком-либо патологическом
процессе со стороны шейки матки.
74. Цитологические исследования
• В мазках из влагалища наряду сэпителиальными клетками могут быть и
другие элементы, в частности, эритроциты,
лейкоциты. Особенно много лейкоцитов
выявляется после менструации. Они могут
появляться у женщин в период менопаузы.
• В мазках на стадии менструации нередко
обнаруживаются гистиоциты.
• Эпителиальные клетки слизистой оболочки
цервикального канала разной величины
расположены изолированно или в виде групп,
железистоподобных структур, форма
призматическая, ядра овальной или округлой
формы, хроматин нежный мелкодисперсный,
цитоплазма слабо-базофильная, в
апикальной части содержатся зерна слизь.
75. Цитологические исследования
• Наряду с секреторным призматическим эпителиемвстречаются реснички хорошо выраженные на
апикальной поверхности.
• В ряде случаев эпителиальные клетки в мазках
располагаются не вдоль продольной оси тела
клетки, а поперечно, клетки при этом выглядят
округлыми или полигональными с центральным
расположением ядра.
• В мазках могут обнаруживаться и резервные
клетки призматического эпителия. Резервные
клетки округлой формы, скудной бледноокрашивающейся цитоплазмой и круглым,
занимающим почти всю цитоплазму ядром.
Хроматин ядра плохо различим.
76. Цитологические исследования
• При исследовании мазков, взятых у женщин присекреторной фазе цикла, во время беременности
и при дисгормональных изменениях возможно
обнаружение метаплазированного многослойного
плоского эпителия.
• Клеточные элементы похожи на клетки
многослойного плоского эпителия, но
цитоплазма их содержит либо слизь, либо и
гликоген и слизь.
• При беременности в мазках наряду с подобного
рода эпителиальными элементами отмечаются
нередко и децидуальные клетки.
77.
Исследование мочиБиохимическое исследование мочи
• Еще одним важным показателем изменений, происходящих в
организме человека, является биохимическое исследование
мочи.
• В отличие от биохимического анализа крови, это несложный
метод исследования, при помощи которого становится
возможным оценить правильность функционирования почек и
других внутренних органов, а также выявить на ранних стадиях
воспалительный процесс в мочеполовых путях.
• Рассматривая такие показатели, как наличие белка, изменение
цвета и степени прозрачности жидкости, можно определить
наличие у человека мочекаменной болезни, сахарного диабета
и даже гепатита.
• Однако даже такой простой, казалось бы, субстрат, как моча,
требует некоторой деликатности при сборе, хранении и,
главное, четкого определения временного промежутка, за
который требуется собрать пробу.
78. Стандартные правила забора мочи
• При плановом назначении лабораторноготеста с исследованием мочи материал
следует собирать из утренней порции.
• Перед сбором мочи обязательны
гигиенические процедуры - тщательное, с
мылом подмывание, чтобы в мочу не
попали бактерии сальных и потовых
желез.
• Для общего анализа мочи собирают строго
утреннюю порцию мочи, выделенную
сразу же после сна.
• Для бактериологического исследования в
стерильную посуду утром собирают
среднюю порцию свободно выпущенной
мочи в количестве 3-5 мл.
79. Стандартные правила забора мочи
• Для биохимического анализа мочи должен бытьчетко соблюден 24-часовой период сбора мочи.
• Первая утренняя порция мочи удаляется.
• Все последующие порции мочи, выделенные в
течение дня, ночи и утренняя порция следующего
дня собираются в одну емкость, которая хранится в
холодильнике (+4°С - +8°С ) в течение всего времени
сбора (это необходимое условие, так как при
комнатной температуре существенно снижается
содержание глюкозы).
• После завершения сбора мочи содержимое емкости
точно измерить, обязательно перемешать и сразу же
отлить в контейнер 5-10 мл для исследования.
• На направительном бланке обязательно указывают
суточный объем мочи (диурез) в миллилитрах, рост
и вес пациента.
80.
• Расходные материалы для забора мочи:• Забор мочи лучше осуществлять в одноразовый
контейнер во избежание контаминации пробы и
получения ложных результатов. Контейнер для
забора должен быть четко маркирован.
• Запрещается! брать мочу из судна, утки или
горшка, так как на стенках этих сосудов может
сохраняться осадок моющих веществ,
способствующих разложению свежей мочи.
• Хранение и транспортировка образцов мочи
• Собранную мочу как можно быстрее доставляют в
лабораторию. Длительное хранение мочи при
комнатной температуре приводит
• к изменению физических свойств,
• разрушению клеток и
• размножению бактерий.
81.
• Моча, собранная для общего анализа, можетхраниться не более 1,5 — 2 ч (обязательно в
прохладном месте). Наиболее приемлемый
способ сохранения мочи — охлаждение
(можно хранить в холодильнике, но не в
морозилке). При охлаждении не
разрушаются форменные элементы, но
возможно влияние на результаты
определения относительной плотности.
• Мочу для бактериологического
исследования необходимо доставлять в
лабораторию в течение 2 часов при
комнатной температуре или допускается
хранить в холодильнике (не в морозилке) в
течение 1 суток.
82. Правила забора материала на бактериологические исследования
• В последние годы клиническая микробиологиякак составная часть клинической лабораторной
диагностики является наиболее динамично
развивающейся областью медицины.
• Достижения медицинской науки и создание
соответствующей индустрии позволяют
реализовать стратегию, направленную на
своевременное получение диагностической
информации об инфекционном процессе в
организме для целенаправленного воздействия
на его течение.
83. Правила забора материала на бактериологические исследования
• Рекомендации по созданиюстандартной системы, направленные
на максимальное сохранение
образцов различных биоматериалов
с момента составления заявки на
исследование до доставки пробы в
микробиологическую лабораторию,
и улучшение качества исследований.
84. Используемые термины и понятия
• Биоматериал (биологический материал) илипросто «материал» — любые типы проб
биологического происхождения (имеющие
непосредственное отношение к организму
человека) полученные прижизненно или при
вскрытии, а также материал, полученный при
контроле санитарно-гигиенического состояния
внешней среды.
• Проба биологического материала или просто
проба — разными способами отобранный
биологический материал, качество и количество
которого позволяет использовать его для
микробиологического исследования.
85. Используемые термины и понятия
• Контейнер —емкость, специально
предназначенная для
отбора и безопасной
транспортировки
биологического
материала, удобно и
герметично
закрывающаяся
86. Используемые термины и понятия
• Транспортная система со средой —представляет собой стерильную
пластиковую пробирку с
агаризованной или жидкой
транспортной средой, закрытую
герметично пробкой. Помимо
пробирки со средой в систему
входит зонд-тампон,
вмонтированный в пробку.
Пробирка имеет бумажную этикетку
для маркировки пробы, которая
одно временно служит контролем
вскрытия пробирки со средой.
Пробирка со средой и зонд-тампон с
пробкой стерильно упакованы в
блистер из ламинированной бумаги
и полиэтилена.
87. Транспортные системы
• В зависимости от транспортной среды, системы бываютуниверсальные для аэробов (среды Стюарт и Эймс или
Амиес),
• для анаэробов и фекальной флоры (среда Кери Блейр) и
• со специальными средами для вирусов или хламидий
88.
Транспортные системыТранспортные системы с
агаризованной средой
Погружение пробы в
транспортную среду системы
89. Используемые термины и понятия
• Зонд-тампон — средствовзятия пробы
биологического материала,
состоящее из оси,
изготовленной из дерева,
пластика или металла и
накрученной на нее
головки из волокнистого
материала природного
происхождения (хлопок),
полусинтетического
(вискоза) или
синтетического (дакрон).
• Выбор материала оси и
тампона зависит от
особенностей объекта
микробиологического
исследования
90. Используемые термины и понятия
• Тубсер (тупфер) — средство взятия пробыбиологического матери ала, представляющее
собой сухую стерильную пробирку с пробкой, в
которую вмонтирован зонд-тампон.
91. Используемые термины и понятия
• Целлюлозная пробка — этопромышленноизготовленна
я газопроницаемая пробка,
используемая вместо ватномарлевых тампонов для
стерильного хранения сред
или культивирования
аэробной флоры.
• Подлежит многократной (не
менее 50 раз) стерилизации
в сухожаровом шкафу или в
автоклаве.
92. Используемые термины и понятия
• Стерильная одноразовая пробирка(емкость) — пробирка (емкость) из
пластика или стекла стерильная «по
производству» или стерилизованная
в лаборатории с герметичной или
газопроницаемой пробкой,
подлежащая обязательной
утилизации после контакта с
биологическим материалом
93.
Стерильные пробиркиПробирки стерильные с
завинчивающимися крышками на
разный объем
94.
•Мазок — биологический материал (жидкийили полужидкий), нанесенный тонким и, повозможности, равномерным слоем на
предметное стекло и
предназначенный для микроскопического
исследования.
95. Используемые термины и понятия
Вакуумная пробирка (система) —
представляет собой максимально
безопасную закрытую систему для
взятия проб венозной крови. В нее
входит одноразовая стерильная
пробирка, в которой создано
дозированное разряжение (вакуум)
герметично укупоренная пробкой из
силиконовой резины.
При помощи двусторонней иглы и
держателя при пунктировании
кровеносного сосуда или иной
полости, заполненной жидким
содержимым, в пробирку за счет
разряжения аспирируется заданный
объем крови (или другой
биологической жидкости).
Во время аспирации и после нее
разгерметизации системы не
происходит, и проба постоянно
остается изолированной от
окружающей среды. Взаимная
контаминация пробы и среды
исключена.
96. Используемые термины и понятия
• Международный стандарт безопасности СЕ classIIA — наличие Марки СЕ означает, что
производственные технологии и организация
производства находятся под строгим и
постоянным внутренним и внешним контролем.
• Марка СЕ Класс безопасности IIА, присваивается
стерильным инвазивным хирургическим
инструментам, предназначенным для работы в
открытом операционном поле. Их высокая
безопасность обеспечена тем, что они
производятся из не токсичных материалов в
помещении, свободном от частиц на 99,9% с
последующей стерилизацией, под строжайшим
внутренним и внешним контролем.
97.
98. Сбор и транспортировка проб для бактериологического исследования
Общие положения• Взятие материала предпочтительно проводить до
начала антибактериальной терапии. На фоне
антибактериальной терапии материал забирают
перед очередным приемом (введением)
антимикробных препаратов, то есть в момент,
когда их концентрация в организме минимальна.
• При взятии пробы следует строго соблюдать
правила асепти ки, во избежание ее случайной
посторонней контаминации.
• для взятия проб следует использовать
стерильные инструменты, а для их
транспортировки стерильные пробирки или
контейнеры.
99. Сбор и транспортировка проб для бактериологического исследования
• Использование нестерильных сухих,чистых пробирок допускается только для
отбора и транспортировки крови на
серологические исследования.
• Количество материала должно быть
достаточным для проведения
исследования.
• Транспортировка материала должна
осуществляться в максимально короткие
сроки: как правило, не более 1,5 — 2
часов.
100. Сбор и транспортировка проб для бактериологического исследования
• Всегда следует стремиться использоватьтранспортные системы со средой (консерванты),
что позволяет пролонгировать время
транспортировки до 24 часов и более или
осуществлять посев непосредственно у постели
больного (кровь, ликвор и др.);
• Материал для исследования на неспорообразующие
анаэробы, доставляемый без использования
транспортных систем со средой (консервантов)
должен транспортироваться:
-в специальном герметично закрытом флаконе,
заполненном инертным газом, в который проба
вносится путем прокола крышки иглой шприца;
-в одноразовом шприце, из которого удален воздух,
и кончик которого закрыт либо стерильной
резиновой пробкой, либо иглой, с надетым на нее
штатным защитным колпачком.
101. Сбор и транспортировка проб для бактериологического исследования
Все образцы должны иметь четкую маркировку,
обеспечива ющую их безошибочную
идентификацию. К каждому образцу
прикладывается направление, в котором
указывается
наименование лечебного учреждения,
Ф.И.О., возраст больного,
вид и цель исследования,
Ф.И.О. врача направившего материал,
дата и время получения материала и другая
информация необходимая для получения
адекватного результата и его правильной
интерпретации.
102. Стандартные правила забора, хранения и транспортировки кала
*• Кал для исследования собирают в
чистую, сухую, широкогорлую
посуду, желательно одноразовый
контейнер, снабженный мерной
ложечкой.
• Не рекомендуется использовать
баночки и флаконы с узким горлом,
особенно из под лекарственных
препаратов, спичечные коробки и
т.д.).
• Необходимо избегать примеси к калу
мочи и выделений из половых
органов.
103. Стандартные правила забора, хранения и транспортировки кала
• Для выявления паразитов проба должнабыть немедленно доставлена в
лабораторию, т.к. вегетативные формы
паразитов можно обнаружить только в
свежих образцах кала при температуре
тела хозяина.
• Цисты паразитов стабильны.
• Для сохранения паразитов в образцах
кала можно использовать растворы
мертиолят-йод-формалин и ацетат натрияформалин.
104. Правила сбора кала на бактериологические исследования
• При сборе кала для диагностики дисбактериоза илиисследования на условно-патогенную флору
используют тщательно вымытые и лишенные
следов дезинфицирующих средств судна или
горшки.
• На дно судна, для защиты материала от следов
дезинфектанта можно поместить лист чистой
бумаги.
• Пробу испражнений отбирают сразу после
дефекации с помощью стерильной мерной ложечки.
Две мерных ложечки испражнений положить в
стерильный контейнер. Проба должна быть
доставлена в лабораторию в течение 2 часов.
Консерванты применять запрещается.
105. Правила сбора кала на бактериологические исследования
• Для выявления бактерий дизентерийной итифопаратифозной группы забор материала
осуществляется средним медицинским персоналом
из прямой кишки с помощью ректальных тампонов
(петель).
• Пациента просят лечь на бок с притянутыми к
животу бедрами и ладонями развести ягодицы.
• Петля (тампон) вводится в задний проход на глубину
5-6 см.
• Материал необходимо брать сразу в транспортную
питательную среду (Кэри-Блейр), в этом случае
проба может храниться до доставки в лабораторию
в течение суток при комнатной температуре.
106. Правила забора материала на бактериологические исследования
• Отделяемое верхних дыхательных путей забирают износовых ходов с помощью стерильного тампона,
• а из зева – с помощью увлажненного стерильного
ватного тампона.
• Мазки из носа и глотки берут разными тампонами.
• Материал из глотки и с миндалин следует забирать
натощак или не ранее чем через 3-4 часа после еды.
При взятии мазков с задней стенки глотки и миндалин
нельзя касаться тампоном языка, слизистой щек,
язычка, зубов.
• Если есть налеты, материал забирают с границы
пораженных и здоровых тканей, слегка нажимая на
них тампоном.
• При антибиотикотерапии исследование проводят не
ранее чем через 3 дня после отмены препарата.
107. Правила забора материала на бактериологические исследования
• Пробы должны бытьдоставлены в
лабораторию в
течение 2-3 часов.
• Однако при заборе
материала в
универсальную
транспортную среду
(среда Эймса, среда
Эймса с углем) его
можно хранить сутки
при комнатной
температуре.
108.
Правила забора материала набактериологические исследования
Транспортные системы со средами
Эймс, Стюарт, Кери Блейр,
тампоны стерильные в пробирке
109. Правила забора материала на бактериологические исследования
• Забор отделяемого глазаосуществляется врачомокулистом после проведения
местного обезболивания.
• Для забора материала
используют стерильный
ватный тампон.
• Пробу доставляют в
лабораторию в течение 2-3
часов.
• При взятии материала в
универсальную
транспортную среду (среда
Эймса, среда Эймса с углем)
его можно хранить сутки при
комнатной температуре.
110. Правила забора материала на бактериологические исследования
• Перед взятием отделяемого изполовых органов у мужчин
необходимо обмыть головку
полового члена теплой водой или
изотоническим раствором с
помощью ватного тампона и
удалить свободно стекающие
выделения.
• Материал для микроскопического
исследования забирают при
помощи бактериологической петли,
желобоватого зонда, маленькой
ложечки Фолькмана и т.д.
• В лабораторию должны быть
направлены минимум 2 мазка от
одного пациента.
• Материал для бактериологического
исследования забирают с помощью
одноразовых тампонов на
металлическом аппликаторе.
111. Правила забора материала на бактериологические исследования
• Взятие отделяемого половыхорганов у женщин проводит
акушер-гинеколог. Из вульвы и
преддверия влагалища материал
забирают стерильным ватным
тампоном.
• При воспалении бартолиниевых
желез проводят их пункцию.
• Материал из влагалища получают
до проведения мануального
исследования. После введения
зеркал и подъемника с помощью
ватного тампона берут мазки с
заднего свода или с участков
слизистой с видимыми
патологическими изменениями.
112. Правила забора материала на бактериологические исследования
• Материал из цервикальногоканала забирают тонким ватным
цервикальным тампоном после
тщательной обработки шейки
матки другим тампоном,
смоченным стерильным
физиологическим раствором или
стерильной водой. При этом
нельзя касаться цервикальным
тампоном стенок влагалища.
• Пробы доставляют в
лабораторию в течение 2-3 часов.
При взятии материала в
универсальную транспортную
среду (среда Эймса, среда Эймса
с углем) его можно хранить сутки
при комнатной температуре.
113. Значимость различных методов исследования
• Исследования методом ПЦР ибактериологические исследования –
их место в современной диагностике
• В таблице представлены
современное представление о
достоинствах и недостатках
различных методов лабораторной
диагностики заболеваний,
передающихся половым путем
114.
Характеристикаметода
Методы ПИФ
Бактериологический
метод
Методы ИФА
ПЦР
Исследуемый
материал
Любой
Большинство
Сыворотка крови
Любой
Значение правильно
взятых проб
Решающее
Решающее
Решающее
Решающее
Условия
транспортировки
проб
Если препарат
фиксирован–
условия не важны
Быстрая доставка
или хранение при
низкой температуре
Не имеет значения
Быстрая доставка
или хранение при
низкой температуре
Условия хранения
•на короткое время
•длительно
при +4 °С 3-5 суток
при +4°С
при -20 ° С
Быстрая доставка
или хранение при
низкой температуре
+4 °С 1-2 суток,
-20 °С 2 недели,
длительно - в
жидком азоте
Время выполнения
30 минут
72 часа
3 часа
4,5-5 часов
Зависимость
результатов от;
Опыта врача,
Селективности
среды и/или
чувствительности
клеточной культуры
Чувствительности и
специфичности тестсистемы
Хорошего контроля и
отсутствия
контаминации
Способность к
поддержанию
штамма
Нет
Да
Нет
Нет
метод выбора
терапии
Нет
Да
Нет
Нет
контроль лечения
Ограничено
Рекомендуется
Ограничено
Рекомендуется с
ограничениями
115. Правила биологической безопасности
• К работе по взятию и транспортировкебиологического мате риала допускается
только медицинский персонал,
прошедший специальный инструктаж по
технике работы и мерам безопасности.
• При взятии биологического материала
должны использовать ся средства
защиты: медицинские халаты, шапочки,
сменная обувь, резиновые (латексные,
виниловые) перчатки, а при
необходимости — дополнительно
марлевые маски (респираторы), очки,
клеенчатые фартуки.
116. Правила биологической безопасности
• Работать с исследуемым материалом следует врезиновых (латексных, виниловых) перчатках,
все повреждения кожи на руках должны быть
закрыты лейкопластырем или напальчником.
Следует избегать уколов и порезов.
• В случае загрязнения кожных покровов кровью
или другими биологическими жидкостями
следует немедленно обработать их в течение 2
мин. тампоном, обильно смоченным 70%
спиртом, вымыть под проточной водой с мылом
и вытереть индивидуальным тампоном. При
загрязнении перчаток кровью их протирают
тампоном, смоченным 3% раствором хлорамина,
6% раствором перекиси водорода.
117. Правила биологической безопасности
• При подозрении на попадание крови на слизистыеоболочки, их немедленно обрабатывают струей
воды, 1% раствором протаргола; рот и горло
прополаскивают 70% спиртом или 1% раствором
борной кислоты или 0,05% раствором перманганата
калия.
• для транспортировки образцов следует
использовать преимущественно пластиковую
одноразовую тару, герметично закрытую
пластмассовыми, резиновыми пробками или
завинчивающимися крышками. Запрещается
использовать стеклянную посуду со сколами,
трещинами и т.п. При транспортировке со судов,
закрытых целлюлозными (ватными) пробками,
следует исключить их увлажнение.
118. Правила биологической безопасности
Термосумки• Транспортировка биоматериала
осуществляется в специальных
закрытых переносках (укладках),
желательно —
термостатированных,
выдерживающих дезинфекцию
• Сопроводительная документация
помещается в предназначен ный
для нее карман переноски
(укладки), а в случае его
отсутствия — кладется в
переноску в отдельном
полиэтиленовом па кете.
• При хранении биологического
материала в холодильнике
каждый образец упаковывается в
отдельный полиэтиленовый па
кет. Для этой цели выделяется
отдельный холодильник,
хранение в котором пищевых
продуктов и лекарственных
препаратов не допустимо.
119. Требования к доставке проб биоматериала в лабораторию
Все собранные пробы отправляют в микробиологическую
лабораторию немедленно после получения, за исключением
случаев использования емкостей с транспортными средами,
разрешенными к применению для этих целей в Российской
Федерации в установленном порядке.
Это необходимо для:
сохранения жизнеспособности возбудителей и возможности
выделения микроорганизмов, требующих особых условий куль
тивирования (Haemophylus и др.);
предотвращения избыточного роста быстрорастущих и активных
микроорганизмов;
поддержания соотношения исходных концентраций изолятов
при наличии в пробе микробных ассоциаций;
сокращения времени контакта пробы с некоторыми
антисептиками, используемыми местно, которые могут обладать
антибактериальной активностью;
объективизации клинического диагноза инфекционновоспалительного заболевания и оценки результатов терапии.
120. Требования к доставке проб биоматериала в лабораторию
• Допускается использование альтернативных методов дляувеличения сроков доставки биоматериала в лабораторию.
• Пробы хранят в холодильнике при температуре 2—8°С, за
исключением нижеперечисленных случаев.
• Когда пробу хранят в специализированной транспортировочной
емкости (транспортировочная система), разрешенной к
применению в установленном порядке, представляющей собой
стерильную одноразовую пробирку с агаризованной или жидкой
транспортировочной средой и зондом-тампоном,
вмонтированным в пробку и стерильно упакованным вместе с
пробиркой. В таких емкостях пробы хранят при комнатной
температуре (+18—+25 °С). Транспортные среды, специальные
плотные с активированным углем и без него, позволяют
обеспечить сохранение жизнеспособности микроорганизмов,
требующих особых условий культивирования, в течение 48—72
часов.
121. Требования к доставке проб биоматериала в лабораторию
• Для проб на аназробы и для фекальной флорыиспользуют специальные емкости с
транспортной средой, пробирки со средами для
выделения кампилобактерий и хеликобактера,
разрешенные к применению в установленном
порядке.
• Такие среды создают анабиотические условия
для микроорганизмов, что способствует
снижению их метаболизма, сдерживанию роста,
препятствует их высыханию и накоплению
продуктов жизнедеятельности.
• Каждую пробу, собранную в жидкую среду,
тщательно перемешивают со средой.
122. Требования к доставке проб биоматериала в лабораторию
• Когда кровь культивируют в бульоне, тогдапосле получения пробу хранят в
термостате при температуре 35—37°С.
• Если пробы собирают в специальные
емкости с двухфазной средой для
последующего исследования, их следует
хранить при комнатной температуре (18—
25°С).
• Когда при возможном наличии
температурозависимых микроорганизмов
(Neisseria spp.) пробы оставляют при
комнатной температуре (18—25 °С).
123. Требования к доставке проб биоматериала в лабораторию
• Когда пробу хранят в емкостях с соответствующимипитательными средами, подготовленных в лаборатории
или разрешенных к применению в условленном порядке
при проведении:
• бактериологических исследований — в пробирках с
вмонтированными зондами-тампонами или без них со
средой, состоящей из забуференного физиологического
раствора с глицерином для определения энтеробактерий
семейства еишечных ( дизгруппу) и аэромонад.
• При работе с тампонами, вмонтированными в
целлюлозную газопроницаемую пробку, следят за тем,
чтобы не замочить (не загрязнить) пробку средой и/или
собранным материалом. Собранную пробу тщательно
перемешивают со средой. Используют также готовые
пробирки со специальной плотной средой, разрешенные к
применению в установленном порядке;
124. Требования к доставке проб биоматериала в лабораторию
• вирусологических исследований — вспециальных емкостях с жидкой средой,
разрешенных к применению в
установленном порядке;
• паразитологических исследований — пробу
тщательно смешивают с консервантом.
• Пробы ликвора хранят при комнатной
температуре (18—25°С), а при проведении в
лаборатории вирусологических
исследований— в термостате при 35—37 °С.
125. Требования к доставке проб биоматериала в лабораторию
• Для транспортирования проб, исследуемых наналичие аэробов и факультативных анаэробов,
используют:
• одноразовые стерильные сухие пробирки с
вмонтированным зондом-тампоном (тубсеры) или
емкости с транспортной средой, разрешенные к
применению для этих целей в РФ; допускается
использование стерильных стеклянных пробирок,
укупоренных целлюлозной газопроницаемой пробкой
с вмонтированным зондом-тампоном,
простерилизованных в лаборатории;
• одноразовые стерильные емкости с
завинчивающейся крышкой (допускаются стеклянные
с газопроницаемой пробкой) — для сбора проб мочи,
мокроты, фекалий, бронхо-альвеолярного лаважа,
биопсийного (кусочки ткани) материала;
126. Требования к доставке проб биоматериала в лабораторию
• стерильные одноразовые с завинчивающейся пробкой илистеклянные пробирки — для сбора стерильных жидкостей,
бронхо-альвеолярного лаважа, отделяемого из дренажей или
соскобов;
• стерильные одноразовые чашки Петри — для сбора проб
волос или для транспортирования соскобов с маркировкой
дна чашки;
• специальные стерильные носоглоточные и урогенитальные
зонды-тампоны с осью из алюминия (диаметром оси — 0,9 мм)
и маленьким тампоном из хлопка или вискозы (диаметр
тампона — 2,5 мм), вмонтированным в пробку, укупоривающую
стерильную одноразовую пробирку для взятия всех типов
материала и мазков для проб из носоглотки на В. регtussis и
стерильные зонды-тампоны с осью из алюминия (диаметр оси
— 1 мм) и тампоном из хлопка или вискозы (диаметр тампона
— 2,5 мм) из уретры у мужчин.
127. Требования к доставке проб биоматериала в лабораторию
• Для транспортирования проб, исследуемых на наличиеанаэробов, используют емкости со специальными
транспортными средами и пробирки со специальными
транспортировочными средами, и пробирки с тиогликолевой
средой; пробирки со средами для выделения кампилобактерий
и хеликобактерий, разрешенные к применению для этих целей в
Российской федерации в установленном порядке. Пробу,
собранную в жидкую среду, тщательно с ней перемешивают.
для получения проб рекомендуются следующие приемы:
• отделяемое дренажей, используемых для активной аспирации
полостей, отсасывают стерильным шприцем с плотным
поршнем в объеме 2—4 мл; на заполненный шприц надевают
стерильную иглу, закрытую стерильным ватным тампоном,
удаляют из шприца избыток воздуха; ватный тампон
сбрасывают в дезинфицирующий ра створ; конец иглы
вкалывают в стерильную резиновую пробку и в таком виде
шприц с материалом доставляют в лабораторию;
128. Требования к доставке проб биоматериала в лабораторию
• содержимое очагов инфекции и полостей,получаемое путем их пунктирования, собирают в
объемы 2—4 мл с помощью 2-, 5-, 10-миллилитровых шприцев с плотным поршнем; из
шприца удаляют избыток воздуха, закрыв иглу
стерильным ватным тампоном, который затем
сбрасывают в дезинфицирующий раствор; иглу
дезинфицируют протиранием тампоном,
смоченным 70% этиловым спиртом; для
герметизации конец иглы вкалывают в
стерильную резиновую пробку, и в таком виде
шприц с материалом доставляют в лабораторию.
• При сборе большого объема материала (З мл и
более) анаэробные бактерии могут оставаться
жизнеспособными в течение 24 ч при комнатной
температуре (18—20°С).
129. Требования к доставке проб биоматериала в лабораторию
• Если отделяемого всего несколько капель, егопереносят из шприца в небольшую емкость или в
пробирку с транспортировочной средой
немедленно после получения (емкость с
транспортировочными средами накануне получают
в лаборатории).
• Кусочки тканей (биопсийный материал) при
подозрении на анаэробную инфекцию собирают в
стерильные одноразовые емкости с
завинчивающейся крышкой (допускается — в
стеклянную посуду с при тертой крышкой) и
доставляют в лабораторию немедленно.
• Для транспортирования проб, исследуемых на
наличие вирусов, используют специальные
емкости с жидкой средой для сохранения вирусов.
130. Пробы биоматериала на иммунологические исследования
Общие положения• Проведение иммуносерологических исследований
основано на применении технологических приемов
(методик), позволяющих определять специфические
антигены возбудителей инфекционных, и инфекционновоспалительных заболеваний, и/или вводимых при
вакцинации, и ответной реакции на них организма
образование антител
• Это необходимо для объективизации клинического
диагноза, результатов терапии, оценки качества
вакцинации, своевременной организации и проведения
противоэпидемических мероприятий.
• Тест-системы, предназначенные для определения
специфических антигенов, используются для
идентификации конкретного микроорганизма в пробе
клинического материала или выращенного in vitго.
131. Иммунологические исследования
• С помощью методов, предназначенных дляопределения антител, дается характеристика ответа
организма (человека) на конкретный антиген без
учета или с учетом специфического класса
иммуноглобулинов (Ig), в котором они находятся.
• IgM — ранние антитела (4—7 суток от первичного
инфицирования микроорганизмами),
• IgG — поздние ан титела, которые (в зависимости
от антигена) могут находится в организме от 5—7
суток до 3—4 недель (период реконвалесценции) и
даже всю жизнь.
• Сывороточные IgA при всей их вариабельности по
срокам образования (11—15 суток) и персистенции
в организме (до 30 суток) отражают не столько
реакцию на конкретный бактериальный антиген,
сколько на деструкцию органа, обусловленную
воспалительным процессом микробной этиологии.
132. Иммунологические исследования
• Уровень секреторного sIgA—прогностический признак вероятности
развития инфекции на слизистых оболочках
при нарушениях микроэкологии, т. е.
микробиологического аспекта системы
антиинфекционной резистентности (САИР), а
также вероятности проникновения
(транслокации) возбудителя в другие органы
и ткани.
• Уровень IgE антител увеличивается в ответ
на паразитарные инфекции, но
специфическая реакция на другие
инфекционные агенты в этом классе Ig
отсутствует.
133. Иммунологические исследования
• Возникновение инфекционного и инфекционновоспалительного заболевания, течениепатологического процесса и эффективность терапии в
большой степени зависят от состояния защитных сил
организма, т. е. от факторов системы
антиинфекционной резистентности, в частности, в ее
иммунологическом аспекте.
• Нарушения в синтезе и функциональной активности
терминальных компонентов каскада комплемента
(мембран-атакующего комплекса) — фактор,
предрасполагающий к развитию рецидивирующих
нейссериальных (N.gonorrhoae) инфекций.
• Мутация в рецепторе γ-интерферона — основа
тяжелейшей диссеминированной микобактериальной
инфекции и фатального исхода от Mycobacterium
bovis — основы противотуберкулезной вакцины
Кальметта—Герена.
134. Иммунологические исследования
• Полиморфизм генов человека — основаустойчивости к малярии, а врожденное
отсутствие некоторых эритроцитарных
антигенов среди определенной
человеческой субпопуляции определяет их
абсолютную устойчивость к парвовирусам.
• Недостаточность или нарушения в
функционировании бактерицидных систем в
клетке нейтрофилами/или в целом в
процессе фагоцитоза — основа развития
воспалительного процесса, вызванного
условно-патогенными микроорганизмами
135. Иммунологические исследования
• В настоящее время имеется возможностьопределения и подсчета количества В-лимфоцитов
активирующих плазматические клетки, образующие
антитела, с параллельным определением
специфических антигенов. Для этого используют
пробу периферической крови, в которой также
определяют вирусы лихорадки денге, гриппа, респи
раторно-сенсициальный вирус, вирус
иммунодефицита человека (Вич).
• Учитывая важность иммунологического и
микробиологического аспектов системы
антиинфекционной резистентности организма в
развитии и течении инфекционно процессов, в т. ч.
внутрибольничной природы, в научно-практических
лабораториях рекомендуется проводить
комплексные клинико и иммуно-серологические
обследования.
136. Иммунологические исследования
• Иммуносерологическое обследование включаетопределение:
• антител к эндо- и экзотоксинам, клеточной стенке и ее
компонентам микробов-возбудителей
воспалительных процессов;
• С-реактивного белка (ОРБ) и других белков острой
фазы как показателей наличия и активности
воспаления инфекционной при роды;
• бактерицидной активности сыворотки (БАС) и/или
других жидкостей тела с аутоштаммами пациента;
этот тест до назначения антибактериальной терапии
свидетельствует о состоянии комплекса
гуморальных факторов защиты организма, при
наличии антибактериальной терапии позволяет
проводить мониторинг ее активности;
137. Иммунологические исследования
• иммуноглобулинов М, G, А классов в сыворотке кровии других жидкостях организма как показателя остроты
и длительности процесса, способности
обследованного реагировать на возбудитель, а также
как необходимых компонентов, участвующих в
фагоцитозе нейтрофилов в качестве опсонинов (IgM и
IgG) показателя наличия деструкции органа (IgA) в
результате воспаления;
• активности комплемента и его компонентов в качестве
субстанции, приводящей к лизису клетки
микроорганизма если комплекс антиген-антитело
находится на ее поверхности, и как инициатора
выброса нейтрофилов, если комплекс находится в
тканях, а также как опсонина;
138. Иммунологические исследования
• лизоцима как показателя состояниялейкоцитов, способности организма
к лизису грамположительнь кокков и
в крови — Е. соli;
• фагоцитарной функции нейтрофилов
в незавершенном и завершенном
вариантах с контрольными и
аутоштаммами, выделенными из
очага воспаления;
139. Иммунологические исследования
• В-лимфоцитов, учитывая их способностьк дифференциации в плазматические
клетки и образованию специфических
антител в различных классах
иммуноглобулинов;
• Т-лимфоцитов и их субпопуляций как
контролирующих активность Влимфоцитов и реагирующих с клетками с
более низкой степенью специфичности,
чем те, с которыми реагируют
цитотоксические Т-лимфоциты.
140. Иммунологические исследования
• Стерильную посуду для сбора проб и ихтранспортирования (кровь и другие жидкости
организма обследованных) накануне получают в
лаборатории.
• Иммуносерологические исследования проводят
параллельно с микробиологическими,
анализирующими материал из очага воспаления,
обсемененность слизистой верхних дыхательных
путей (нос, зев), гениталий и содержимого кишечника.
• Все пробы готовят в один и тот же день: при
поступлении, накануне операции или с операционного
стола (до операции), на 3—4-е сутки после операции(2—
3-е сутки после госпитализации у терапевтических
больных), на 14—16-е сутки после операции (после
госпитализации терапевтических больных), перед
выпиской из стационара или в сроки, оговоренные
клиницистами.
141. Иммунологические исследования
• Комплексные исследования с анализом проводят сцелью
• изучения патогенеза воспалительного процесса
определенной локализации, вызванного условнопатогенной микрофлорой, которые позволяют
установить
• нарушения в системе антиинфекционной
резистентности организма,
• определить возможность развития внутри больничной
инфекции и реакцию на нее конкретного больного,
• а так же способность пациента реагировать на
определенный возбудитель (возбудители),
• проводить мониторинг эффективности
антибактериальной и специфической иммунотерапии и
других лечебных мероприятий.
142. Иммунологические исследования
• Методы исследования, применяемые виммуносерологии
• Выбор оптимального метода определения
антигенов и антител зависит от соответствия
собранной пробы целям и задачам
исследования (сроки от начала заболевания,
отсутствие гемолиза и липолиза пробы,
контаминации посторонней микрофлорой) и
требований к спектру исследований, которые
могут быть выполнены в конкретной
лаборатории.
• Используют следующие методы исследования:
• Реакция агглютинации — используют для
подтверждения наличия инфекции, вызванной
определенным бактериальным антигеном.
143. Иммунологические исследования
• Непрямая (пассивная) гемагглютинация (РПГА) слатексными частицами или эритроцитами барана —
используют для определения на личия антител к
возбудителям кишечных инфекций, в модификации с
использованием латексных частиц (диагностикумов)—
для диагностики бактериальных менингитов,
определения антигенов Candida, гонококков,
гемофильной палочки.
• Ингибиция гемагглютинации — модифицированная
РПГА, используют для определения антител к вирусам
краснухи, гриппа, парагриппа, RS• Преципитация — реакция между растворимыми
антигенами и антителами, используют метод диффузии
в геле.
• Радиальная иммунодиффузия — определение
антигенов или антител в моноспецифической системе с
чувствительностью 1—10 мг/л, используют для
сравнения антигенов (чувствительность — несколько
нанограмм/мл).
144. Иммунологические исследования
• Электроиммунодиффузия — подобнарадиальной, но миграция реагентов
направляется электрическим полем, и ее
чувствительность в 5—10 раз выше, чем в
радиальной иммунодиффузии.
• Быстрые методы определения антигена и
антител (15—20 мин) - основаны на
использовании коллоидных, меченных
золотом антител. Определяют антитела к ВИЧ и
антиген хламидии трахоматис. диагностику
лихорадки денге осуществляют с помощью
иммунохроматографического определения
сывороточных IgM и IgG/
145. Иммунологические исследования
• Методы с меченными антителами —специфичные высокочув ствительные методы
для определения антигенов в клетках и тканях:
• прямая (ПИФ) и непрямая (НИФ)
иммунофлуоресценция, а также антигенов
микроорганизмов. Используют для
определения кластеров дифференциации и
антигенов на поверхности лимфоцитов. Можно
определять антигены в мазке материала
(инфекции, передаваемые половым путем). С
использованием прямой
иммунофлуоресценции определяют антиген в
количестве не менее 105 микробных тел.
Непрямая иммунофлуоресценция в 5—10 раз
чувствительнее, чем прямая.
146. Иммунологические исследования
• Радиоиммунологические (метка — 125I) исследования(РИА) и ELISA (метка-фермент: пероксидаза хрена) —
каждый из методов используют для количественного
определения конкретного антигена в растворе даже
при наличии смеси антигенов.
• Применяют для идентификации вирусов (герпес
симплекс, ЦМВ, герпес зостер), возбудителей
коклюша (Bordetella pertussis), бруцеллеза (Brucella
abortus) в мазке материала — пневмонии (Legionella
pneumophiliae, МусорIаsma pneumoniае), болезни
Лайма (Воггеliа burgdorferi) сифилиса (Т. pallidum)
ИППП (Chlamidia sрр., Ureaplasma sрр.), кишечных
инфекций (Salmonella sрр., Shigella
sрр.),Streptococcus гр. А, Тохорlasma gondii,
Неiсоbаctег руlогi — в крови. Чувствительность
методов — 1—2 нг/мл.
147. Иммуносерологические исследования
• Альтернативный метод —иммуноблоттинг, используемый для
мониторирования инфекций, вызванных
ВИЧ, вирусами гепатита, Т. pallidum,
Воггеliа burgdorferi (чувствительность —
1—2 нг/мл) и других.
• Мечеными конъюгатами определяют и
мониторируют ответ (выработка антител)
на антигены вирусов (ВИЧ, ЦМВ, герпес
симплекс, герпес зостер), Т. pallidum,
Воггеliа burgdorferi.
148. ПЦР-диагностика
• Полимеразная цепная реакция (ПЦР) и различныемодификации на ее основе (методы гибридизации
ДНК и РНК) — основана на замене биологической
амплификации (накопление клеток микроорганизма
при культивировании in vitro на ферментативную
(энзиматическую) амплификацию специфических
последовательностей нуклеиновых кислот
возбудителя.
• Гибридизация нуклеиновых кислот возбудителя
позволяет определять гены, ответственные за
антибиотикорезистентность, наличие в биолробе
медленно растущих и требующих особых условий
культивирования микроорганизмов (например,
легионеллы и микобактерии), тех, которые
невозможно культивировать in vitro (возбудитель
болезни Уиппла—Тгорherymа whiiрреIii и др.).
149. ПЦР-диагностика
Сбор и хранение образцов для ПЦРдиагностики• Материалом для исследования служат:
соскоб из уретры, цервикального канала,
заднего свода влагалища, секрет
предстательной железы, сперма, моча, мазки
с конъюнктивы.
• Сбор материала (соскоб из урогенитального
тракта) у женщин. Соскобы производят из
трех различных точек: цервикальный канал,
уретра, задний свод влагалища. При
необходимости материал для исследования
берут из эрозивно-язвенных поражений. Сбор
материала производят отдельными
одноразовыми стерильными зондами.
150. ПЦР-диагностика
Сбор материала из цервикального канала.• Удаляют слизь с поверхности шейки матки
тампоном, вводят зонд в цервикальный канал
на 1,0—1,5 см и вращают его в течение 3—5 с.
• Извлекают зонд, избегая касания стенок
влагалища, и помещают его в стерильную
одноразовую пробирку с транспортировочной
средой (0,3 мл).
• Погрузив рабочую часть зонда в
транспортную среду, вращают зонд в течение
10—15 с, избегая разбрызгивания раствора.
• Вынимают зонд из раствора. Прижимая его к
стенке пробирки и отжав избыток жидкости,
удаляют зонд и закрывают пробирку.
151. ПЦР-диагностика
Сбор материала из уретры.• Перед забором соскоба из уретры необходимо
обработать ее наружное отверстие тампоном,
смоченным стерильным физиологическим
раствором. Производят массаж уретры пальцем со
стороны влагалища, прижимая ее к лобковой кости.
Вводят зонд в уретру на глубину 1,0—1,5 см и
аккуратно, не поранив слизистую, несколькими
вращательными движениями производят соскоб
эпителиальных клеток и переносят зонд в пробирку с
Транспортной средой (0,3 мл).
• Погрузив рабочую часть зонда в транспортную среду,
вращают зонд в течение 10—15 с, избегая
разбрызгивания раствора. Вынимают зонд из
раствора. Прижимая его к стенке пробирки и отжав
избыток жидкости, удаляют зонд и закрывают
пробирку.
152. ПЦР-диагностика
Сбор материала из заднего свода влагалища.• В случае избытка слизи и обильных выделений их
удаляют стерильным ватным тампоном. Проводят
зондом по поверхности слизистой в области
заднего свода влагалища и эктоцервикса и
переносят зонд в пробирку с транспортной средой
(0,3 мл).
• Погрузив рабочую часть зонда в транспортную
среду, вращают зонд в течение 10—15 с, избегая
разбрызгивания раствора. Вынимают зонд из
раствора. Прижимая его к стенке пробирки и отжав
избыток жидкости, удаляют зонд и закрывают
пробирку.
153. ПЦР-диагностика
Сбор материала у мужчин.• Сбор материала из уретры. Перед сбором соскоба из
уретры необходимо обработать головку полового
члена в области наружного отверстия уретры
тампоном, смоченным стерильным физиологическим
раствором.
• Производят массаж уретры. При наличии свободно
стекающих из уретры выделений удаляют их сухим
тампоном. водят зонд в уретру на глубину 3—4 см.
Несколькими вращательными движениями производят
соскоб эпителиальных клеток и переносят зонд в
пробирку с транспортной средой.
• Погрузив рабочую часть зон да в транспортировочную
среду, вращают зонд в течение 10—15 с, избегая
разбрызгивания раствора. Вынимают зонд из
раствора. Прижимая его к стенке пробирки и отжав
избыток жидкости, удаляют зонд и закрывают
пробирку.
154. ПЦР-диагностика
Сбор секрета предстательной железы может бытьосуществлен двумя способами:
1. после окончания массажа предстательной железы ее
секрет в количестве 0,5—1,0 мл собирают в
одноразовую стерильную пробирку объемом 1,5 мл;
2. при невозможности получить секрет сразу после
массажа собирают первую порцию мочи (в которой
содержится секрет предстательной железы) в
количестве 10 мл (см. правила забора мочи).
• Сбор спермы осуществляют в стерильные
одноразовые флаконы или пробирки.
• Сбор проб мочи для анализа отбирают первую
порцию у ренней мочи в количестве не меньше 20—
40 мл в специальный сухой стерильный флакон или
сухую стерильную пробирку.
155.
ПЦР-диагностикаСбор проб с конъюнктивы.
• Сбор пробы осуществляют сухими терильными
ватными тампонами под местной анастезией (2 капли
раствора дикаина или инокаина).
• Оттянув нижнее веко, вращающими движениями
провести зонд 4—5 раз по конъюнктиве, захватывая
внешний и внутренний углы глаза. После забора
материала тампон (рабочую часть зонда с ватным
тампоном) помещают в стерильную одноразовую
пробирку с транспортной средой.
• Погрузив рабочую часть зонда в транспортную среду,
вращают зонд в течение 10— 15 с, избегая
разбрызгивания раствора.
• Вынимают зонд из раствора. ГIрижимая его к стенке
пробирки и отжав избыток жидкости, удаляют зонд и
закрывают пробирку.
156. Выбор методов диагностики при инфекционных заболеваниях
• Планируя схему обследования больного, врачпредусматривает комплекс лабораторных
исследований, направленных на этиологическую
диагностику процесса. При этом он исходит из
наблюдаемой клинической картины, данных
эпиданамнеза, технических возможностей доступных
ему лабораторий, периода развития заболевания.
Также учитываются возможность взятия материала
для исследования и приемлемость сроков получения
ответа.
• Информация, призванная облегчить составление
плана лабораторного обследования больных с
отдельными симптомокомлексами суммирована в
таблицах 6—12. При составлении таблиц
использованы следующие обозначения:
157. Выбор методов диагностики при инфекционных заболеваниях
• стандартный бактериологический метод — посев накомплекс питательных сред, применение которого
регламентировано для данного вида исследуемого
материала приказом МЗ СССР «Об унификации
микробиологических (бактериологических) методов
исследования, применяемых в клиникодиагностических лабораториях лечебнопрофилактических учреждений» №535
• специальный бактериологический метод — метод,
предназначенный для выделения определенного
микроорганизма, обнаружение которого с помощью
стандартного метода маловероятно или невозможно;
этот метод будет использован только в случае, если на
необходимость поиска данного микроорганизма
специально указано в направлении;
158. Выбор методов диагностики при инфекционных заболеваниях
• лаборатории ЛПУ — бактериологические лабораториилечебно профилактических учреждений; перечень
выполняемых ими исследований определен
«Рекомендуемым перечнем лабораторных
исследований для клинико-диагностических
лабораторий лечебно-профилактических учреждений»,
утвержденным МЗ СССР 24 октября 1989 года и
приказом № 8 МЗ и МП России от 19.01.95 «0 развитии и
совершенствовании деятельности лабораторий
клинической микробиологии (бактериологии) лечебнопрофилактических учреждений»;
• лаборатории ООИ — лаборатории особо опасных
инфекцийФЦГИЭ и противочумных станций;
• специализированные лаборатории — лаборатории
противотуберкулезных учреждений, кожновенерологических диспансеров пт. п.
159. Бактериологический метод
Системы для отбора икультивирования
материала, полученного на
зонд-тампон, включая
смывы. Представляет
собой зонд,
вмонтированный в
целлюлозную
газопроницаемую пробку
160. Бактериологический метод
Чашки Петри, в том числе —двух- и трехсекционные
Штативы для чашек Петри
161. Бактериологический метод
Петли бактериологическиестерильные пластиковые.
Калиброваны на 1 и 10 мкл.
Имеют штык для засевания
агара проколом
Петли бактериологические многоразовые
металлические, диаметр 5 мм
162. Бактериологический метод
Шпатели Дригальскогостерильные одноразовые
(L-форма и Т-форма)
163. Бактериологический метод
Пипетка Пастеровскаястерильная пластиковая
164. Бактериологический метод
Штатив для заливки скошенного агара в пробирках (нержавеющая сталь)165. Бактериологический метод
Спиртовка с герметичной крышкой и притертым колпачком166. Бактериологический метод
Шпателиларингологические
стерильные
(дерево и пластик)
167. Бактериологический метод
Стекла с лунками для серологических реакцийСтекла для
иммунофлюоресценции
168. Бактериологический метод
Бусины стеклянные для смешивания иизмельчения материала
169. Расходные материалы
Микропробирки типаЭппендорф
170. Расходные материалы
Микропробирки коническиес завинчивающейся крышкой
171. Расходные материалы
Готовые наборы для окраскипо Граму и по Цилю
172. Расходные материалы
Пипетки серологические стеклянные173. Расходные материалы
Устройства для заполнения пипетокСтеклянные пастеровские пипетки
174. Расходные материалы
Наконечники для дозаторовстерильные с фильтром на разный объем
175.
176.
177. Фильтрование
• — процесс механического разделения твердыхи жид ких компонентов растворов.
• Сущность фильтрования в том, что жидкость с
находящимися в ней частицами твердого
вещества пропускают через фильтр.
• В результате твердые частицы, размер которых
больше, чем размер пор фильтра, задерживаются
на его поверхности.
• Жидкость, прошедшая через фильтр и
освобожденная от находившихся в ней твердых
примесей, называют фильтратом.
• Эффективность и скорость фильтрования зависят
от условий про ведения процесса и
фильтрующихся систем.
178.
• К важнейшим условиям, влияющим напроцесс фильтрования, относят
фильтрующие материалы,
температуру фильтрования и давление.
В соответствии с этими условиями
применяют следующие способы
фильтрования:
при обычном атмосферном давлении;
под вакуумом;
при нагревании;
при охлаждении;
при повышенном давлении.
179. Выбор фильтров по размеру пор нужно проводить с учетом их маркировки.
• Пористость бумажных фильтров определяют поцвету бумажной ленты, которой оклеивают
упаковку фильтров.
• Приняты следующие условные обозначения:
• розовая (или черная) лента —
быстрофильтрующие фильтры (диаметр пор - 10
нм );
• белая лента — бумага средней проницаемости
(диаметр пор ~3 нм );
• синяя лента — плотные фильтры (диаметр пор ~
1-2 ,5 нм ), пред назначенные для фильтрования
мелкозернистых осадков;
• желтая лента — обезжиренные фильтры.
180.
181. Тканевые фильтры.
• Из данного вида фильтра нужный выбирают,исходя из состава суспензии, вида
растворителя и температуры разделяемых
фаз.
• Полиакрилонитриловые ткани (нитрон, орлон,
плутон) отличаются высокой прочностью в
сухом и влажном состоянии.
• Они пригодны для фильтрования
концентрированных серной и хлороводородной
кислот, концентрированных водных растворов
шелочей даже при 100 °С.
182.
• Полиамидные ткани (капрон, найлон, анид)также устойчивы к действию водных растворов
щелочей при температурах, близких к 100 °С, и
выдерживают воздействие разбавленных
кислот при обычных температурах.
• Полиэфирные ткани (лавсан, терилен, дакрон)
отличаются повышенной термостойкостью (до
150 °С). Ткани из этих материалов не
разрушаются в среде окислителей и кислот, но
быстро теряют свою прочность в нагретых
водных растворах щелочей.
183.
• К преимуществам синтетическихфильтровальных материалов относится их
высокая механическая прочность в сочетании с
термостойкостью (кроме некоторых полимеров),
устойчивость к действию многих агрессивных
жидкостей.
• Так в качестве фильтрующих материалов можно
использовать фильтры из стекловолокнистой
бумаги и коротковолокнистого асбеста, которые
называют «абсолютными фильтрами».
Стекловолокнистую бумагу применяют для
фильтрования радиоактивных и химически
агрессивных веществ
184.
• Особый интерес для фильтрованияконцентрированных кислот и щелочей
представляют фильтры из хлорированного
поливинилхлорида, флексолитовые
(политетрафторэтиленовые), политеновые
(полиэтиленовые) и из некоторых других
химически стойких пластиков.
• Все эти виды фильтров применяют, когда
обычные фильтры непригодны из-за их
чувствительности к концентрированным
кислотам или щелочам и некоторым другим
агрессивным жидкостям.
185.
• !!Нельзя использовать фильтры,материал которых неизвестен, не
проверив предварительно их стойкость по
отношению к фильтруемой суспензии.
• Превосходной устойчивостью к
агрессивным растворам, в том числе к
концентрированным кислотам и щелочам,
а также к органическим растворителям,
обладают пористые пластины и пленки из
фторопласта.
186.
• Воронки с пористой стеклянной пластинкой можноиспользовать для фильтрования любых жидкостей,
кроме плавиковой кислоты, горячей фосфорной
кислоты и горячих концентрированных растворов
щелочи.
• После использования их необходимо промывать
обратным током воды или с помощью пропускания под
вакуумом жидкостей, растворяющих или разрушающих
застрявший в порах осадок.
• Стеклянные фильтрующие пластинки различаются по
диаметру пор. В лабораторной практике наибольше
распространение нашли пластинки с максимальным
размером пор 160, 100, 40 и 16 мкм.
187.
188.
Фильтры Петрянова.
Это волокнистые фильтры с очень тонкими волокнами диаметром от 1,5 до 7
мкм. Они используются для удаления из воздуха и газов высокодисперсных
аэрозолей с размером частиц менее 1 мкм.
Фильтры из губчатой платины – уникальные фильтры для быстрого
фильтрования самых тончайших осадков. Платиновый фильтр служит долго,
так как осадок можно удалить с него любым реагентом, не разрушающим
платину
Для фильтрования агрессивных и горячих жидкостей и газов часто
используют фильтры из стеклоткани саржевого или полотняного
переплетения.
Очень практичны также фильтры из стекловолокнистой бумаги.
Значительно реже в лабораториях используются фильтры с сыпучими
фильтровальными материалами: кварцевым песком, карборундом,
активным углем, а также некоторыми неорганическими солями.
Однако, при работе с труднофильтрующимися осадками они обладают
несомненными преимуществами.
189.
• Для создания слоя необходимой плотности сыпучие материалыпредварительно просеивают через соответствующие сита для
образования однородных фракций порошка, затем насыпают
порошок в воронку с ватным тампоном.
• Но применять такие фильтры можно лишь в случае, если осадок
не представляет ценности.
• Аналогично фильтрующий слой можно сформовать из волокнистых
материалов, например целлюлозной или асбестовой массы.
• Введение волокнистых или сыпучих материалов непосредственно в
фильтруемую суспензию препятствует уплотнению осадка на
фильтре при фильтровании с отсасыванием на воронке Бюхнера и
значительно упрощает операцию.
• При использовании материалов с сильно развитой поверхностью
необходимо учитывать возможность адсорбции растворенных
веществ фильтрующим слоем.
190. Способы фильтрования
• Фильтрование можно проводитьразличными способами.
• Выбор способов фильтрования зависит от
характера подлежащих фильтрованию
жидкостей и свойств осадка, который
нужно отделить от жидкости.
191. Центрифуги и центрифугирование
• Центрифугирование — разделение неоднородных систем(напри мер, жидкость-твердые частицы) на фракции по
плотности при помощи центробежных сил.
• Приборы, применяемые для этой цели, называют
центрифугами.
• Лабораторная центрифуга — специальное устройство, которое используют в лабораторных условиях для разделения
жидкостей или элементов разной плотности.
• Центрифугирование представляет собой процесс очень
быстрого вращения емкостей со смесью вокруг
фиксированной центральной точки (неподвижной оси).
• Требуемого эффекта достигают за счет того, что вещества
осаждаются с различной скоростью, зависящей от массы и
плотности входящих в их состав частиц.
• В результате действия центробежной силы, созданной
вращением, самые тяжелые компоненты раствора
скапливаются на дне емкости, легкие — на поверхности.
• Именно поэтому главная задача центрифуги — разделение
веществ по плотности при помощи центробежной силы.
192.
• Основная часть любой центрифуги — ротор (в лабораторных центрифугах он обычно располагается на вертикально установленномвалу электродвигателя или вращается посредством различных
передач от вала двигателя).
• Существует два основных типа центробежных роторов: с
фиксированным углом наклона и качающимися стаканами или
переменным углом (альтернативное название бакет-ротор).
• Роторы с фиксированным углом удерживают пробирки под
устойчивым углом (обычно 45°) относительно оси вращения.
• Бакет-ротор раскачивается при приложении центростремительной
силы и удерживает ячейки под углом около 90° относительно угла
поворота.
• В этих роторах осадок образуется на дне кони ческой
центрифужной пробирки, тогда как при использовании ротора с
фиксированным углом осаждение происходит под определенным
углом к пробирке.
• При наклонном положении пробирок происходит расслоение компонентов смеси более быстро.
• Разделение смеси ведут в пробирках самых разнообразных форм и
объемов.
• При работе на больших скоростях используют пробирки из
полиэтилена, так как стеклянные лопаются.
193.
194.
195.
196.
197.
• Расположенные в роторе одна противдругой пробирки с обрабатываемым
материалом должны быть
уравновешены.
• Этим осуществляется равномерная
нагрузка на вал ротора и обеспечивается
равномерное вращение вала
центрифуги.
198. Классификация центрифуг
• Центрифуги бывают настольными и напольными (с ножками).По своему назначению центрифуги различают:
• общелабораторные — используют в большинстве типов лабораторий
для подготовки проб биологического материала к проведению
лабораторных анализов и решения других задач;
• рефрижераторные, или центрифуги с функцией охлаждения, —
используют для обеспечения специальных условий подготовки проб
биологического материала к исследованию;
• гематокритные — частота вращения ротора таких центрифуг может
достигать 15 000 об ./м и н, предназначены для определения только
гематокрита, важнейшего показателя степени кровопотери.
Гематокритные центрифуги по своей сути — аналитическое оборудование,
так как позволяют получить результат исследования — гематокритную
величину.
Центрифуги для лабораторных целей классифицирую т по суммарному
объему загруженных образцов и скорости вращения ротора.
• По суммарному объему загруженных образцов различают центрифуги:
• микроцентрифуги (предназначены для центрифугирования про бирок
объемом 1 ,5-2,0 мл каждая);
• общелабораторные (суммарный объем образца около 0,5 л);
• специализированные повышенного объема (обычно до 6 л).
199.
• Скорость седиментации зависит отцентробежного ускорения(G), прямо
пропорционального угловой скорости
ротора (ω, в рад*с-1) и расстоянию
между осью
• вращения и частицей (r, в см):
2
• G=ω r







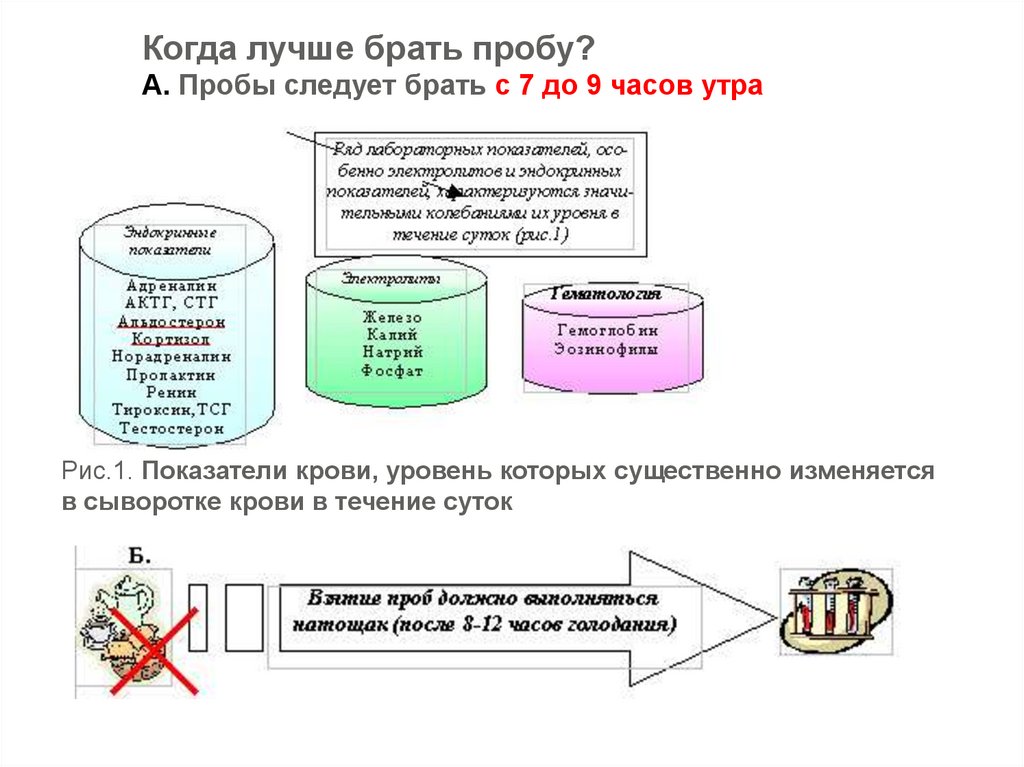



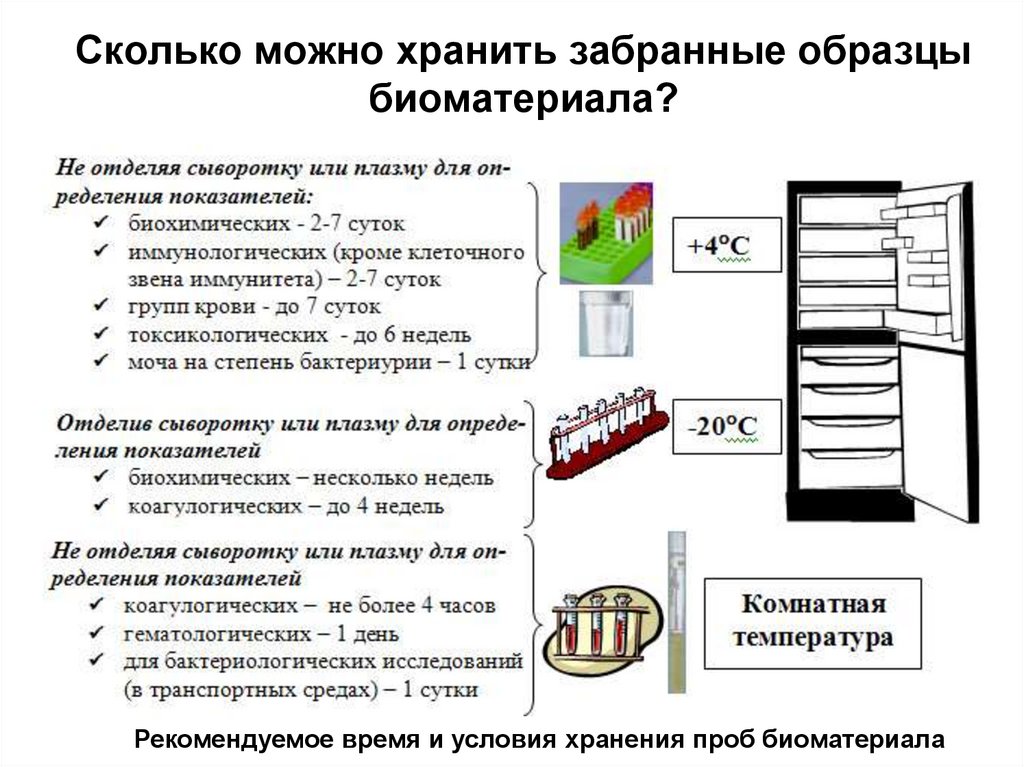












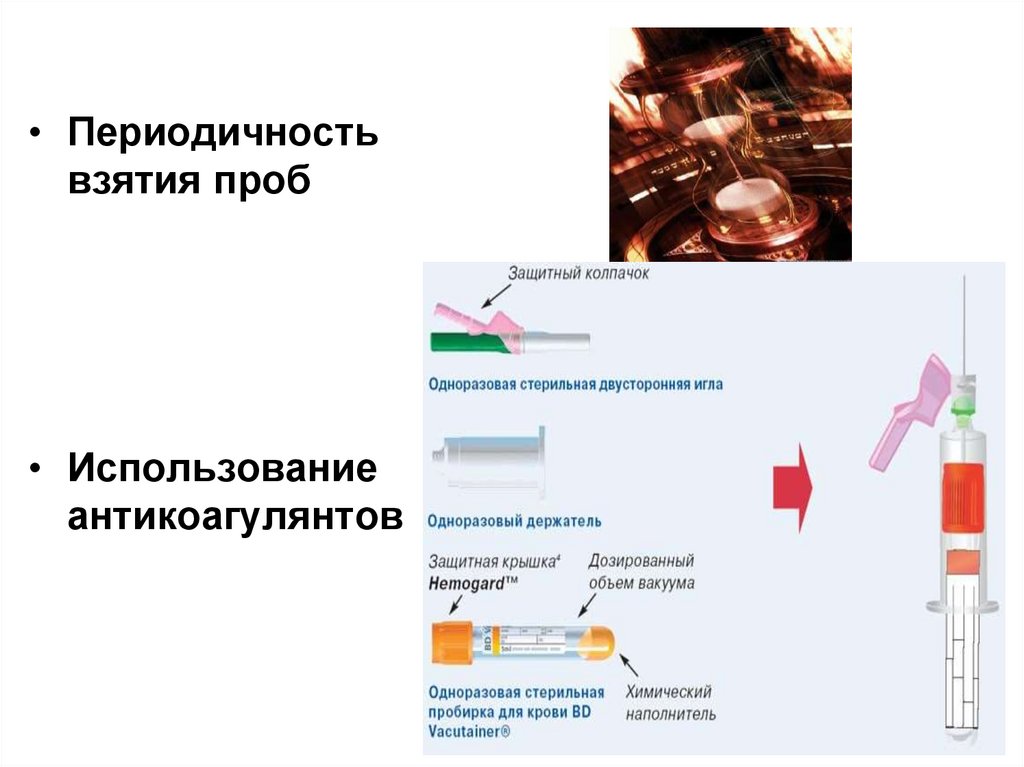

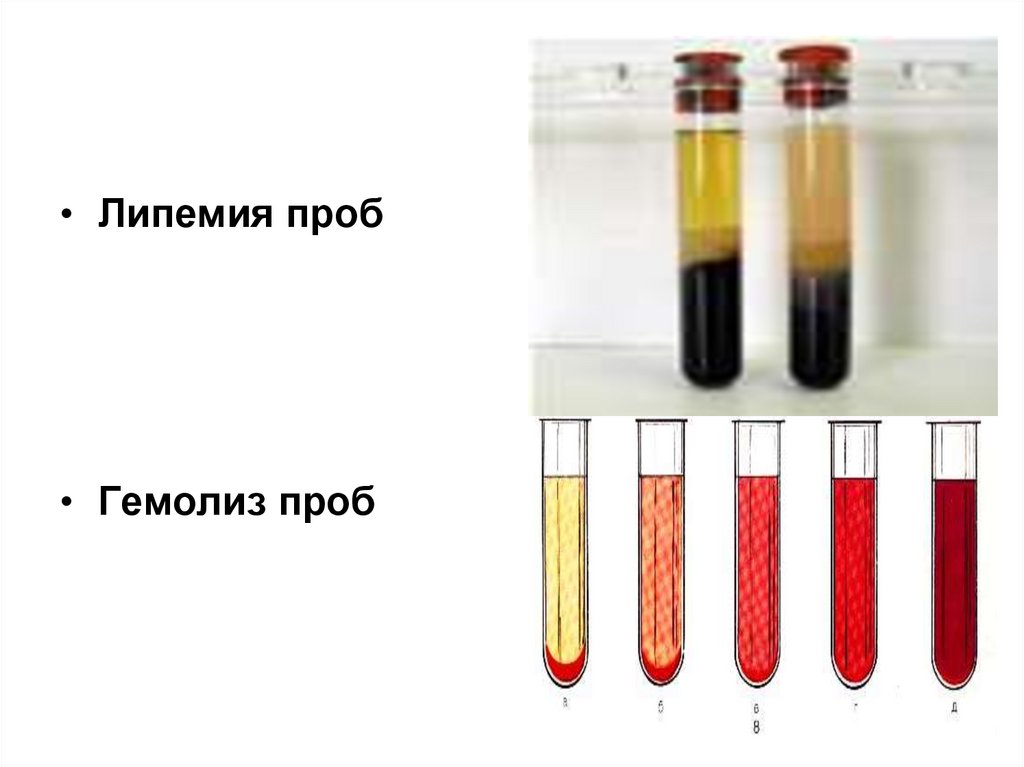
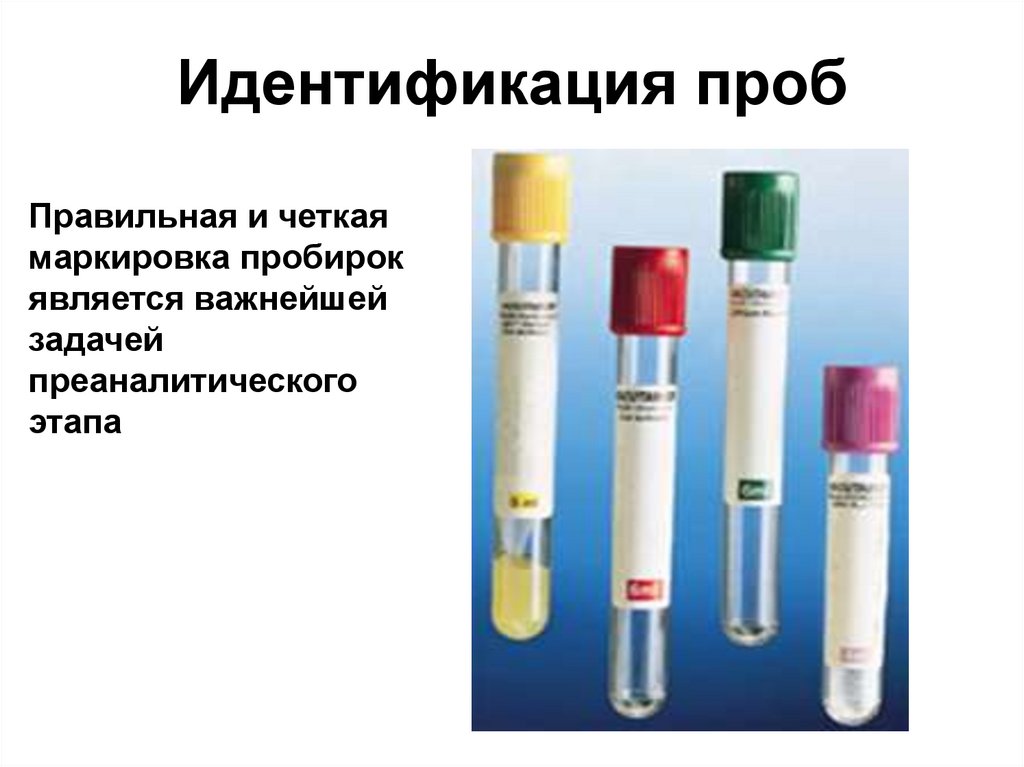





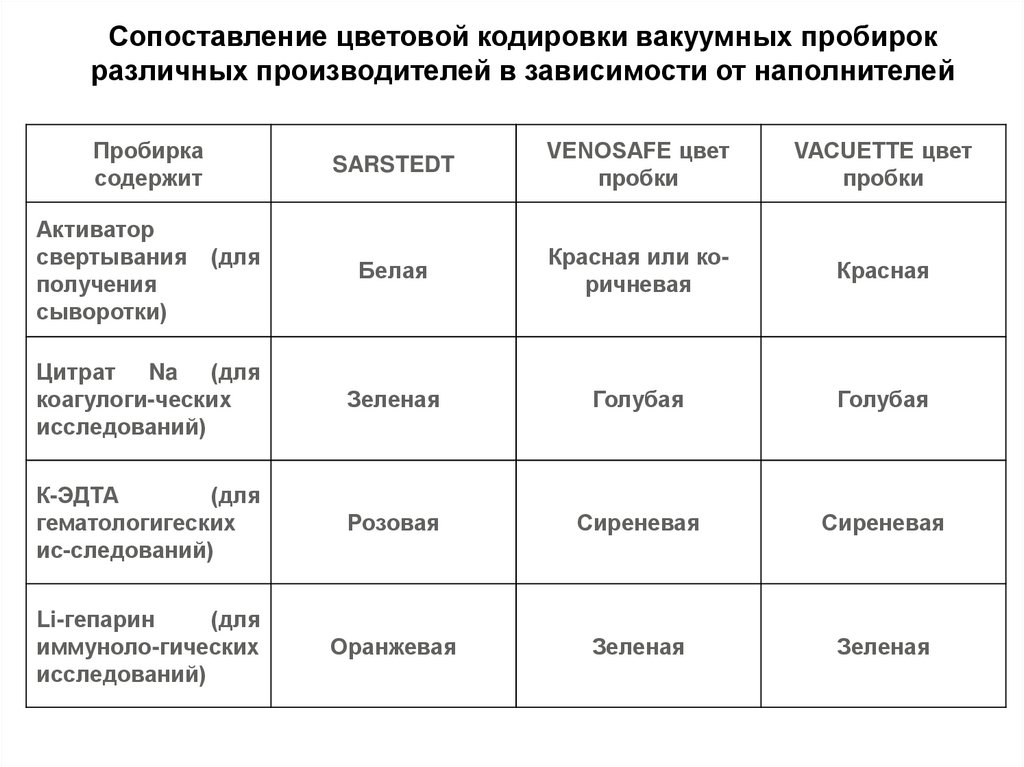


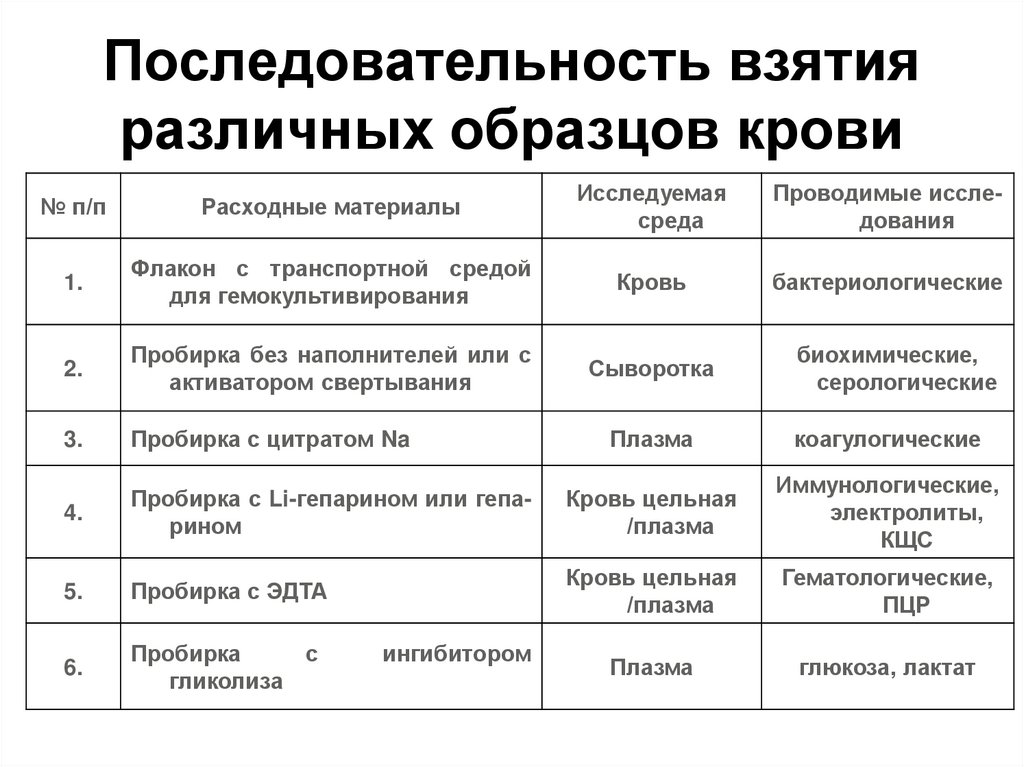










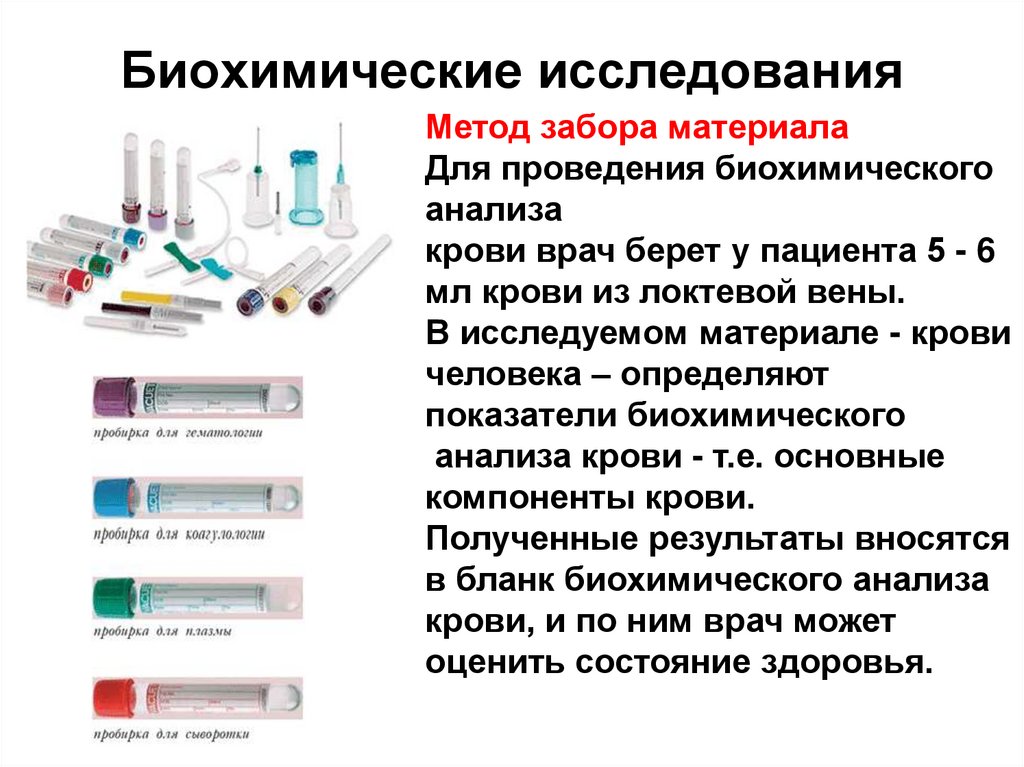


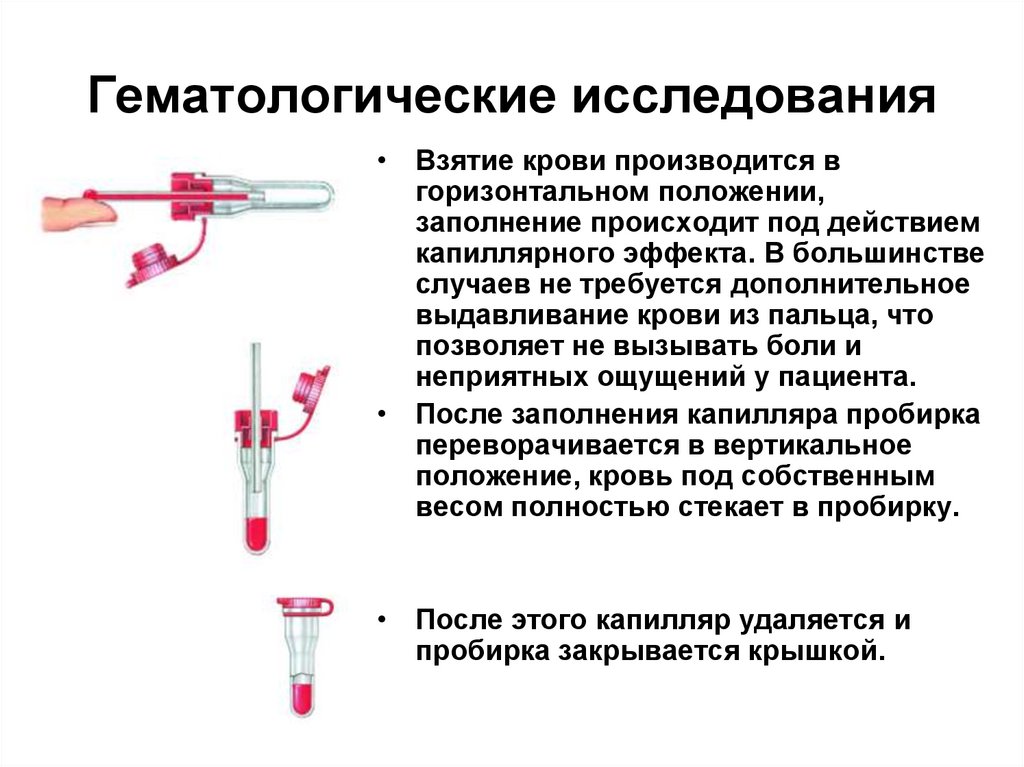

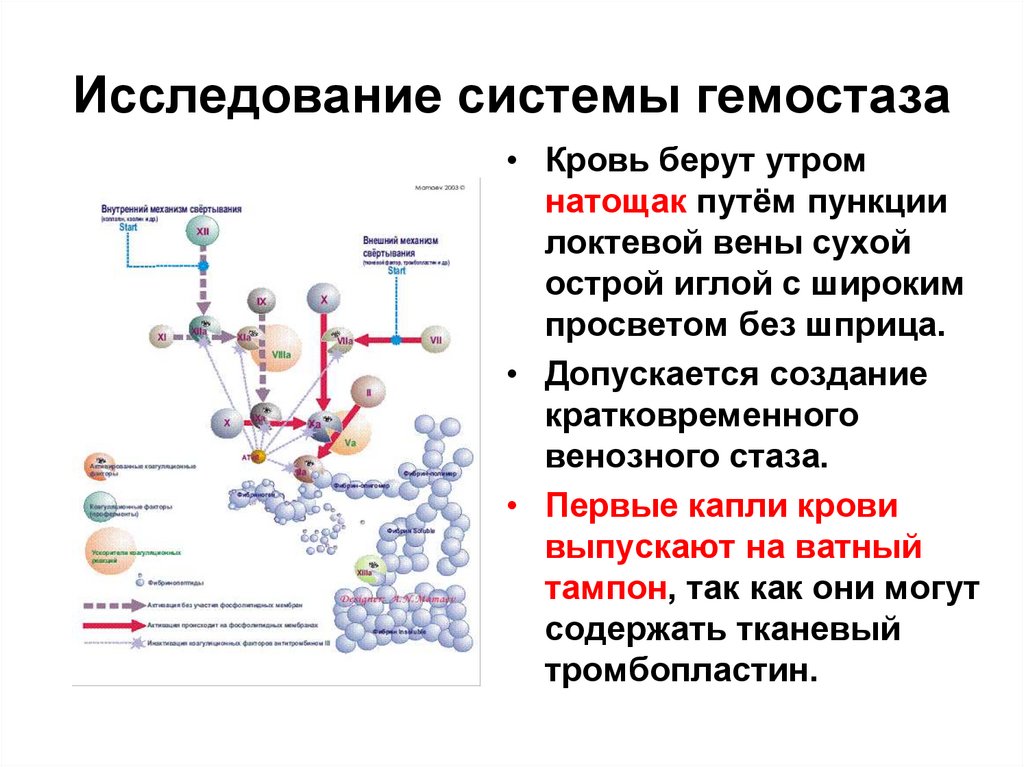














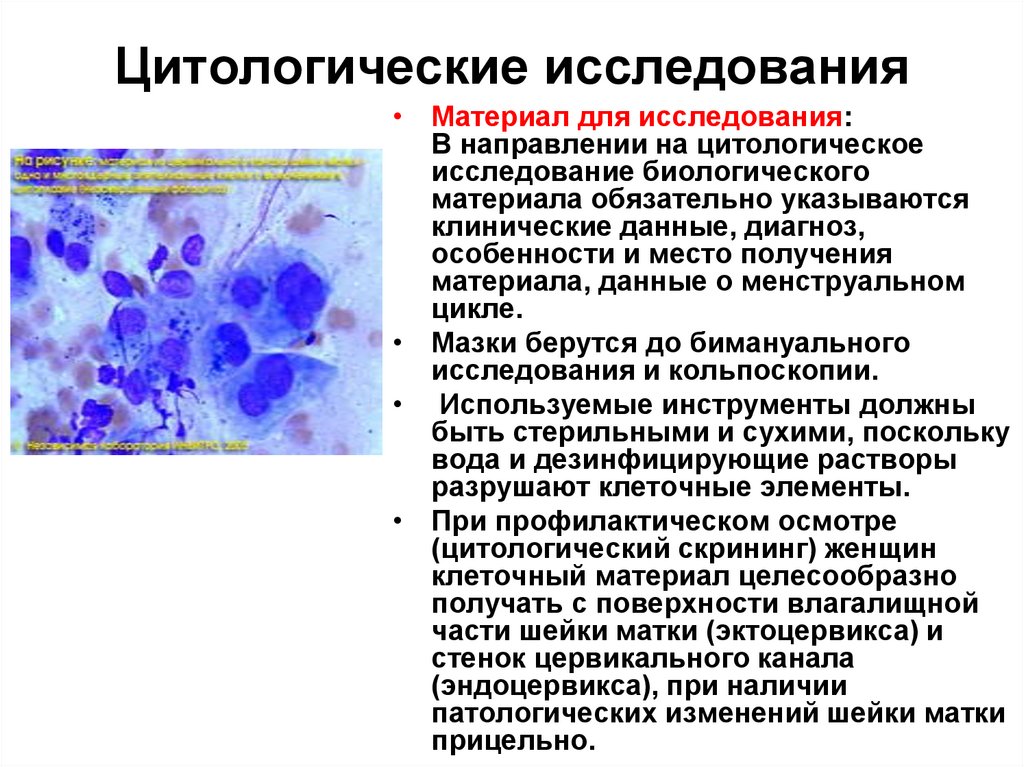


















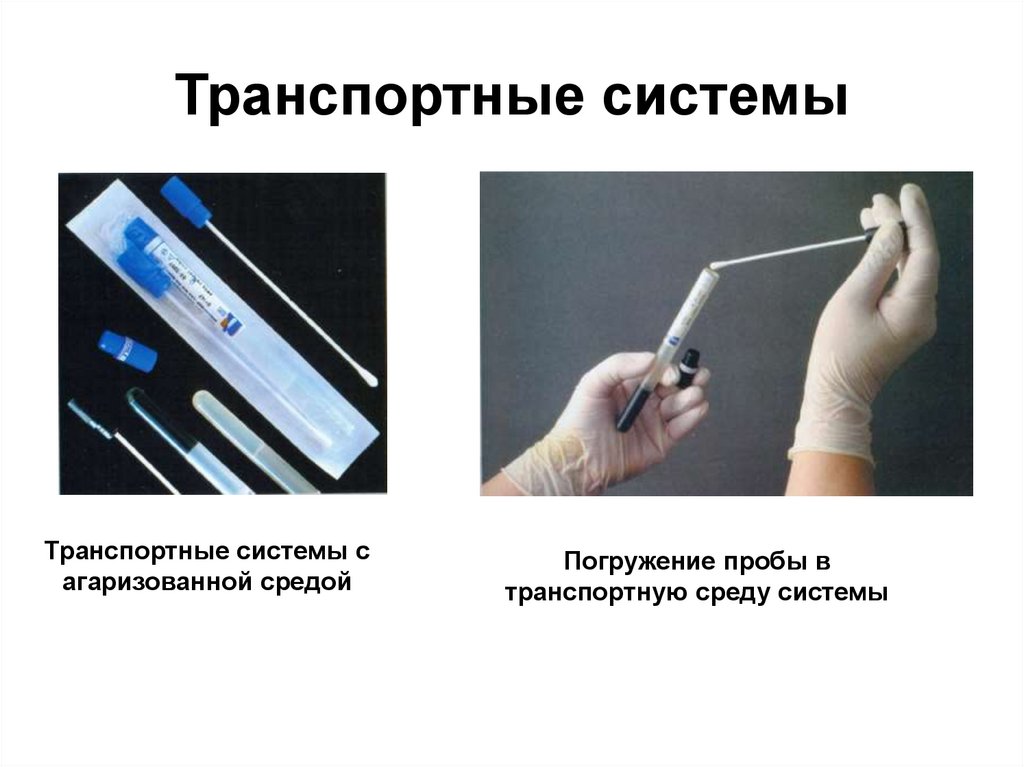























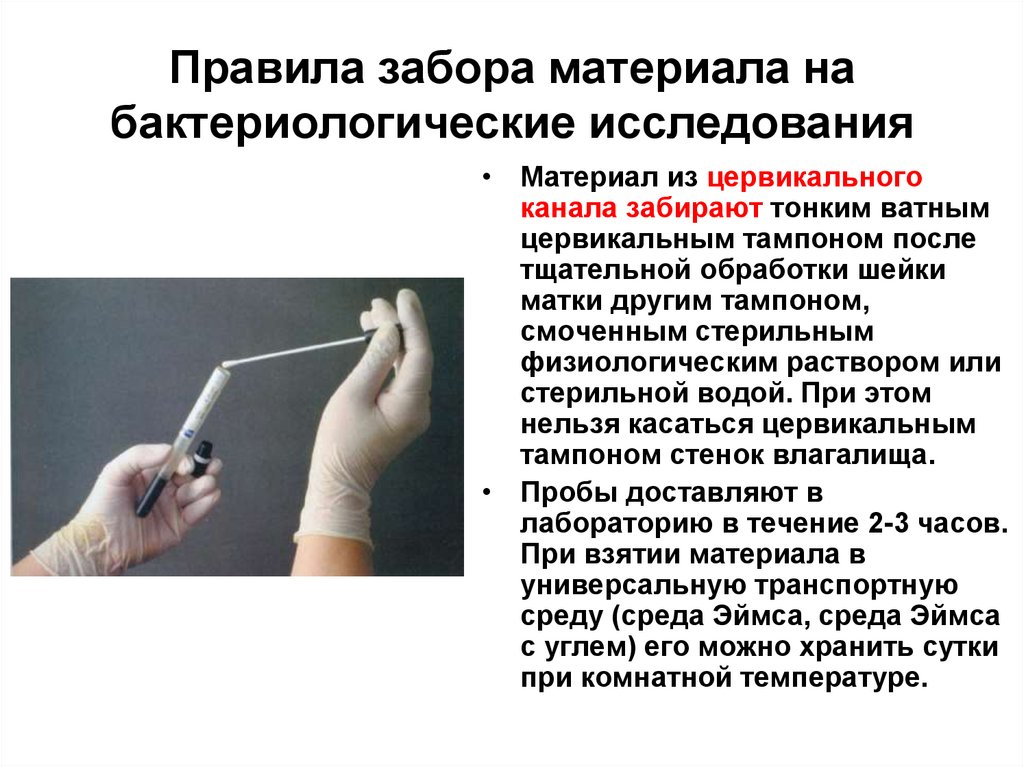

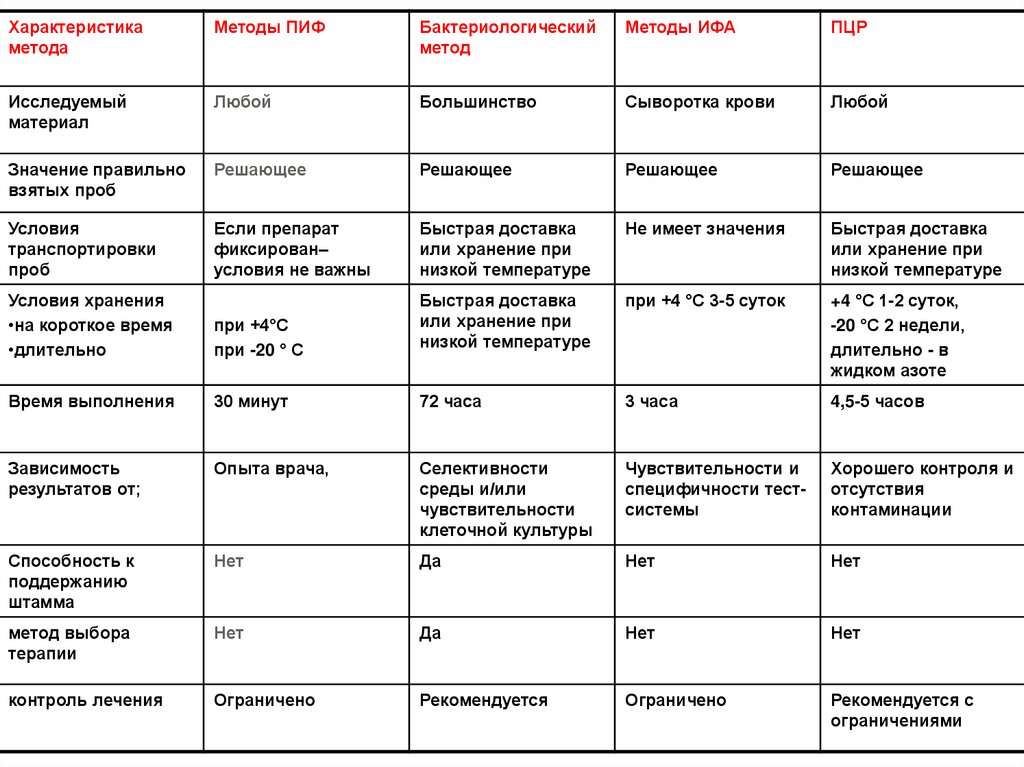











































































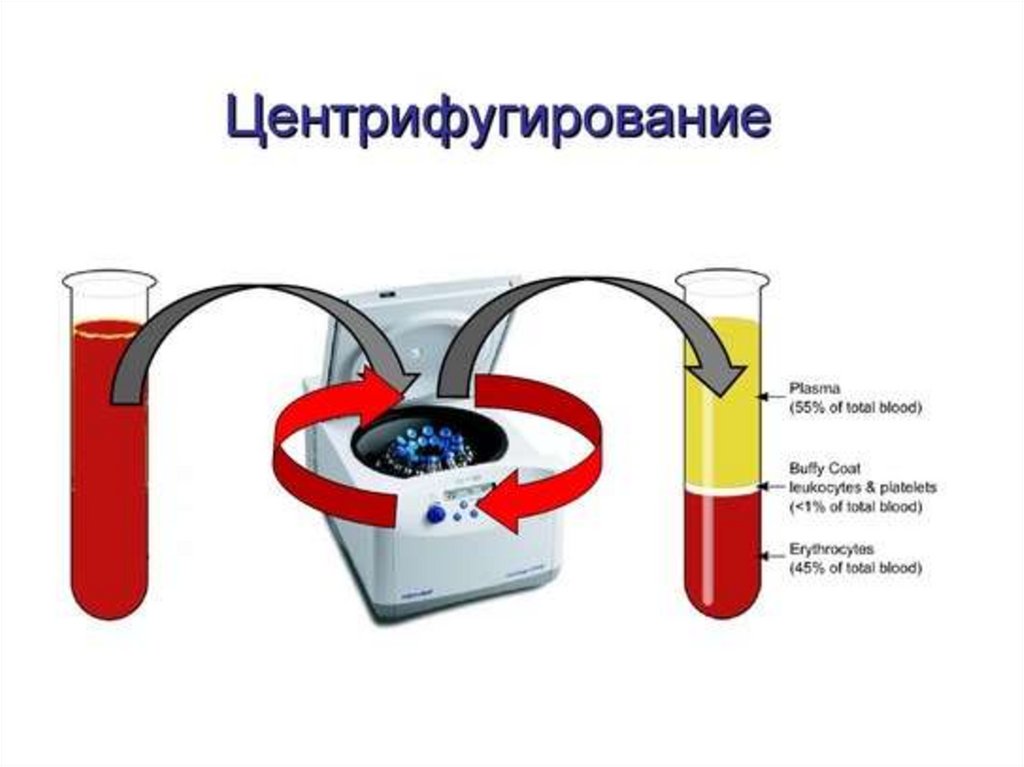

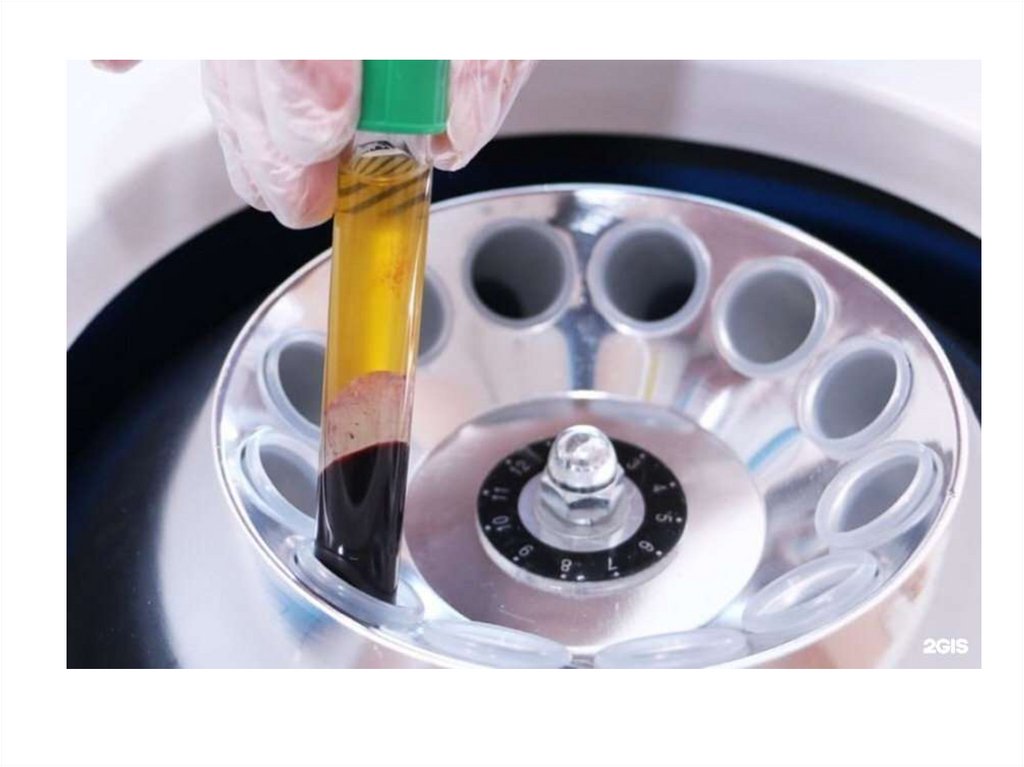
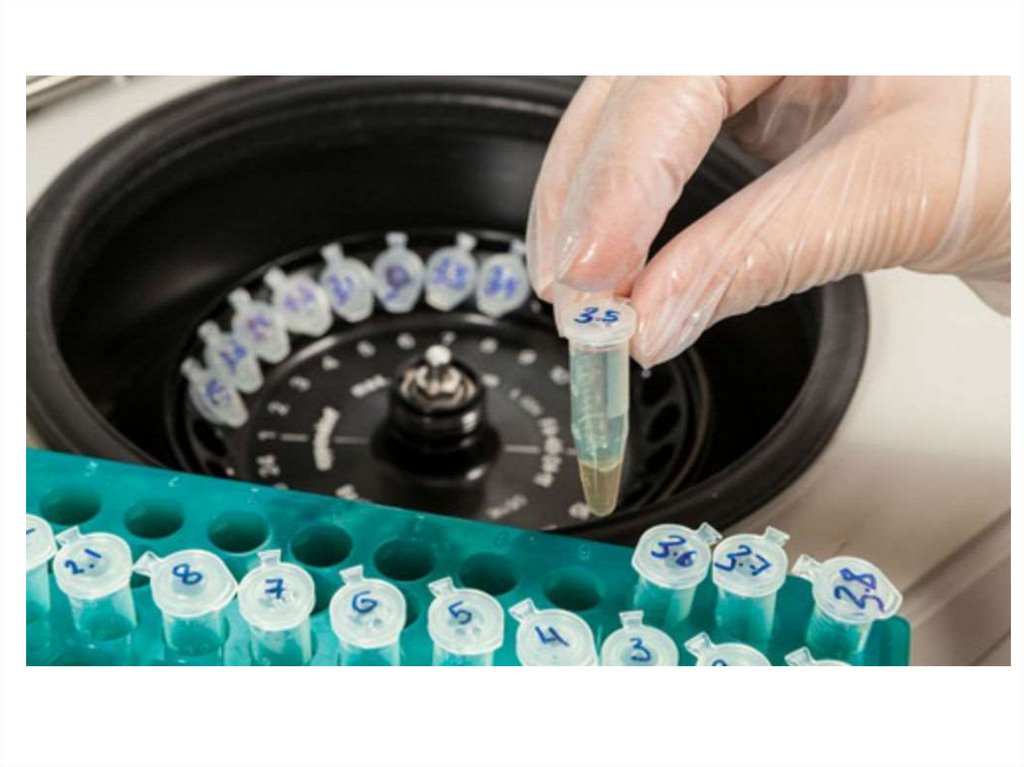




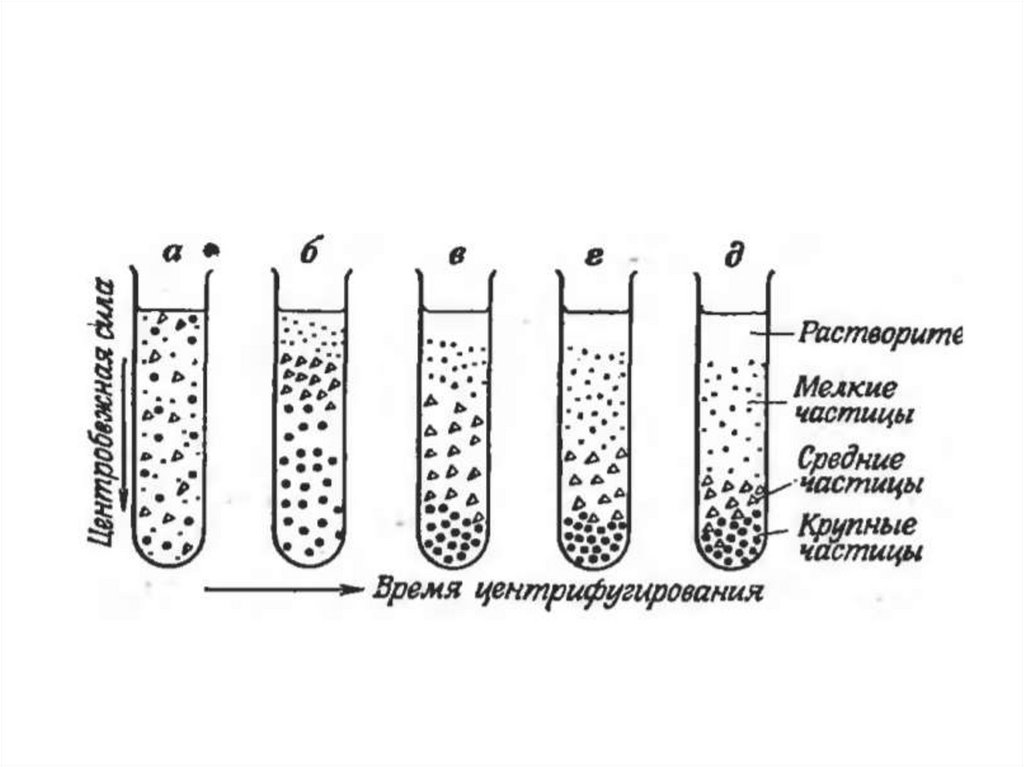

 medicine
medicine








