Similar presentations:
Химиялық тепе-теңдік
1.
2.
Химиялық тепе-теңдік — бір немесе бірнеше қарама-қарсы жүретін қайтымды реакцияларжылдамдықтарының теңескен күйі.Қайтымды реакция аяғына дейін жүрмейді, ол
басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері
реакцияжылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған
заттың концентрациясы азайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан
пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция
жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды.
3.
Әрекеттесуші заттардың концентрациясы химиялық реакция жылдамдығына қалайәсер етеді?
Химиялық реакциялар тез жүруі үшін түйісетін молекулалар саны көп болуы керек, яғни
концентрацияны өсіру керек. Реакцияның жылдамдығына әрекеттесуші заттардың
концентрацияларының әсерін зерттеген Норвегияның екі ғалымы Гульдберг және Вааге 1867
жылы мынадай қорытындыға келген: химиялық реакцияның жылдамдығы реакцияласушы
заттардың концентрацияларының көбейтіндісіне тура пропорционал болады, оны
әрекеттесуші массалар заңы деп атайды.
Жалпы А + В = С теңдеуі бойынша жүретін реакциялар үшін бұл заң мынадай теңдеумен
өрнектеледі.:
ν = k САСВ
Мұндағы СА және СВ – А және В заттарының концентрациясы, моль/л, k – жылдамдық
константасы деп аталатын пропорционалдық коэффицент.
4.
Химиялық тепе-теңдіктің орны тепе-теңдік кезінде барлық реагенттер мен өнімдердіңконцентрациясын анықтау арқылы сипатталуы мүмкін. Барлық реагенттер
концентрациясының тепе-теңдігі бір-бірімен тепе-теңдік тұрақтысының формуласы
арқылы байланысқан.
Тепе-теңдік тұрақтысы формуласын реакция теңдеуінен оңай шығаруға болады. Гомогендік
реакция үшін жалпы формула арқылы беріледі:
aA + bB ⇌ cC + dD, ол келесідегідей түрді қабылдайды:
Kc=[C]c[D]d[A]a[B]b
Kc - тепе-теңдік тұрақтысы
a,b,c,d - стехиометриялық
коэффициенттер
[A] - А реагентінің тепе-теңдік
концентрациясы
[B] - B реагентінің тепе-теңдік
концентрациясы
[C] - С реагентінің тепе-теңдік
концентрациясы
[D] - D реагентінің тепе-теңдік
концентрациясы
5.
Тепе-теңдік константасы - реакцияның маңыздысипаттамасы, оның мәні көп
болған сайын , реакция «тереңірек» жүреді, яғни реакция
нәтижесінде түзілген
заттардың шығымы жоғары болады. Гетерогенді
реакциялар үшін тепе-теңдік
константасы мәніне де қатты заттардың концентрациясы
кірмейді
Химиялық тепе-теңдік кезінде реакциялар тоқтамайды, тек
қарама-қарсы реакциялардың жылдамдықтары теңеседі,
уақыт
бірлігінде түзілген заттар молекулаларының саны
реакцияға
түскен заттар молекулалары санына тең болады.
6.
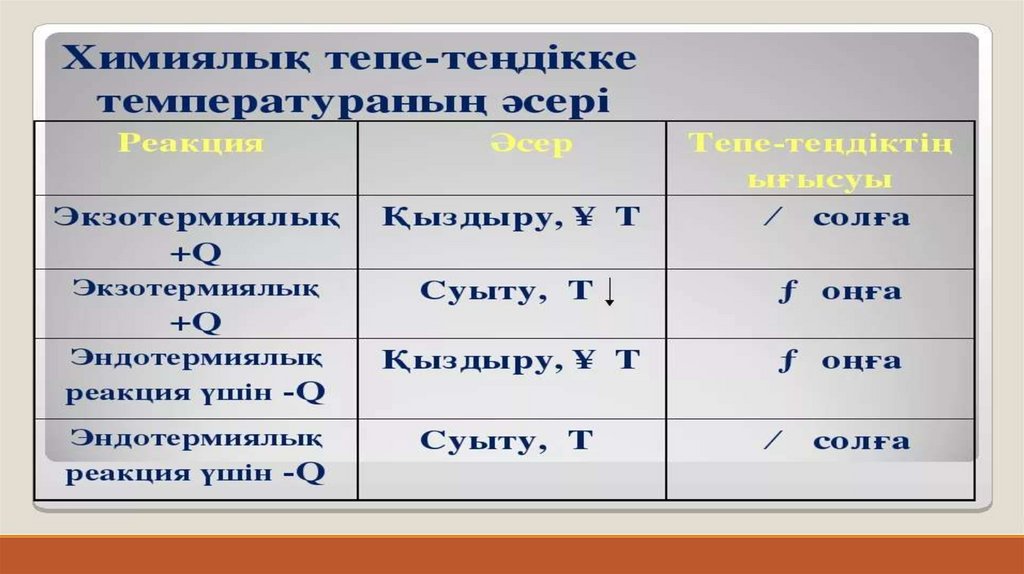
Химиялық тепе-теңдікті ығыстыруҚозғалмалы химиялық тепе-теңдікті реакция жүру жағдайын
(температураны, қысымды, концентрацияны) өзгерту арқылы
бұзуға болады. Химиялық тепе-теңдікті бұзу (қозғау) жүйенің
басқа тепе-теңдік жағдайға ауысуына әкеледі.
Жағдайлардың химиялық тепе-теңдікке әсер етуі 1884 жылы
француз оқымыстысы А.-Л. Ле-Шателье жасаған принциппен
анықталады.
Ле-Шателье принципі деп аталатын тепе-теңдікті ығыстыру
принципінің қазіргі анықтамасы:
Тепе-теңдік жуйесіне сырттай әсер еткен кезде, химиялық
тепе-теңдік осы әрекетке қарама-қарсы әсер ететін жаққа
қарай ығысады.
7.
8.
9.
Қысымды өзгерту, ең болмаса бір зат газ тәріздес жағдайға түскен жүйеге ғана әсер етеді (қатты жәнесұйық заттар ескерілмейді, себебі олардың өздерінің көлемдері газдар мен булардың көлемдерімен
салыстырғанда өте аз).
Қайтымды реакцияларда қысымды арттыру тепе-теңдікті газ тәріздес заттардың мөлшері азаятын жаққа
қарай, яғни көлем азаю жағына қарай, ал қысымды азайту газ тәріздес заттардың мөлшері көбейетін, яғни
көлемі артатын жаққа қарай ығысады:
болғанда, қысымды өзгерту тепе-теңдік
ығысуын тудырмайды.
10.
11.
Тепе-теңдікті ығыстыруға концентрацияның әсеріТепе-тендік жүйедегі газ тәріздес бір заттың (реагенттің немесе өнімнің)
концентрациясын жоғарылатқанда, тепе-теңдік осы заттың жұмсалу
(шығындану) жағына қарай ығысады. Заттың концентрациясын азайтқанда,
тепе-теңдік сол заттың түзілу жағына қарай ығысады. Қатты және сұйық заттар
мөлшерлерін өзгерту тепе-теңдік жағдайына әсер етпейді.
Тепе-теңдікті оңға ығыстыру үшін А
реагентінің артықтық мөлшерін (В
орнына), ал солға ығыстыру тек D өнімінің
артыкпығымен ғана мүмкін болады (басқа
өнім - қатты зат).
12.
Қысым және температураның тепе-теңдік әсері:Изобаралық, изотермиялық потенциал немесе Гиббс
энергиясы белгілі қоспасы бар қайтымды реакция
үшін келесідей жазылады:
Вант-Гофф изотермасының теңдеуі химиялық
реакцияның максималды жұмысын есептеуге және
сол арқылы оның кез-келген нақты жағдайда (Т
температурасы мен ci реактивтерінің концентрациясы
немесе Pi ішінара қысымы кезінде) өздігінен жүру
мүмкіндігін анықтауға мүмкіндік береді.
13.
14.
Химиялық реакциялар жылдамдығының температураға тәуелділігіТемпература жоғарлаған сайын химиялық реакцияның жылдамдығы
артады.Гомогендік реакциялар жылдамдығының температураның жоғарлауына
байланысты артуын 1884 жылы ашылған Вант- Гофф ережесі анықтайды:“Tемператураны
10° өсіргенде реакцияның жылдамдығы 2-4 есе артады”
υТ2 = υТ1 γТ2 – Т1/10,
мұндағы
γ – температуралық коэффициент














 chemistry
chemistry








