Similar presentations:
Циклические углеводороды
1.
Циклическиеуглеводороды
2.
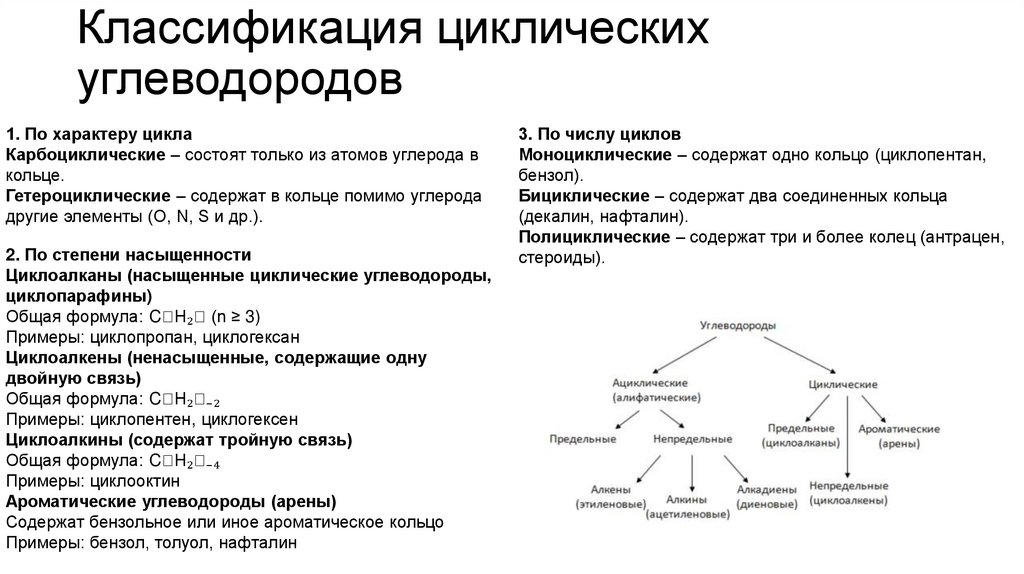
Классификация циклическихуглеводородов
1. По характеру цикла
Карбоциклические – состоят только из атомов углерода в
кольце.
Гетероциклические – содержат в кольце помимо углерода
другие элементы (O, N, S и др.).
2. По степени насыщенности
Циклоалканы (насыщенные циклические углеводороды,
циклопарафины)
Общая формула: CₙH₂ₙ (n ≥ 3)
Примеры: циклопропан, циклогексан
Циклоалкены (ненасыщенные, содержащие одну
двойную связь)
Общая формула: CₙH₂ₙ₋₂
Примеры: циклопентен, циклогексен
Циклоалкины (содержат тройную связь)
Общая формула: CₙH₂ₙ₋₄
Примеры: циклооктин
Ароматические углеводороды (арены)
Содержат бензольное или иное ароматическое кольцо
Примеры: бензол, толуол, нафталин
3. По числу циклов
Моноциклические – содержат одно кольцо (циклопентан,
бензол).
Бициклические – содержат два соединенных кольца
(декалин, нафталин).
Полициклические – содержат три и более колец (антрацен,
стероиды).
3.
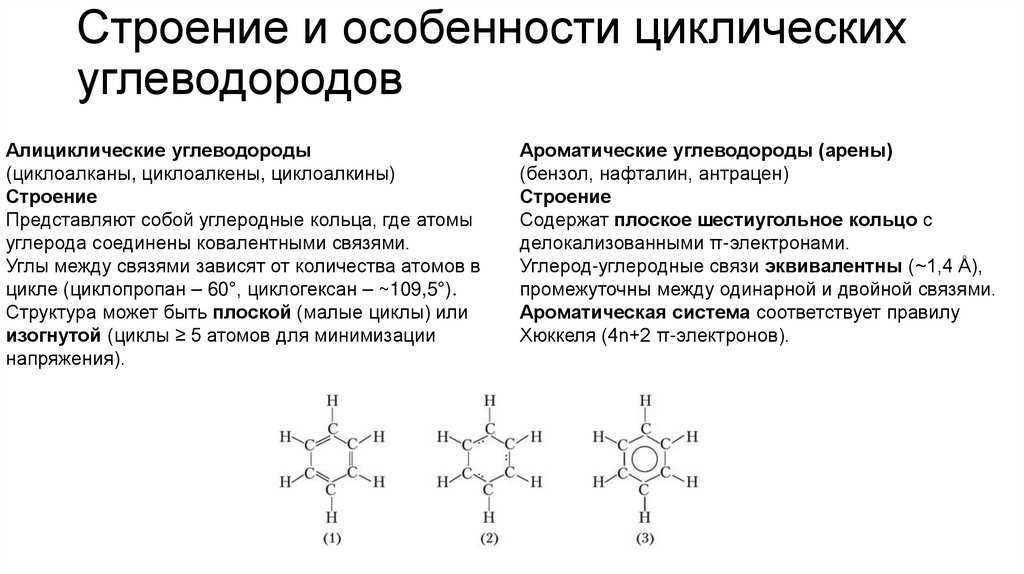
Строение и особенности циклическихуглеводородов
Алициклические углеводороды
(циклоалканы, циклоалкены, циклоалкины)
Строение
Представляют собой углеродные кольца, где атомы
углерода соединены ковалентными связями.
Углы между связями зависят от количества атомов в
цикле (циклопропан – 60°, циклогексан – ~109,5°).
Структура может быть плоской (малые циклы) или
изогнутой (циклы ≥ 5 атомов для минимизации
напряжения).
Ароматические углеводороды (арены)
(бензол, нафталин, антрацен)
Строение
Содержат плоское шестиугольное кольцо с
делокализованными π-электронами.
Углерод-углеродные связи эквивалентны (~1,4 Å),
промежуточны между одинарной и двойной связями.
Ароматическая система соответствует правилу
Хюккеля (4n+2 π-электронов).
4.
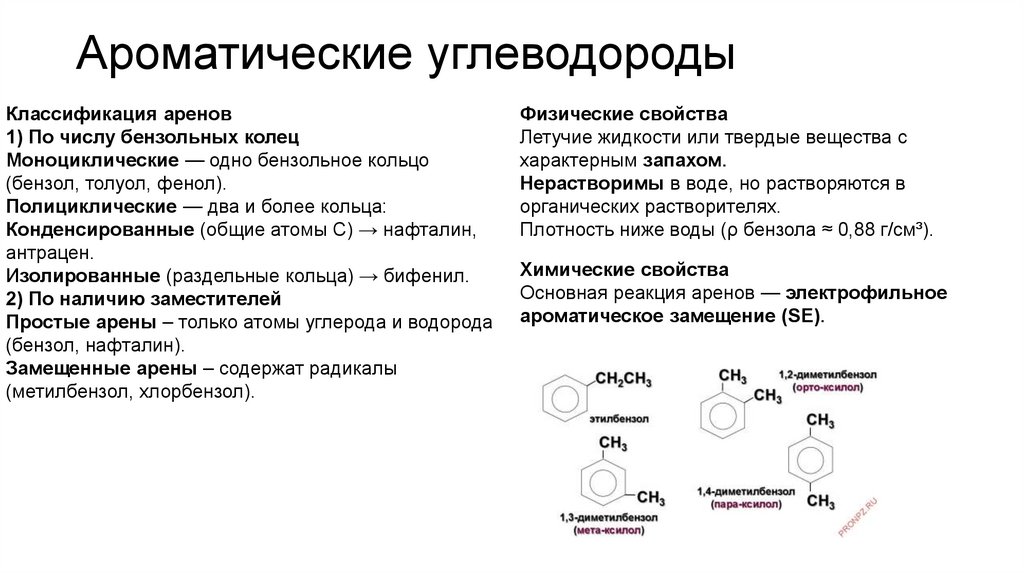
Ароматические углеводородыКлассификация аренов
1) По числу бензольных колец
Моноциклические — одно бензольное кольцо
(бензол, толуол, фенол).
Полициклические — два и более кольца:
Конденсированные (общие атомы C) → нафталин,
антрацен.
Изолированные (раздельные кольца) → бифенил.
2) По наличию заместителей
Простые арены – только атомы углерода и водорода
(бензол, нафталин).
Замещенные арены – содержат радикалы
(метилбензол, хлорбензол).
Физические свойства
Летучие жидкости или твердые вещества с
характерным запахом.
Нерастворимы в воде, но растворяются в
органических растворителях.
Плотность ниже воды (ρ бензола ≈ 0,88 г/см³).
Химические свойства
Основная реакция аренов — электрофильное
ароматическое замещение (SE).
5.
Неароматические циклическиеуглеводороды
Классификация
1) По степени насыщенности
Циклоалканы (циклопарафины) – только одинарные
связи.
Циклоалкены – содержат одну или несколько
двойных связей.
Циклоалкины – содержат тройные связи (редкие,
нестабильные в малых циклах).
2) По размеру цикла
Малые циклы (C₃–C₄) – напряженные (циклопропан,
циклобутан).
Средние циклы (C₅–C₇) – менее напряженные
(циклопентан, циклогексан).
Большие циклы (C₈ и выше) – почти без напряжения
(циклодекан, циклододекан).
Строение
Атомы углерода в sp³-гибридизации (в
циклоалканах).
Возможны конформации (например, циклогексан –
«кресло» и «ванна»).
Циклоалкены и циклоалкины имеют углероды sp²- и
sp-гибридизации соответственно.
Физические свойства
Бесцветные вещества с запахом (похожи на
соответствующие алканы).
Нерастворимы в воде, хорошо растворяются в
органических растворителях.
Температура кипения выше, чем у ациклических
аналогов.
Химические свойства
1) Реакции замещения (Sₙ) (циклоалканы)
2) Реакции присоединения (циклоалкены,
циклоалкины)
3) Реакции окисления
6.
Методы синтеза циклическихуглеводородов
Методы синтеза циклоалканов
1) Внутримолекулярная циклизация
дигалогеналканов
Реакция Вюрца (Zn, Na)
CH₂Br-(CH₂)ₙ-Br + Na → циклоалкан + NaBr
2) Гидрирование аренов (каталитическое)
Бензол + 3H₂ → циклогексан (кат. Pt, Pd, Ni)
Реакция Дильса-Альдера (синтез больших циклов)
Диен + диенофил → циклоалкен
Методы синтеза циклоалкенов
1) Внутримолекулярная дегидрогалогенизация
Br-(CH₂)ₙ-Br + Zn → циклоалкен + ZnBr₂
2) Дегидратация циклических спиртов
Циклический спирт + H₂SO₄ → циклоалкен + H₂O
Методы синтеза аренов
1) Тримеризация ацетилена (реакция Реппе)
3HC≡CH → бензол (кат. C, 400°C)
2) Дегидрирование циклоалканов
Циклогексан → бензол + 3H₂ (кат. Pt, 300°C)
3) Реакция Фриделя-Крафтса (алкилирование,
ацилирование бензола)
Бензол + RCl + AlCl₃ → алкилбензол
Бензол + RCOCl + AlCl₃ → ацилбензол



 chemistry
chemistry