Similar presentations:
АлкАНы. Парафины. Насыщенные углеводороды. Предельные углеводороды. Ациклические углеводороды
1.
АлкАНыПарафины
Насыщенные углеводороды
Предельные углеводороды
Ациклические углеводороды
2.
АлкАНы углеводороды, в молекулах которыхвсе атомы углерода связаны
одинарными Ϭ-связями
3.
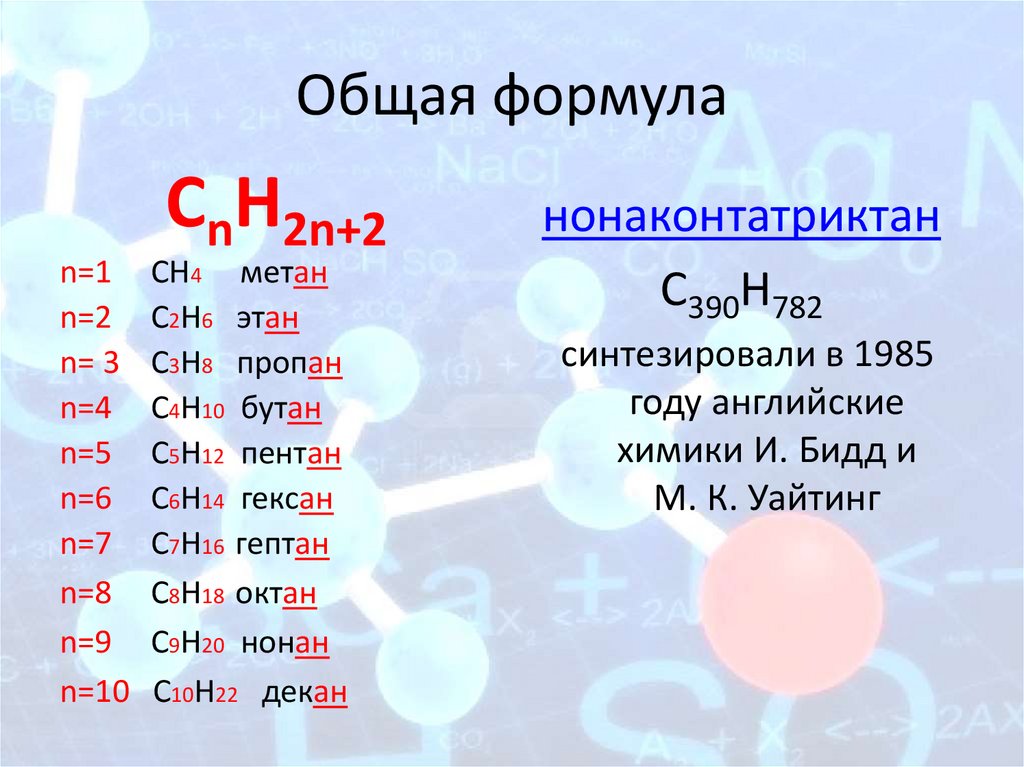
Общая формулаCnH2n+2
n=1 СН4 метан
n=2 С2Н6 этан
n= 3 С3Н8 пропан
n=4 С4Н10 бутан
n=5 С5Н12 пентан
n=6 С6Н14 гексан
n=7 С7Н16 гептан
n=8 С8Н18 октан
n=9 С9Н20 нонан
n=10 С10Н22 декан
нонаконтатриктан
C390H782
синтезировали в 1985
году английские
химики И. Бидд и
М. К. Уайтинг
4.
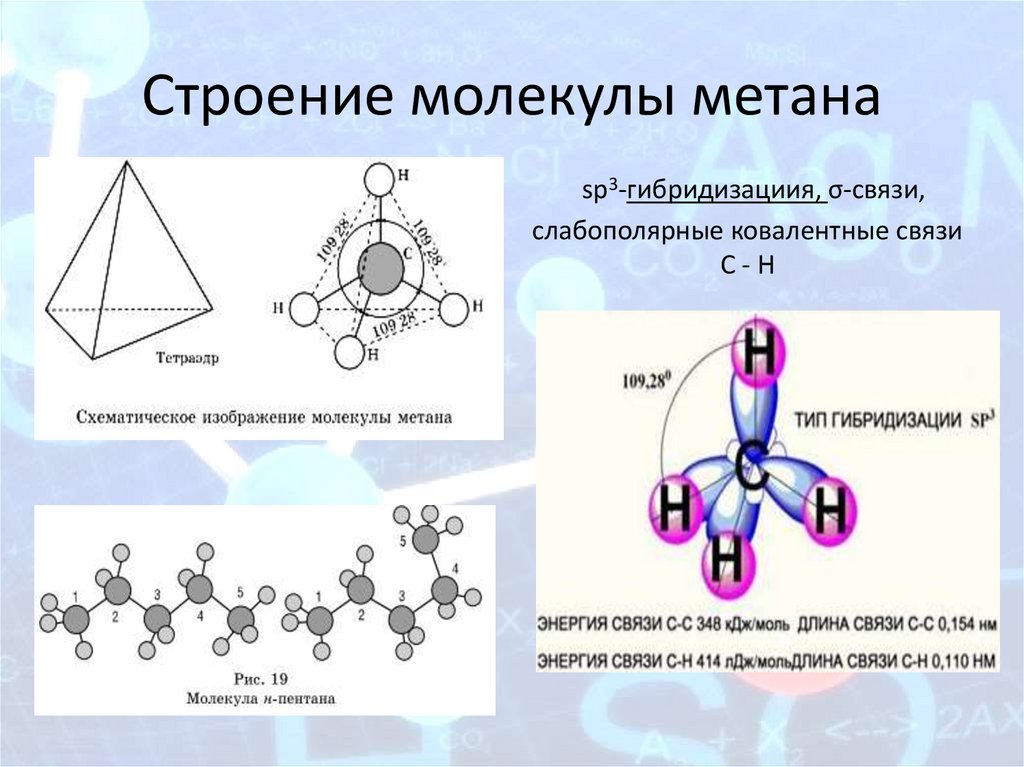
Строение молекулы метанаsp3-гибридизациия, σ-связи,
слабополярные ковалентные связи
С-Н
5.
Изомерия и номенклатураИзомерия
Начиная с n=4, появляется
явление структурной
изомерии
Алканы с n=1,2,3 изомеров
не имеют
Номенклатура
Доминирующей номенклатурой
является номенклатура IUPAC. В
тоже время в ней присутствуют
элементы тривиальных
названий. Так, первые четыре
члена гомологического ряда
алканов имеют тривиальные
названия. Названия остальных
гомологов образованы от
греческих латинских
числительных с добавлением
суффикса “ан”
6.
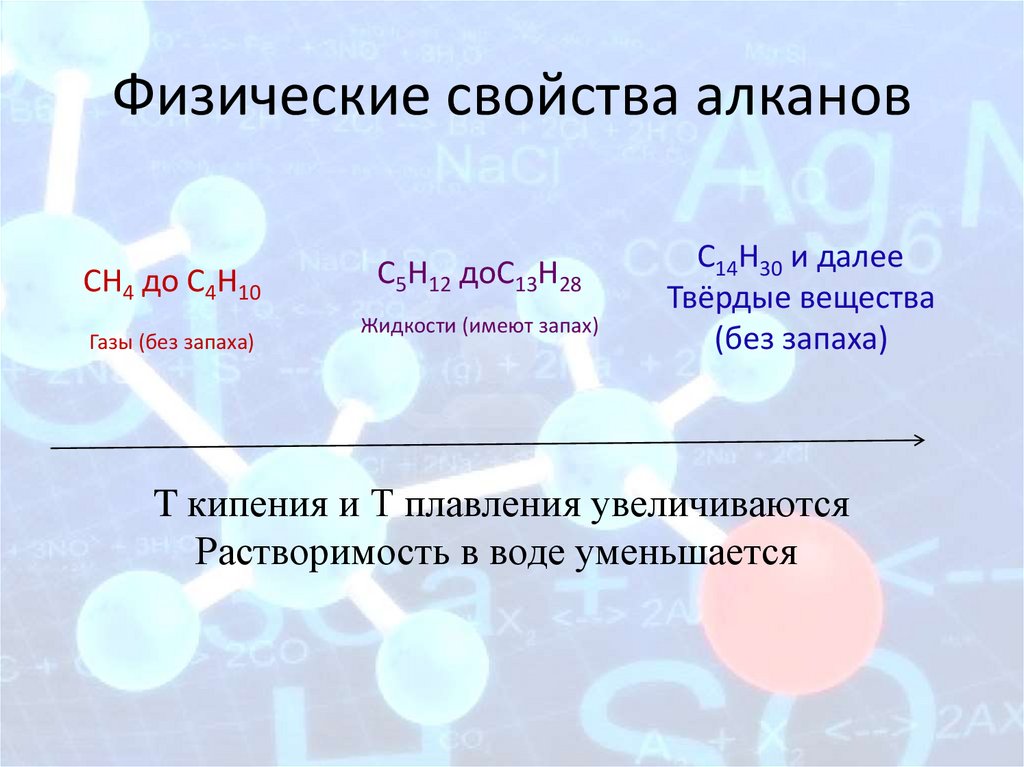
Физические свойства алкановCH4 до C4H10
Газы (без запаха)
C5H12 доC13H28
Жидкости (имеют запах)
C14H30 и далее
Твёрдые вещества
(без запаха)
T кипения и Т плавления увеличиваются
Растворимость в воде уменьшается
7.
Получение алкановМЕТАН
1. Из природного газа
2. Гидролиз карбида алюминия
Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
Также можно карбид алюминия обработать
кислотой (кислотный гидролиз)
Al4C3 + 12HCl → 3CH4↑ + 4AlCl3
Другие алканы получить этим способом нельзя!
8.
Получение алкановМЕТАН
3. Газификация твёрдого топлива
(t=600с, P, Ni )
С + 2Н2 → СН4
4. Синтез водяного газа (t=300с, Ni )
CO + 3H2 → CH4 + H2O↑
9.
Получение алкановГомологи метана
1. Гидрирование непредельных
углеводородов (алкенов и алкинов)
• Из алкенов СnH2n +H2 → CnH2n+2
CH2=CH2 + H2 → CH3-CH3
• Из алкинов СnH2n-2 + 2H2 → CnH2n+2
CH≡CH + 2H2 → CH3-CH3
Реакции протекают при нагревании и
катализаторе – никеле или платине
(t°C, Ni, Pt, Pd)
10.
Получение алкановГомологи метана
2. Реакция Вьюрца (Вьюрц Шарль Адольф, фр.
химик, 1855г)
t
2R-I + 2Na → 2NaI + R-R
CH3I + CH3I + 2Na → C2H6 + 2NaI
CH3Cl + C2H5Cl + 2Na → C2H6 + C3H8 + C4H10 + 2NaCl
11.
Получение алкановМетан и его гомологи
1. Сплавление солей карбоновых кислот со
щелочами (декарбоксилирование солей
карбоновых кислот) - реакция Дюма
t
CH3COONa +NaOH → CH4 ↑ +Na2CO3
2. Электролиз солей карбоновых кислот
(синтез Кольбе)
2R-COONa + 2H2O
электр-з
→ R – R↑ + 2CO2↑ + H2↑ + 2NaOH
12.
Химические свойства• Ковалентные связи неполярные и очень
прочные →реакции замещения!!!
• При комнатной температуре не
взаимодействуют с сильными кислотами,
щелочами, окислителями (КMnO4)
• Не обесцвечивают бромную воду и
перманганат калия
13.
I. Реакции замещения1. Галогенирование (радикальное замещение)
( с хлором Cl2 –на свету, Br2- при нагревании)
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан)
14.
I. Реакции замещения2. Нитрование (реакция Коновалова) (t=140c,
HNO3 разб. )
CH4 + HNO3 (разб) → CH3NO2+ H2O
15.
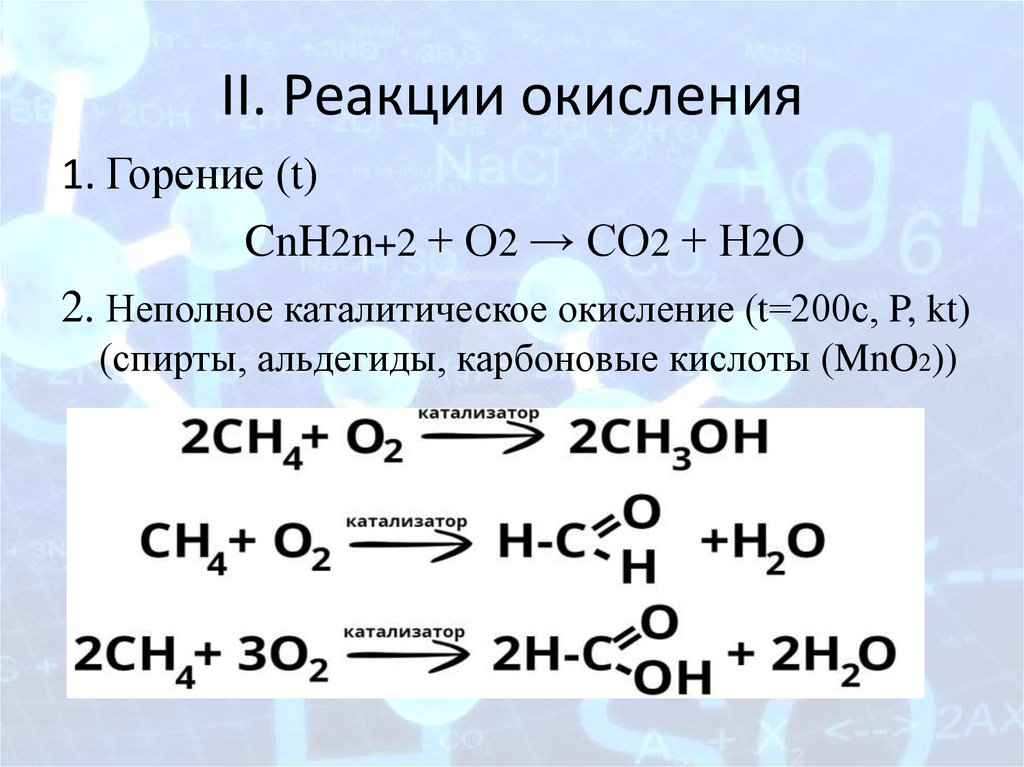
II. Реакции окисления1. Горение (t)
CnH2n+2 + О2 → СО2 + Н2О
2. Неполное каталитическое окисление (t=200с, P, kt)
(спирты, альдегиды, карбоновые кислоты (MnO2))
16.
III. Термическое преобразование1. ПИРОЛИЗ МЕТАНА
(Пиролиз - термическое разложение)
• Длительное нагревание до 1000°C.
СН4 → С + 2Н2
• Мгновенное нагревание до 1500°C.
2СН4 → CH≡CH + 3Н2
17.
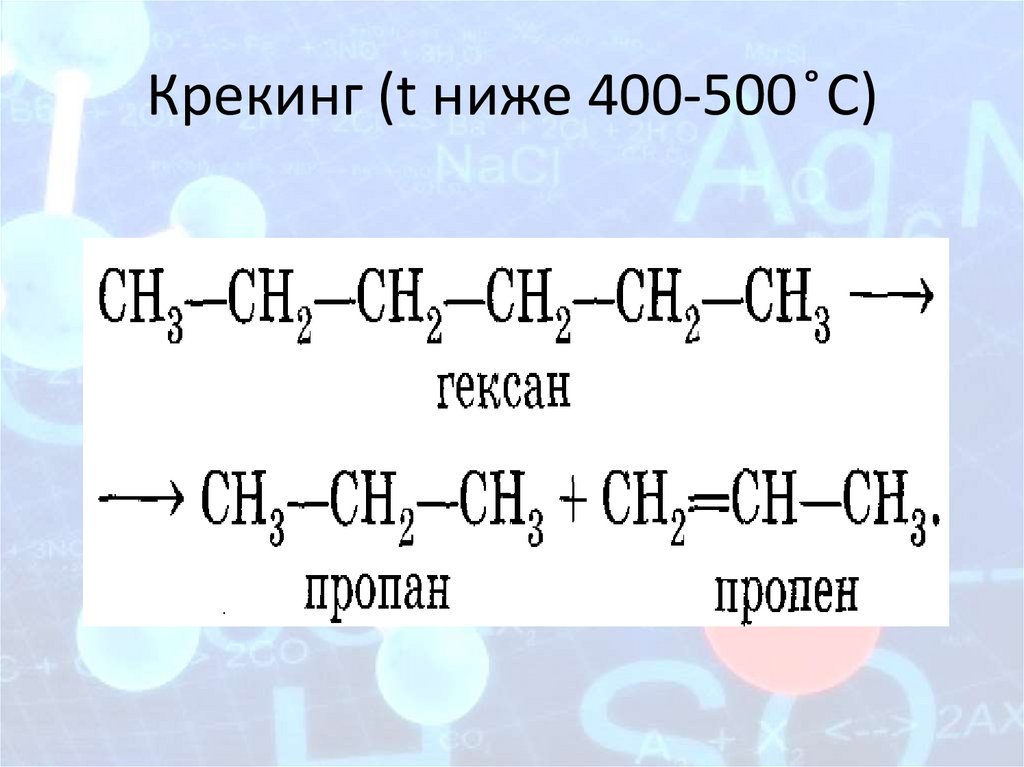
2. Крекинг1) Крекинг - (англ. cracking, от crack — расщеплять),
переработка нефти и её фракций, протекающая с
распадом тяжёлых углеводородов. Наряду с
распадом при крекинге, происходят
изомеризация, циклизация, полимеризация и
конденсация.
2) Для алканов с длинными цепями при крекинге
получается алкан и алкен. Причём при длине
больше 5 атомов С получится смесь
углеводородов разной длины.
C6H14 →C2H6 + C4H8
18.
Крекинг (t ниже 400-500 ̊С)19.
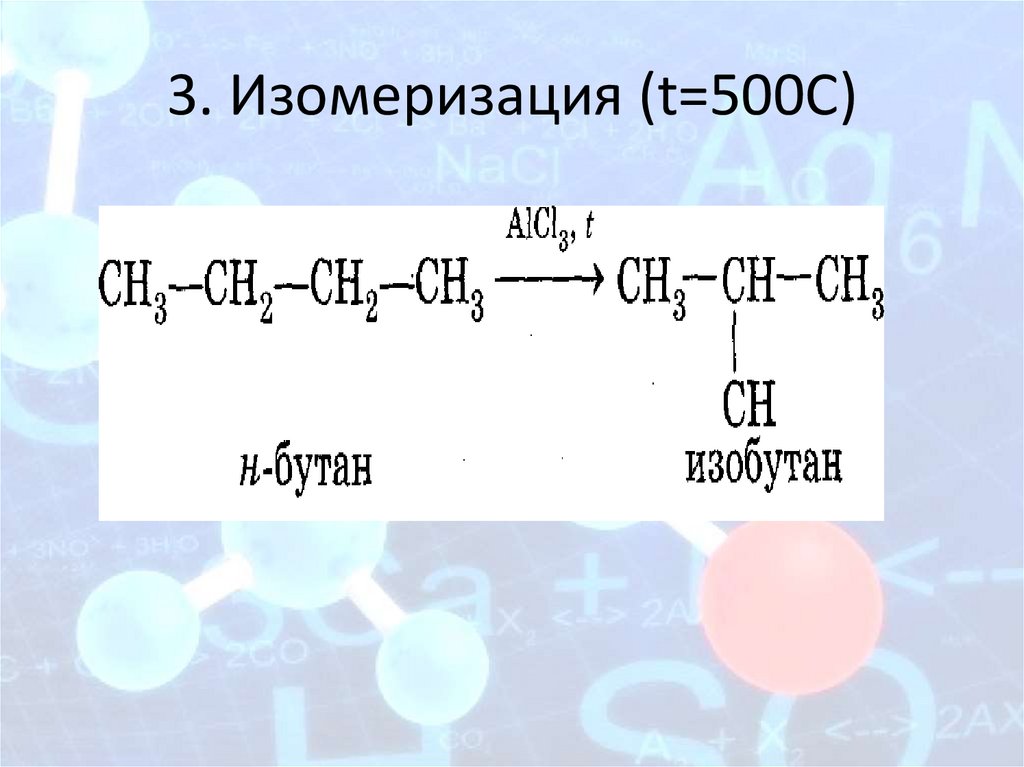
3. Изомеризация (t=500С)20.
IV. Отщепление1. Дегидрирование
• t=400-600 °C, кат.- Pt, Ni, Al2O3, Cr2O3
СН3-СН3 → CH2=CH2 + Н2
2. Дегидроциклизация (ароматизация)
• ( t=300c, Pt)
21.
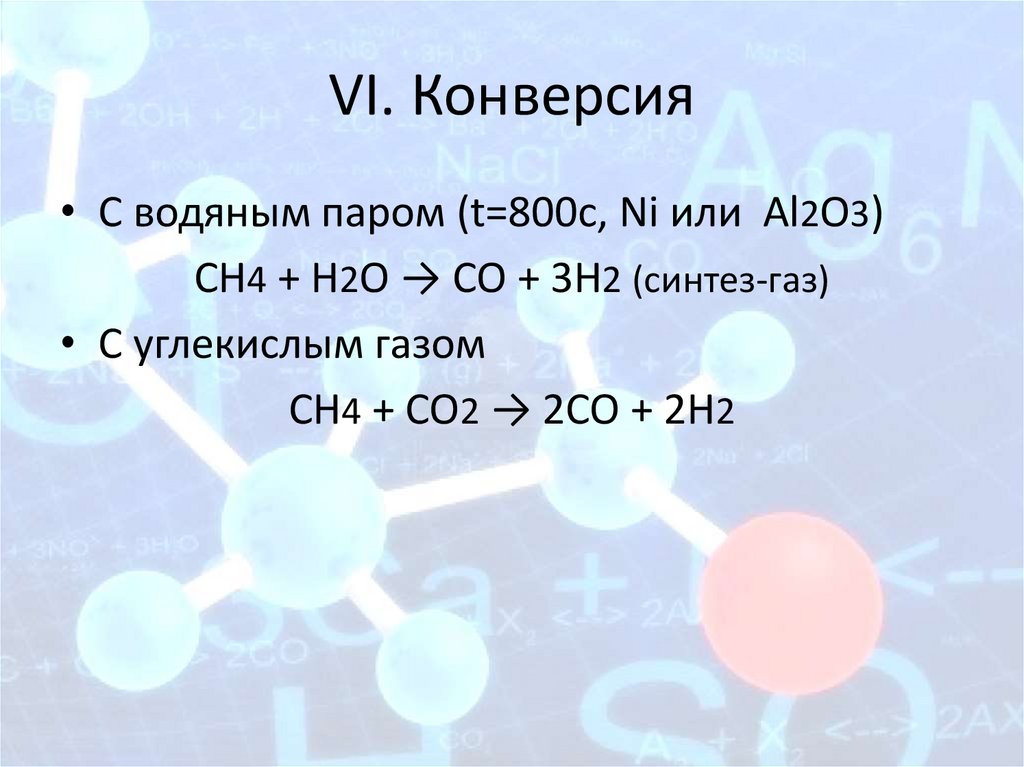
VI. Конверсия• С водяным паром (t=800с, Ni или Al2O3)
СН4 + Н2О → СО + 3Н2 (синтез-газ)
• С углекислым газом
СН4 + CO2 → 2СО + 2Н2
22.
Задачи1. Относительная плотность по водороду некоторого
алкана 15. Определите его формулу.
2. Плотность алкана при н.у. 2,59 г/л. Определите его
формулу.
3. Массовая доля углерода в алкане составляет 84%.
Определите его формулу.
4. При сгорании 2,2г органического вещества,
имеющего плотность по воздуху 1,517,
образовалось 3,36л углекислого газа (н.у) и 3,6г
воды. Определите формулу органического
вещества.
23.
Список литературы1.
2.
2.
3.
4.
5.
6.
Габриелян О.С. Химия. 10 класс. Базовый уровень: учебебник/
О.С.Габриелян.-2-е изд., стереотип. - М.:Дрофа, 2017.
Егоров А.С. Химия: экспресс-репититор для подготовки к ЕГЭ. –
Ростов н/Д:Феникс,2017.
Крышилович Е.В. Химия.- Москва:Эксмо,2018.
Органическая химия. 10 класс. Интерактивные дидактические
материалы. – М.: Планета,2012.
Химия. Большой справочник для подготовки к ЕГЭ: справочное
издание/ под ред. Дронькина В.Н. – Ростов н/Д: Легион,2017.
http://himege.ru/
https://ru.wikipedia.org/
















 chemistry
chemistry








