Similar presentations:
Кислород. Природные соединения
1.
Кислород2.
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха.Плохо растворим в воде. Жидкий кислород – голубоватая жидкость,
кипящая при -183оС.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим
запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент.
Кислород входит в состав многих минералов — силикатов, карбонатов и
др.
Массовая доля элемента кислорода в земной коре — около 47 %.
Массовая доля элемента кислорода в морской и пресной воде составляет
85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по
объёму и 23,10 % по массе.
3.
Природные соединения1. Воздух - в составе воздуха кислород занимает 21%.
1. В форме различных минералов в земной коре кислорода содержится около 50%.
1. В живых организмов кислород входит в состав органических веществ: белков,
жиров, углеводов и нуклеиновых кислот.
Атом кислорода имеется два
неспаренных электрона,
максимальная валентность II.
4.
Получение1. В промышленности кислород получают перегонкой жидкого воздуха.
2. Лабораторные способы получения кислорода:
Разложение некоторых кислородосодержащих веществ:
• Разложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2
• Разложение бертолетовой соли в присутствии катализатора MnO2:
2KClO3 → 2KCl + 3O2
• Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O + O2
2HgO → 2Hg + O2
2KNO3 → 2KNO2 + O2
• На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑
5.
Химические свойстваЯвляется самым активным неметаллом после фтора. Чаще всего реакции с
кислородом экзотермичны (горение), ускоряются при повышении температуры.
1. Реакции с неметаллами
NO + O2 → (t) NO2
N2 + O2 → 2NO
S + O2 → (t) SO2
2C + O2 = (t) 2CO
(неполное окисление - угарный газ, соотношение 2:1)
C + O2 = (t) CO2
(полное окисление - углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
6.
7.
2. Реакции с металламиВ реакциях кислорода с металлами образуются оксиды, пероксиды и
супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
2Ca + O2 → 2CaO
3. Горение воды
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2
4. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2H2S + 3O2→ 2H2O + 2SO2
4NH3 + 3O2→ 2N2 + 6H2O
4NH3 + 5O2→ 4NO + 6H2O
2CO + O2→ 2CO2
8.
5. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления вводных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
9.
Оксиды — сложные веществаОксиды — сложные вещества, состоящие из атомов двух химических элементов,
один из которых — кислород.
В составе сложных веществ атомы кислорода всегда проявляют валентность,
равную II. Например: SiO2, CuO, CaO, Al2O3 и др. Такие сложные вещества
называют оксидами.
При
обычных
условиях
оксиды
различных
элементов могут находиться в жидком (H2O),
твердом (CaO) и газообразном (CO2) состояниях.
Они могут иметь самую разную окраску (белые
CaO, Al2O3, черные CuO, Ag2O, красный HgO,
коричневый
Fe2O3)
и
различаться
другими
физическими свойствами.
10.
Название оксидовНазвание оксида образуется из слова оксид и названия химического
элемента. Например,
оксид магния — MgO,
оксид натрия — Na2O,
оксид водорода — H2O.
Если
атомы
химического
элемента
проявляют
переменную валентность, то после названия этого элемента в
круглых скобках следует указать римскую цифру, показывающую
валентность этого химического элемента в данном оксиде.
Например,
оксид серы(IV) — SO2,
оксид серы(VI) — SO3,
оксид железа(III) — Fe2O3,
оксид фосфора(V) — P2O5.
11.
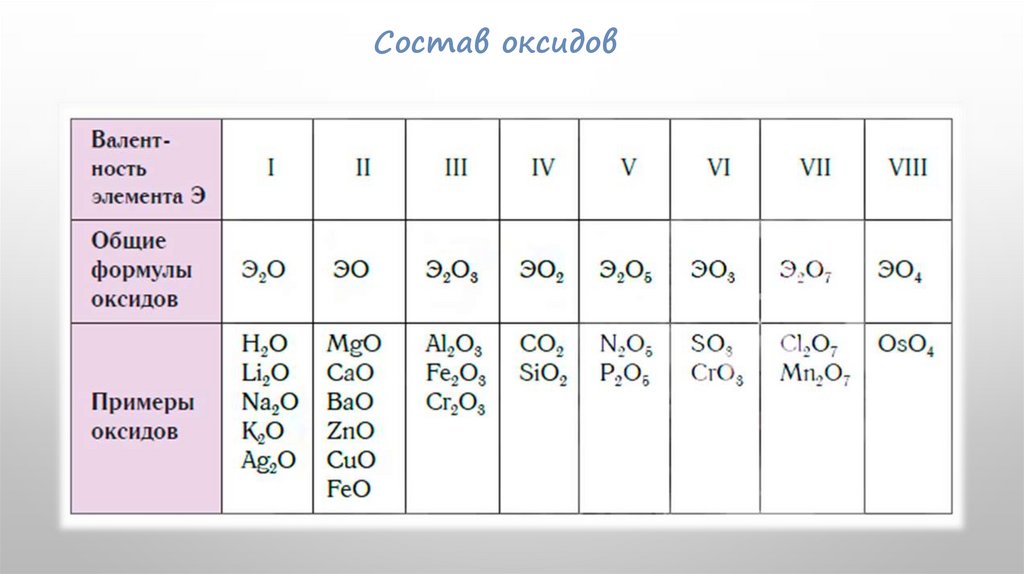
Состав оксидов12.
Получение оксидов1. Взаимодействие простых веществ с кислородом:
4Al + 3O2 → 2Al2O3
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
3Fe + 2O2 → Fe3O4
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
S + O2 → SO2
2SO2 + O2 = 2SO3
N2 + O2 = 2NO
2. Окисление сложных веществ:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак
окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов.
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном
растворе угольная кислота, сернистая
кислота, гидроксид аммония, гидроксиды
серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Разложение солей.
Например, нерастворимые карбонаты и
карбонат
лития
при
нагревании
разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
13.
Классификация оксидов14.
15.
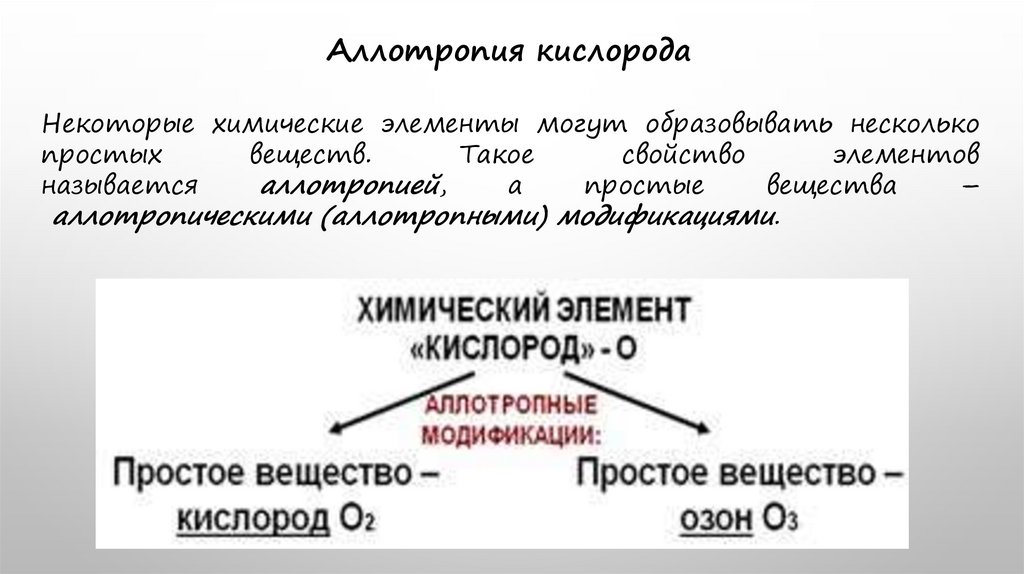
Аллотропия кислородаНекоторые химические элементы могут образовывать несколько
простых
веществ.
Такое
свойство
элементов
называется
аллотропией,
а
простые
вещества
–
аллотропическими (аллотропными) модификациями.
16.
Задания1. Определите массу:
а) 3 моль газообразного кислорода,
б) 14 моль
газообразного кислорода.
2. Определите массовую долю кислорода: а) в серной кислоте H2SO4,
б) в
пероксиде водорода Н2O2, в) в карбонате кальция СаСО3,
г) в сульфате
меди CuSO4.
4. Из перечня веществ выберите оксиды и дайте им названия.
K₂S, N₂O, MgSO₄, KCl, CuS, Fe₂O₃, NaOH, Cl₂O₅, SO₃, P₂O₃.
5. Напишите уравнения химических реакций получения следующих оксидов и
назовите их:
Li₂O, CaO, B₂O₃.
6. На основании данных значений валентности выберите из приведенного ниже
перечня веществ формулы оксидов, которые составлены правильно. Напишите
уравнения химических реакций получения этих оксидов и дайте им названия.
III
II
II I
III
VI
Al₂O₃, Ba₂O, NO, K₂O, Au₂O, Cr₂O₃.












 chemistry
chemistry








