Similar presentations:
Тема 7 Химическая термодинамика
1.
Тема 7Химическая
термодинамика
2.
• Химические реакции неразрывно связаны сэнергетическими явлениями
• В каждом веществе есть запас энергии (U)
• Энергия химических соединений сосредоточена
главным образом в химических связях
• Продукты питания позволяют организму
использовать энергию химических соединений,
содержащихся в пище. В организме эта энергия
преобразуется в движение, работу, идет на
поддержание постоянной температуры тела
3.
Химическая термодинамика изучает законы,описывающие обмен энергией между изучаемой
системой и внешней средой
Разделы:
• Химическое равновесие
• Термохимия (учение о тепловых эффектах)
• Теория растворов
Основные задачи:
• Предсказать возможность осуществления процесса,
указать направление его протекания
• Рассчитать равновесный состав
• Предсказать влияние различных факторов на
состояние равновесия
4.
Система – отдельное тело (совокупностьвзаимодействующих тел), которое может быть
выделено из окружающей среды и существовать вне еѐ
По структуре
гомогенные (одна фаза, отсутствует
поверхность раздела фаз)
гетерогенные (несколько фаз,
отделенных друг от друга поверхностью
раздела)
однокомпонентные
многокомпонентные
открытые (обмениваются теплом и
По взаимод-ю веществом)
с окружающей закрытые (обмениваются только теплом)
средой
изолированные (не обмениваются ни
теплом, ни веществом)
По составу
5.
• Состояние любой системы определяетсясовокупностью еѐ свойств
• Выделяют
термодинамические параметры (p, V, T) и
термодинамические функции (внутренняя
энергия, энтальпия, энтропия, энергия Гиббса и пр.)
• Свойства системы разделяются на
экстенсивные (зависят от размера системы – m, V)
и интенсивные (не зависят от размера системы –
p, T, ρ, C)
Свойства системы
6.
• Внутренняя энергия (U) – функция состояниясистемы, характеризующая еѐ общую энергию за
вычетом кинетической и потенциальной энергии
• Энтальпия (H = U + pV) – функция состояния
системы, не зависящая от пути протекания
процесса. Показывает количество энергии, которое
доступно для преобразования в теплоту при
определенной температуре и давлении
• Энтропия (S) – функция состояния системы,
определяющая меру необратимого рассеивания
энергии
Термодинамические функции
7.
Количество теплоты, полученное системой,идѐт на изменение еѐ внутренней энергии и
совершение работы против внешних сил
Q U A
• Первое начало представляет собой закон
сохранения энергии для
термодинамических систем
• При постоянном давлении Q = ΔH
Первое начало термодинамики
8.
Энтропия изолированнойсистемы не может
уменьшаться
Второе начало позволяет определить:
• направление протекания процесса
• возможность (невозможность) его осуществления
• условия состояния равновесия
Второе начало термодинамики
9.
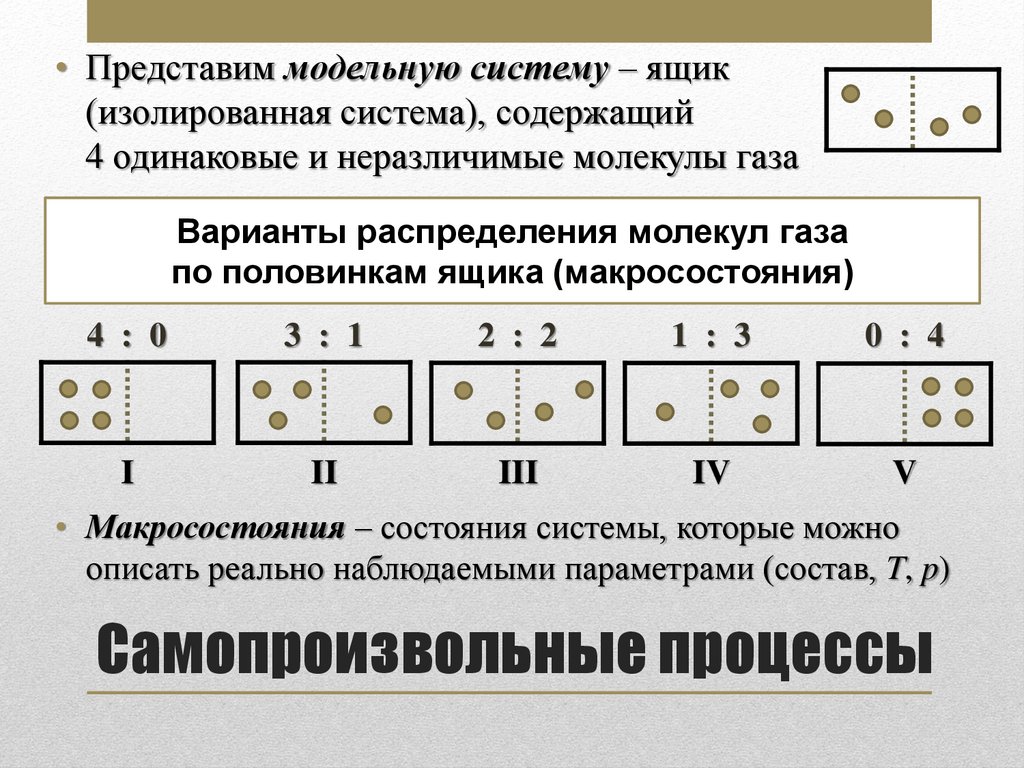
• Представим модельную систему – ящик(изолированная система), содержащий
4 одинаковые и неразличимые молекулы газа
Варианты распределения молекул газа
по половинкам ящика (макросостояния)
4 : 0
3 : 1
2 : 2
1 : 3
0 : 4
I
II
III
IV
V
• Макросостояния – состояния системы, которые можно
описать реально наблюдаемыми параметрами (состав, T, p)
Самопроизвольные процессы
10.
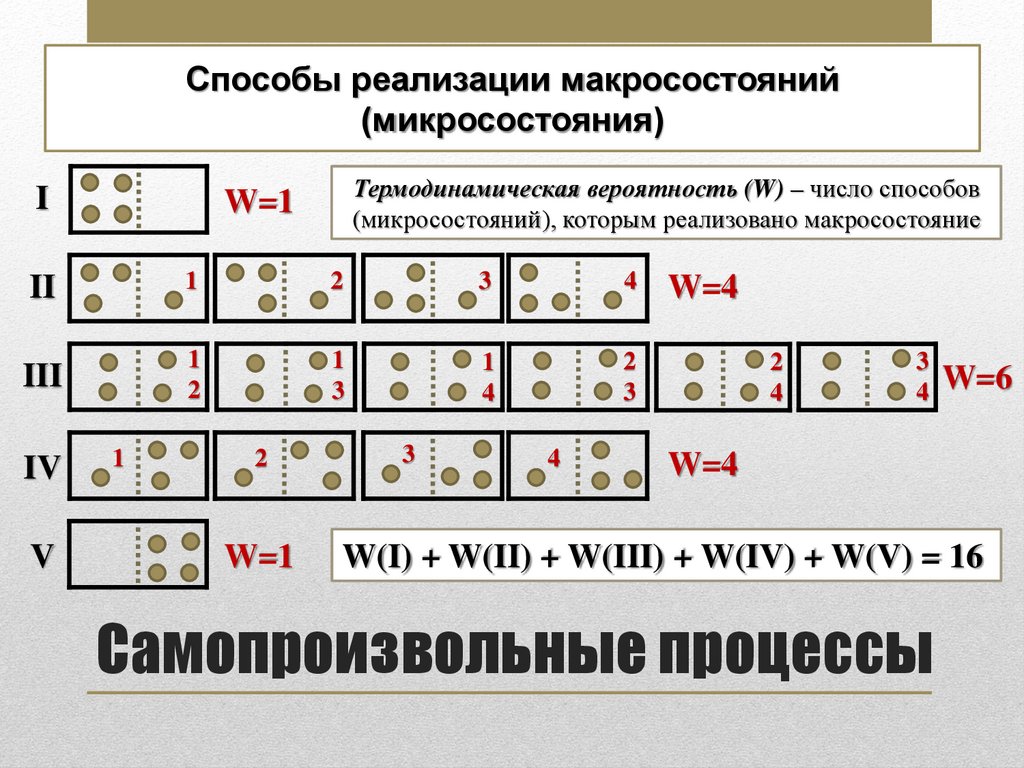
Способы реализации макросостояний(микросостояния)
I
Термодинамическая вероятность (W) – число способов
(микросостояний), которым реализовано макросостояние
W=1
II
1
2
3
4
III
1
2
1
3
1
4
2
3
IV
V
1
2
W=1
3
4
W=4
2
4
3
4 W=6
W=4
W(I) + W(II) + W(III) + W(IV) + W(V) = 16
Самопроизвольные процессы
11.
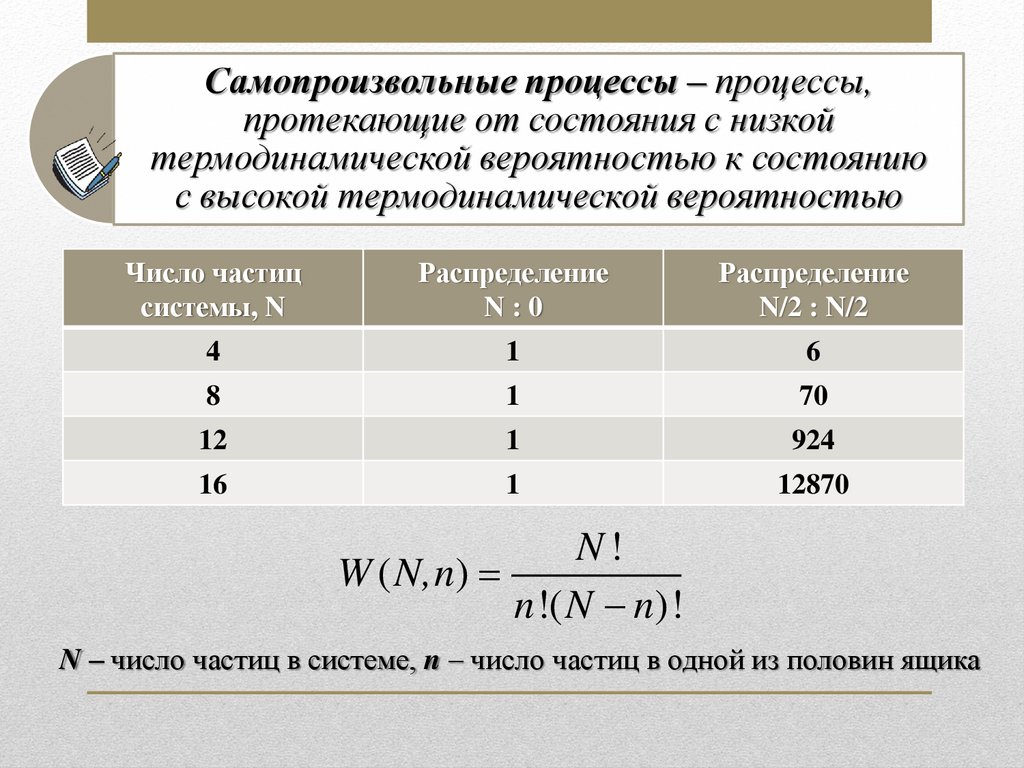
Самопроизвольные процессы – процессы,протекающие от состояния с низкой
термодинамической вероятностью к состоянию
с высокой термодинамической вероятностью
Число частиц
системы, N
Распределение
N:0
Распределение
N/2 : N/2
4
1
6
8
1
70
12
1
924
16
1
12870
N!
W ( N,n)
n !( N n)!
N – число частиц в системе, n – число частиц в одной из половин ящика
12.
В изолированной системе энтропия служиткритерием самопроизвольности протекания
процесса и состояния равновесия
• При протекании необратимого процесса энтропия
возрастает (ΔS > 0)
• В состоянии равновесия S постоянна (ΔS = 0)
• Если ΔS < 0, то протекание процесса в данных
условиях маловероятно
Изолированные системы
13.
В закрытых системах критериемсамопроизвольности протекания процесса при
постоянном давлении и температуре служит
энергия Гиббса (G = H – TS)
• При протекании необратимого процесса G убывает
(ΔG < 0)
• В состоянии равновесия G постоянна (ΔG = 0)
• Если ΔG > 0, то протекание процесса в данных
условиях маловероятно
Закрытые системы
14.
• Термодинамическое условие – одно изнеобходимых для протекания химической реакции
• Так, катализатор способен снизить активационный
барьер и ускорить химическую реакцию, но не
способен запустить реакцию, которая при данных
условиях не идет самопроизвольно
• Например, не найдется катализатора, который
вызовет разложение воды на водород и кислород
(ΔG > 0). Это можно сделать только электролизом,
совершая электрическую работу
Термодинамическое условие
15.
Химическоеравновесие
16.
Теоретические все реакции обратимы,практически – нет
Практически необратимы реакции, в
которых происходит:
• Выпадение осадка
• Выделение газа
• Образование других малодиссоциирующих
соединений
• Горение углеводородов
• Разложение взрывчатых веществ
Необратимые реакции
17.
• Установлено, что большинство реакцийпротекают обратимо, причѐм, с разными
скоростями
• По мере протекания скорость прямой
реакции уменьшается, обратной реакции –
увеличивается
• Когда эти скорости уравниваются, наступает
состояние химического равновесия
Обратимые реакции
18.
dD + eEaA + bB
V1
V2
V1 k1[A]a [B]b
V2 k2 [D]d [E]e
Условие равновесия : V1 V2
k1[A] [B] k2 [D] [E]
a
b
d
d
e
e
k1 [D] [E]
K
a
b
k2 [A] [B]
Константа равновесия
19.
• Физический смысл K в том, что онапоказывает во сколько раз k1 > k2
• Концентрации веществ, находящихся в
гетерофазе (например, твердые реагенты),
считаются постоянными, и не входят в
выражение константы равновесия
• K зависит от природы реагирующих
веществ и температуры
• K не зависит от концентраций
реагирующих веществ, от давления,
от наличия/отсутствия катализатора
!
20.
• Например, для реакцииCH4 (г) + Cl2 (г) = CH3Cl (г) + HCl (г)
[CH 3Cl][HCl]
K
[CH 4 ][Cl 2 ]
• Для реакции
Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г)
[H 2 O]3
K
[H 2 ]3
21.
Если на систему, находящуюся в состоянииравновесия, воздействовать извне, то внутри
системы возникнут самопроизвольные процессы,
стремящиеся ослабить это воздействие
• Смещение равновесия можно вызвать изменением
температуры, концентрации, давления (для газовых
реакций)
• Катализ не влияет на смещение равновесия
N 2 3H 2
2NH 3 H 0
Принцип Ле Шателье
22.
Задача:Вычислить константу равновесия реакции:
CH4 (г) + Cl2 (г) = CH3Cl (г) + HCl (г)
С0(CH4) = 1 моль/л, С0(Cl2) = 1,5 моль/л, [HCl] = 0,5 моль/л
Решение:
CH 4 Cl2
С0 1, 0
1,5
[ ] 0,5
1, 0
CH 3Cl HCl
0
0
0,5
0,5
2
[CH 3Cl][HCl]
0,5
K
0,5
[CH 4 ][Cl2 ]
0,5 1, 0
О чѐм говорит значение K = 0,5?
23.
Термохимияизучает тепловые эффекты
химических реакций
24.
Тепловой эффект (Q) – количество выделенной(поглощенной) теплоты при протекании
необратимого процесса при постоянном давлении
или объеме, и при условии равенства температур
исходных и конечных веществ
• При постоянном давлении Q = ΔH
• ΔH – энергия, потраченная на разрыв связей
реагентов, минус энергия, выделенная при
образовании связей продуктов реакции
25.
По тепловому эффекту:• Экзотермические реакции проходят с выделением
тепла (Q > 0, ΔH < 0)
2H 2 (г) O 2 (г) 2H 2 O(г) 483, 7 кДж (на 1 моль O 2 )
H 2 (г) 1 2 O 2 (г) H 2 O(г) 241,9 кДж (на 1 моль H 2 )
• Эндотермические реакции проходят с поглощением
тепла (Q < 0, ΔH > 0)
N 2 (г) O 2 (г) 2NO(г) 180, 7 кДж
Q 180, 7 кДж
H 180, 7 кДж
Уравнения химических реакций, в которых
указывается тепловой эффект и агрегатные состояния
веществ, называются термохимическими
26.
Тепловой эффект химической реакции не зависит отпути протекания процесса, а определяется только
начальным и конечным состоянием системы
• Является частным случаем первого начала термодинамики
• Позволяет рассчитать тепловые эффекты процессов
H1 H 2 H 3
ΔH1
A1, A2 , A3
ΔH2
Закон Гесса
B1, B2 , B3
ΔH3
27.
Тепловой эффект реакции есть сумма теплотобразования продуктов за вычетом суммы теплот
образования реагентов с учѐтом коэффициентов
• Теплота (энтальпия) образования (ΔHf , ΔHобр ) –
тепловой эффект образования 1 моль химического
соединения из простых веществ
H х. р. n H
пр
пр
f
1-е следствие
n
исх
H
исх
f
28.
Тепловой эффект реакции есть сумма теплотсгорания реагентов за вычетом суммы теплот
сгорания продуктов с учѐтом коэффициентов
• Теплота сгорания (ΔHс ) – тепловой эффект
взаимодействия 1 моль химического соединения с
молекулярным кислородом
H х. р. n
исх
H
исх
с
2-е следствие
n H
пр
пр
с
29.
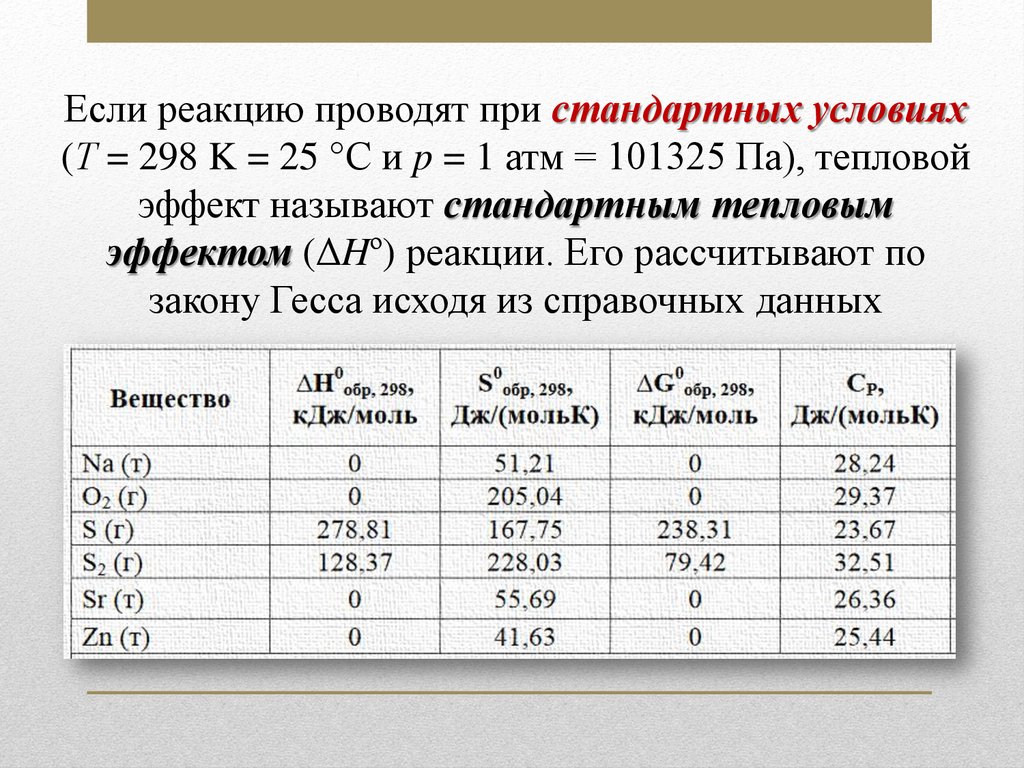
Если реакцию проводят при стандартных условиях(Т = 298 K = 25 °С и p = 1 атм = 101325 Па), тепловой
эффект называют стандартным тепловым
эффектом (ΔHº) реакции. Его рассчитывают по
закону Гесса исходя из справочных данных
30.
1. Стандартное изменение энтальпииH n H f
пр
пр
n
исх
H f
исх
2. Стандартное изменение энтропии
S n S f
пр
пр
n
исх
Sf
исх
3. Стандартное изменение энергии Гиббса
G n пр G f пр nисх G f исх
G H T S
Расчёт т/д потенциалов реакций
31.
Задача:Вычислите изменение энергии Гиббса при 298 K и
температуру, при которой K = 1 для химической реакции:
Fe2O3 (к) + 3H2 = 2Fe (к) + 3H2O (г)
Решение:
1) H 298 (2 0 3 ( 241,81)) ( 822,16 3 0) 96, 7 кДж/ моль
2) S 298 (2 27,15 3 188, 7) (89,96 3 131) 137, 4 Дж/ моль·K
137, 4
3) G298 H T S 96, 7 298
55, 75 кДж/моль
1000
ΔG > 0, значит реакция не идет самопроизвольное при 298 K
Константа равновесия равна единице при ΔG = 0, тогда
4) T
H 96, 7
705,8 K
S 0,137
32.
1. Термодинамика позволяет предсказать возможностьсамопроизвольного протекания процесса в заданных
условиях, но не учитывает время его протекания
2. Термодинамика дает возможность рассчитать параметры
наступления химического равновесия и предсказать
влияние различных факторов на это состояние
3. Термодинамическое условие протекания реакции –
необходимое, но недостаточное. Многие
термодинамически выгодные реакции (ΔG < 0) не
протекают самопроизвольно или протекают слишком
медленно из-за наличия кинетического условия –
преодоления активационного барьера
Выводы по теме
33.
1.2.
3.
4.
Проработать пройденный лекционный
материал, подготовиться к опросу
Выполнить на Moodle тест «Химическая
термодинамика»
Письменно выполнить задания: 5, 7, 8
Тема: Химическое равновесие
Письменно выполнить задание: 5, 8
Тема: Энергетика хим. реакций
Домашнее задание





























 chemistry
chemistry








