Similar presentations:
Тема 6 Кинетика и катализ
1.
Тема 6Кинетика и
катализ
2.
Химическиереакции
3.
Химическая реакция – превращение однихвеществ (реагенты) в другие (продукты) за
счет разрыва старых и/или образования новых
химических связей
• Продукты отличаются от реагентов
составом и/или строением
• В химических реакциях ядра атомов не
изменяются, т.е. общее число атомов
каждого вида остается неизменным
4.
По типупревращений
соединения
А+В→С
разложения
А→В+С
обмена (замещения) А + ВС → АВ + С
По характеру
переносимой
частицы
перенос протона (кислотно-основные)
перенос электрона (окислительновосстановительные)
По тепловому
эффекту
экзотермические (выделение тепла)
эндотермические (поглощение тепла)
По
обратимости
обратимые
необратимые
Классификация реакций
5.
Почему все возможныехимические реакции до
сих пор не произошли?
6.
• Для того, чтобы частицы вступили в химическуюреакцию они должны столкнуться
• Не любое столкновение частиц приводит к их
взаимодействию. В реакции могут участвовать
только те частицы, энергия которых больше средней
энергии молекул на определенную величину,
которая называется энергией активации (Ea)
• Частицы, обладающие энергией активации,
называются активными
Теория активных столкновений
/теория активированного комплекса/
7.
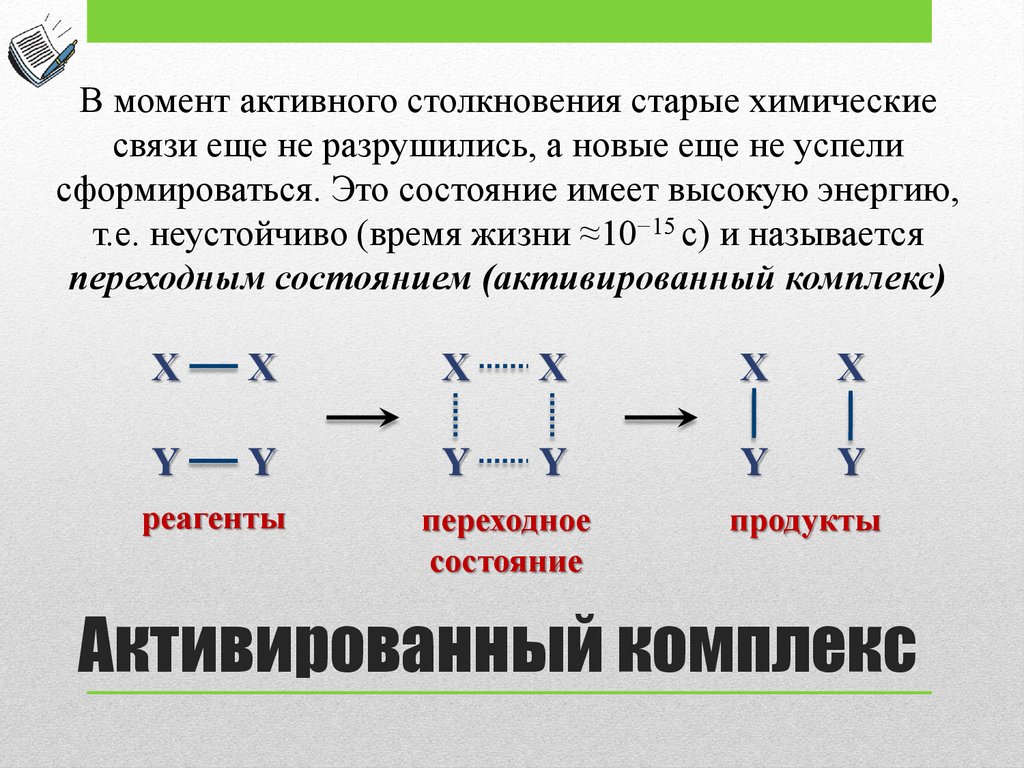
В момент активного столкновения старые химическиесвязи еще не разрушились, а новые еще не успели
сформироваться. Это состояние имеет высокую энергию,
т.е. неустойчиво (время жизни ≈10−15 с) и называется
переходным состоянием (активированный комплекс)
Х
Х
Х
Х
Х
Х
Y
Y
Y
Y
Y
Y
реагенты
переходное
состояние
продукты
Активированный комплекс
8.
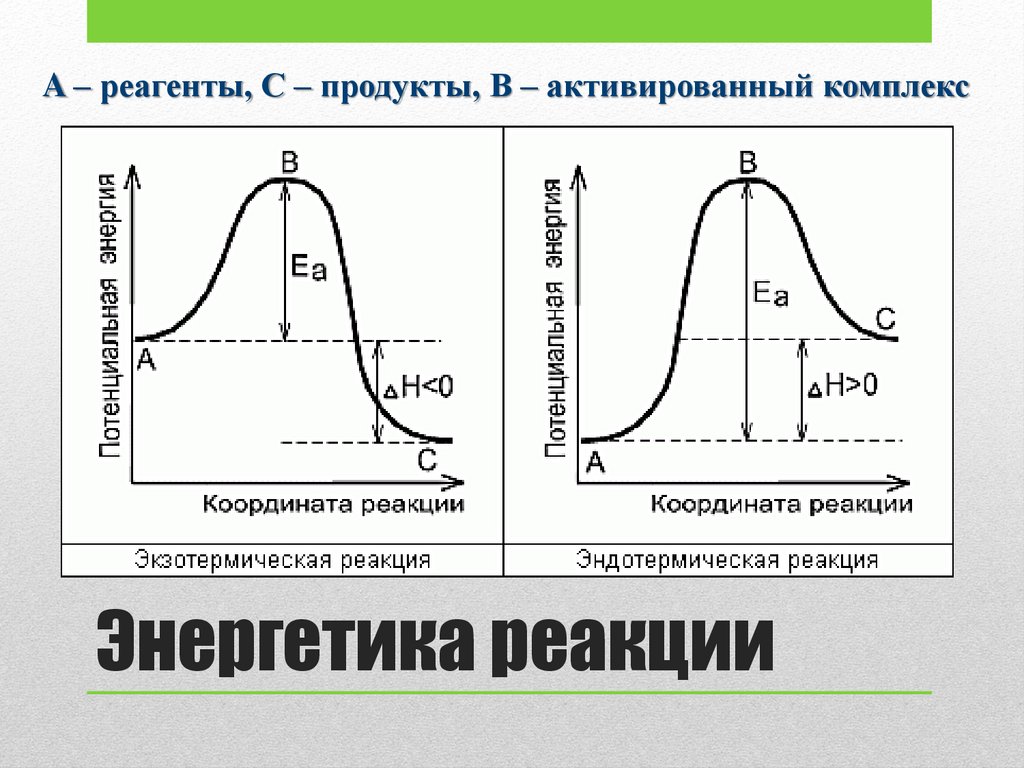
A – реагенты, С – продукты, В – активированный комплексЭнергетика реакции
9.
Что бы произошло,если бы реакции не
имели активационного
барьера?
10.
• Для каждой химической реакции характерно своесобственное значение энергии активации (для
молекул обычно в пределах 80 – 240 кДж/моль)
• Энергия активации конкретной реакции
практически не зависит от температуры
• Из-за наличия активационного барьера все
реакции идут с конечной скоростью
• Время в химии изучает химическая кинетика
Энергия активации
11.
Характерные времена химических реакций10–14 – 10–11 с
элементарные реакции образования и
разрыва химических связей
10–6 с
взрывные реакции и реакции ионного
обмена в растворе
100 – 105 с
органические реакции,
обмен веществ, биосинтез
105 – 107 с
коррозия металлов
> 1012 с
образование и разрушение горных пород
Время в химии
12.
Химическаякинетика
13.
Химическая кинетика изучает скорость имеханизмы протекания химических реакций, а
также специфические реакции (кинетика
гетерогенных процессов, катализ и пр.)
• Простые реакции протекают в одну стадию,
сложные – в несколько стадий (последовательные,
параллельные, сопряженные, цепные)
• Если все компоненты реакции находятся в одной фазе
– гомогенная реакция, если в разных – гетерогенная.
Гомогенные реакции протекают во всѐм объѐме,
гетерогенные – на поверхности раздела фаз
• В кинетике используются молярные концентрации
веществ, выраженные в [моль/л]
14.
В физикеВ химии
V = S / Δt
V = ΔC / Δt
м/с
км/ч
моль / (л·с)
Понятие «скорость»
15.
Скорость гомогенной химической реакции –изменение концентрации вещества (С) в единицу
времени (τ)
• Различают среднюю и мгновенную скорость. Для
гомогенной реакции:
C моль
υ
τ л с
dC моль
υ
dτ л с
Скорость реакции
16.
Скорость гетерогенной реакции – изменениеколичества вещества (ν) в единицу времени (τ) на
единице поверхности раздела фаз (S)
ν моль
υ
2
S τ с м
Скорость реакции
17.
• Природа реагентов• Концентрация реагентов
(для газов – давление)
• Температура
• Присутствие катализатора
Факторы, влияющие на
скорость гомогенной реакций
18.
• При увеличении концентрации реагентов скоростьхимической реакции возрастает за счет увеличения
числа столкновений между частицами
Закон действующих масс (ЗДМ): скорость
химической реакции при данной температуре
пропорциональна произведению концентраций
реагентов в степенях, равных их
стехиометрическим коэффициентам
υ k[A] [B]
a
b
– кинетическое уравнение
Зависимость от концентрации
19.
• k – константа скорости химической реакции,является коэффициентом пропорциональности в
ЗДМ и учитывает природу реагирующих веществ
• k зависит от температуры, но не зависит от
концентрации
Fe 2 O3 (к) 3H 2 (г)
2Fe(к) 3H 2 O (г)
υ k[H 2 ]
3
Константа скорости
20.
РеакцияТ, oC
Кинетическое
уравнение
k
H+ + OH– → H2O
20
v = k [H+][OH–]
1,4.1011 л/моль.с
NH4+ → NH3 + H+
20
v = k [NH4+]
24 с–1
Количественный вывод:
при 20 оС реакция нейтрализации протекает в
6.109 раз быстрее, чем реакция распада иона
аммония на аммиак и ион водорода
Константа скорости
21.
Молекулярность – число исходных частиц,одновременно взаимодействующих друг с другом в
одном элементарном акте реакции
Число
реагирующих
частиц
Молекулярность
реакции
Пример реакции
1
мономолекулярная
NH4+ → NH3 + H+
2
бимолекулярная
H+ + OH– → H2O
3
тримолекулярная
2 NO + O2 → 2 NO2
Молекулярность реакции
22.
Какова молекулярностьреакции:
K2Cr2O7 + 14 HI → 3 I2 +
+ 2 CrI3 + 2 KI + 7 H2O
23.
• В реальных химических реакциях одновременноестолкновение уже трех частиц маловероятно,
тримолекулярных реакций немного
• Большинство реакций происходит либо при
распаде одной частицы (А → Б + В + Г…), либо
при столкновении двух частиц (А + Б → В + Г)
• Если уравнение реакции сложное, такая реакция
включает в себя несколько более простых реакций
– элементарных стадий
• Только для таких стадий справедливо
кинетическое уравнение ЗДМ
Механизм сложной реакции
24.
• В этом случае говорят о механизмесложной реакции, который включает в себя
несколько элементарных реакций, каждая
из которых описывается собственным
кинетическим уравнением и имеет свою
константу скорости
• Общую скорость реакции определяет самая
медленная элементарная реакция –
лимитирующая стадия
Механизм сложной реакции
25.
K2Cr2O7 + 14 HI → 3 I2 + 2 CrI3 + 2 KI + 7 H2Oнеправильно:
υ k[K 2 Cr2 O 7 ][HI]
14
правильно:
υ k[K 2 Cr2 O7 ]
но это можно определить только
экспериментальным путем!
Механизм сложной реакции
26.
Порядок реакции по данному веществу –показатель степени при концентрации данного
вещества в кинетическом уравнении
• Для элементарных реакций порядок – целочисленная
величина, совпадающая с молекулярностью
• Для сложных реакций порядок можно определить только
экспериментально (может быть целым, дробным, нулевым)
2 NO + O2 → 2NO2
υ k[NO] [O 2 ]
2
по O2 – первый порядок, по NO – второй порядок,
суммарно – третий порядок
Порядок реакции
27.
Правило Вант-Гоффа: при повышениитемпературы на 10 градусов скорость химической
реакции возрастает в 2-4 раза
υ2 υ1 γ
T2 T1
10
10 lg
υ
υ2
1
γ 10
T2 T1
γ – температурный коэффициент, определяется
экспериментально
Позволяет оценить, во сколько раз увеличится скорость
реакции при повышении температуры на 10 градусов
Зависимость от температуры
28.
Во сколько разувеличится скорость
химической реакции
при повышении
температуры на 30 ºС,
если γ = 4?
29.
На сколько градусовследует повысить
температуру, чтобы
скорость реакции
выросла в 32 раза
(γ = 2)?
30.
Уравнение Аррениуса: с позиции теорииактивных столкновений, с повышением
температуры резко возрастает число активных
частиц, поэтому скорость реакции увеличивается
k2 Ea 1 1
ln
k1
R T1 T2
k – константа скорости реакции
Ea – энергия активации
R – универсальная газовая постоянная
Зависимость от температуры
31.
Катализизменение скорости реакции в
присутствии катализатора
32.
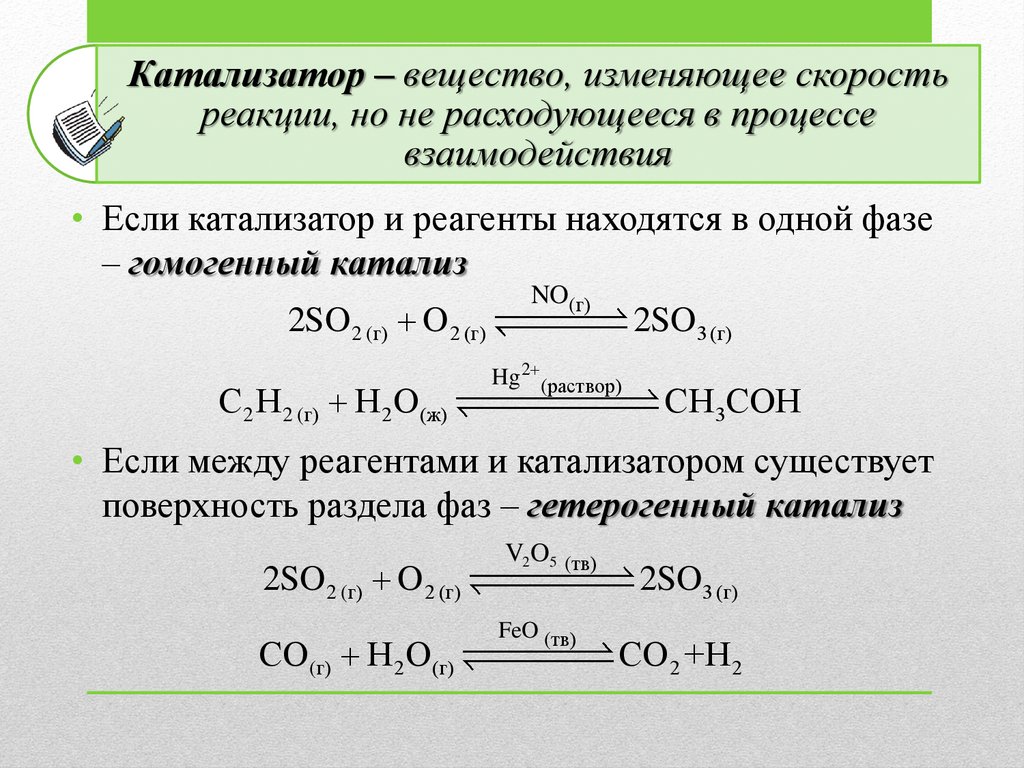
Катализатор – вещество, изменяющее скоростьреакции, но не расходующееся в процессе
взаимодействия
• Если катализатор и реагенты находятся в одной фазе
– гомогенный катализ
2SO 2 (г) O 2 (г)
С2 H 2 (г) H 2 O (ж)
NO(г)
2SO3 (г)
Hg 2 (раствор)
CH 3COH
• Если между реагентами и катализатором существует
поверхность раздела фаз – гетерогенный катализ
2SO 2 (г) O 2 (г)
V2O5 (тв)
СO (г) H 2 O (г)
FeO (тв)
2SO3 (г)
CO 2 +H 2
33.
υ1A B AB
υ3
υ2
A K AK ( B) AB + K
υ 2 , υ3
υ1
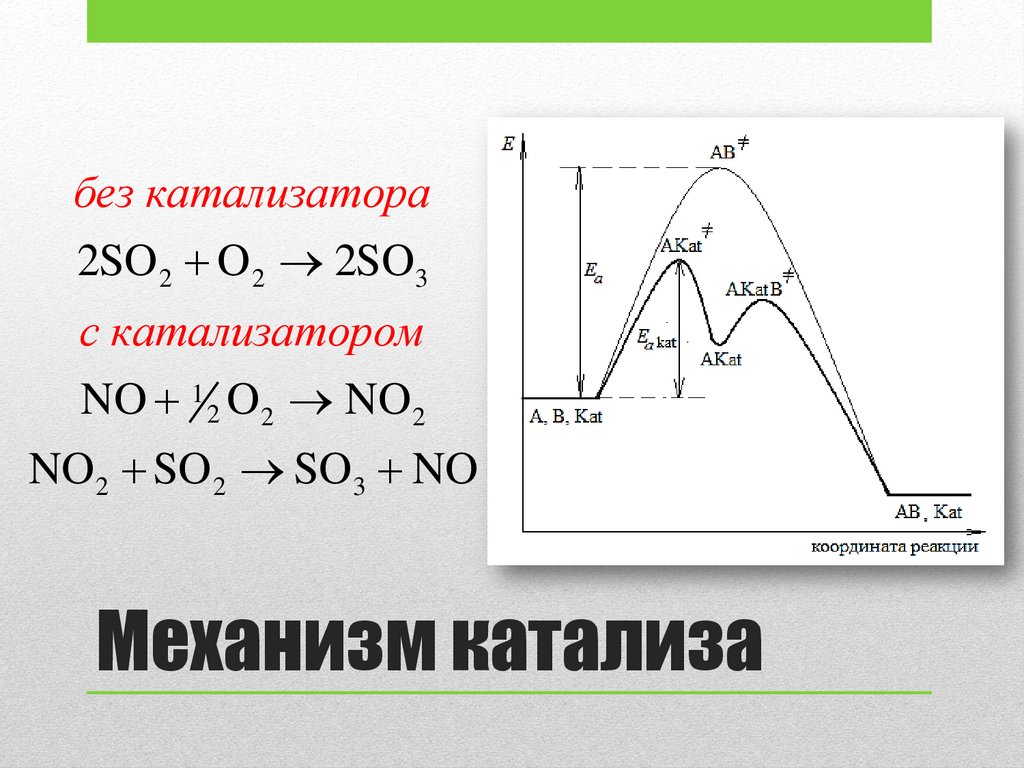
• Детальный механизм действия катализатора очень сложен
• В случае гомогенного катализа катализатор образует с
реагентами промежуточные соединения (интермедиаты)
• В итоге величина Ea реакции с участием катализатора
оказывается ниже Ea такой же реакции при его отсутствии.
Практически реакция идет по другому пути
Механизм катализа
34.
без катализатора2SO 2 O 2 2SO3
с катализатором
NO 1 2 O 2 NO 2
NO 2 SO 2 SO3 NO
Механизм катализа
35.
• Важную роль играют биологические катализаторы –ферменты (энзимы), имеющие белковую природу
• Гидролиз жиров, белков и углеводов, синтез и распад
белков и нуклеиновых кислот происходит в
присутствии специфических ферментов. Например,
амилаза, участвующая в процессе пищеварения,
расщепляет крахмал до олигосахаридов
• Отсутствие даже одного фермента или какой-нибудь
его дефект могут привести к серьезным
отрицательным последствиям для организма
Катализ в живых организмах
36.
Ингибитор – вещество, подавляющее илизадерживающее течение процесса
• Ингибиторы используют в каталитических и цепных
реакциях, протекающих с участием активных центров.
Торможение реакции обусловлено тем, что ингибитор
блокирует активные центры катализатора или
реагирует с активными частицами с образованием
малоактивных радикалов
• Ингибитор вводится в систему в намного меньшей
концентрации, чем концентрация реагентов
Отрицательный катализ
37.
• Ингибиторы применяют для предотвращениянежелательных процессов: окисления,
полимеризации, коррозии металлов
• Многие лекарства работают по ингибирующему
принципу (антиалергенные и
противовоспалительные препараты, лекарства от
гипертонии, антиоксиданты)
Отрицательный катализ
38.
• Гидрохинон – ингибитор окисления бензальдегида• Соединения технеция, амины, сульфиды, альдегиды –
ингибиторы коррозии сталей
• Дифенилкетон – ингибитор полимеризации стирола
• Трихлорид азота – сильный ингибитор реакции хлора с
водородом (0,001 % достаточно для прекращения
реакции)
• Урацилы – ингибиторы аминного типа, тормозящие
цепное окисление в живых организмах
• Ингибиторы АПФ – соединения, применяющиеся для
лечения сердечной и почечной недостаточности
Примеры ингибиторов
39.
1. Необходимое условие для протекания реакции –кинетическое – преодоление активационного барьера,
который может являться препятствием для
самопроизвольного протекания даже очень энергетически
выгодных реакций
2. Никакая химическая реакция не может происходить
мгновенно (сразу между всеми молекулами), т.к.
значительная их часть не обладает достаточной для этого
энергией. Любая реакция протекает с конечной скоростью
3. Преодолеть активационный барьер можно повышением
температуры, действием света, введением катализатора,
подбором растворителя
Выводы по теме
40.
1. Проработать пройденныйлекционный материал,
подготовиться к опросу
2. Выполнить на Moodle тест
«Кинетика и катализ»
3. Письменно выполнить
задания: 4, 5, 7, 8, 9, 10
Тема: Скорость хим. реакций
Домашнее задание




































 chemistry
chemistry








