Similar presentations:
Демонстрационный вариант экзаменационной работы
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
Кафедра химии
ОБЩАЯ ХИМИЯ,
БИООРГАНИЧЕСКАЯ ХИМИЯ
КОНСУЛЬТАЦИЯ
Демонстрационный вариант
экзаменационной работы
Лектор: доктор биологических наук, профессор,
зав. кафедрой химии Ирина Петровна Степанова
2.
Общие положенияЭкзамен проводится в письменной форме.
На выполнение экзаменационной работы
отводится 2,0 астрономических часа (120
минут).
3.
Структура билетаБИЛЕТ СОСТОИТ ИЗ 2 ЧАСТЕЙ И
СОДЕРЖИТ 20 ЗАДАНИЙ.
Часть 1 включает 15 тестовых заданий. К
каждому заданию дается 4 варианта
ответов, из которых один правильный.
Десять заданий оценивается по 1 баллу,
пять заданий - по 2 балла.
Максимальное число баллов за часть 1 –
20 баллов.
4.
Структура билетаОтветы на тестовую часть необходимо
представить в виде матрицы.
ОТВЕТЫ НА ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ
№ задания
Ответ
Тестовый
балл
1
2
3
4
5
6
5.
Структура билетаЧасть 2, предусматривающая
развернутый письменный ответ, включает
2 задания и 3 расчетные задачи.
Задания 16 и 17 оцениваются в 4 балла,
задачи 18 и 19 – в 7 баллов, задача 20 – в 8
баллов.
Максимальное число баллов за часть 2 –
30 баллов.
6.
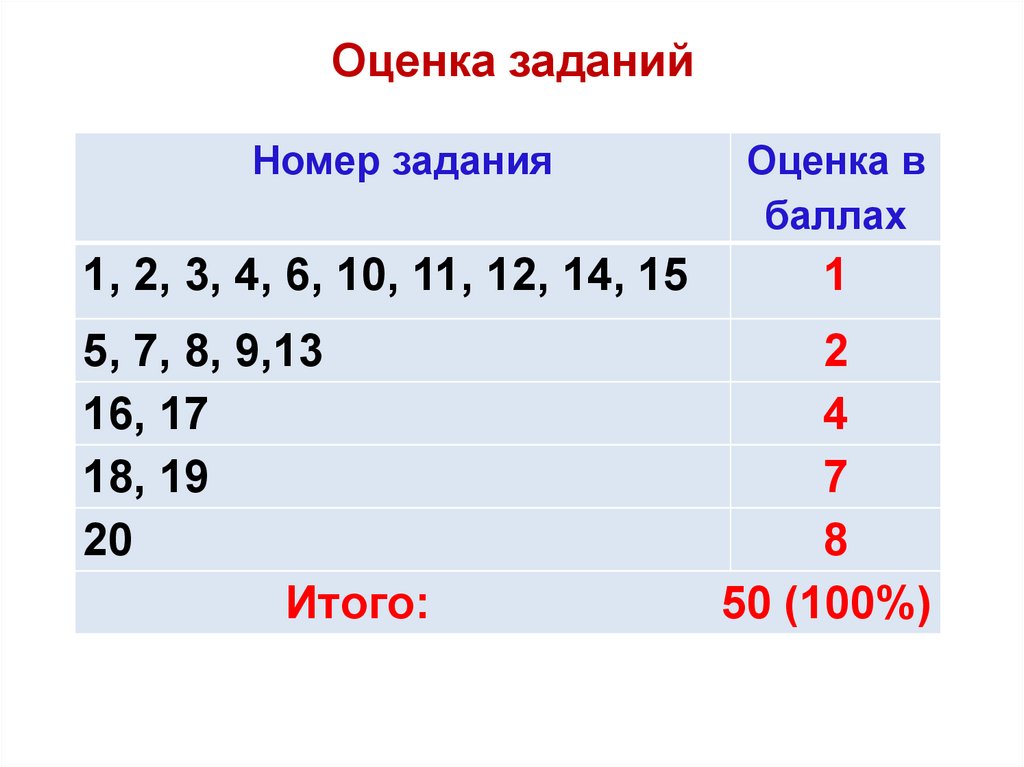
Оценка заданийНомер задания
Оценка в
баллах
1, 2, 3, 4, 6, 10, 11, 12, 14, 15
1
5, 7, 8, 9,13
16, 17
18, 19
20
Итого:
2
4
7
8
50 (100%)
7.
Время выполнения заданийРекомендуемое время выполнения задания
в 1 балл – 1-2 минуты, в 2 балла – 3-4 минуты.
На выполнение тестовых заданий отводится
не более 40 минут!!!
Рекомендуемое время решения заданий 16 и
17 вместе с оформлением – 5-10 минут, задач
18 и 19 – 10-15 минут, задачи 20 – 15-20 минут.
8.
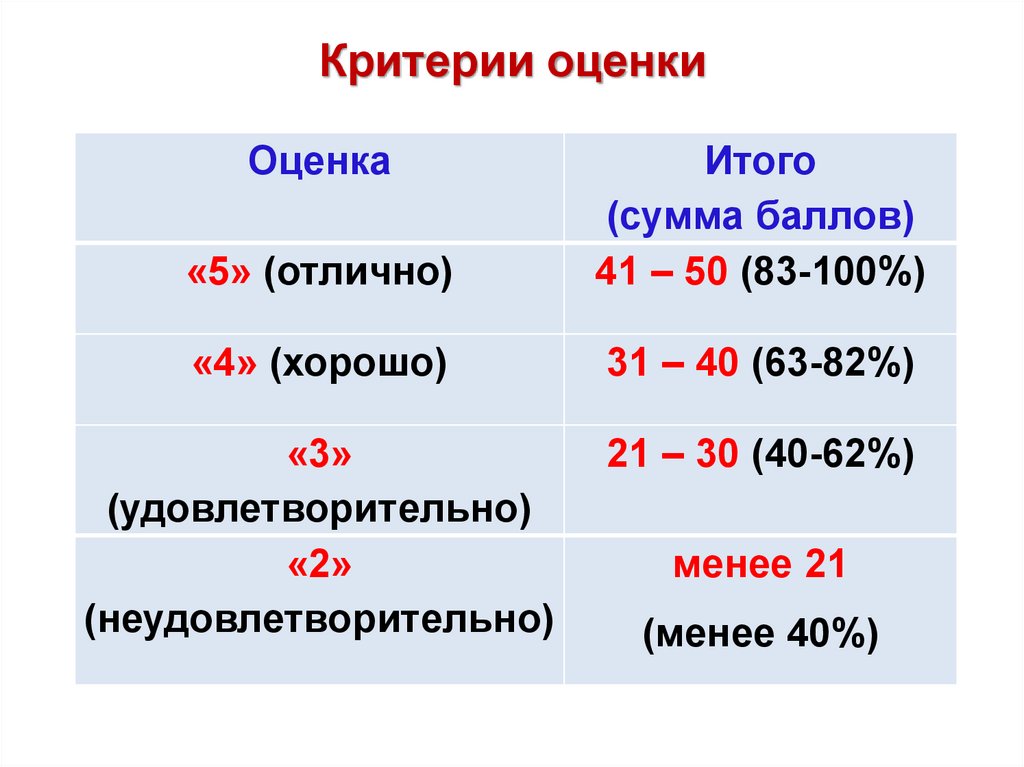
Критерии оценкиОценка
«5» (отлично)
Итого
(сумма баллов)
41 – 50 (83-100%)
«4» (хорошо)
31 – 40 (63-82%)
«3»
(удовлетворительно)
«2»
(неудовлетворительно)
21 – 30 (40-62%)
менее 21
(менее 40%)
9.
Общие положенияПри выполнении работы Вы можете
пользоваться:
• периодической системой химических элементов
Д.И. Менделеева;
• таблицей стандартных электродных потенциалов
металлов;
• таблицей растворимости солей, кислот и
оснований;
• таблицей старшинства характеристических групп;
• таблицей электронных эффектов заместителей;
• калькулятором.
10.
Демонстрационныйбилет
11.
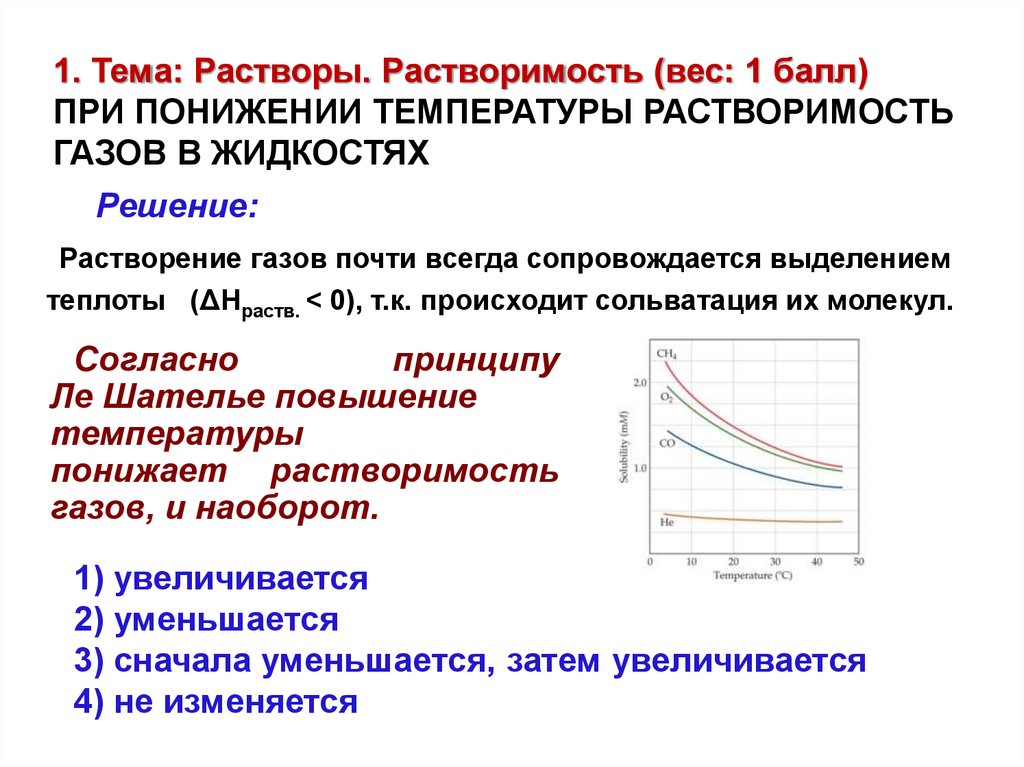
1. Тема: Растворы. Растворимость (вес: 1 балл)ПРИ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ РАСТВОРИМОСТЬ
ГАЗОВ В ЖИДКОСТЯХ
Решение:
Растворение газов почти всегда сопровождается выделением
теплоты (ΔHраств. < 0), т.к. происходит сольватация их молекул.
Согласно
принципу
Ле Шателье повышение
температуры
понижает растворимость
газов, и наоборот.
1) увеличивается
2) уменьшается
3) сначала уменьшается, затем увеличивается
4) не изменяется
12.
2. Тема: Химическая термодинамика. Основныепонятия. (вес: 1 балл)
В ИЗОБАРНО-ИЗОТЕРМИЧЕСКИХ УСЛОВИЯХ
ПРОЦЕСС ПРОТЕКАЕТ САМОПРОИЗВОЛЬНО В
СЛУЧАЕ ΔН0 < 0, ΔS0 < 0 ПРИ
Решение:
ΔG0 = ΔH0 – TΔS0
Процесс протекает самопроизвольно, если ΔG0 ˂ 0.
ΔG0 ˂ 0 при низких температурах, если ΔН0 < 0 и
ΔS0 < 0.
1) любых температурах
2) никогда не протекает
3) при высоких температурах
4) при низких температурах
13.
3. Тема: Коллигативные свойства растворов. Осмос(вес: 1 балл)
ПРИ ПОМЕЩЕНИИ ЭРИТРОЦИТА В
ГИПОТОНИЧЕСКУЮ СРЕДУ ПРОИСХОДИТ
1) плазмолиз
2) сначала плазмолиз, затем гемолиз
3) гемолиз
4) клетка нормально функционирует
14.
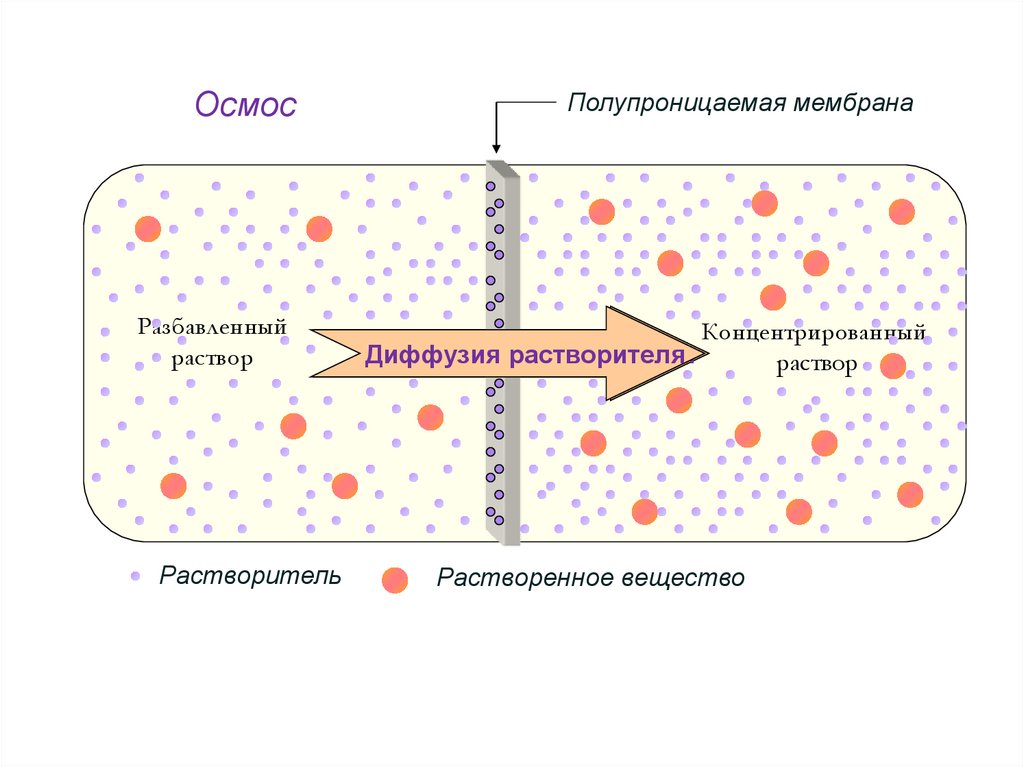
ОсмосПолупроницаемая мембрана
Разбавленный
раствор
Концентрированный
Диффузия
Диффузиярастворителя
растворителя
раствор
Растворитель
Растворенное вещество
15.
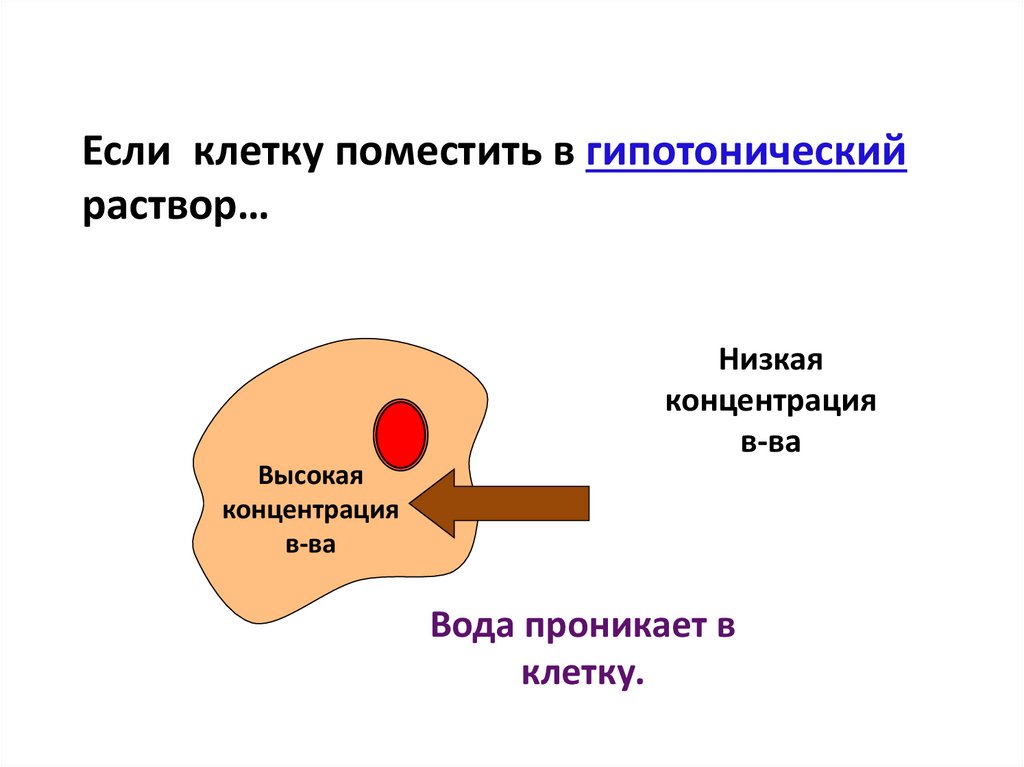
Если клетку поместить в гипотоническийраствор…
16.
Если клетку поместить в гипотоническийраствор…
Низкая
концентрация
в-ва
Высокая
концентрация
в-ва
Вода проникает в
клетку.
17.
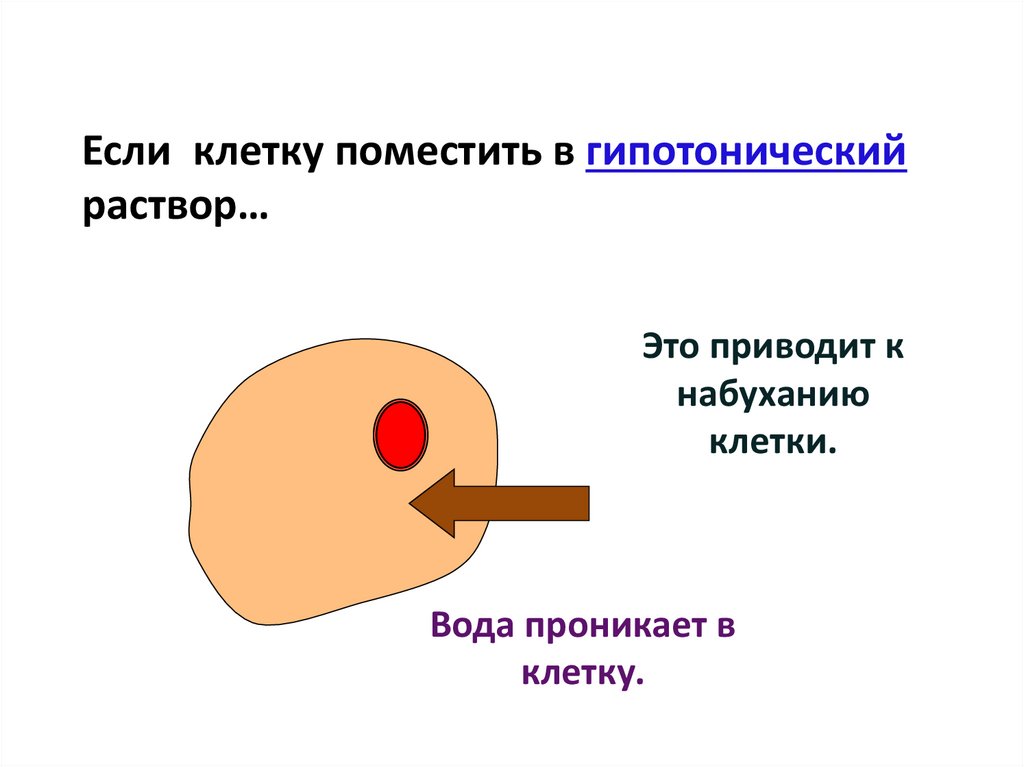
Если клетку поместить в гипотоническийраствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
18.
Если клетку поместить в гипотоническийраствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
19.
Если клетку поместить в гипотоническийраствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
20.
Если клетку поместить в гипотоническийраствор…
В конечном итоге
клетка лопается.
Это явление
называют
лизисом.
Вода проникает в
клетку.
21.
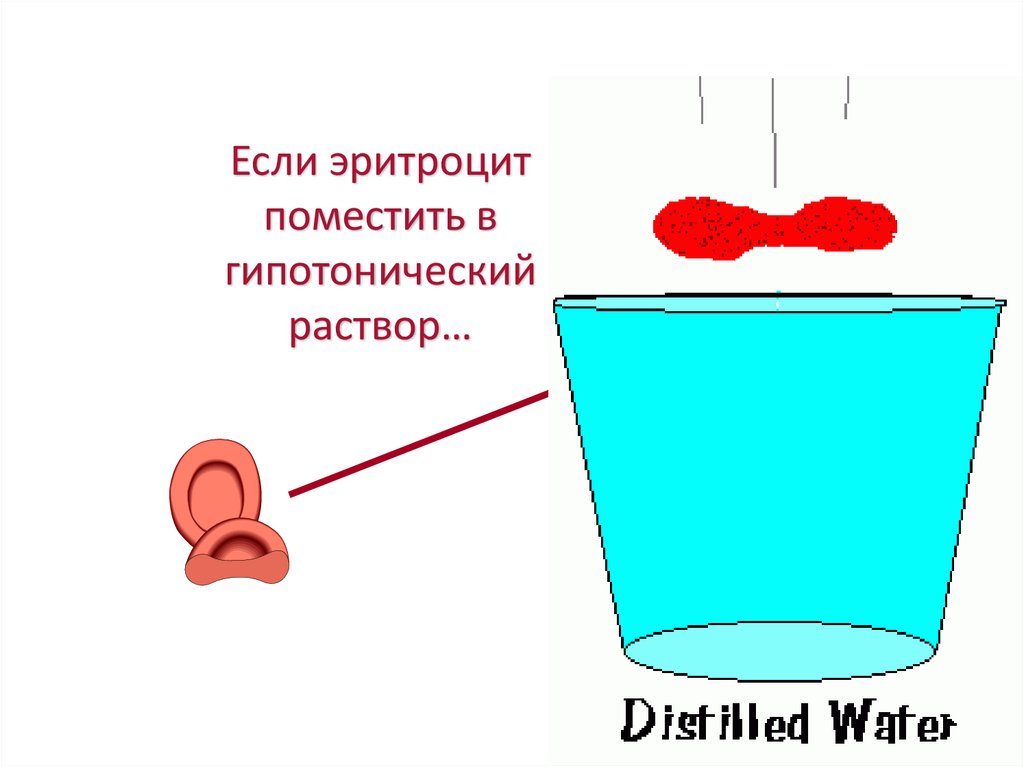
Если эритроцитпоместить в
гипотонический
раствор…
22.
Если эритроцитпоместить в
гипотонический
раствор…
Оболочка
Вода
клетки
устремляется
в клетку. разрывается
(гемолиз).
23.
4. Тема: Растворы сильных и слабыхэлектролитов (вес: 1 балл)
ДЛЯ БИОЛОГИЧЕСКИХ СИСТЕМ IN VIVO ПРИ pH 6,8
РЕАКЦИЯ СРЕДЫ РАСТВОРА
Решение:
Для биологических систем in vivo (t ≈ 37оС)
уравнение ионного произведения воды
принимает вид:
pH pOH lg 2,3 10 14 13,6
Поэтому in vivo:
нейтральная среда: рН = 6,8;
кислая среда: рН < 6,8;
щелочная среда: рН > 6,8.
1) слабо щелочная
2) щелочная
3) кислая
4) нейтральная
24.
5. Тема: Коллигативные свойства растворов. Осмос(вес: 2 балла)
ВЫЧИСЛИТЬ МАССУ ХЛОРИДА ЦИНКА В 1 дм3
РАСТВОРА, ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ КОТОРОГО
РАВНО 2,74050·105 Па ПРИ 200С.
Дано:
Решение:
2+ + 2Cl3
-3
3
ZnCl
↔
Zn
2
Vр-ра = 1 дм = 1·10 м
N
m( x )
3
T = 293 К
i i
i
RT
i
N0
1
M V
R = 8,314 Дж·моль-1·К-1
π = 2,74050·105 Па
m(ZnCl 2 )
274050 3
8,314 293
m(ZnCl2)?
136 0,001
1) 5,1 г
2) 15,3 г
3) 1,7 г
4) 0,51 г
m(ZnCl2) = 5,1 г
25.
6. Тема: Водородный показатель средырастворов. Буферные системы (вес: 1 балл)
Белковая буферная система является кислой и
нейтрализует
1) основные метаболиты
2) кислые метаболиты
3) и кислые, и основные метаболиты
4) не участвует в поддержании pH плазмы крови
26.
Буферные системы кровиБелковая буферная система:
ProtH
H+ + ProtProtNa
Na+ + ProtЭта система обладает 7-10% буферной
емкости крови, может нейтрализовать как
кислые, так и основные продукты.
27.
В макромолекуле белка многочисленнымиотрицательные заряды сосредоточены на
внешней стороне, и положительные заряды в
щелях молекулы.
- - -+ + -
- ++
++ +
+ +
++
+
+
-- + +
+
+
+++
+
+
+
+
+
- - - - - - -
28.
H+ ионы притягиваются к отрицательнымзарядам.
H+
H+
H+
H+
H+
H+
H+
H+
H+
H+
H+
- - -+ + - + - - - +
++ +
+ +
++
+
+
-- + +
+
+
+
+
+
+
+
+
+
+
- - - - - - H+
H+
H+
H+
H+
H+
H+
H+
H+
H+
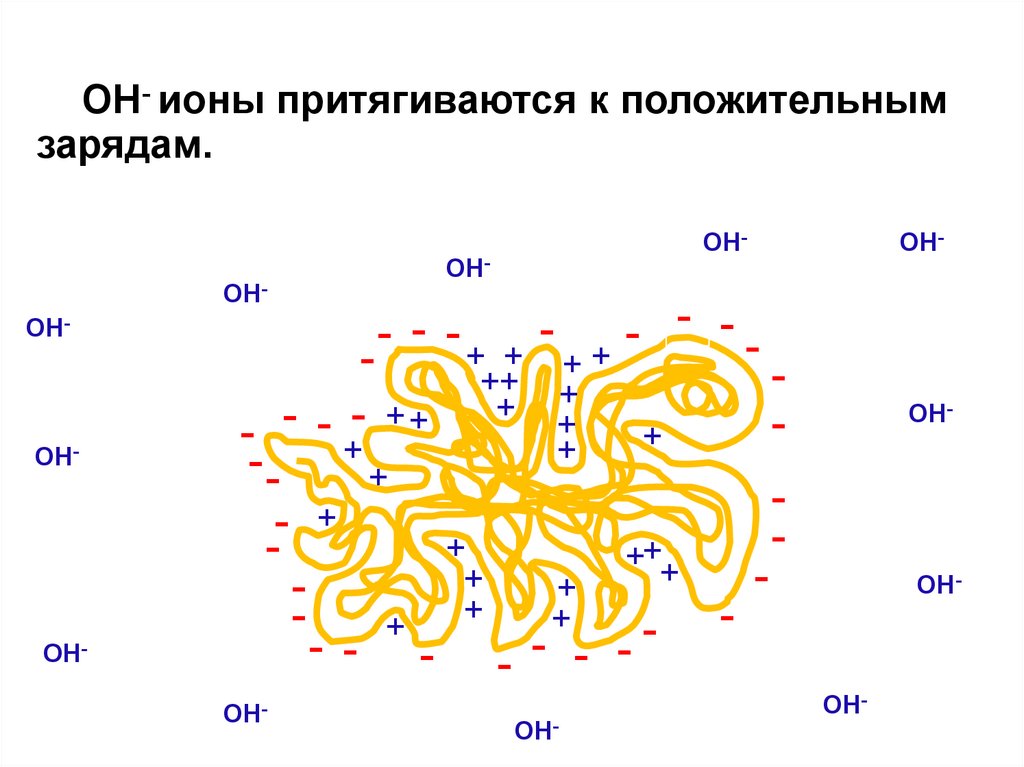
29.
OH- ионы притягиваются к положительнымзарядам.
OH-
OH-
OHOHOH-
OH-
OH-
- - -+ + -
- ++
++ +
+ +
+
+
- -+
+
+
-+
+
+
+++
+
+
+
+
+
- - - - - - OH-
OH-
OH-
OHOH-
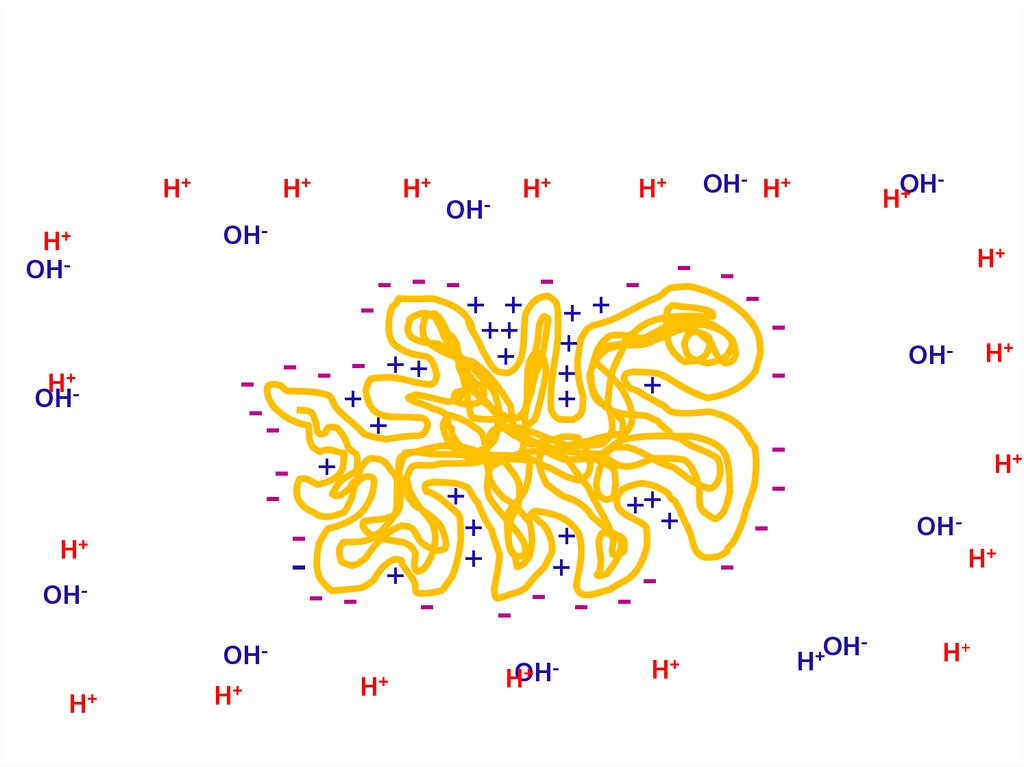
30.
H+H+
OH-
H+OH
H+
OH-
H+
H+
OH-
- - -+ + -
H+
OH- H+
H+
H+
+ HOH
OH
+
H
- ++
++ +
+ +
+
+
- -+
+
+
-+
+
+
+++
+
+
+
+
+
- - - - - - OH-
H+
OH-
H+
H+
H+
H+
OH-
H+
OHH+
OH+
H
H+
31.
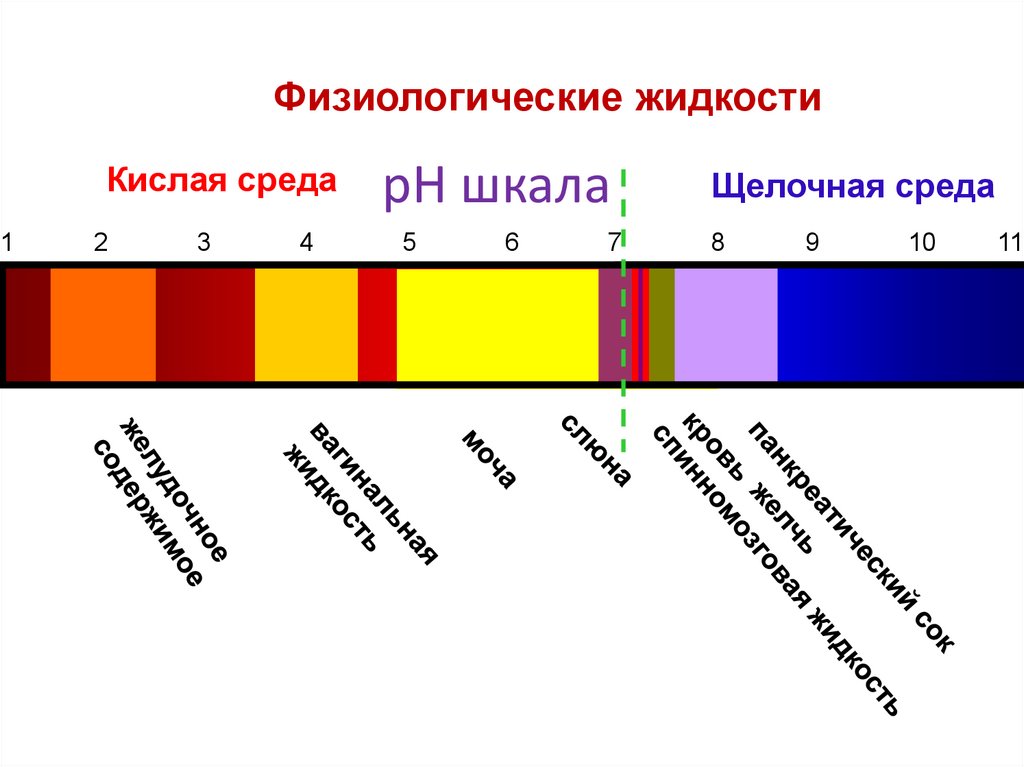
Физиологические жидкостиКислая среда
1
2
3
4
pH шкала
5
6
7
Щелочная среда
8
9
10
11
32.
7. Тема: Водородный показатель среды растворов(вес: 2 балла)
рН СМЕШАННОЙ СЛЮНЫ РАВЕН 6,9. КОНЦЕНТРАЦИИ
ИОНОВ Н+ И OH- В СМЕШАННОЙ СЛЮНЕ
(СООТВЕТСТВЕННО)
рН = - lgС(Н+); С(Н+) = 10-pH
Решение:
С(Н+) = 10-6,9 = 1,26∙10-7 моль∙дм-3
рOН = 14 - pH; рOН = 14 – 6,9 = 7,1;
рOН = - lgС(OН-); С(OН-) = 10-pOH;
С(OН-) = 10-7,1 = 7,94∙10-8 моль∙дм-3
1) 1,26∙10-6 моль∙дм-1 и 7,94∙10-7 моль∙дм-1
2) 1,26∙10-8 моль∙дм-1 и 7,94∙10-9 моль∙дм-1
3) 1,26∙10-7 моль∙дм-1 и 7,94∙10-8 моль∙дм-1
4) 1,26∙10-7 моль∙дм-1 и 7,94∙10-7 моль∙дм-1
33.
8. Тема: Буферные системы (вес: 2 балла)РАССЧИТАЙТЕ БУФЕРНОЕ ОТНОШЕНИЕ ОКСАЛАТНОЙ
БУФЕРНОЙ СИСТЕМЫ, В РАСТВОРЕ С рН 0,25, если
Ка(Н2С2О4) = 5,6·10-2.
Дано:
рН = 0,25
Кa(H2C2O4) = 5,6·10-2
1
C соль V соль
z
?
1
C кислота V кислота
z
1)
















































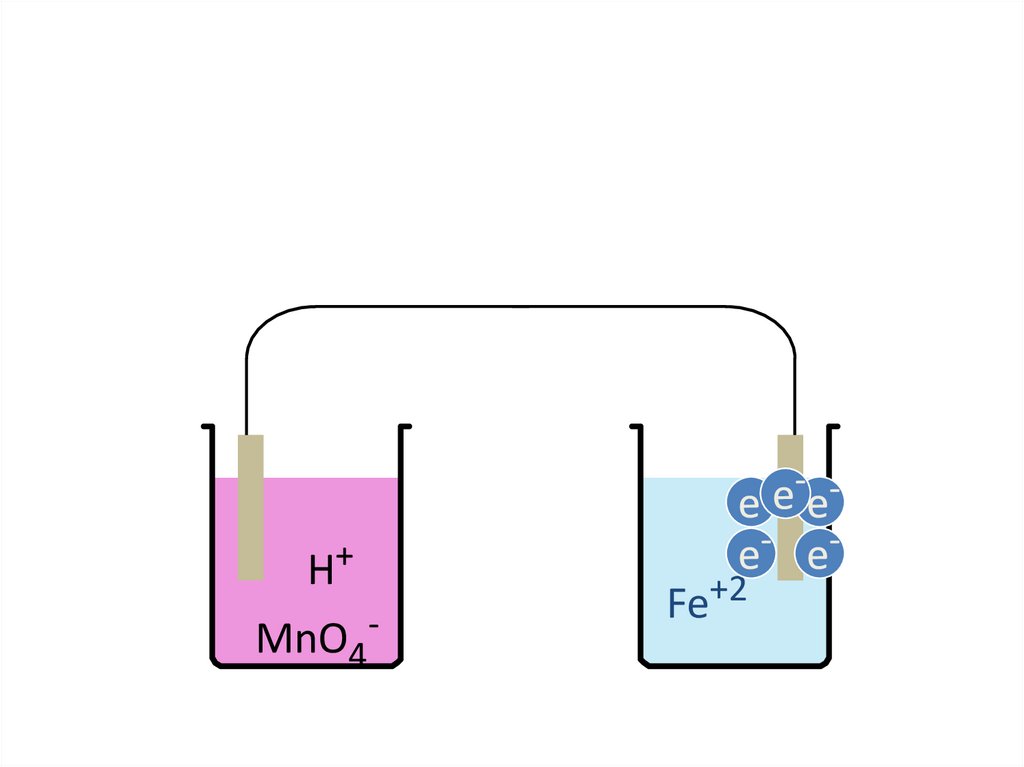
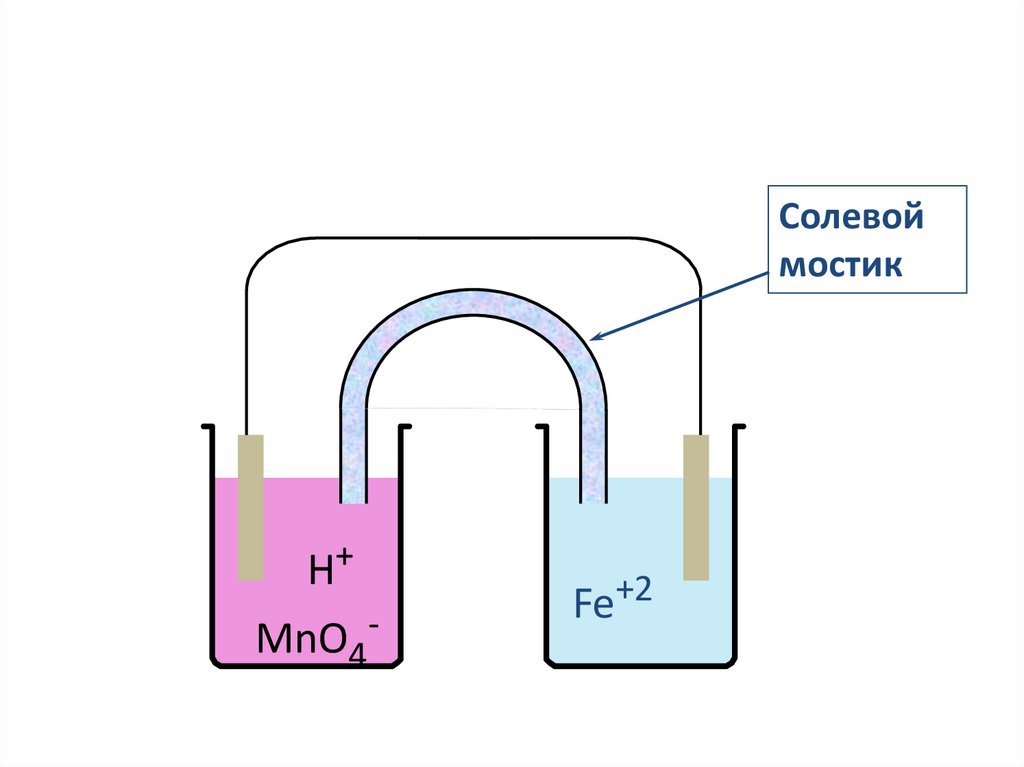
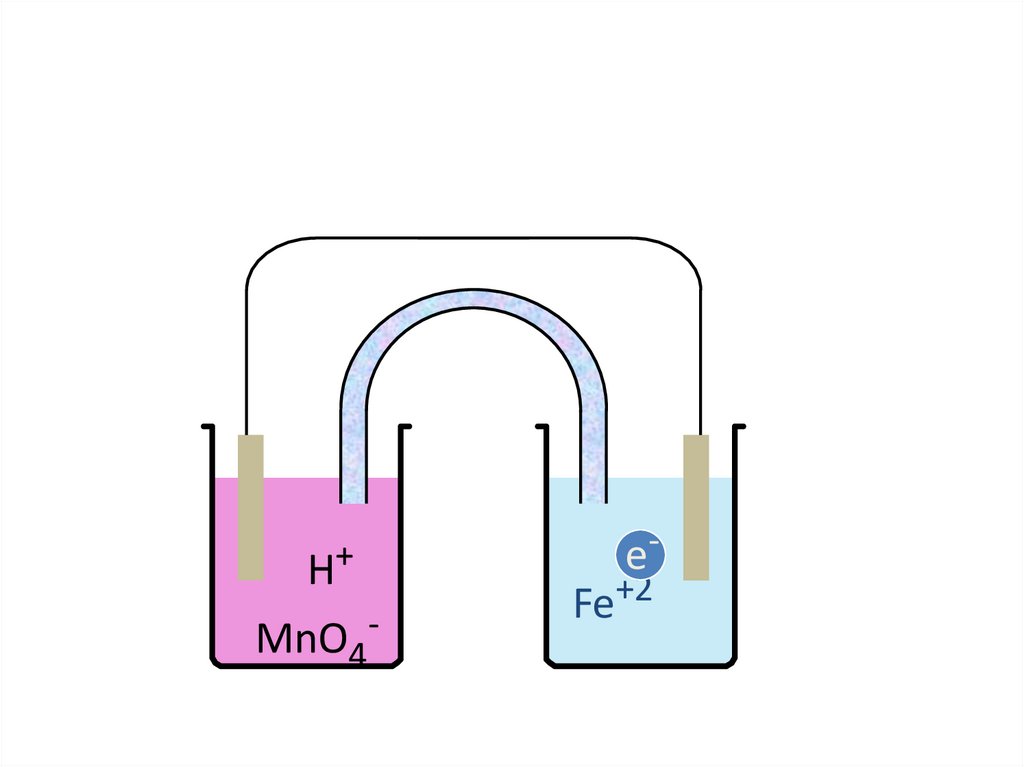

 pedagogy
pedagogy








