Similar presentations:
Цепь переноса электронов
1.
Цепь переноса электронов2.
3.
4.
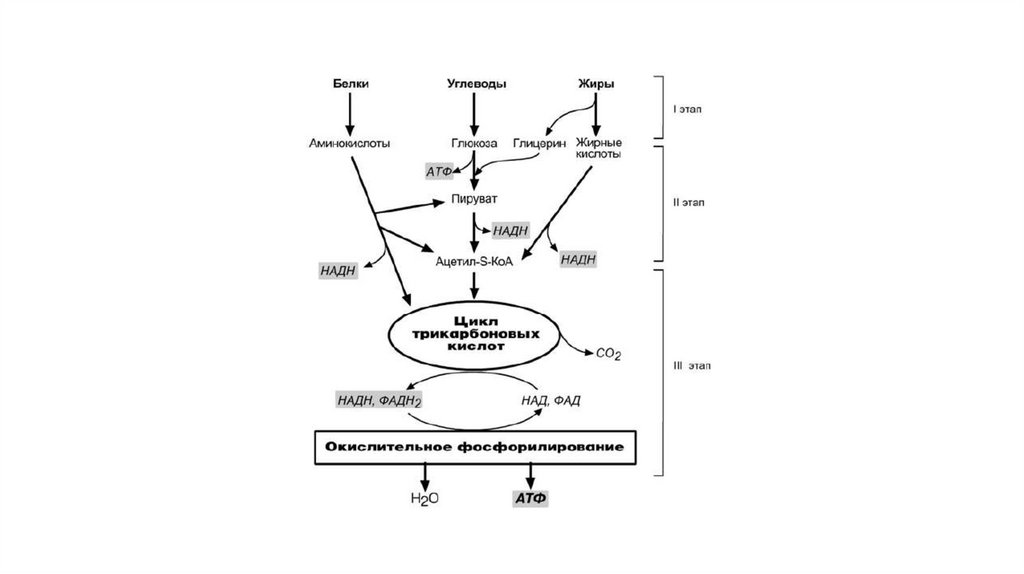
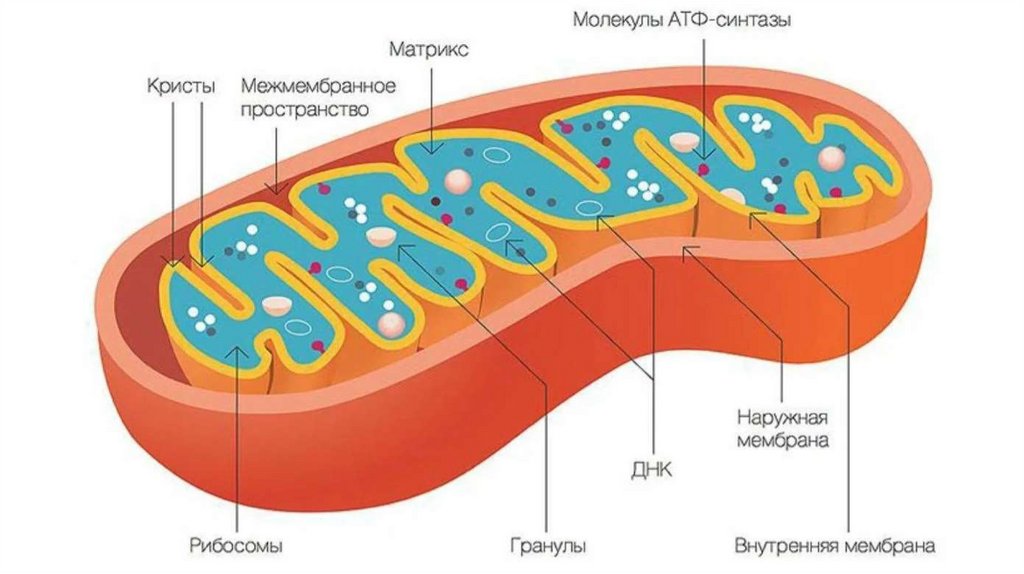
Окислительное фосфорилированиеОкислительное фосфорилирование – это многоэтапный процесс,
происходящий во внутренней мембране митохондрий и
заключающийся в окислении восстановленных эквивалентов
(НАДН и ФАДН2) и сопровождающийся синтезом АТФ.
По современным представлениям внутренняя митохондриальная
мембрана содержит ряд мультиферментных комплексов,
включающих множество ферментов. Эти ферменты называют
дыхательными ферментами, а последовательность их
расположения в мембране – дыхательной цепью или цепью
переноса электронов.
5.
6.
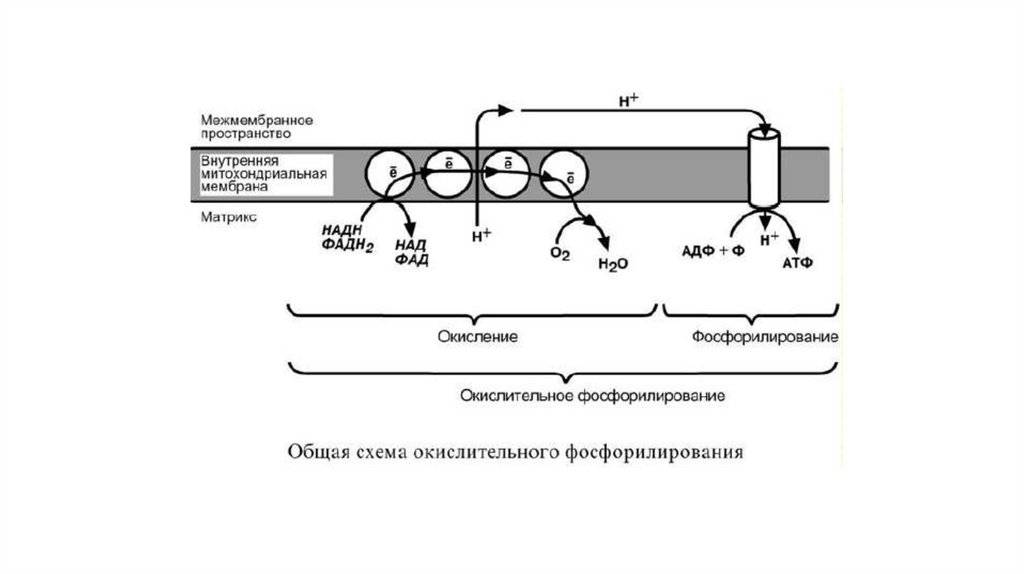
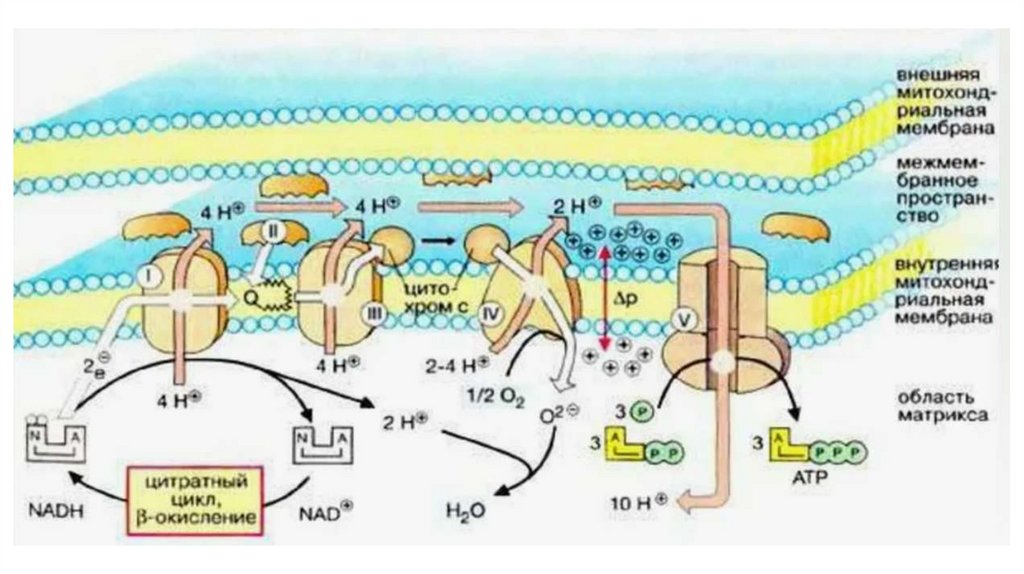
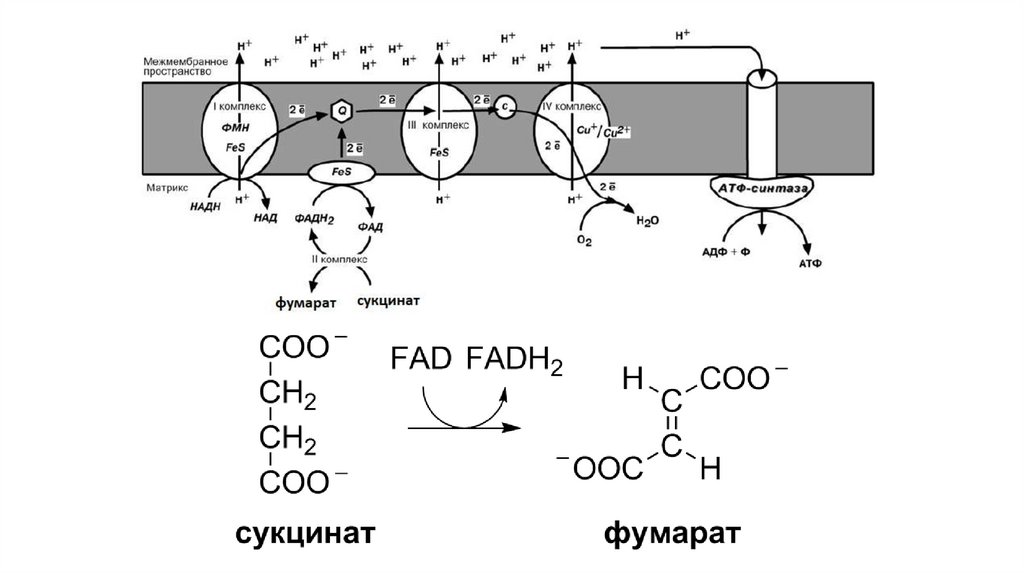
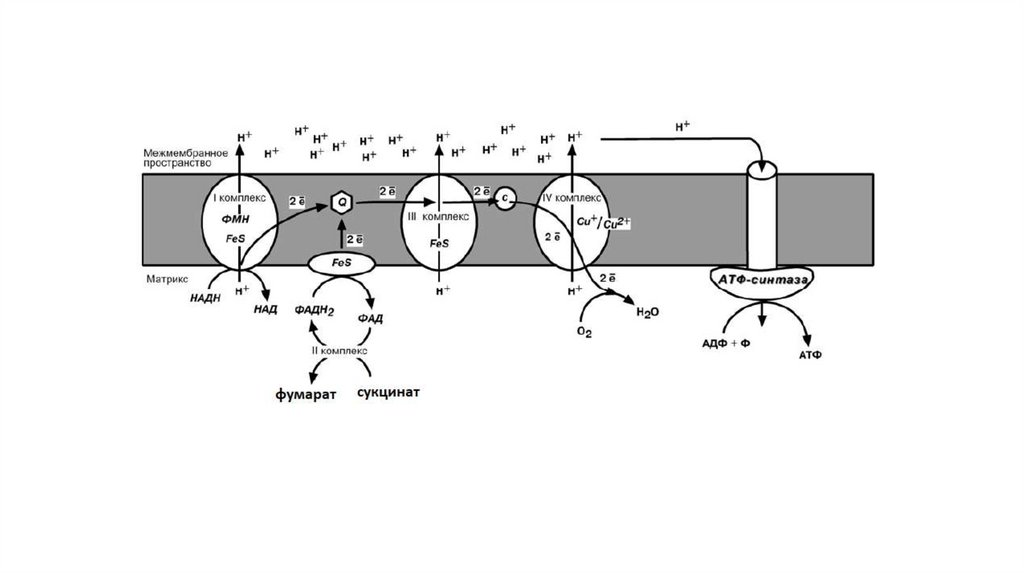
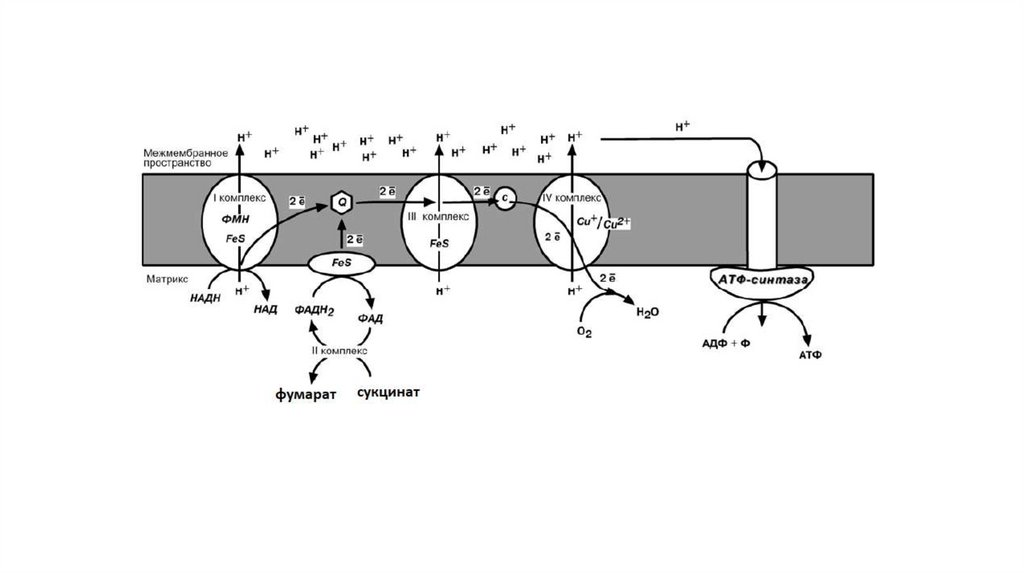
Принцип работы дыхательной цепиВ целом работа дыхательной цепи заключается в следующем:
1. Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают
атомы водорода (т.е. протоны водорода и электроны) на ферменты
дыхательной цепи.
2. Электроны движутся по дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в
межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и
восстанавливают его до воды.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФсинтазу.
6. При этом они теряют энергию, которая используется для синтеза АТФ.
7.
8.
9.
10.
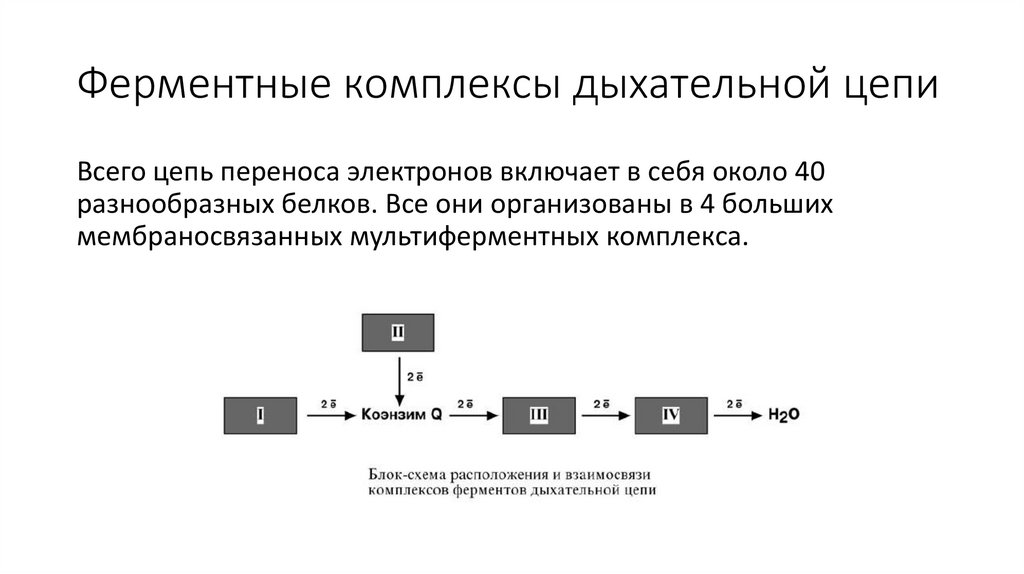
Ферментные комплексы дыхательной цепиВсего цепь переноса электронов включает в себя около 40
разнообразных белков. Все они организованы в 4 больших
мембраносвязанных мультиферментных комплекса.
11.
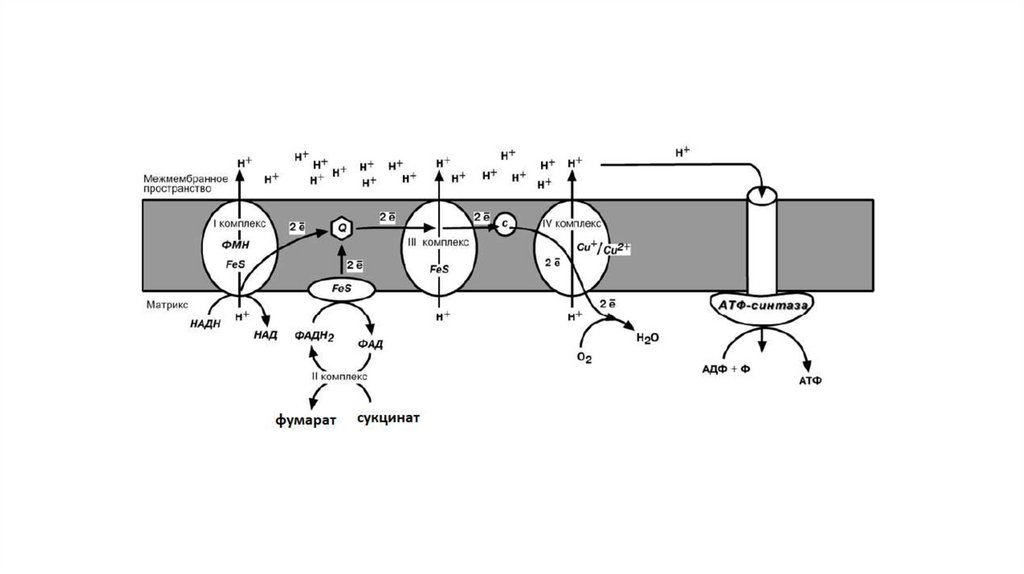
I КОМПЛЕКСI комплекс носит общее название НАДН-убихинон-редуктаза,
содержит ФМН, 22 белковых молекулы, из них 5 железосерных
белков.
Функция:
1. Принимает электроны от НАДН и передает их на коэнзим Q
(убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней
митохондриальной мембраны.
12.
13.
II КОМЛЕКССукцинат-убихинон-редуктаза
Функция:
1. Восстановление ФАД в окислительно-восстановительных
реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные
белки внутренней мембраны митохондрий. Далее эти электроны
попадают на коэнзим Q.
14.
15.
III КОМПЛЕКСIII комплекс – убихинон-цитохром с-редуктаза, кроме цитохромов
в нем имеются 2 железо-серных белка.
Функция:
1. Принимает электроны от коэнзима Q и передает их на цитохром
с.
2. Переносит 2 иона Н+ на наружную поверхность внутренней
митохондриальной мембраны.
16.
17.
IV КОМПЛЕКСIV комплекс – цитохром с-оксидаза. В комплексе имеется 2 иона
меди.
Функция:
1. Принимает электроны от цитохрома с и передает их на кислород
с образованием воды.
2. Переносит 4 иона Н+ на наружную поверхность внутренней
митохондриальной мембраны.
18.
19.
Трансмембранный электрохимическийпотенциал
Трансмембранный электрохимический потенциал (градиент
протонов, ΔµH+) представляет собой особую форму
аккумулирования энергии в клетке. Он возникает в ходе работы
электротранспортной цепи внутренней мембраны митохондрий.
Электроны поступают в дыхательную цепь с НАДН и ФАДН2,
транспортируются по цепи, теряя энергию, которая расходуется на
выкачивания протонов из матрикса в межмембранное
пространство, что приводит к возникновению трансмембранного
электрохимического потенциала.
20.
Электрохимический потенциал включает две составляющие:разность электрического потенциала и разность концентраций
протонов Н+, то есть концентрационный градиент.
Энергия электрохимического потенциала может использоваться
для образования АТФ из АДФ и неорганического фосфата в
сложном белковом комплексе АТФ-синтазе, который также
локализован во внутренней мембране митохондрий. Такой способ
синтеза АТФ называется окислительным фосфорилированием.
21.
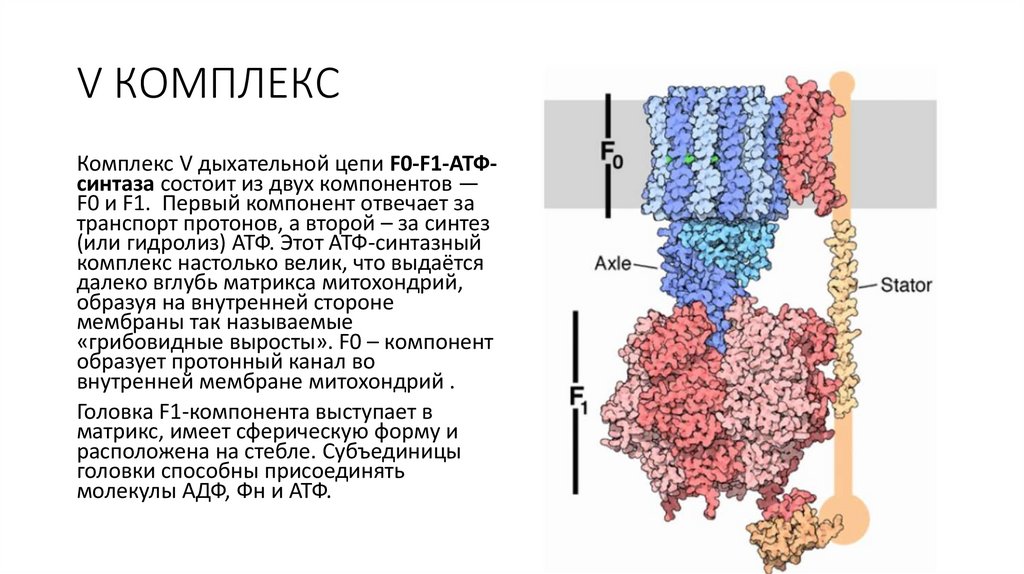
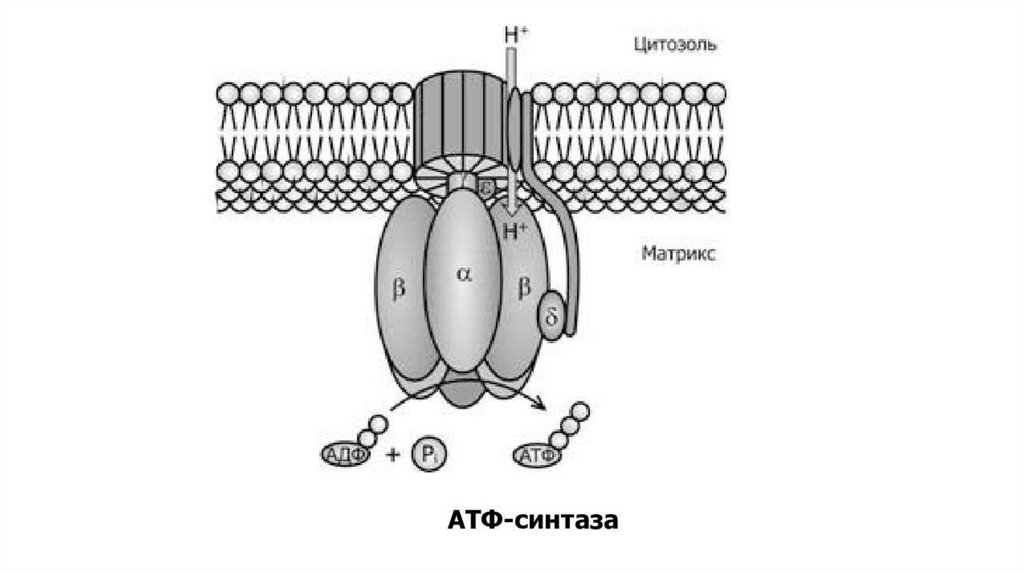
V КОМПЛЕКСКомплекс V дыхательной цепи F0-F1-АТФсинтаза состоит из двух компонентов —
F0 и F1. Первый компонент отвечает за
транспорт протонов, а второй – за синтез
(или гидролиз) АТФ. Этот АТФ-синтазный
комплекс настолько велик, что выдаётся
далеко вглубь матрикса митохондрий,
образуя на внутренней стороне
мембраны так называемые
«грибовидные выросты». F0 – компонент
образует протонный канал во
внутренней мембране митохондрий .
Головка F1-компонента выступает в
матрикс, имеет сферическую форму и
расположена на стебле. Субъединицы
головки способны присоединять
молекулы АДФ, Фн и АТФ.
22.
23.
В процессе движения протонов через F0 выделяется энергиядостаточная для поворота стебля, это приводит к высвобождению
молекулы АТФ из активного центра β-субъединиц. Таким образом,
энергия электрохимического градиента (∆μН+) преобразуется в
энергию химических связей АТФ, то есть энергия, необходимая для
синтеза АТФ, тратится не непосредственно на образование
фосфоангидридной связи между АДФ и Фн, а на «выталкивание»
образованного АТФ из активного центра. Для синтеза 1 молекулы
АТФ необходимо прохождение приблизительно 3-х протонов Н+.
Кроме того, энергия трансмембранного градиента протонов может
использоваться на выработку тепла и транспорт ионов через
мембрану митохондрий. Окислительное фосфорилирование –
основной источник АТФ для большинства клеток организма
человека.
24.
25.
Коэффициент Р/ОМерой эффективности работы дыхательной цепи принято считать
отношение количества синтезированного АТФ или неорганического
фосфата к количеству потребленного кислорода (АТР:О или Р/О).
При окислении НАДН и FADH2 в дыхательной цепи митохондрий
образуется соответственно около 3 и 2 молекул АТФ. Однако
подобные соотношения отражают «идеальную ситуацию», когда
все необходимые для процесса окислительного
фосфорилирования компоненты присутствуют в достаточных
количествах, а энергия электрохимического потенциала
расходуется только для синтеза АТФ.
26.
Разобщение тканевого дыхания иокислительного фосфорилирования.
Синтез АТФ в Комплексе V дыхательной цепи происходит в том случае,
если трансмембранный перенос протонов внутрь митохондрии
происходит по протонпроводящему пути (фактору F0) АТФ-синтазы. Если
же протоны поступают в митохондрии, минуя F0, синтеза АТФ не
происходит. Нарушение синтеза АТФ в дыхательной цепи, вызванное
снижением ∆μН+ без нарушения транспорта восстановительных
эквивалентов по дыхательной цепи, получило название разобщение
дыхания и фосфорилирования (или разобщение окисления и
фосфорилирования). Вещества, способствующие этому процессу,
называют разобщителями. В результате разобщения энергия ∆μН+ не
трансформируется в энергию химических связей АТФ, а рассеивается в
виде тепла.
27.
Разобщители вызывают увеличение проницаемости внутреннеймембраны митохондрий для протонов и других ионов.
Известен ряд веществ, способствующих трансмембранному
переносу протонов. Их называют протонофорами. Это
гидрофобные соединения, которые свободно перемещаются в
липидном бислое и обратимо связывают протоны (например,
анионы жирных кислот), транспортируя их внутрь митохондрий,
что приводит к снижению ∆рН-компонента протонного потенциала
и, следовательно, ∆μН+.
Ряд протонофоров вырабатывается в организме человека – это .
Экзогенные разобщители в организме не образуются, они являются
ядами и могут использоваться в качестве противомикробных
препаратов. Антибиотики-разобщители очень токсичны и могут
использоваться только для местного применения.
28.
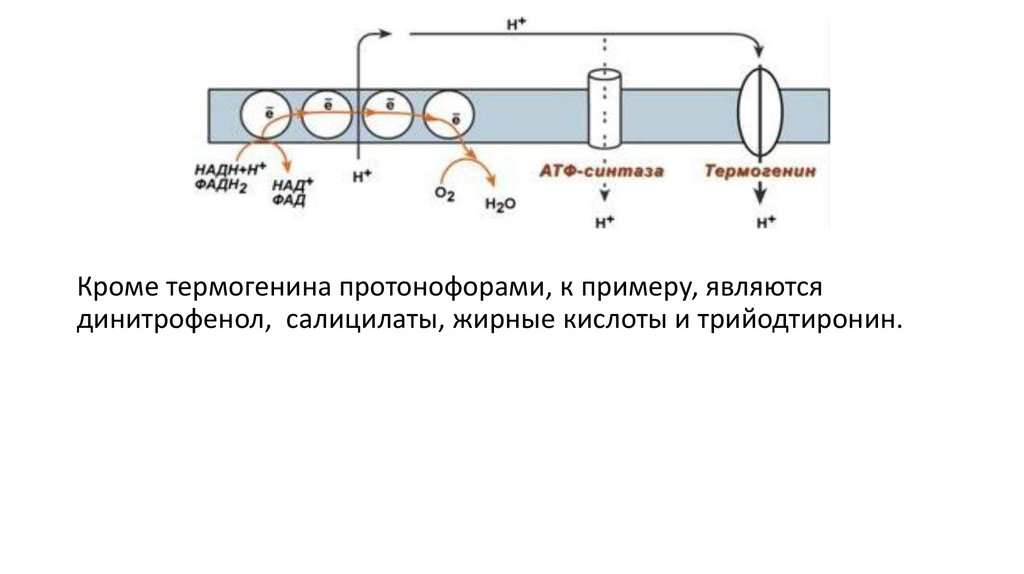
Физиологическим протонофором является белок "термогенин", визобилии имеющийся в клетках бурой жировой ткани (до 15% от
всех белков митохондрий). Существенным отличием бурой
жировой ткани от белой является большое количество
митохондрий, которые придают клеткам буро-красный цвет. При
охлаждении организма эти клетки получают сигналы по
симпатическим нервам, и в них активируется расщепление жира –
липолиз. Окисление жиров приводит к получению НАДН и ФАДН2,
активизации работы дыхательной цепи и возрастанию
электрохимического градиента. Однако АТФ-синтазы в мембранах
митохондрий этих клеток мало, зато много термогенина.
Благодаря ему, большая часть энергии ионов водорода
рассеивается в виде тепла, обеспечивая поддержание
температуры тела при охлаждении.
29.
Кроме термогенина протонофорами, к примеру, являютсядинитрофенол, салицилаты, жирные кислоты и трийодтиронин.
30.
Разобщители-ионофоры осуществляют транспорт в матриксмитохондрий положительно заряженных ионов, обычно К+ или
Na+. Это приводит к снижению электрической составляющей
протонного потенциала и, следовательно, к снижению ∆μН+ и
нарушению синтеза АТФ. Так действует ряд антибиотиков:
валиномицин, нигерицин и др. Разобщители грамицидин и
амфотерицин образуют в мембране каналы, проницаемые для
нескольких ионов (Н+, К+, Na+).
31.
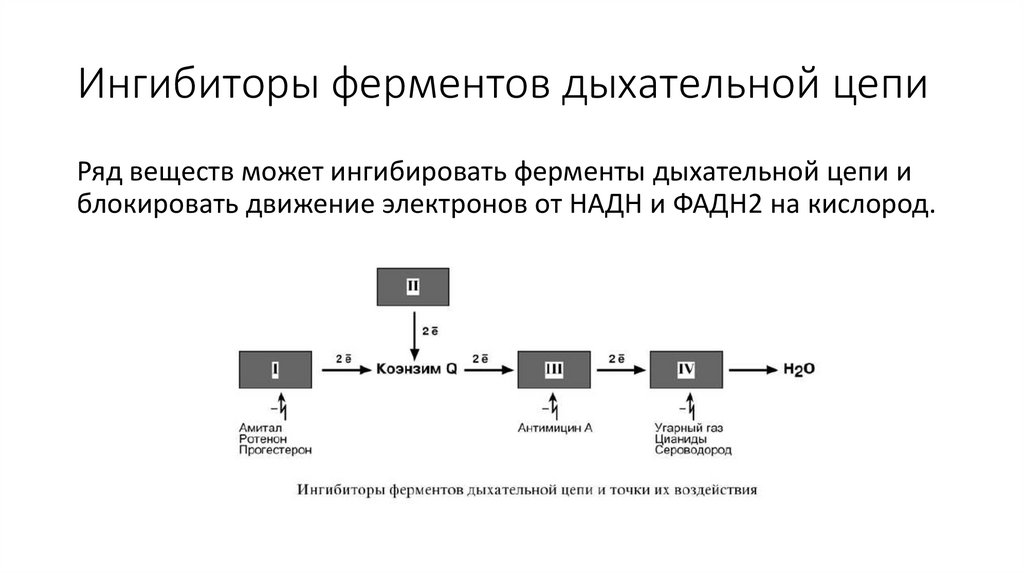
Ингибиторы ферментов дыхательной цепиРяд веществ может ингибировать ферменты дыхательной цепи и
блокировать движение электронов от НАДН и ФАДН2 на кислород.
32.
Выделяют три основных группы ингибиторов:• действующие на I комплекс, например, амитал, ротенон,
прогестерон,
• действующие на III комплекс, например, антимицин А,
• действующие на IV комплекс, например, сероводород (H2S),
угарный газ (СО), цианиды (-CN).
33.
Гипоэнергетические состоянияПричинами гипоэнергетических состояний может быть следующее:
• гиповитаминозы экзогенные и/или эндогенные – снижается скорость и
эффективность окислительных реакций. Возникает обычно при нехватке
витаминов группы В – В1, В2, никотиновой кислоты, В6, пантотеновой
кислоты и аскорбиновой кислоты.
• дефицит белка в пище – снижается синтез всех ферментов и ферментов
катаболизма в частности.
• снижение потребления углеводов и липидов как основных источников
энергии.
• дефицит кислорода – отсутствие акцептора для электронов вызывает
"переполнение« дыхательных ферментов, повышение электрохимического
градиента, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма.
• дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и
меди – компонента цитохромоксидазы.

















 biology
biology








