Similar presentations:
Значення окисновідновних реакцій у житті людини, природі й техніці
1. Значення окисно-відновних реакцій у житті людини, природі й техніці
Значення окисновідновних реакцій у життілюдини, природі й техніці
2. Мета уроку
- Повторити теоретичний матеріал проокисно- відновні реакції.
- Удосконалювати навики складання
електронних балансів окисно- відновних
реакцій.
- Розкрити значення окисно- відновних
реакцій.
3.
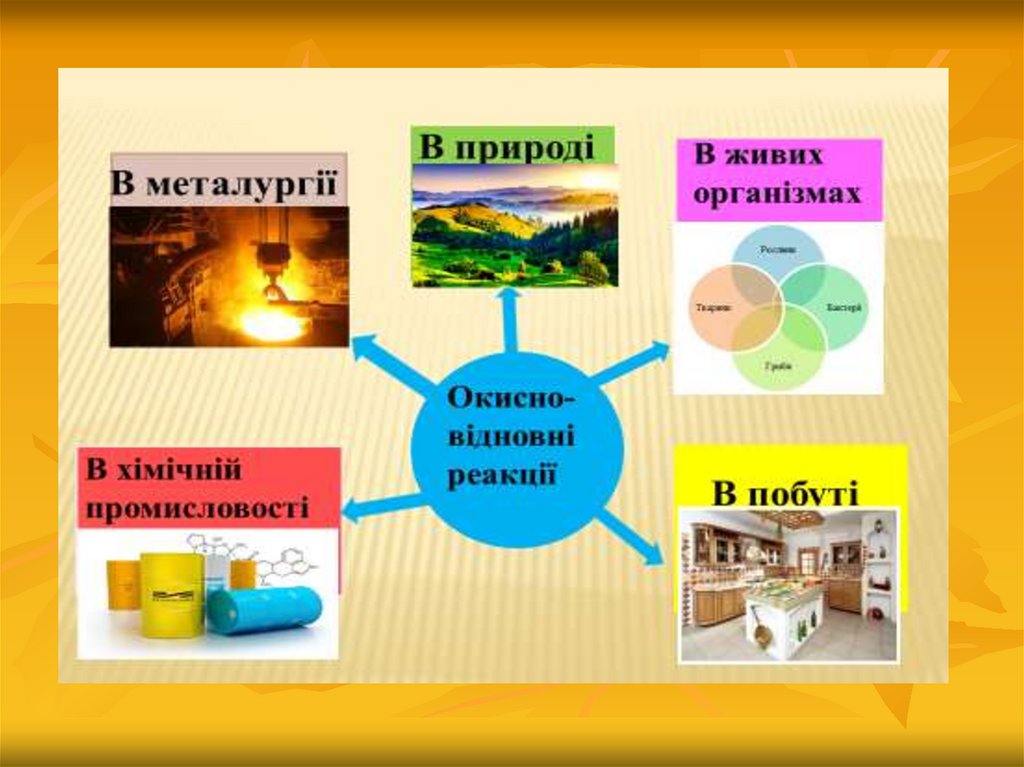
4. Окисно-відновні реакції у природі
5. Окисно-відновні реакції у природі
Завдяки окисно-відновним процесам на ранніхстадіях існування нашої планети утворилися
гірські породи і мінерали
6. Окисно-відновні реакції у природі
Під час грози,відбувається
зв’язування
атмосферного азоту.
Це ОВР.
N2 + O2 = NO
NO + O2 = NO2
7. Окисно-відновні реакції у природі
Реакція, щовідбувається під час
виверження вулкану:
H2S + O2 = SO2 + H2O
Складіть рівняння
окисно – відновної
реакції.
8.
Корозія – це явище руйнування металів ісплавів унаслідок хімічних реакцій з
речовинами навколишнього середовища
9. Окисно-відновні реакції у повсякденному житті
Щорічно корозіяз’їдає 20% від
загальної маси
вироблених металів
та сплавів.
Fe + O2 + H2O →
Fe(OH)2
Fe(OH)2 + O2 + H2O
→ Fe(OH)3
10.
11.
12. Окисно- відновні реакції в живих організмах.
Реакція фотосинтезу6CO2 + 6H2O →
C6H12O6 + 6O2
13. Окисно-відновні реакції у природі
Процеси гниттяПерегнивають
відмерлі
рештки тварин,
опале листя.
14. Окисно- відновні реакції в металургії
. Окисно-відновніпроцеси
використовуються у
металургії під час
виплавки чавуну та
сталі, одержання та
очищення
кольорових,
рідкісних металів.
15.
16. Скласти електронний баланс окисно- відновної реакції
:FeO + C → Fe + CO
Cr2O3 + Al → Cr + Al2O3
V2O5 + H2 → V + H2O
17. Окисно – відновні реакції в побуті
Ржавіння металівПочорніння срібних виробів
Хімічна завивка волосся
Відбілювання і дезинфекція
18. Окисно - відновні реакції в хімічній промисловості
Синтез аміаку3H2+N2 =2 NH3
Виробництво H2SO4
1 стадія: S + O2 = SO2
2 стадія: 2SO2 + O2
=2SO3
3 стадія: SO3 + H2O =
H2SO4
19. Відповіді на тести
I варіант1 Б
2 Б
3 Б
4 Г
5 Г
6 Б
II варіант
1 В
2 В
3 В
4 А
5 В
6 А


















 chemistry
chemistry








