Similar presentations:
Окисно-відновні реакції. 9 клас
1. Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники.
Хімія 9 клас2. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
АКТУАЛІЗАЦІЯ ОПОРНИХ
ЗНАНЬ
Хімічний диктант
Записати рівняння реакцій, вказати їх типи.
1 варіант
1. SO3 + H2O
2. Fe + HCl
3. N2O5 + H2O
4. CaO + HCl
5. FeO + H2SO4
6. Cu + H2SO4
7. CO2 + H2O
8. KOH + H2SO4
9. Fe(OH)3
10. Fe + CuSO4
2 варіант
1. SO2 + H2O
2. Al + HCl
3. P2O5 + H2O
4. MgO + HCl
5. CaO + H2O
6. Na2O + H2SO4
7. Hg + H2SO4
8. Cu(OH)2 + HCl
9. H2CO3
10. Zn + HgCl2
3. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ, ЇХ ЗНАЧЕННЯ
На сьогоднішньому уроці перед вами стоятьзавдання:
• з’ясувати роль окисно-відновних реакцій у
природі, техніці, житті людини;
• удосконалити вміння визначати ступені
окиснення, записувати схеми процесів
окиснення та відновлення, підбирати
коефіцієнти методом електронного
балансу.
4. Запишемо рівняння реакції
Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu05.
6.
• Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0• Відновник
• Окисник
Fe0 - 2e = Fe+2
Cu+2 + 2e = Cu0
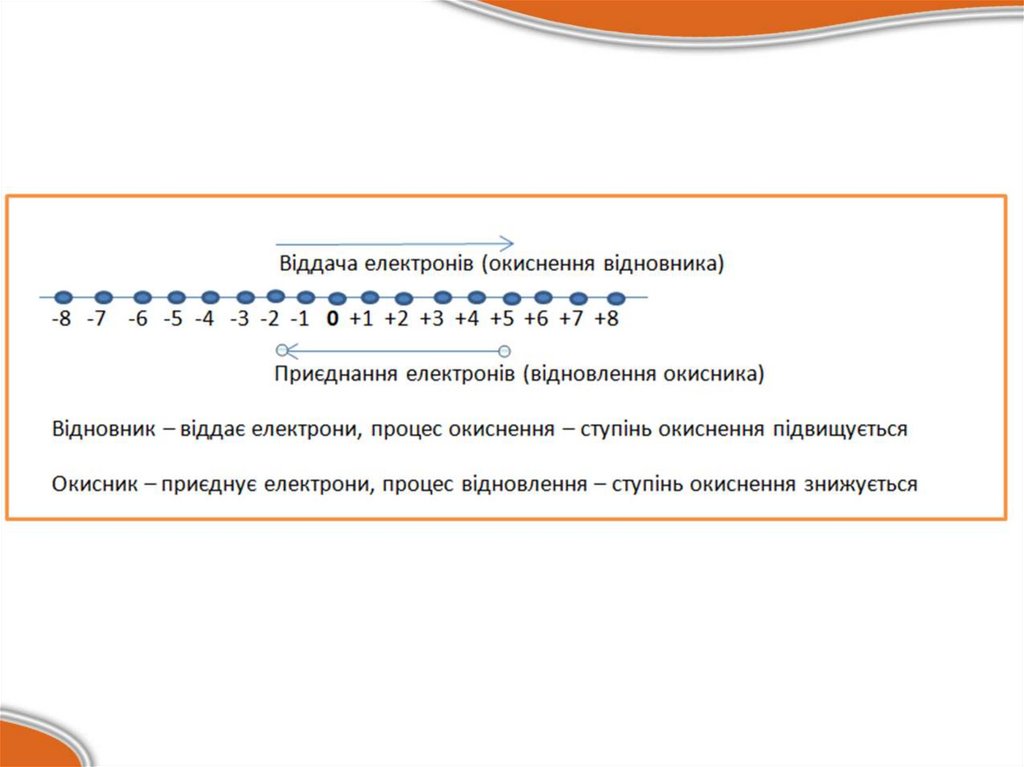
7. Основні поняття
• Окиснення — це процес віддачі електрона.• Відновлення — процес прийому
електрона.
• Атом, що віддає електрони, називається
відновником.
• Атом, що приймає електрони,
називається окисником.
8.
9. АЛГОРИТМ СКЛАДАННЯ ЕЛЕКТРОННОГО БАЛАНСУ
Визначити, які елементи в процесі хімічної реакції
змінюють ступінь окиснення.
Записати окремо процеси окиснення та відновлення з
указівкою кількості електронів, що беруть участь у
кожнім процесі.
У записаному рівнянні реакції визначити ступені
окиснення всіх елементів.
Визначити окисник і відновник.
Визначити коефіцієнти, на які необхідно помножити
рівняння окиснення й відновлення, щоб кількість
електронів, відданих відновником і прийнятих
окисником, була однаковою.
Просумувати рівняння окиснення й відновлення з
урахуванням отриманих коефіцієнтів або розставити
відповідні коефіцієнти у вихідному рівнянні.
10. Оформлення окисно-відновної реакції з електронним балансом
11. Окисно-відновні реакції в природі та житті людини:
• - процеси дихання у тварин• - процес фотосинтезу у
рослин
• - процес дихання у людини
• - металургія
• - електроніка
• - електротехніка
• - енергетика
• - косметологія
12. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
• 3і списку рівнянь реакцій учні повинні вибрати окисновідновні та скласти електронний баланс.1 варіант:
KBr + Сl2 → КСl + Вr2;
Zn + HCl → ZnCl2 + H2;
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O;
Al + S → Al2S3;
NaOH + P2O5 → Na3PO4 + H2O;
13. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
• 3і списку рівнянь реакцій учні повинні вибрати окисновідновні та скласти електронний баланс.2 варіант:
Fe + Cl2 → FeCl3;
NaOH + HCl → NaCl + H2O;
KClO3 + P → KCl + P2O5;
CaO + CO2 → CaCO3;
KCl + F2 → KF + Cl2;
14. Перевірка
• 1 варіант:2KBr + Сl2 → 2 КСl + Вr2;
Cl20+ 2е → 2Cl- 2 1
2Br- - 2е → Br20 2 1
Zn + 2HCl → ZnCl2 + H2;
2Cl- - 2е → Cl20 2 1
2H+ +2е→ H20 2 1
2Al + 3S → Al2S3;
Al0 – 3е → Al+3 3 2
S0 +2е → S-2
2 3
15.
• 2 варіант:2Fe + 3Cl2 → 2 FeCl3;
Fe0 – 3е →Fe+3 3 2
Cl20+ 2е → 2Cl- 2 3
5KClO3 + 6P → 5KCl + 3P2O5;
P0 – 5е → P+5 5 6
Cl+5+ 6е→Cl- 6 5
2KCl + F2 → 2KF + Cl2;
2Cl- - 2е → Cl20 2 1
F20 + 2е → 2F- 2 1
16. ДОМАШНЄ ЗАВДАННЯ
• Вивчити поняття 15 параграфу• Завдання 179, 180















 chemistry
chemistry








