Similar presentations:
Карбоновые кислоты
1.
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙУНИВЕРСИТЕТ
Царскосельский аграрно-технологический колледж
Химия
Тема: «Карбоновые кислоты».
Автор: к.х.н. ЧУМАЧЕНКО Е.В.
Санкт-Петербург
2.
3.
УЧЕБНЫЕ ВОПРОСЫ:Определение.
2. Классификация карбоновых
кислот.
3. Номенклатура .
4. Изомерия.
5. Физические свойства.
6. Химические свойства.
7. Получение.
8. Применение.
1.
4.
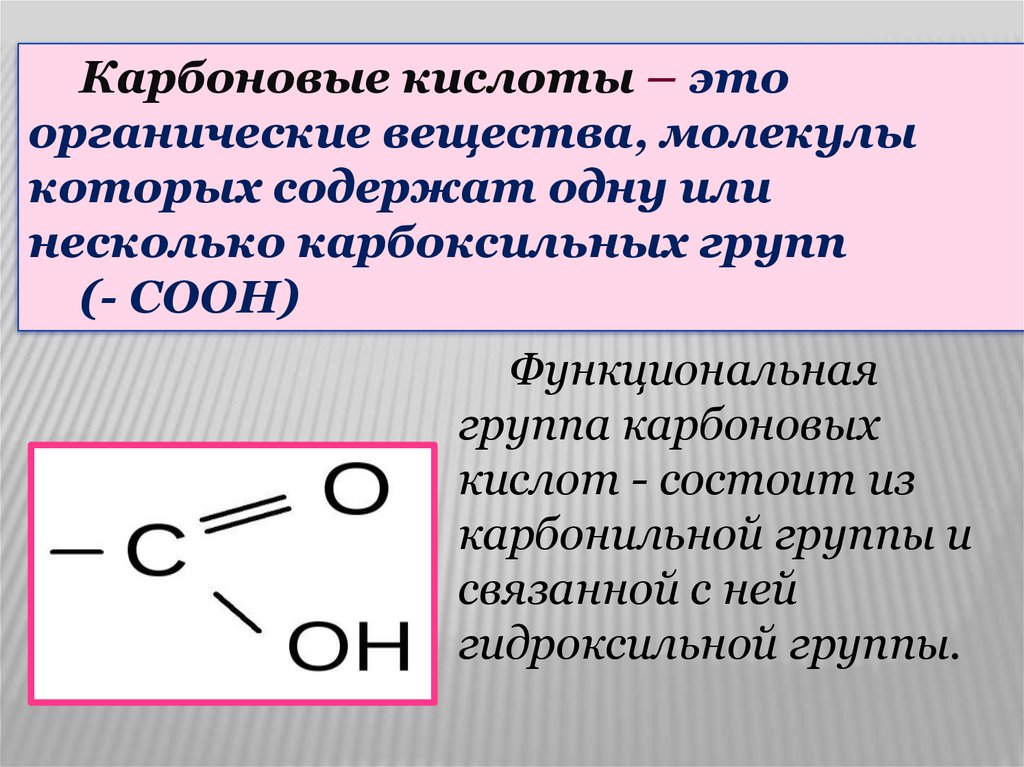
Карбоновые кислоты – этоорганические вещества, молекулы
которых содержат одну или
несколько карбоксильных групп
(- СООН)
Функциональная
группа карбоновых
кислот - состоит из
карбонильной группы и
связанной с ней
гидроксильной группы.
5.
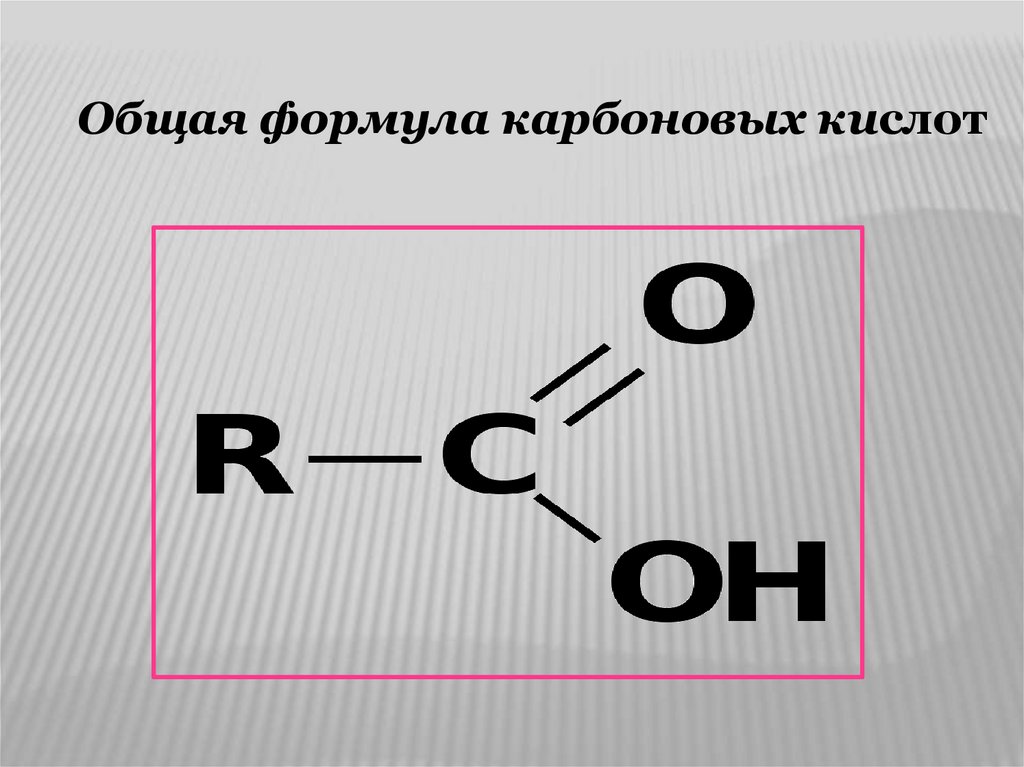
Общая формула карбоновых кислот6.
КЛАССИФИКАЦИЯ КИСЛОТ:По числу карбоксильных групп
делятся на одноосновные – НСООН
– муравьиная кислота;
двухосновные – НООС-СООН –
щавелевая кислота и т.д.
По типу углеводородного радикала
они делятся на предельные,
непредельные и ароматические.
7.
АЛГОРИТМ СОСТАВЛЕНИЯНАЗВАНИЙ КАРБОНОВЫХ КИСЛОТ
1.
2.
3.
4.
Найдите главную (самую длинную)
цепь углеродных атомов (включая
атом карбоксильной группы).
Пронумеруйте углеродные атомы
главной цепи, начиная с углерода
карбоксильной группы.
Назовите соединение по алгоритму
углеводородов.
В конце названия допишите суффикс
«ов», окончание «ая» и слово «кислота»
8.
Название кислот9.
ИЗОМЕРИЯ ОДНООСНОВНЫХКАРБОНОВЫХ КИСЛОТ
Углеводородного
скелета:
СН3СН2СН2СООН –
бутановая кислота
СН3СНСООН
│
СН3
2-метилпропановая
кислота
Межклассовая со
сложными
эфирами:
СН3СН2СООН –
пропановая
кислота
СН3СООСН3 –
метиловый эфир
уксусной кислоты
10.
ФИЗИЧЕСКИЕ СВОЙСТВАФизические
свойства
предельных
одноосновных карбоновых кислот в
значительной
степени
обусловлены
наличием между молекулами прочных
водородных связей (более прочных, чем
между молекулами спиртов). Поэтому
температуры кипения и растворимость
в воде у кислот больше, чем у
соответствующих спиртов.
11.
ХИМИЧЕСКИЕ СВОЙСТВА1. Горение: СН3СООН +2О2=2СО2+2Н2О
2. Свойства слабых кислот:
a. Mg+2CH3COOH=(CH3COO)2Mg+H2↑
b. CaO+2CH3COOH=(CH3COO)2Ca+H2O
c. NaOH+CH3COOH=CH3COONa+H2O
d.K2CO3+CH3COOH=CH3COOK+H2O+CO2↑
12.
ХИМИЧЕСКИЕ СВОЙСТВА3. Этерификация (реакция со
спиртами, приводящая к
образованию сложного эфира):
НСООН+С2Н5ОН=НСООС2Н5+Н2О
Муравьиная
кислота
этанол
этиловый эфир
муравьиной кислоты
13.
ХИМИЧЕСКИЕ СВОЙСТВА:4. Замещение в углеводородном радикале:
СН3-СН2-СООН+Cl2=CH3-CHCl-COOH+HCL
5. Качественная реакция на муравьиную
кислоту – реакция серебряного зеркала:
HCOOH+Ag2O=CO2↑+H2O+2Ag↓
Окисление гидроксидом меди (II)
14.
ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ1.Окисление альдегидов:
kat, t
RCHO+O2
2RCOOH
(лабораторные окислители: Ag2O,
Cu(OH)2, KMnO4 и др.)
15.
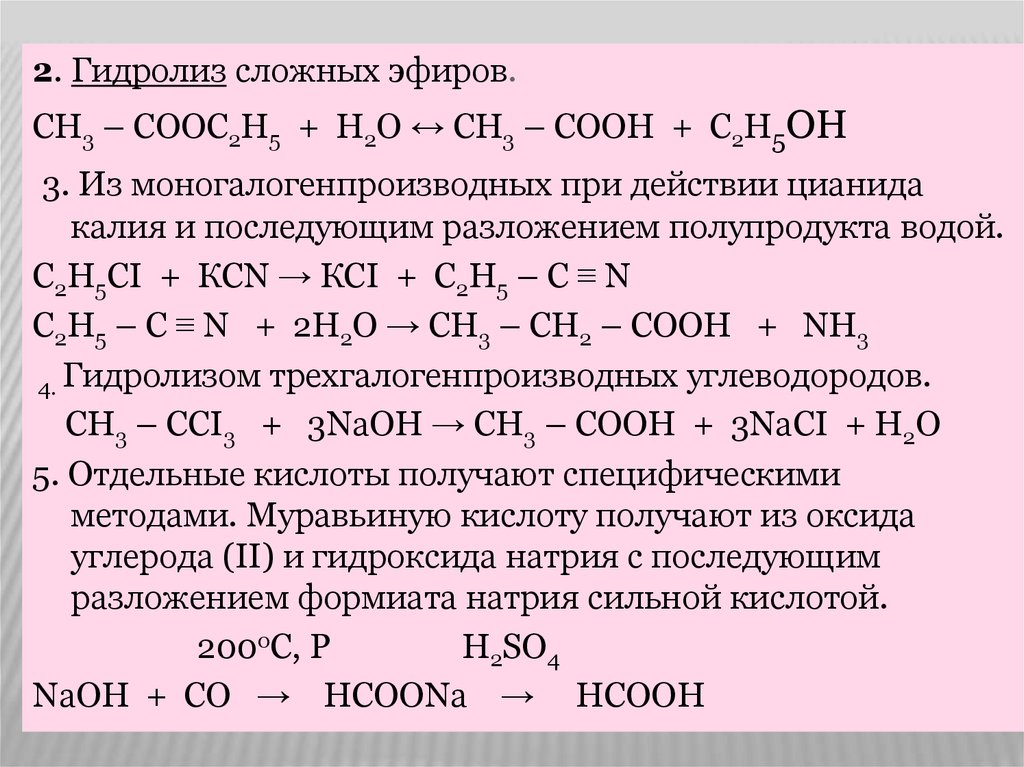
2. Гидролиз сложных эфиров.СН3 – СООС2Н5 + Н2О ↔ СН3 – СООН + С2Н5ОН
3. Из моногалогенпроизводных при действии цианида
калия и последующим разложением полупродукта водой.
С2Н5СI + КСN → КСI + С2Н5 – С ≡ N
С2Н5 – С ≡ N + 2Н2О → СН3 – СН2 – СООН + NН3
4. Гидролизом трехгалогенпроизводных углеводородов.
СН3 – ССI3 + 3NаОН → СН3 – СООН + 3NаСI + Н2О
5. Отдельные кислоты получают специфическими
методами. Муравьиную кислоту получают из оксида
углерода (II) и гидроксида натрия с последующим
разложением формиата натрия сильной кислотой.
200оС, Р
Н2SO4
NаОН + СО → НСООNа → НСООН
16.
6. Уксусную кислоту получаюткаталитическим окислением бутана
кислородом воздуха:
С4Н10 + 5О2 → 4СН3 – СООН + 2Н2О
17.
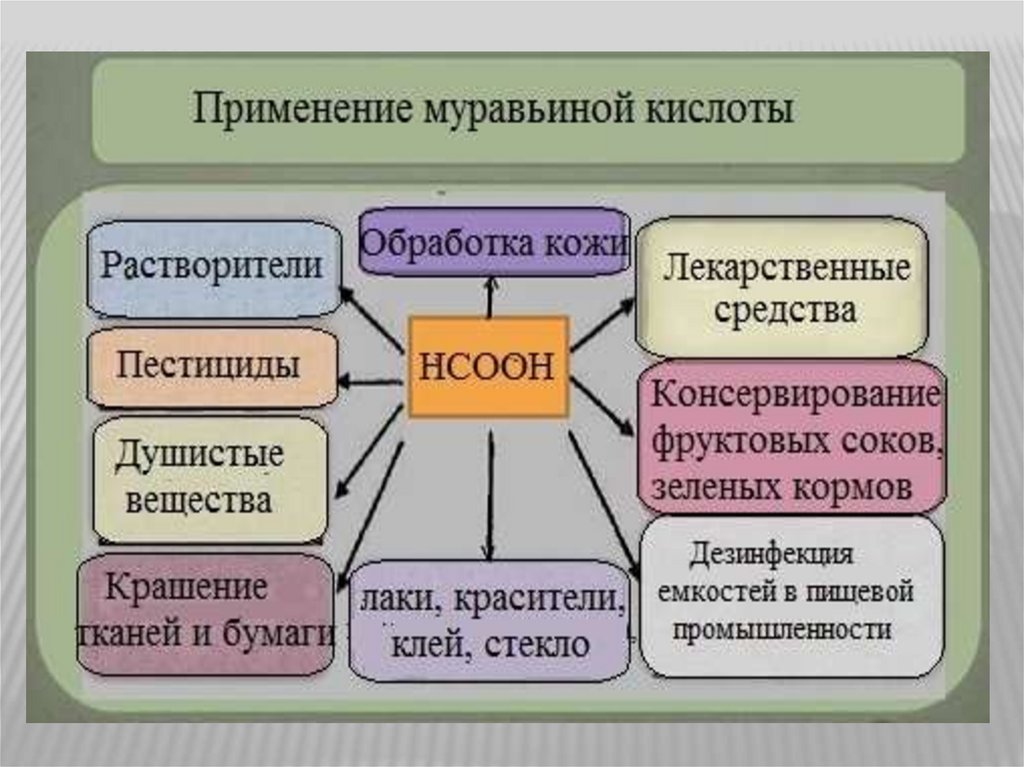
Применение карбоновых кислотБлагодаря своему уникальному молекулярному составу муравьиная
кислота обладает антибактериальными свойствами, поэтому основная сфера
ее применения – это пищевая промышленность (пищевая добавка E 236). В
пищевой промышленности она используется в качестве дезинфицирующего и
консервирующего средства при производстве кондитерских изделий,
консервированных и молочных продуктов, безалкогольных напитков. Помимо
этого, муравьиная кислота применяется для дезинфекции пивных и винных
бочек.
Она применяется в химической промышленности в качестве
восстановителя при синтезе органических веществ, при получении щавелевой
кислоты. А также, при изготовлении стекла, промышленного клея,
промышленных лаков и химических красителей.
Сложные эфиры муравьиной кислоты используют в качестве
растворителей и душистых веществ.
В текстильной промышленности ее используют в качестве протравы при
крашении тканей, в кожевенном производстве – для отмывания извести,
используемой при обработке шкур.
Муравьиная
кислота
обладает
болеутоляющим,
бактерицидным,
противовоспалительным, согревающим действием и благодаря этим
свойствам находит широкое применение в медицине. Ее используют в
медицине в качестве наружного обезболивающего средства.
18.
19.
Из всех карбоновых кислот уксусная кислота находит наиболееширокое применение. Она необходима для синтеза красителей для
тканей, лекарственных веществ, сложных эфиров, растворителей
лаков. Большое ее количество расходуются для производства
искусственного волокна (ацетатного шелка), пластических масс,
невоспламеняющейся
кинопленки,
органического
стекла,
ядохимикатов, стимуляторов роста растений.
В пищевой промышленности (пищевая добавка Е 260) уксусную
кислоту применяют для консервирования овощей, грибов, рыбы и в
качестве приправы к пище. Консервирующее действие кислоты
связано с подавлением развития гнилостных бактерий и плесневых
грибков.
Солями уксусной кислоты (Al, Fe, Cr) протравливают ткани при
крашении, они способствуют закреплению красителей на волокне.
Ацетат свинца применяется для изготовления свинцовых белил и
свинцовой примочки в медицине.
Соли уксусной кислоты используются также в сельском хозяйстве.
В результате применения 2,4-дихлорфеноксиуксусной кислоты и ее
солей на полях с зерновыми погибают только широколиственные
сорняки, что используется при выращивании зерновых культур.
Уксусный ангидрид применяется в производстве пластических
масс, искусственного шелка, ацетанилида.
20.
21.
ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ:Высшие карбоновые кислоты
( пальмитиновая –С15Н31СООН,
стеариновая – С17Н35СООН и т.д.)
называются жирными и они входят в
состав масел и жиров,
взаимодействием их со щелочами
получают мыло.
22.
САМОСТОЯТЕЛЬНАЯ РАБОТА:1.Выписать формулы веществ, с
которыми может вступать в
реакцию уксусная кислота. (Са,
СаО, СО2, Р2О5, СаСО3, Н2СО3)
23.
2. Записать структурнуюформулу вещества 2-метилгексановая
кислота.
24.
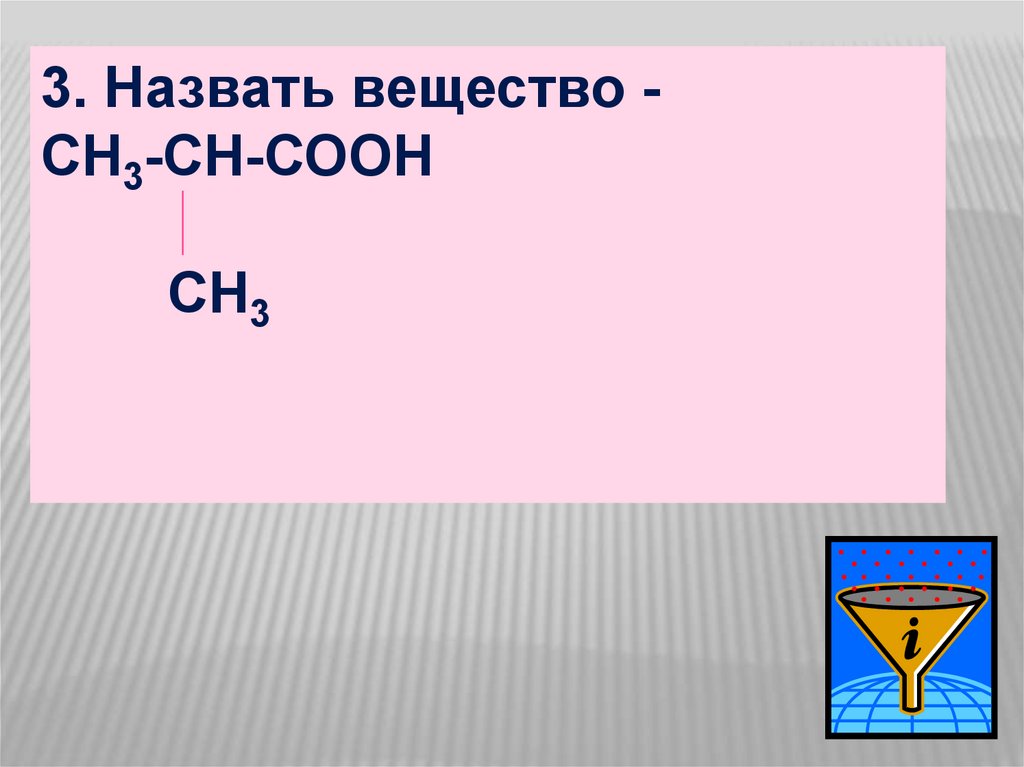
3. Назвать вещество СН3-СН-СООНCH3
25.
4. В пищевой промышленностиуксусная кислота используется в
качестве консерванта и регулятора
кислотности под кодом Е-260.
Напишите структурную формулу
предыдущего гомолога этой кислоты,
имеющего код Е- 236 . Назовите
вещество.




















 chemistry
chemistry








