Similar presentations:
Периодические изменения свойств химических элементов
1.
Периодическиеизменения свойств химических
элементов.
Тема урока:
2.
Основные понятия темыХимический элемент – это вид атомов с
одинаковым зарядом ядра.
Химическое соединение – это химически
индивидуальное вещество, состоящее из
химически связанных атомов одного или
нескольких элементов.
3.
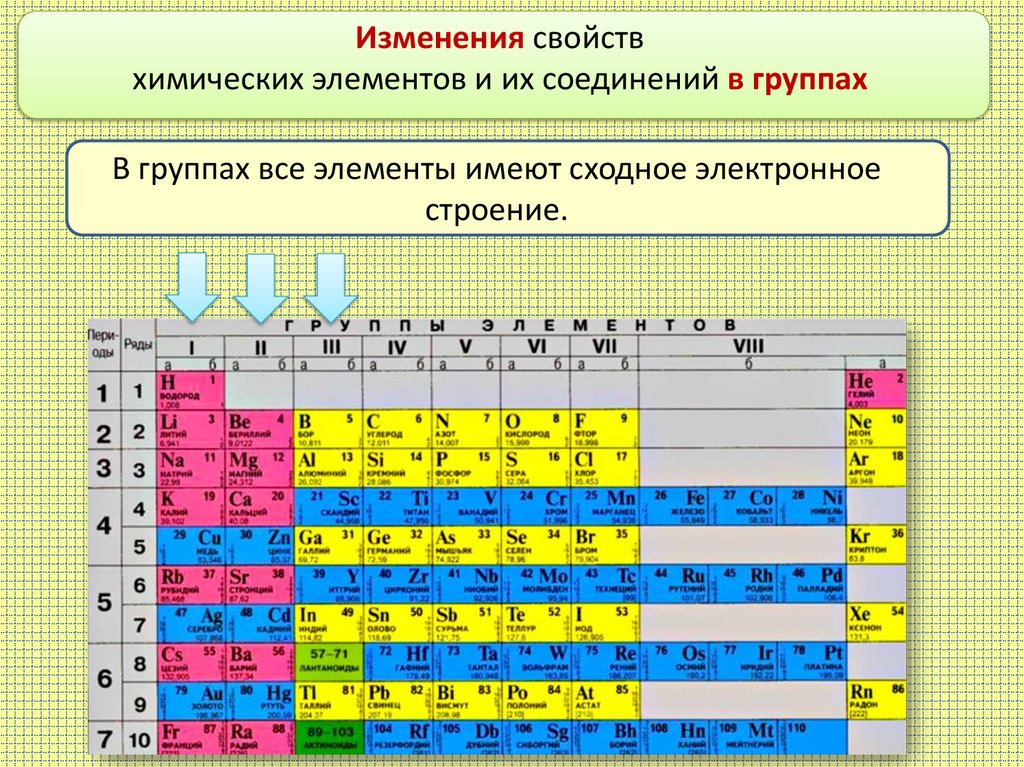
Изменения свойствхимических элементов и их соединений в группах
В группах все элементы имеют сходное электронное
строение.
4.
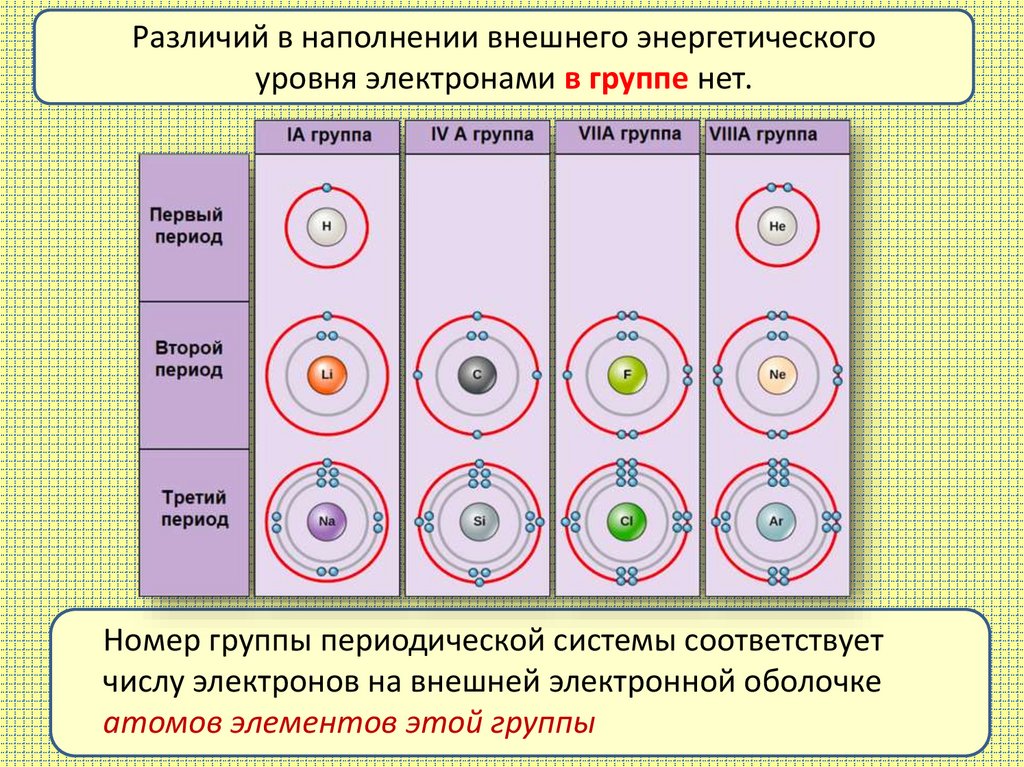
Различий в наполнении внешнего энергетическогоуровня электронами в группе нет.
Номер группы периодической системы соответствует
числу электронов на внешней электронной оболочке
атомов элементов этой группы
5.
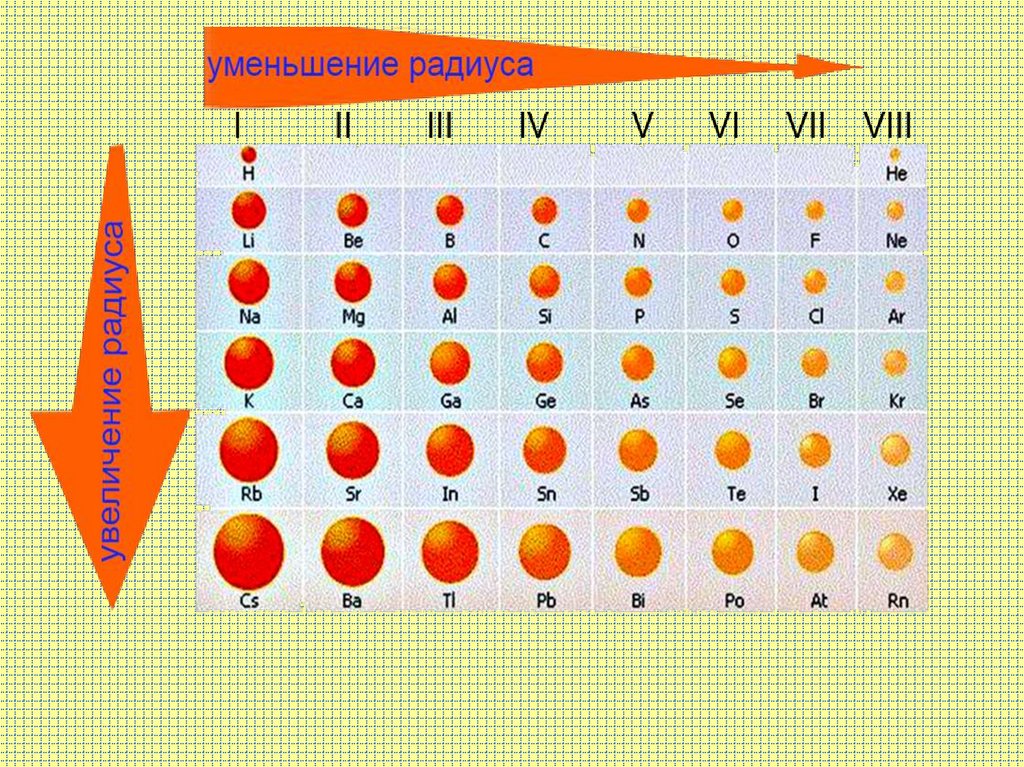
Меняется размер атома - сверху вниз вгруппе радиусы атомов увеличиваются!
Периодический закон Д. И. Менделеева:
«свойства химических элементов; а также формы и
свойства образуемых ими простых веществ и
соединений находятся в периодической зависимости
от величины зарядов ядер их атомов»
это означает:
6.
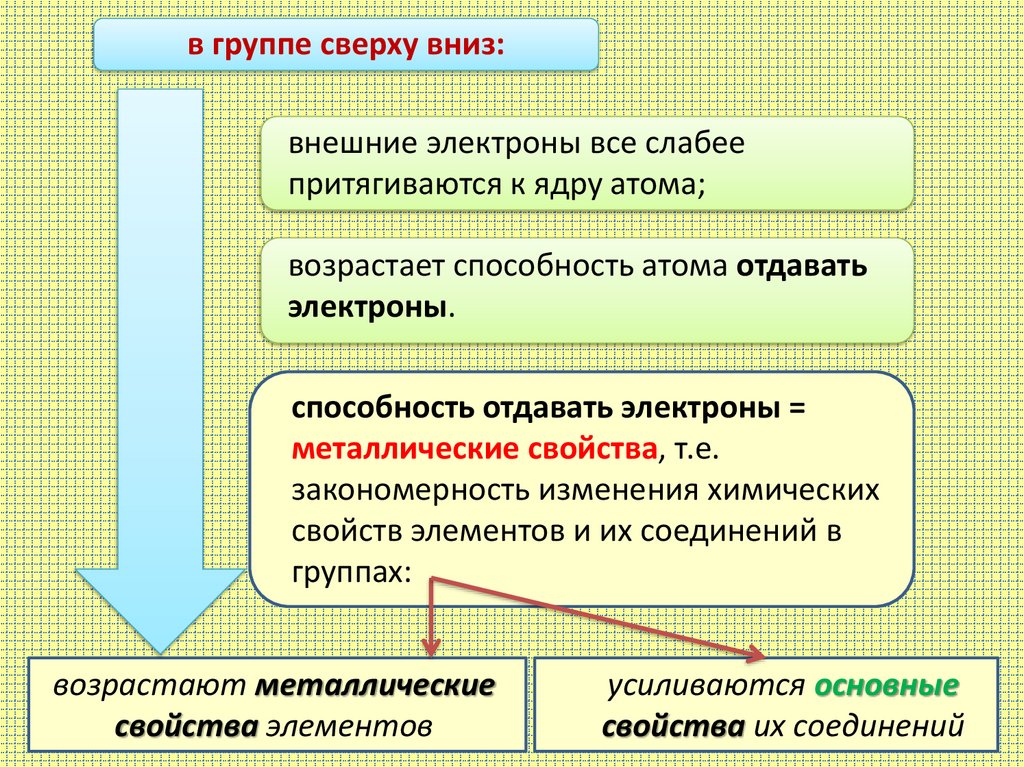
в группе сверху вниз:внешние электроны все слабее
притягиваются к ядру атома;
возрастает способность атома отдавать
электроны.
способность отдавать электроны =
металлические свойства, т.е.
закономерность изменения химических
свойств элементов и их соединений в
группах:
возрастают металлические
свойства элементов
усиливаются основные
свойства их соединений
7.
Изменения свойствхимических элементов и их соединений в периодах
8.
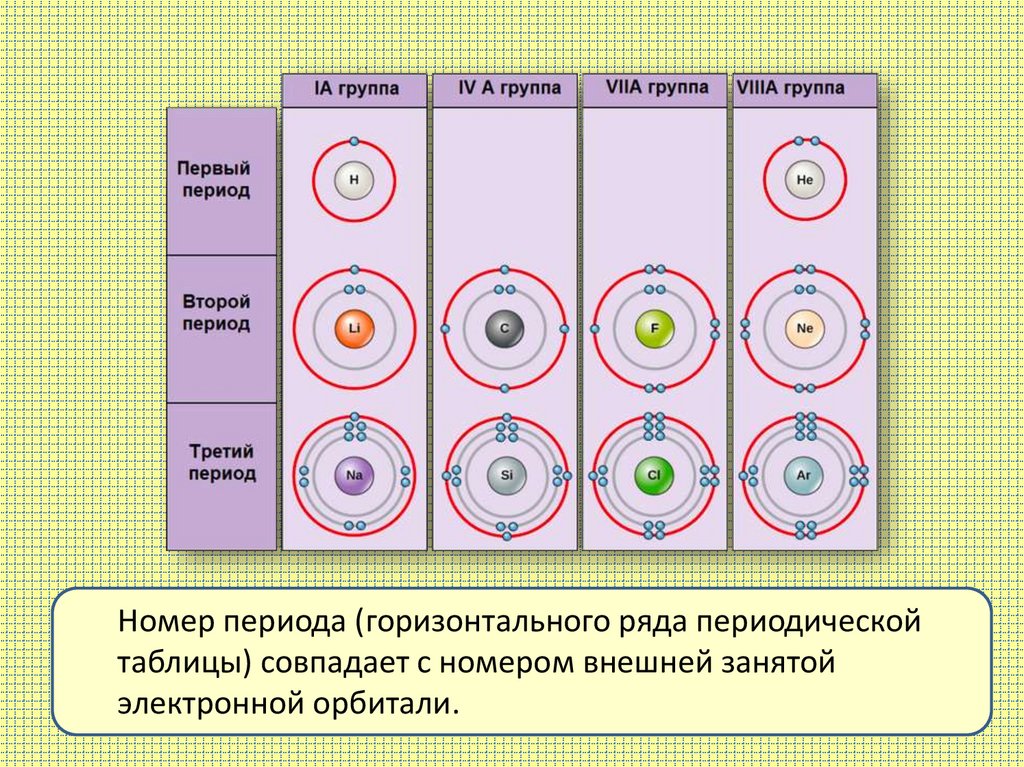
Номер периода (горизонтального ряда периодическойтаблицы) совпадает с номером внешней занятой
электронной орбитали.
9.
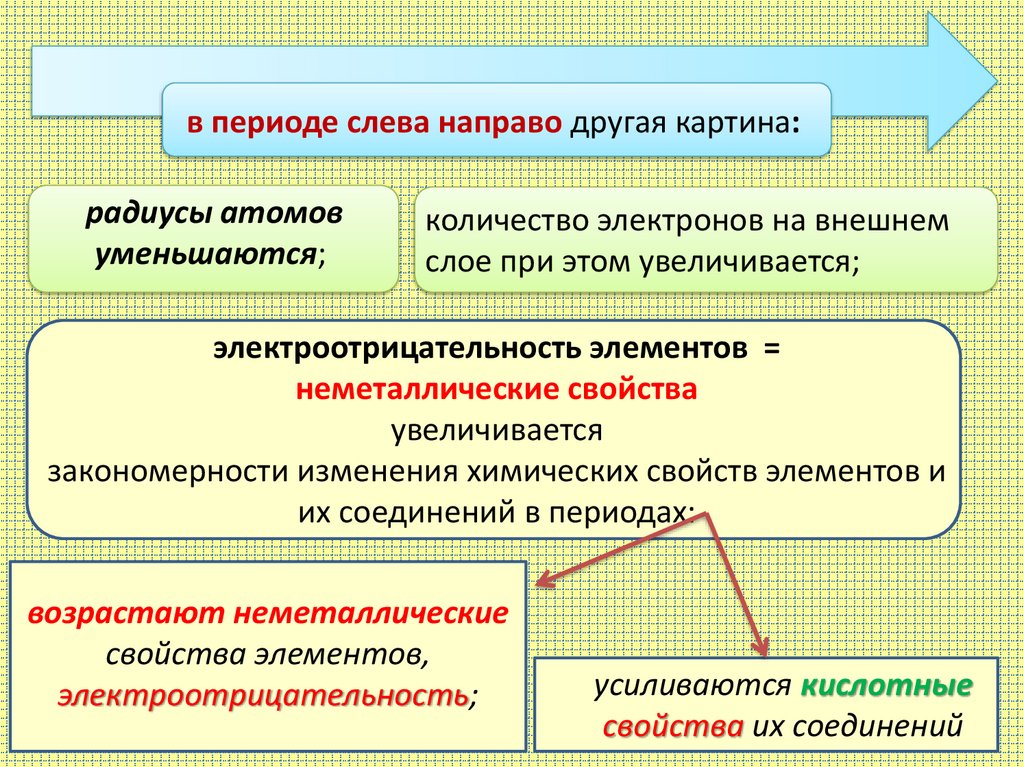
в периоде слева направо другая картина:радиусы атомов
уменьшаются;
количество электронов на внешнем
слое при этом увеличивается;
электроотрицательность элементов =
неметаллические свойства
увеличивается
закономерности изменения химических свойств элементов и
их соединений в периодах:
возрастают неметаллические
свойства элементов,
электроотрицательность;
усиливаются кислотные
свойства их соединений
10.
11.
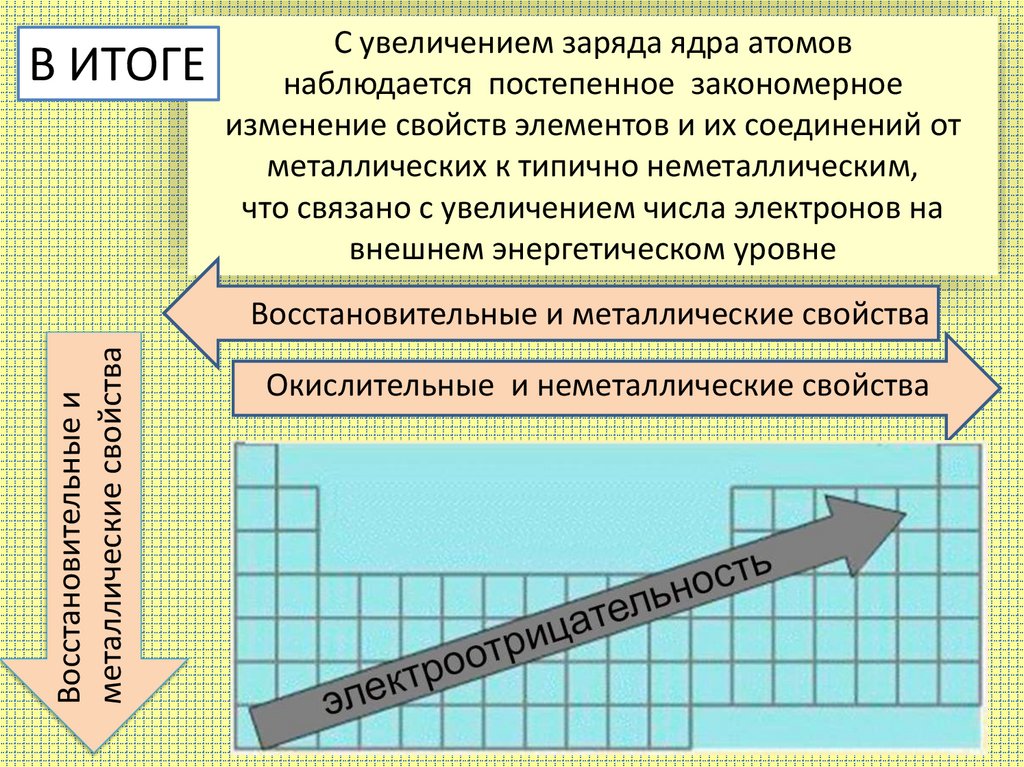
С увеличением заряда ядра атомовВ ИТОГЕ наблюдается постепенное закономерное
изменение свойств элементов и их соединений от
металлических к типично неметаллическим,
что связано с увеличением числа электронов на
внешнем энергетическом уровне
Восстановительные и
металлические свойства
Восстановительные и металлические свойства
Окислительные и неметаллические свойства
12.
Есть еще элементы, которые образуют такназываемые амфотерные соединения.
Они проявляют как металлические, так и
неметаллические свойства.
Zn Cr Al Sn Pb
Mn Fe Be
13.
Закрепление материалаЗадание №1:
Сравните металлические свойства элементов,
поставив вместо знак «<» или «>»:
Na K; Al Mg; Rb Sr; Na Cs; K Al
Сравните неметаллические свойства элементов,
поставив вместо знак «<» или «>»:
S O; F P; Si C; P S; N O
14.
Проверьте себя:Сравните металлические свойства элементов,
поставив вместо знак «<» или «>»:
Na < K; Al < Mg; Rb > Sr; Na > Cs; K > Al
Сравните неметаллические свойства элементов,
поставив вместо знак «<» или «>»:
S < O; F > P; Si < C; P < S; N < O
15.
Задание №2:Расположите элементы в порядке уменьшения их
металлических свойств:
а) Al, Na, K, B, Bа, Mg
б) Na, Rb, Mg, Ca, Cs, Al
Расположите элементы в порядке уменьшения их
неметаллических свойств:
а) C, S, Si, O, P, Cl, F
б) Si, N, P, Cl, Br, As, S
16.
Проверьте себя:Расположите элементы в порядке уменьшения их
металлических свойств:
а) K > Bа > Nа > Mg > Al > B
б) Cs > Rb > Ca > Na > Mg > Al
Расположите элементы в порядке уменьшения их
неметаллических свойств:
а) F > O > Cl > S > C > P > Si
б) N > Cl > Br > S > P > As > Si
17.
Домашнее задание:Изучить §32, по данной
презентации сделать конспект
выполнить тест (смотри ниже!!!)
18.
1. В ряду Li → Ве → В → СА усиливаются восстановительные свойства
простых веществ
Б усиливается металлические свойства
В усиливаются неметаллические свойства
Г неметаллические свойства элементов
ослабевают
19.
2. Усиление металлических свойствэлементов представлено в ряду:
А N → Р → As
Б S → Р → Si
В Sb → As → P
Г Al → C → N
20.
3. Электронную конфигурацию1s22 s22p63s23p64s1 имеет атом
А Ca0
Б Al0
В Cs0
Г К0
21.
4. В каком ряду атомный радиус увеличиваетсяА С->O->F
Б Ba->Ca->Mg
В Al->P-> Cl
Г O-> S->Se
22.
5.А. P-As-Sb
Б Si-P-S
В C-Si-Ge
Г Cl-Br-I
23.
6. Даны элементы: F, O, N, Cl.Какие утверждения верны?
А в заданном ряду элементов
электроотрицательность уменьшается
Б атомный радиус уменьшается
В неметаллические свойства простых веществ
усиливаются
Г количество электронов во внешнем
энергетическом уровне уменьшается
24.
7. Наиболее выраженыметаллические свойства у:
А фосфора
Б азота
В рубидия
Г водорода
25.
8. Металлические свойства магния выраженысильнее, чем у
А калия
Б бария
В кальция
Г алюминия
26.
9. Выберите правильное утверждение:А - в ряду элементов: Na – Si – Cl
неметалличность простых веществ, образуемых
этими элементами, усиливается
B - в этом ряду число электронных уровней в
оболочке увеличивается
А утверждение А верно
Б верное утверждение - B
В оба утверждения верны
Г оба неверны
27.
10. Элементс порядковым номером 20 имеет:
А неметаллические свойства
Б в оболочке 3 энергетических уровня
В атомный радиус меньше атома серы
Г на внешнем энергетическом уровне 2
электрона




















 chemistry
chemistry








